人教版高一化学必修一知识点:氧化还原反应
高一化学氧化还原反应专题知识点
第一章氧化还原反应一、化学反应类型(1)氧化还原反应的实质:发生电子转移(电子的得失或电子对的偏移)。
化合价降低 +ne-被还原氧化剂+还原剂=还原产物+氧化产物化合价升高-ne-被氧化(2)氧化剂:得电子(或电子对偏向)的物质;还原剂:失去电子(或电子对偏离)的物质;氧化性:氧化剂具有氧化性,指得电子的性质或能力;还原性:还原剂具有还原性,指失电子的性质或能力;被氧化:还原剂被氧化;被还原:氧化剂被还原;氧化产物:还原剂失电子被氧化后的产物;还原产物:氧化剂得电子被还原后的产物。
联系:氧化剂(具有氧化性)——得电子——化合价降低——被还原——发生还原反应——还原产物还原剂(具有还原性)——失去电子——化合价升高——被氧化——发生氧化反应——氧化产物2、氧化还原反应的一般规律同一反应中:①氧化反应与还原反应同时发生,相互依存。
②氧化剂得电子总数与还原剂失电子总数相等。
即氧化剂化合价降低总数与还原剂化合价升高总数相等。
3、氧化还原反应中电子转移的表示方法(双线桥法)书写要求:(1)连接反应前后不同价态的同一种元素;(2)线桥跨越等号;(3)一定要标出得、失电子的总数,并且数值相等。
二、离子反应1.强电解质和弱电解质融化状态下能否导电。
②电解质的导电是有条件的:电解质必须在水溶液中或熔化状态下才能导电。
③能导电的物质并不全部是电解质:如铜、铝、石墨等。
④非金属氧化物(SO2、SO3、CO2)、大部分的有机物为非电解质。
⑤电解质溶液中,阳离子所带正电荷总数与阴离子所带负电荷总数相等,股显电中性,称电荷守恒。
(2)强电解质和弱电解质(1)离子反应a.定义:有离子参加或有离子生成的反应称为离子反应。
指在水溶液中有电解质参加的一类反应。
b.本质:溶液中某些离子能相互作用,使这些离子的浓度减小。
c.、离子反应分类与发生条件:间的某个反应,而且可以表示同一类型的离子反应。
书写步骤:“一写”:首先以客观事实为依据写出反应的化学方程式;“二改”:把易溶于水、易电离物质改写成离子形式(最关键的一步):“三删”:删去方程式两边未参加反应的离子;“四查”:检查离子方程式两边各元素的原子个数和电荷总数是否相等。
1.3.1氧化还原反应的概念课件高一上学期化学人教版

问题一:
得氧 失氧
问题二: 在一反应中只发生氧化反应或只发生还原反应吗? 氧化反应和还原反应之间的关系是什么?
同时发生、相依相存
反应前后有元素化合价变化的反应称为 氧化还原反应
阅读课本P23第二、三自然段的内容
化合价变化的实质原因?
Na
+11
失 去 电 子
ቤተ መጻሕፍቲ ባይዱ
Na+
+11
实质
1. 判断下列反应是否为氧化还原反应? 2.从基本类型(化合、分解、置换、复分解)的角度,如何分类? 3.总结氧化还原反应与四个基本类型反应的关系。
得氧、失氧的观点
化合价升降的观点
电子转移 (得失或偏移)的观点
氧化反应
得到氧的反应
还原反应
失去氧的反应
氧化还原反应 有得失氧的反应
元素化合价升 高的反应
元素化合价降 低的反应
有元素化合价升 降的反应
特征、标志
失去电子(电子 对偏离)的反应
得到电子(电 子对偏向)的 反应 有电子转移(得失 或偏移)的反应
电子
+17
Cl
得 到 电 子
+17
Cl-
Na+ Cl-
失去电子,化合价升高;得到电子,化合价降低。
H
+1
共用电子对
+17
Cl
HCl
+1
+17
+
H
Cl-
电子对偏离,化合价升高;电子对偏向,化合价降低。
根据以上分析,从电子转移的角度总结:
什么是氧化反应? 什么是还原反应? 什么是氧化还原反应?
从不同的观点认识氧化还原反应
氧化还原反应 高一上学期化学人教版(2019)必修一

2Na+ Cl2 = 2NaCl
化合反应 氧化还原反应
点燃
H2O+ CaO == Ca(OH)2
2H2O =通电 2H2↑+O2↑
△
CaCO3 == CaO+CO2↑
化合反应 分解反应 分解反应
非氧化还原反应 氧化还原反应 非氧化还原反应
Fe+CuSO4=FeSO4+Cu
Zn+H2SO4 == ZnSO4 +H2
以 2Na + Cl2 = 2NaCl 反应为例分析:
Na
+11
பைடு நூலகம்
28
e11
7 8 2 +17 Cl
Na+ +11 2 8
8 8 2 +17 Cl-
Na+ Cl-
化合价升降原因之一:电子的得失
以 H2 + Cl2 = 2HCl 反应为例分析:
H +1 1
7 8 2 +17 Cl
H Cl
共用电子对 化合价升降原因之二:共用电子对的偏移
练习
书本P27 T4、T5
4、下列变化中,涉及氧化还原反应的是__①_②__③___(填序号)。
①金属的冶炼
②钢铁的锈蚀
③食物的腐败
④钟乳石的形成
5.下列4种基本类型的反应中,一定是氧化还原反应的是__③___(填序号,
下同),一定不是氧化还原反应的是__④___,可能是氧化还原反应的是
___①__②____。
只能作还原剂 既能作还原剂,也能作氧化剂 只能作氧化剂
化合价 -2
0
S
S
+4
+6
S
人教版化学必修一氧化还原反应ppt33张课件
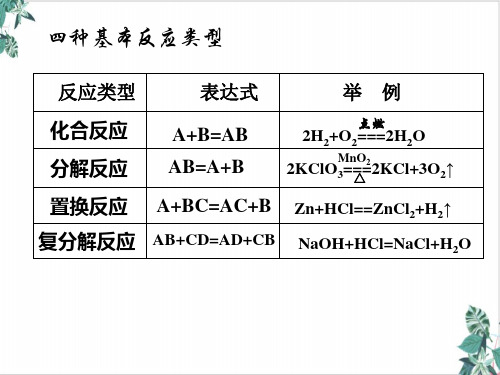
单质还原性逐渐减弱:K>Ca>Na>Mg>Al>Zn>Fe…
2.元素处于最低价态时,只能做还原剂:Cl-、S2-、I- 元素处于最高价态时,只能做氧化剂:KMnO4、 FeCl3、H2SO4、HNO3
阳离子氧化性逐渐增强: K+<Ca2+<Na+<Mg2+<Al3+<Zn2+<Fe 2+…
3.归中规律 同种元素不同价态间发生氧坏反应时,高价+ 低价 中间价态,即“只靠拢,不交叉。”
例:在KClO3+6HCl(浓)===KCl+3Cl2+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为 。
3、这是从电子得失的角度看(也是氧化还原反应的实质):
因此,有电子转移(得失或电子对偏移)的反应都是氧化还原反应。
Fe + 2HCl = FeCl2 + H2 ↑
2e-
CH4 + 2O2 = CO2 + 2H2O
8e-
-4 0 +4 -2
0 +1 +2 0
有单质参加的
有单质生成的
三、氧还反应中电子转移的表示方法
1.双线桥法:
(1)标出反应中化合价发生变化的元素的化合价,判断其升降。
(2)画线条,箭头由反应物指向生成物中同种元素。
(3)在桥上标明电子“得”“失”电子,同时用a×b e-形式表示得、失电子数。 a—得、失电子的原子总数 b—每个原子得失电子数(a,b为1时可省略)
如: 2Fe+3Cl2 =2FeCl3 Fe+S= FeS 则氧化性:Cl2 > S
人教版高一化学必修一第二章第三节氧化还原反应和答案

氧化还原反应的基本规律1、守恒规律氧化还原反应中,氧化剂得到电子总数等于氧化剂失去的电子总数,表现为化合价升高总数等于化合价降低总数。
2、强弱规律对于氧化还原反应“氧化剂+还原剂====还原产物+氧化产物”能进行,则满足:氧化性:氧化剂>氧化产物还原性:还原剂>还原产物3、价态规律当元素具有可变化合价时,一般情况下:例如,浓H2SO4中的S只具有氧化性,H2S中的S只具有还原性,单质S既具有氧化性也具有还原性。
4.先后规律在浓度相差不大的溶液中(1)如果一种氧化剂遇到了几种还原剂时,将按照还原性由强到的顾序依次反应。
例如:Zn、Fe同时加入盐酸中,还原性Zn>Fe,则Zn先与盐酸反应。
(2)如果一种还原剂遇到了几种氧化剂时,将按照氧化性由属到弱的顺序依次反应。
例如在含有Fe2+、Cu2+的溶液中加入锌粉,氧化性:Cu2+>Fe2+,则锌粉先与Cu2+反应,然后再与Fe2+反应5.归中规律例如:守恒法在金属与硝酸反应计算中的应用1、某稀硫酸和稀硝酸的混合溶液中c(NO3-)+c(SO42-)=2.5mol/L,取200mL该混合酸,则能溶解铜的最大质量为()A. 12.8gB. 19.2gC. 32.0gD. 38.4g通过离子方程式进行计算2、锌和某浓度的HNO3反应时,若参加反应的锌与HNO3的物质的量之比为2:5,产物有硝酸锌、X和水,则X可能是()A、NH4NO3B、N2OC、N2O3D、NO23、将38.4g铜与150mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L,请回答:①NO2的体积为___L.②若铜与硝酸刚好反应完全,则原硝酸溶液的浓度为___mol•L-1.4、在某100 mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.4 mol/L、0.1 mol/L,向该混合液中加入1.92 g铜粉,加热,待充分反应后,所得溶液中铜离子物质的量浓度是()A.0.15 mol/L B.0.225 mol/L C.0.30 mol/L D.0.45 mol/L5、R2O6n-在一定条件下可以把Mn2+氧化成MnO4-,若反应后R2O6n-转变为RO3n-.又知反应中氧化剂与还原剂的物质的量之比为5:2,则n值为()6、已知2Fe2++Br2═2Fe3++2Br−往100mL溴化亚铁溶液中缓慢通入2.24L(标准状况)氯气,反应完成后溶液中有1/3的溴离子被氧化成溴单质。
《氧化还原反应概念》高一必修一PPT课件(第2.3.1课时)

学
反
应
有无化合价变化
化合反应 分解反应 置换反应 复分解反应
氧化还原反应 非氧化还原反应
人教版高中化学必修一精品课件
精品系列课程
你认为以下说法正确吗? 举例说明
1.置换反应全部属于氧化还原反应。 2. 复分解反应全部属于非氧化还原反应。 3. 有单质参加的化合反应都是氧化还原反应 4 .有单质生成的分解反应都是氧化还原反应
高温 C + 2CuO ═ CO2↑ + 2Cu CuO + H2 = 2Cu + H2O
△ 上述几个氧化还原反应除了有氧得失之外还有什么共同点?
各种元素的化合价在反应前后有无变化? 你认为氧化反应、还原反应与元素化合价的升降有什么关系?
人教版高中化学必修一精品课件
精品系列课程
得到氧,化合价升高, 氧化反应 ,被氧化
精品系列课程
电子转移
Na+ Cl-
人教版高中化学必修一精品课件
精品系列课程
●●
Cl
● ●
●
还
●● 得
原
到
反 应
一 个 电
子 ●●
Cl-
● ●
● ●
●●
●
Na
失
去
氧
一
化
个
反
电
应
子
Na+
人教版高中化学必修一精品课件
精品系列课程
【思考与交流5】
通过对氯气与金属钠反应分析,请预测氯气还能与哪些物质反应? 反应中氯气将如何变化? 为什么氯气能发生这些反应?请从微观的角度进行解释。 请以氯气与氢气反应生成氯化氢为例进行说明
淡黄色
点燃或加热
人教版高中化学必修一精品课件
1.3氧化还原反应(第1课时认识氧化还原反应)高一化学人教版(2019)必修第一册

注总数 ➢ 正确标注反应中转移的电子总数。
氧化还原反应-单线桥法
用单线桥法表示下列方程式电子转移的方向和数目:
Δ
2e-
【例题4】
+2
CuO
+
0
H2
==Δ=
0
Cu
+
+1
H2O
【例题5】
2e-
+4
MnO2
+
-1
4HCl(浓)
Δ
===
+2
MnCl2
+
0
Cl2↑
+
H2
氧化还原反应与四种基本反应类型的关系
交叉关系
置换反应 复分解反应
√ H2SO4 + Fe == FeSO4 + H2↑ √ CuSO4 + Fe == FeSO4 + Cu
× HCl + NaOH == NaCl + H2O × BaCl2 + H2SO4 == BaSO4↓+ 2HCl
包含关系 无关
氧化还原反应与四种基本反应类型的关系
价态变化原子个数×每个原子得失电子数
氧化还原反应-双线桥法
【例题1】用双线桥法表示下列方程式电子转移的方向和数目:
得到3e-,化合价降低,被还原
+4
MnO2
+
-1
4HCl(浓)
Δ
===
+2
MnCl2
+
0
Cl2↑
+
H2
失去2×e-,化合价升高,被氧化
记忆口诀: 升失氧,降得还
氧化还原反应-双线桥法
思考与讨论
人教版化学必修一氧化还原反应知识点总结

一、氧化还原相关概念1.定义:凡是反应过程中有元素化合价变化(或电子转移)的反应叫氧化还原反应。
2.特征 : 元素化合价的升降;3.实质 : 电子转移。
4.规律:二.氧化还原反应与四种基本反应类型三.氧化还原中的电子转移表示法(应用于实际)(1) 双线桥法:表示同一元素的原子或离子间的电子转移情况(必须表明得失电子,其他可不标)(2)单线桥法:在反应物中箭头由还原剂指向氧化剂2==2Na2O常见的氧化剂(1)非金属性较强的单质 : O2、Cl2(2)变价元素的高价态化合物:KMnO4、FeCl3、浓硝酸、浓硫酸(3)其他 : HCIO、MnO2、Na2O2、H2O2、漂白粉Ca (CIO)2常见的还原剂(1)金属性较强的单质: Al、Fe、Zn(2)某些非金属单质: H2、S、C(3)变价元素的低价态化合物: CO(4)其他: 浓盐酸、NH3四、氧化性、还原性强弱的判断1.根据氧化还原反应的方向判断氧化剂(氧化性)+还原剂(还原性)=还原产物+氧化产物氧化性:氧化剂>氧化产物还原性:还原剂>还原产物五、氧化还原反应的有关规律1.守恒规律 : 化合价升降总数相等,得失电子总数相等。
2.强弱规律 : 强氧化剂+强还原剂=弱还原产物+弱氧化产物。
3.价态规律:元素处于最高价态,只有氧化性;处于最低价态,只有还原性;若处于中间价态,既有氧化性又有还原性,但在一个反应中,主要表现一种性质。
五、附基本知识点1、化合价口诀钾钠银氢正一价 , 钙镁钡锌正二价;铝有正三氧负二,氯负一价最常见2、原子团NH4+铵根SO42-硫酸根 NO3- 硝酸根OH-氢氧根CO32-碳酸根PO43-磷酸根3、“口诀”熟记难溶(不溶)物质。
钾、钠、铵盐水中溶。
硝酸盐见水无影踪。
盐酸盐不溶银、亚汞(熟记AgCl不拆)。
硫酸盐不溶钡和铅(熟记BaSO4不拆)。
习题。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
人教版高一化学必修一知识点:氧化还原反应
充分利用时间,最大限度地压缩非学习时间,各种学习以外的事情速战速决。
下面是XX小编为您推荐人教版高一化学必修一知识点:氧化还原反应。
一、概念判断:
1、氧化还原反应的实质:有电子的转移得失
2、氧化还原反应的特征:有化合价的升降判断是否氧化还原反应
3、氧化剂具有氧化性得电子的能力,在氧化还原反应中得电子,发生还原反应,被还原,生成还原产物。
4、还原剂具有还原性失电子的能力,在氧化还原反应中失电子,发生氧化反应,被氧化,生成氧化产物。
5、氧化剂的氧化性强弱与得电子的难易有关,与得电子的多少无关。
6、还原剂的还原性强弱与失电子的难易有关,与失电子的多少无关。
7、元素由化合态变游离态,可能被氧化由阳离子变单质,
也可能被还原由阴离子变单质。
8、元素价态有氧化性,但不一定有强氧化性;元素态有还原性,但不一定有强还原性;阳离子不一定只有氧化性不一定是价态,,如:Fe2+,阴离子不一
定只有还原性不一定是态,如:SO32-。
9、常见的氧化剂和还原剂:
10、氧化还原反应与四大反应类型的关系:
【同步练习题】
1.Cl2是纺织工业常用的漂白剂,Na2S2O3可作为漂白布匹后的脱氯剂。
S2O32-和Cl2反应的产物之一为SO42-。
下列说法不正确的是
A.该反应中还原剂是S2O32-
B.H2O参与该反应,且作氧化剂
C.根据该反应可判断氧化性:Cl2 SO42-
D.上述反应中,每生成lmolSO42-,可脱去2molCl2
答案:B
点拨:该反应方程式为:S2O32-+4Cl2+5H2O===2SO42-+8Cl-+10H+,该反应中氧化剂是Cl2,还原剂是S2O32-,H2O参与反应,但既不是氧化剂也不是还原剂,故选B。
2.2022 河南开封高三一模分析如下残缺的反应:
RO3-+________+6H+===3R2 +3H2O。
下列叙述正确的是
A.R一定是周期表中的第ⅤA族元素
B.R的原子半径在同周期元素原子中最小
C.上式中缺项所填物质在反应中作氧化剂
D.RO3-中的R元素在所有的反应中只能被还原
答案:B
点拨:RO3-中R为+5价,周期表中ⅤA、ⅦA元素均可形成RO3-离子,A错误;据元素守恒,反应中只有R、H、O三种元素,则缺项一定为R-,且配平方程式为RO3-+5R-+6H+===3R2 +3H2O,据此可得R为ⅦA元素,B正确;R-中R 处于态,只能作还原剂,C错误;RO3-中R元素处于中间价态,在反应中既可被氧化又可被还原,D项错。
3.已知KH和H2O反应生成H2和KOH,反应中1molKH
A.失去1mol电子
B.得到1mol电子
C.失去2mol电子
D.没有电子得失
答案:A
点拨:KH中H为-1价,KH+H2O===KOH+H2
置换反应一定是氧化还原反应;复分解反应一定不是氧化还原反应;化合反
应和分解反应中有一部分是氧化还原反应。
例、在H+、Fe2+、Fe3+、S2-、S中,只有氧化性的是________________,只有还原性的是________________,既有氧化性又有还原性的是___________。
二、氧化还原反应的表示:用双、单线桥表示氧化还原反应的电子转移情况
1、双线桥:谁变谁还原剂变成氧化产物,氧化剂变成还原产物
例:
2、单线桥:谁给谁还原剂将电子转移给氧化剂
例:
三、氧化还原反应的分析
1、氧化还原反应的类型:
1置换反应一定是氧化还原反应
2CuO+C=2Cu+CO2SiO2+2C=Si+2CO
2Mg+CO2=2MgO+C2Al+Fe2O3=2Fe+Al2O3
2Na+2H2O=2NaOH+H2 2Al+6H+=2Al3++3H2
2Br-+Cl2=Br2+2Cl Fe+Cu2+=Fe2++Cu
2化合反应一部分是氧化还原反应
2CO+O2=2CO23Mg+N2=Mg3N2
2SO2+O2=2SO32FeCl2+Cl2=2FeCl3
3分解反应一部分是氧化还原反应
4HNO3浓=4NO2 +O2 +2H2O2HClO=2HCl+O2
2KClO3=2KCl+3O2
4部分氧化还原反应:
MnO2+4HCl浓=MnCl2+Cl2 +2H2O
Cu+4HNO3浓=CuNO32+2NO2 +2H2O
3Cu+8HNO3=3CuNO32+2NO +4H2O
Cu+2H2SO4浓=CuSO4+SO2 +2H2O
5自身氧化还原反应:歧化反应
Cl2+H2O=HCl+HClO3S+6OH-=2S2-+SO32-+3H2O
2Na2O2+2H2O=4NaOH+O2 ;2Na2O2+2CO2=2Na2CO3+O2
2CaOH2+2Cl2=CaCl2+CaClO2+2H2O
6同种元素不同价态之间的氧化还原反应归中反应
2H2S+SO2=3S+3H2O
5Cl +ClO3-+6H+=3Cl2 +3H2O
7氧化剂、还原剂、氧化产物、还原产物不止一种的氧化还原反应:
2KNO3+S+3C=K2S+N2 +3CO2
2KMnO4=K2MnO4+MnO2+O2
2、氧化还原反应分析:
1找四物:氧化剂、还原剂、氧化产物、还原产物
2分析四物中亮的关系:特别是歧化反应、归中反应、部分氧化还原反应 3电子转移的量与反应物或产物的关系
例:根据反应:8NH3+3Cl2==6NH4Cl+N2,回答下列问题:
1氧化剂是_______,还原剂是______,氧化剂与还原剂的物质的量比是____________;
2当有68gNH3参加反应时,被氧化物质的质量是____________g,生成的还原产物的物质的量是____________mol。
