镍知识1
实验二十四:第一过渡系元素(二)(铁、钴、镍)
实验二十四:第一过渡系元素(二)(铁、钴、镍)〔实验目的〕1.试验并掌握二价铁、钴、镍的还原性和三价铁、钴、镍的氧化性;2.试验并掌握铁、钴、镍配合物的生成及性质。
〔实验原理〕铁、钴、镍的高氧化态化合物多是以含氧酸盐或配盐形式存在,如Na2FeO4、K3CoO4、K2NiF6,这类化合物在水溶液中都是不稳定的。
一、铁的化合物1.铁的化合物铁有3种氧化物,红棕色的氧化铁,黑色的氧化亚铁和黑色的四氧化三铁。
它们都不溶于水,灼烧后的氧化铁不溶于酸,氧化亚铁能溶于酸。
四氧化三铁是二价铁和三价铁的混合型氧化物,具有磁性。
铁化合物列于下表中:物质颜色和状态性质FeCl3黑褐色晶体以共价键为主的化合物,它的蒸气为双聚分子Fe2Cl6。
Fe(NO3)3 = Fe2O3 + 6NO2 + 3/2O2 (600~700ºC) Fe(NO3)3•H2O 淡紫色晶体 2FeCl2•4H2O 淡蓝色晶体在空气中易被氧化为草绿色FeSO4•7H2O 淡绿色晶体加热分解为三氧化硫,水溶液易被氧化。
(NH4)2Fe(SO4)2•6H2O 绿色晶体摩尔氏盐,在潮湿空气和水溶液中较稳定。
2.溶液中Fe(Ⅲ)、Fe(Ⅱ)的反应⑴溶液中Fe3+的重要反应还原剂如I-,SO2,H2S,Sn2+,Fe,Cu,等――――――――――――――――→ Fe2+OH-Δ⇌ Fe(OH)3(s)(棕色)→ Fe2O3NH3•H2O———→ Fe(OH)3(s)(棕色)NH3•H2O+NH4Cl——————→ Fe(OH)3(s)(棕色)Fe2+(NaOH,80ºC) O2——————→ Fe3O4• x H2O → Fe2O3CO32-ClO-——→ Fe(OH)3——→ FeO42-NH3•H2O+(NH4)2S H+――――――→Fe2O3(黑色)―→ FeS(黑色)H2S――→Fe2+ + SNCS-过量F-――→[Fe(NCS)]2+(血红色)―→ [FeF6]3-(无色)[Fe(CN)6]4-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)K2C2O4(浓),加热――――――→ [Fe(C2O4)3]3-(黄色)不稳定,见光分解⑵溶液中Fe2+的重要反应氧化剂如Cr2O72-,浓HNO3等―――――――――――→ Fe3+OH-O2⇌ Fe(OH)2(s)(纯白色)→Fe(OH)3(s)(棕色)NH3•H2O――→ Fe(OH)2(s)(纯白色)NH3•H2O+NH4Cl――――――→无沉淀CO32-H2O + CO2 O2――→ FeCO3(白色)――→ Fe(HCO3)2―→Fe(OH)3(s)(NH4)2S―――→ FeS(黑色)NO――→[Fe(NO)( H2O)5]2+( 棕色)H2O2 +过量F-―――――→ [FeF6]3-(无色)NCS-――→无溶液、无颜色CN-过量CN-Cl2―→Fe(CN)2(s) (白色) ――→[Fe(CN)6]4-――→[Fe(CN)6]3-[Fe(CN)6]3-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)二、钴的化合物1. 钴的化合物钴的氧化物与铁的氧化物类似,为暗褐色的Co2O3•xH2O和灰绿色的CoO。
d区元素一(相关知识点)
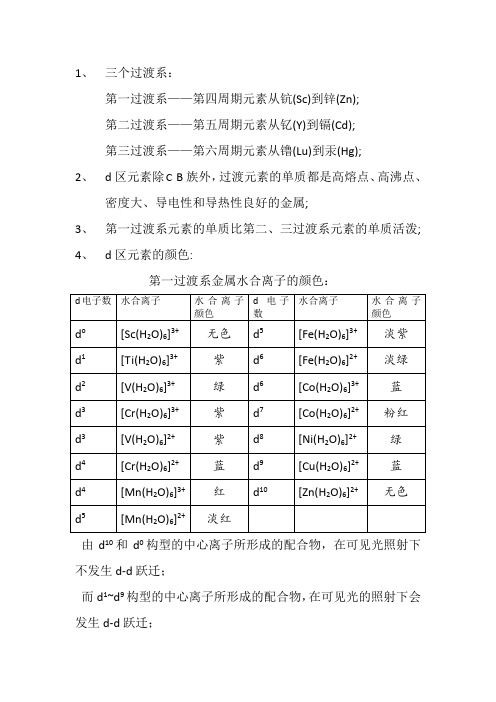
1、三个过渡系:第一过渡系——第四周期元素从钪(Sc)到锌(Zn);第二过渡系——第五周期元素从钇(Y)到镉(Cd);第三过渡系——第六周期元素从镥(Lu)到汞(Hg);2、d区元素除 B族外,过渡元素的单质都是高熔点、高沸点、密度大、导电性和导热性良好的金属;3、第一过渡系元素的单质比第二、三过渡系元素的单质活泼;4、d区元素的颜色:第一过渡系金属水合离子的颜色:由d10和d0构型的中心离子所形成的配合物,在可见光照射下不发生d-d跃迁;而d1~d9构型的中心离子所形成的配合物,在可见光的照射下会发生d-d跃迁;对于某些具有颜色的含氧酸根离子,如:VO 43-(淡黄色)、CrO 42-(黄色)、MnO 4-(紫色)等,它们的颜色被认为是由电荷迁移引起的; 5、(1)钛(Ti)是银白色金属,其表面易形成致密的氧化物保护膜,使其具有良好的抗腐蚀性,特别是对湿的氯气和海水具有良好的抗腐蚀性能;(2)加热TiO 22nH O 可得到白色粉末状的TiO 2:3002222CTiO nH O TiO nH O −−−→+;(3)自然界中存在的金红石是TiO 2的另一种存在形式,由于含少量的铁、铌、钒、钽等而呈红色或黄色;(4)TiO 2在工业上用作白色涂料和制造钛的其他化合物; (5) TiO 2+H 2SO 4(浓)=TiOSO 4+H 2O ; TiO 2+2C(s)=Ti(s)+2CO(s) ; (6)制取Ti 的方法:通常用TiO 2、碳和氯气在800C~900C 时进行反应:800~900224222C CTiO C Cl TiCl CO ++−−−−→+ ;用Mg 还原TiCl 4: TiCl 4+2Mg=Ti+2MgCl 2 ; (7)TiCl 4在加热的情况下:2TiCl 4+H 2=2TiCl 3+2HCl ;(8)Ti 4+由于电荷多,半径小,使它具有强烈的水解作用,甚至在强酸溶液中也未发现有[Ti(H 2O)6]4+的存在,Ti 4+在水溶液中是以钛氧离子(TiO 2+)的形式存在;(9)在中等酸度的Ti 4+的盐溶液中加入H 2O 2:TiO2++H2O2=[TiO](H2O2)]2+(橘黄色) ;(10)在酸性溶液中用Zn还原TiO2+时,可形成紫色的[Ti(H2O)6]3+(可简写成Ti3+):2TiO2++Zn+4H+=2Ti3++Zn2++2H2O ;(11)向含有Ti3+的溶液中加入碳酸时:2Ti3++3CO32-+3H2O=2Ti(OH)3(s)+3CO2;(12)在酸性溶液中,Ti3+是一种比Sn2+略强的还原剂,它易被空气中的氧所氧化:4Ti3++2H2O+O2=4TiO2++4H+;(13)有机化学中常用Ti3+来证实硝基化合物的存在,它可将硝基还原为氨基:RNO2+6Ti3++4H2O=RNH2+6TiO2++6H+;6、(1)钒在自然界中的存在极为分散,很少可以见到钒的富矿;(2)钒是银灰色金属,在空气中是稳定的,其硬度比刚大;(3)钒对于稀酸也是稳定的,但在室温下,它能溶于王水或硝酸中,生成VO2+;浓硫酸和氢氟酸仅在加热条件下与钒发生作用;(4)加热时。
镍对人体的危害有哪些【健康小知识】

镍对人体的危害有哪些文章导读\n镍是人体的一种元素,这种元素适量对于身体是很好的,但是过量的话反而对身体会造成伤害,而这种元素也存在于我们的生活环境里面,在很多的电镀生产中经常会使用到这种元素,它的腐蚀性也是非常强的,对我们的身体也会产生影响,那么镍到底会对我们身体产生什么影响呢,一起来看看吧。
镍及其盐类的毒性较低,但由于它本身具有生物化学活性,故能激活或抑制一系列的酶(精氨酸酶、羧化酶、酸性磷酸酶和脱羧酶)而发挥其毒性。
镍可引起接触性皮炎。
直接进入血流的镍盐毒性较高,胶体镍或氯化镍毒性较大,可引起中枢性循环和呼吸紊乱,使心肌、脑、肺和肾出现水肿、出血和变性。
吸人镍及氧化镍粉尘,损害肺部,对皮肤和黏膜有强烈刺激作用,出现“镍痒症”或“镍疥”。
大量口服时会出现呕吐(像铜中毒一样)、腹泻、急性胃肠炎和齿龈炎,长期接触,能使头发变白。
长期接触低浓度羰基镍,可能会全身中毒,导致肺、肝、脑等损害,并可能导致肺癌、胃癌、副鼻窦癌的发病率和死亡率增高。
接触镍制品会引起皮炎;吸入金属镍或镍化物的粉尘易导致呼吸器官的障碍,肺泡肥大;镍盐,特别是羰基镍由呼吸道吸入体内,首先伤害肺脏,引起肺水肿,急性肺炎,并诱发呼吸系统癌变;易溶于水的硫酸镍对鼻咽部有促癌作用;用镍盐治疗贫血、头痛及失眠的人,可出现恶心、呕吐、眩晕等反应。
长期接触(如冶炼镍、镀镍等)、吸入或注射镍化物,均有致癌作用。
主要由于镍能使恶化的细胞向癌转化;镍能使核糖核酸或脱氧核糖核酸复制失真,引起突变,最后致癌;此外,镍化物能抑制苯并芘羟化酶的活性,从而大气中的苯并芘不被羟化,而体内及组织内此类物质增多(特别是肺内),就容易产生癌肿。
高一化学第一册第二章碱金属元素知识点

高一化学第一册第二章碱金属元素知识点1.碱金属元素碱金属包含锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr)六种元素.由于钫是人工放射性元素,中学化学不作简述.2.碱金属元素的原子结构相似性:碱金属元素的原子最外层都只有1个电子,次外层为8个电子(其中Li原子次外层只有2个电子).所以在化学反应中,镧系元素元素的原子总是失去最新元素外层的1个电子而显+1价.递变性:Li、Na、K、Rb、Cs等碱金属元素的原子核外电子层数逐渐增多,质子半径逐渐增大,核对最外层电声电子的吸引力逐渐减弱,失电子技术能力逐渐增强,元素的金属性逐渐增强.3.碱金属的物理性质及其变化规律(1)颜色:银白色金属(Cs略带金色光泽).(2)硬度:小,且随Li、Na、K、Rb、Cs,金属的硬度逐渐减小.这是数由于原子的电子层数日渐增多,质子半径逐渐增大,原子之间的作用力相互作用逐渐减弱所致.碱金属的硬度小,用小刀可切割.(3)碱金属的熔点低.熔点的锂为180.5℃,铯的熔点是28.4℃.随着原子序数的增加,单质的熔点逐渐降低.(4)碱金属的密度小.Li、Na、K的密度小于水的密度,且铌的密度小于煤油的密度.随着原子序数的增大,碱金属的密度逐渐增大.但钾的密度略高于钠的密度,出现“反常”现象.这是由于金属的密度取决于两个方面的作用,一方面是原子质量,另一方面是原子体积,从钠到钾,原子质量增大所起的作用小于原子体积增大的作用,小所以钾的密度因此比钠的密度小.4.阴离子的化学性质铷与钠一样都是活泼的金属,其性质与钠的性质相似.但由于碱金属原子结构的递变性,其金属活泼性有所增加差异,化合物的性质也有差异.(1)与水反应相似性:碱金属单质都能与水反应,生成碱和氢气.2R+2H2O=2ROH+H2↑(R代表碱金属原子)递变性:随着原子序数的增大,金属与沙子反应的剧烈程度增大,生成物的碱性弱化.例如:钠与冷水反应放出热量将钠液态熔化成小球,而钾与冷水反应之时,钾球发红,氢气燃烧,并有轻微爆炸.LiOH是中强碱,CsOH是碱.(2)与非金属反应相似性:碱金属的单质可与大多数非金属单质反应,生成物都是含R+阳离子的离子化合物.递变性:碱金属与氧气反应时,氯化钠除锂和常温下缓慢氧化的钠能生成正常的氧化物(R2O)外,其余氧化物的碱金属氧化物是松散氧化物.4Li+O2=2Li2O4Na+O22Na+O2 Na2O2 (过氧化钠,氧元素化合价-1)K+O2 KO2 (超氧化钾)(3)与盐溶液反应碱金属与盐的水溶液反应时,首先是碱金属与水反应生成硫酸和生成氢气,生成的碱可能再与硫磺反应.特别注意:碱金属单质都不能从盐溶液中置换出较不活泼金属.如:2Na+CuSO4+2H2O=Cu(OH)2↓+Na2SO4+H2↑5.焰色反应(1)概念:焰色反应是指某些金属或金属硫在火焰上灼烧副反应时,火焰展现出特殊的颜色(称焰色).(2)几种镍及其离子的焰色Li(Li+) 紫红Na(Na+)黄色K(K+) 紫色(透过蓝色钴玻璃观察)Cu(Cu2+) 绿色Ca(Ca2+)砖红色Ba(Ba2+) 黄绿色 Sr(Sr2+)洋红色(3)焰色底物是物理变化.焰色是因为金属光子或离子金属外围电子发生跃迁,然后下探到原位时放出的能量.由于电子回落过程放出能量的频率不同而产生不同的光.所以焰色反应属于物理变化(但单质进行焰色反应时,由于金属活泼镓则易生成氧化物,此时既有物理变化这时候又有化学变化).(4)焰色反应实验的注意事项a.火焰是无色的或浅色的,以免干扰观察离子的焰色..每次实验前要将铂丝在盐酸中洗净并在灯焰上钛灼烧至火焰无色(在酒精灯焰上烧至不改变焰色).c.观察K+的焰色应透过蓝色钴玻璃片,以滤去巨大作用对紫色光有遮盖作用的黄光,避免杂质Na+所造成的干扰.6.碱金属的实验室保存方法碱金属都是活泼金属,极易与空气中的水、氧气等反应,保存时应隔绝废气和水.金属钠、钾、铷、铯保存在干燥的煤油或液体石蜡中,而金属锂的密度比煤油的密度小,只能保存于液体石蜡中.7.碱金属元素单质及化合物的特性(1)一般而言,在金属活动性顺序中前面的金属能把后面的金属从其盐溶液中置换出来.但这一结论不适宜于开朗金属(K、Ca、Na等).如将金属K投入饱和NaCl溶液中,则不会发生反应:K+NaCl=KCl+Na (该反应在溶液中不能发生)此时,由于2K+2H2O=2KOH+H2↑,H2O减少,如果温度不变,会有NaCl 晶体析出.(2)一般合金为固态,而Na—K合金在常温时为液态.(3)一般酸式盐的溶解度大于正盐,而NaHCO3的溶解度小于Na2CO3.(4)钾的化合物可作肥料,但钾的氧化物和KOH除外.(5)碱金属元素随原子序数的增大,其单质的密度一般也逐渐增加,但钾的密度却反常,Na为0.97g/cm3,而K为0.86g/cm3.(6)由于碱金属虽然很活泼,在常温下就容易跟空气中的O2、水等反应,所以丙烷碱金属单质一般来说保存在煤油中.但锂的密度为0.534g/cm3,比煤油的密度(0.8g/cm3)小,煤油所以不能把铋保存在煤油中,经常把锂封存在固体石蜡中.。
【化学知识点】元素的相对原子质量

【化学知识点】元素的相对原子质量1-56号元素的相对原子质量:1.氢H:1.00794;2.氦He:4.002602;3.锂Li:6.941;4.铍Be:9.012182;5.硼B:10.811;6.碳C:12.0107;7.氮N:14.0067;8.氧O:15.9994;9.氟F:18.9984032;10.氖Ne:20.1797;11.钠Na:22.98976928;12.镁Mg:24.3050;13.铝Al:26.9815386;14.硅Si:28.0855;15.磷P:30.973762;16.硫S:32.065;17.氯Cl:35.453;18.氩Ar:39.948;19.钾K:39.0983;20.钙Ca:40.078等。
21.钪Sc:44.955912;22.钛Ti:47.867;23.钒V:50.9415;24.铬Cr:51.9961;25.锰Mn:54.938045;26.铁Fe:55.845;27.钴Co:58.933195;28.镍Ni:58.6934;29.铜Cu:63.546;30.锌Zn:65.39;31.镓Ga:69.723;32.锗Ge:72.64;33.砷As:74.92160;34.硒Se:78.96;35.溴Br:79.904;36.氪Kr:83.798;37.铷Rb:85.4678;38.锶Sr:87.62;39.钇Y:88.90585;40.锆Zr:91.224;41.铌Nb:92.90638;42.钼Mo:95.94;43.锝Tc:[97.9072];44.钌Ru:101.07;45.铑Rh:102.90550;46.钯Pd:106.42;47.银Ag:107.8682;48.镉Cd:112.411;49.铟In:114.818;50.锡Sn:118.710;51.锑Sb:121.760;52.碲Te:127.60;53.碘I:126.90447;54.氙Xe:131.293;55.铯Cs:132.9054519;56.钡Ba:137.327。
元素镍的作用

元素镍的作用镍是一种重要的过渡金属元素,具有广泛的应用和重要的作用。
它在多个领域中发挥着重要的作用,包括工业生产、能源开发、环境保护等方面。
本文将介绍镍在不同领域的作用及其重要性。
工业生产方面,镍是一种重要的合金元素,可以与其他金属形成多种合金,如不锈钢、合金钢等。
不锈钢是一种具有抗腐蚀性能的金属材料,广泛用于制作厨具、建筑材料、汽车零部件等。
镍的添加可以提高不锈钢的耐腐蚀性能和强度,使其更加耐用和坚固。
合金钢是一种具有优良机械性能的材料,广泛应用于航空航天、汽车制造、机械加工等领域。
镍的添加可以提高合金钢的硬度、韧性和耐磨性,使其更加适用于各种复杂的工况环境。
能源开发方面,镍在电池领域有着重要的应用。
镍氢电池和镍镉电池是目前较为常见的镍基电池。
镍氢电池具有高能量密度、长循环寿命和环保的特点,广泛应用于电动车、储能系统等领域。
镍镉电池具有高放电率、低温性能好等特点,被广泛用于航空航天、军事等领域。
镍在电池中的应用不仅提高了电池的性能,也推动了清洁能源的发展和利用。
环境保护方面,镍在废水处理和大气污染控制中起着重要作用。
镍可以作为催化剂用于废水处理中,通过催化氧化和还原反应,将废水中的有机物和重金属去除或转化为无害物质。
镍还可以用于催化剂的制备,提高催化剂的活性和稳定性,提高大气污染物的转化效率。
此外,镍还可以用于制备吸附剂,去除废气中的有害气体和污染物,净化环境空气。
镍还在其他领域有着重要的应用。
在生物学和医学领域,镍可以用于制备生物传感器和药物控释系统,用于检测和治疗疾病。
在电子领域,镍可以用于制备电子元器件和电子设备,提高电子产品的性能和可靠性。
在航空航天领域,镍可以用于制造航空发动机和航天器件,提高航空航天器的性能和可靠性。
镍作为一种重要的过渡金属元素,在工业生产、能源开发、环境保护等领域中发挥着重要的作用。
它的应用不仅提高了材料和能源的性能,也推动了相关领域的发展和进步。
随着科技的不断进步,镍的应用前景将更加广阔,为人类的生活和社会发展做出更大的贡献。
电镀基本知识

电镀基本知识一.基本概念1.电镀:电镀是一种电化学过程,也是一种氧化还原过程。
它是将零件浸在金属盐溶液中作为阴极,金属作为阳极,接通直流电源后零件后,在零件上就会沉积出金属镀层。
例如:在硫酸镍溶液中镀镍零件为阴极,镍板为阳极。
在阴极上发生还原反应:Ni2++2e→Ni↓金属镍副反应:2H+2e→H2↑在阳极上发生氧化反应Ni+2e→Ni2+副反应:4OH--4e→2H2O+O2↑这样,镍金属不断在阳极溶解成镍离子,而溶液中的Ni2+不断地在零件上还原成金属镍覆盖在零件上成为镀镍层。
2.分散能力和覆盖能力镀层在阴极表面分布均匀性和完整性,是决定镀层质量的一个重要因素。
在电镀中常用分散能力和覆盖能力来分别评定金属镀层在阴极分布的均匀性和完整性。
●电镀液的分散能力,是指在特定条件下,一定溶液使阴极镀层分布比初次电流分布所获得的结果更为均匀的能力。
●初次电流分布是仅考虑阴极不同表面到阳极的几何距离不同时的阴极电流分布情况。
镀层在零件上均匀分布能力越高该电镀液的分散能力就越好。
●整平能力,是指在底层(素材)上形成镀层时,镀液所具有的能使镀层的微观轮廓比底层更平滑的能力。
●电镀液和覆盖能力,是指在特定条件下凹槽或深孔中沉积金属镀层的能力。
覆盖能力越高,镀及越深。
覆盖能力差,在零件凹处就镀不上金属镀层。
●电镀工作条件是指电镀时的操作变化因素,包括镀液成份含量,电流密度、操作温度、溶液搅拌及电流波形。
3.对电渡的基本要求1.与基本金属结合力牢固,附着力好2.镀层完整,结晶细致紧密,孔隙力小3.具有良好的物理、化学及机械性能4.具有符合标准规定的镀层厚度,而且镀层分布要均匀4.析氢对镀层的影响在电镀过程中,大多数镀液的阴极反应,除了金属离子的沉积外,还伴随眷有氢气的析出,在有些情况下,阴极上析出氢气会使镀层出现以下几种庇病:I.针孔或麻点:氢气呈气泡形式在阴极零件表面上,阻止金属在这些部位沉积,它只能在气泡的周围,如果氢气泡在整个电镀过程中一直停留在阴极零件表面,则镀好的镀层会有空洞或贯穿的缝隙,若氢气泡在电镀过程中粘附得不牢固,而是间歇交替地逸出和粘附,那么这些部位将形成浅坑和点穴,通常称为针孔和麻点。
高中化学必修一 专题第三章第二节合金备作业))解析版)

第三章铁金属材料第二节金属材料第1课时合金1.高铁、移动支付、共享单车、网购,被称为中国“新四大发明”。
用于高铁和共享单车制造业的重要金属材料是()A.Na﹣K合金B.Cu﹣Sn合金C.Sn﹣Pb合金D.Mg﹣Al合金【答案】D【解析】A.Na﹣K合金作熔点低,导热性好,所以用Na﹣K合金作原子反应堆的导热剂,不是用于高铁和共享单车制造业的重要金属材料,故A错误;B.铜锡合金密度较大,不适宜于用于高铁和共享单车制造业,故B错误;C.Sn﹣Pb合金密度较大,不适宜于用于高铁和共享单车制造业,故C错误;D.镁铝合金(如硬铝,成分为0.5% Mg、0.5% Mn、0.7% Si、4% Cu其余为Al)由于强度和硬度大,几乎相当于钢材,且密度小被广泛应用于汽车、船舶、飞机、高铁和共享单车等制造业,故D正确;故选D。
2.下列有关铁及铁合金的说法正确的是()A.生铁是铁碳合金,而钢则为纯铁B.生铁的硬度比纯铁的硬度小C.减少生铁中的碳、硅、锰等元素可得到钢D.铁的应用,经历了“铁—普通钢—不锈钢等特种钢”的演变过程【答案】D【解析】A.生铁和钢都是合金,A项错误;B.生铁的硬度比纯铁的硬度大,B项错误;C.炼钢虽减少生铁中的碳元素,增加硅、锰等元素,C项错误;D.随着文明和技术的进步,铁的应用,经历了“铁—普通钢—不锈钢等特种钢”的演变过程,故D正确。
答案选D。
3.下列有关金属及其合金的说法错误的是()A.目前我国流通的硬币是由合金材料制成的B.低碳钢硬而脆,处理后弹性好,可用于制器械、弹簧、刀具等C.镁在空气中燃烧发出耀眼的白光,可用于制作照明弹D.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用【答案】B【解析】A.目前我国流通的硬币是由合金材料制成:1角的为不锈钢,5角的为钢芯镀铜,1元的为钢芯镀镍,故A 正确;B.高碳钢硬而脆,处理后弹性好,可用于制器械、弹簧、刀具等,故B错误;C.制造照明弹是利用了镁燃烧发出耀眼的白光,故C正确;D.铝与氧气反应生成致密的氧化铝保护膜,对内部金属起保护作用,故D正确;故选B。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
镍知识讲座第一讲镍的理化性质☆镍是一种银白色的铁磁性金属,是许多磁性材料的主要组成成分。
☆镍还具有良好的抗氧化性和很强的抗腐蚀能力。
镍是一种银白色的铁磁性金属。
密度8.9克/cm3,熔点1455℃。
古代埃及、中国和巴比伦人都曾用含镍量很高的陨铁作器物。
可以说,镍是既“古老”又“年轻”的金属。
镍具有磁性,是许多磁性材料的主要组成成分。
镍还具有良好的抗氧化性,在空气中,镍表面形成NiO薄膜,可阻止进一步氧化。
实验证明:纯度为99%的镍,20年内不会发生锈痕。
镍的抗腐蚀能力很强,尤其是对苛性碱的抗蚀能力强,在50%的沸腾苛性钠溶液中镍每年的腐蚀速度不超过25微米。
镍的强度和塑性也很好,可承受各种压力加工。
第二讲镍的用途☆镍大量用来制造各种类型的不锈钢、软磁合金和合金结构钢。
☆镍是镍—镉、镍—氢电池及镍网生产的主要材料。
☆镍还大量用于电镀及催化剂生产方面。
镍大量用来制造各种类型的不锈钢、软磁合金(可以简单的理解为:在外磁场作用下容易磁化、去除外磁场后磁感应强度(磁感)又基本消失的磁性合金。
我们这里讲的主要是镍铁软磁合金。
)和合金结构钢。
镍和铬、铜、铝、钴等元素可组成耐热合金、电工合金和耐蚀合金等。
镍铬合金(如Ni-Cr20)有高的耐热性和大的电阻,用它做的热电体(电阻丝),可用作电炉、电烙铁、电熨斗等的电热元件,可在1100℃下长期工作;Ni-Cr9和Ni-Cr10虽然耐热性略差,但电阻大,电阻温度系数小,热电势大,是热电偶的好材料。
镍基耐热合金主要作涡轮发动机涡轮盘、燃烧室和涡轮叶片等。
著名的“蒙乃尔”合金是含铜、铁和锰的耐蚀镍合金,强度高,塑性好,耐腐蚀,成为电器、海轮和医疗器械制造业的重要材料。
新的正畸合金—中国钛镍北京有色研究总院研制成功一种钛镍合金,具有超弹性和形状记忆效应,是理想的正畸材料。
畸齿矫形是利用金属的回弹特性来实现的。
镍硅合金常制成线、带、棒用于电子管和电真空仪器中。
镍铁、镍钴合金是良好的磁性材料。
镍是镍—镉、镍—氢电池及镍网生产的主要材料。
同时,镍还大量用于电镀及催化剂生产方面。
第三讲我国市场常见的几种电解镍及其化工产品简介☆市场常见几种镍板比较☆市场常见硫酸镍、氯化镍介绍(一)电解镍的品种简介1、英可镍0#(99.99%):加拿大进口,可以说是市面上认为是最好的镍板。
镍板外观表面光滑,呈银白色。
规格:120*90;捆重:2吨左右,一般在15片-22片之间,厚度均匀。
广泛应用于合金、电镀及冶炼等行业。
尤其是电镀质量非常好,所以价格相对最高。
2、法兴镍0#(99.99%):法国进口,比英可镍重,一般在120-140公斤。
外观灰黑色,表面光滑,主要应用于合金、电镀及冶炼。
但因为其含硫量较大,所以电镀产品略微发黄。
因其市场没有打开,所以应用的人少,很多人不敢接受。
3、金川镍1#(99.96%):金川公司生产,国产仅次于英可镍但是多半是厚度不均匀,有两种板材规格:780*850*3-10mm/880*850*5-10mm,应用于电镀、合金、冶炼行业,性质稳定。
还有一种是桶装(250kg/桶),供货链相对稳定。
4、俄罗斯镍1#(99.98%):俄罗斯进口,84*99*3,可以说是三种镍中外观较差的镍,表面不光滑,颗粒多,1.5t左右的捆包,单片较薄,大约在30-40公斤左右。
绝大多数用于炼钢、合金,很少用于电镀。
5、新疆镍1#(99.98%):新疆有色金属集团生产,外观类似俄镍,1.5t左右的捆包,较小,主要应用于合金、冶炼,少用于电镀。
其市场报价基本和俄镍持平。
(二)镍的化工产品简介目前市场上流通较多的是硫酸镍和氯化镍,品牌主要是金川和吉恩两种。
1、吉恩硫酸镍、氯化镍:吉林吉恩镍业股份有限公司生产,含量分别为Ni+co〉22.2%和Ni》24%,颜色分别为蓝色、绿色呈颗粒状,包装规格均为25kg/包,市场占有率高,含量较金川的大一些,相对市场价格也高一些。
2、金川硫酸镍、氯化镍:金川集团有限公司生产,含量分别为Ni+co〉21.7%和Ni》23.7%,颜色分别为蓝色、绿色呈颗粒状,包装规格均为25kg/包,外编内塑包装袋。
市场占有率较高,质量稳定。
第四讲金属镍的几种制法简述☆电解法☆羰基化法☆氢气还原法①电解法。
将富集的硫化物矿焙烧成氧化物,用炭还原成粗镍,再经电解得纯金属镍。
②羰基化法。
将镍的硫化物矿与一氧化碳作用生成四羰基镍,加热后分解,又得纯度很高的金属镍。
③氢气还原法。
用氢气还原氧化镍,可得金属镍。
第五讲中国镍矿分布及镍的生产布局(一)镍矿的分布中国区5个成矿区带:☆吉林省的红旗岭、赤柏松☆甘肃省的金川☆新疆维吾尔自治区的喀拉通克、黄山☆四川省的冷水菁、杨坪☆云南省的白马寨、墨江等镍矿我国镍矿类型主要分为硫化镍矿和红土镍矿,此外,还有极少量的其他类型镍矿。
多金属硫化镍矿在我国现有镍储量中占有较大比重,分属于5个成矿区带,主要是吉林省的红旗岭、赤柏松;甘肃省的金川;新疆维吾尔自治区的喀拉通克、黄山;四川省的冷水菁、杨坪;云南省的白马寨、墨江等镍矿。
较大的成矿区带主要分布在甘肃、新疆和吉林,较小的成矿区带主要分布在青海、陕西、四川、云南。
云南和四川两省,已探明大量品位在0.6%~1.2%的氧化镍矿。
甘肃省金川镍矿是世界第二大镍矿.但全国总储量也只有784万吨,居世界第九。
我国镍矿分布就大区来看,主要分布在西北、西南和东北,其保有储量占全国总储量的比例分别为76.8%、12.1%、4.9%。
就各省(区)来看,甘肃储量最多,占全国镍矿总储量的62%,其次是新疆(11.6%)、云南(8.9%)、吉林(4.4%)、湖北(3.4%)和四川(3.3%)。
(二)镍矿生产布局中国区四个大型的镍生产基地:☆金川有色金属公司——甘肃金川镍矿☆吉林镍业公司——红旗岭镍矿及镍业公司所属的几个镍矿☆新疆有色金属铜镍公司——新疆喀拉通克铜镍矿☆四川铜镍有限责任公司——成都电冶厂和拉拉铜矿整体改组而成我国开采的镍矿山有10多个,但主要的还是甘肃金川镍矿、吉林红旗岭镍矿及镍业公司所属的几个镍矿。
光是金川镍矿,1994年的采矿量就达165万t,占全国总采矿量的82.5%(表3.10.9)。
电解镍产量占全国镍产量的78.7%。
此外新疆喀拉通克铜镍矿已建成,年采矿能力7.5万t,云南白马寨铜镍矿已建成,年采矿能力1.5万t。
金川有色金属公司是我国镍的最大生产者,金川镍矿60年代投产后,使我国镍的生产发生了重大变化,其一期工程建成后,年产电解镍能力达到2万t,“八五”期间又完成了二期工程,扩建后使电解镍的能力翻了一番,达到4万t/a。
1995年产镍33024t、铜14725t、钴390t、贵金属528kg、硫酸10.05万t。
吉林镍业公司在吉林省磐石县红旗岭镇,矿山建于1960年,是目前我国第二大镍金属生产基地,所形成的生产能力:富家矿设计井下采供矿600t/d,大岭矿井下采供矿400t/d,漂河矿露天采矿200t/d,选矿处理矿量1500t/d,冶炼高冰镍2625t/d。
1995年实际产高冰镍(含镍量)4567t、硫酸镍1100t、铜精矿(含铜量)760t、硫酸1.28万t。
新疆有色金属铜镍公司(即原新疆可可托海矿务局)在新疆阜康市,始建于1950年,是集采矿、选矿、冶炼为一体的大型有色金属联合企业,拥有可可托海稀有金属矿、喀拉通克铜镍矿、阜康冶炼厂。
1984年后公司确立了“推广稀有、大搞有色”的企业发展方针后,分别建成年产2400t铝锭的电解铝厂、年产3500t高冰镍的喀拉通克铜镍矿和以铜镍冶炼为主的、年产2040t电解镍的阜康有色金属冶炼基地。
四川铜镍有限责任公司由成都电冶厂和拉拉铜矿整体改组而成,是一个以有色金属开采、冶炼、加工为主的国有全资公司。
公司现有日采选铜矿石1500t、年产电解镍5000t、电解铜5000t、电解钴60t和含硫活性镍100t的生产能力。
会理镍矿是1958年以四川力马河铜镍矿床为依据设计建成的,1966年形成采选规模500t,粗炼规模1200t镍金属量的生产能力。
1983年力马河坑口主矿体采尽,1986~1992年在盐边冷水菁逐步建成100t/d采选矿山,1995年盐边采选的能力改扩建成300t/d的能力,选矿工程已于当年年底全部竣工,整个改扩建工程于1996年完成,尽管如此,1995年仍生产高冰镍(含镍量)1053.7t。
除了上述四个大型的镍生产基地外,四川重庆、浙江和河南的一些冶炼厂也生产电解镍。
第六讲、中国镍矿的生产现状☆ 60年代以前我国一直缺镍☆ 1963年建成金川镍矿后,我国镍的供需形势才得到明显改变☆ 1995年我国镍矿产量居俄、日、加拿大、澳大利亚、挪威之后,排名世界第6位。
☆我们镍产量世界排名仍然第6位,消费量世界排名第二,预计2010年我国镍的生产量将进入世界第3-5位,消费量将达到世界第一。
60年代以前我国一直缺镍,虽然50年代四川力马河镍矿基地建成,并于1959年首次产出高冰镍,但当时生产能力每年不过1000t高冰镍。
直到60年代建成吉林省盘石镍矿,特别是1963年建成金川镍矿后,我国镍的供需形势才得到明显改变。
1995年我国镍矿石的出矿量达到292.25万t,生产镍精矿(含镍量)4.18万t,高冰镍(含镍量)4.19万t,镍金属3.89万t,镍材1335t。
图3.10.9示出了我国镍金属产量近30年来的增长情况。
图3.10.9镍产量增长曲线全世界1995年精炼镍总产量为91.6万t。
从镍产量来看,1995年我国位居俄罗斯(20.19万t)、日本(13.5万t)、加拿大(12.15万t)、澳大利亚(7.73万t)、挪威(5.32万t)之后,位居世界第6位。
经过40多年的艰苦奋斗,目前我国已经发展成为拥有10多个镍矿山,年出矿450万t 左右的能力,形成年生产电解镍4万t、副产电解铜2.5万t、电解钴及钴盐含钴1100t、铂族金属及金、银等贵金属的生产大国。
我过精炼镍产量世界排名仍然第6位,消费量世界排名第二,预计2010年我国镍的生产量将进入世界第3-5位,消费量将达到世界第一。
第七讲、全球镍矿资源分布☆全球镍矿资源的分布☆已探明储量及占世界总量的份额全球镍资源分布主要集中在古巴的东北部镍矿、加拿大萨德伯里镍矿、俄罗斯诺列尔斯克镍矿、澳大利亚西北部卡尔古利镍矿、新喀里多尼亚镍矿、菲律宾苏里高镍矿和中国的金川镍矿。
其中:澳大利亚:镍矿储量为2200万吨,占世界总量的35.48% ;古巴:镍矿储量为1800万吨,占世界总量的29.03%;俄罗斯:镍矿储量为660万吨,占世界总量的10.65%;加拿大:镍矿储量为620万吨左右,占世界总量的10.05%;印度尼西亚(320万吨)、缅甸(92万吨)和越南(12万吨);我国镍矿储量257.95万吨。
