实验室制备氧气的三种方法
制取氧气的三种方法

制取氧气的三种方法
实验室中有三种常见的制取氧气的方法:一、氯酸钾制取氧气;二、高锰酸钾制取氧气;三、过氧化氢制取氧气(实验室中最常见的方法)。
氧气,化学式O₂,相对分子质量
32.00,无色无味气体,氧元素最常见的单质形态。
熔点-218.4℃,沸点-183℃。
不易溶于水,1L水中溶解约30mL氧气。
氯酸钾制取氧气
化学式:2KClO3==(催化剂MnO2写在横线上方)2KCl+3O2(气体上升符号)
优点:利用率高
高锰酸钾制取氧气
化学式:2KMnO4==(反应条件:加热)K2MnO4+MnO2+O2(气体上升符号)
优点:不需要催化剂
过氧化氢制取氧气(实验室中最常见的方法)
化学式:2H2O2==(催化剂MnO2写在横线上方)2H2O+O2
优点:不需要加热,环保节能。
实验室制取氧气的方法

实验室制取氧气的方法氧气在实验室中是一种非常常见的气体,它在化学实验、生物实验以及其他实验中都有着重要的作用。
制取氧气的方法有很多种,下面将介绍几种常用的方法。
首先,最常见的方法是通过加热过氧化氢来制取氧气。
过氧化氢(H2O2)在加热的过程中会分解成水和氧气,化学方程式为2H2O2→2H2O+O2。
在实验室中,可以将过氧化氢溶液加热至80℃左右,通过吸收器收集生成的氧气。
这种方法制取的氧气纯度较高,适用于一些对氧气纯度要求较高的实验。
其次,还可以通过加热氯酸钾来制取氧气。
氯酸钾(KClO3)在加热的过程中也会分解成氧气和氯化钾,化学方程式为2KClO3→2KCl+3O2。
在实验室中,可以将氯酸钾加热至高温,通过吸收器收集生成的氧气。
这种方法制取的氧气也具有较高的纯度,适用于一些对氧气纯度要求较高的实验。
另外,还可以通过电解水来制取氧气。
电解水是将水分解成氢气和氧气的过程,化学方程式为2H2O→2H2+O2。
在实验室中,可以使用电解装置,将水进行电解,从而分离出氧气。
这种方法制取的氧气也具有较高的纯度,适用于一些对氧气纯度要求较高的实验。
最后,还可以通过过氧化锰和硫酸的反应来制取氧气。
过氧化锰和硫酸反应会释放出氧气,化学方程式为2KMnO4+3H2SO4→K2SO4+2MnSO4+3H2O+5O2。
在实验室中,可以将过氧化锰和硫酸混合,从而释放出氧气。
这种方法制取的氧气也具有较高的纯度,适用于一些对氧气纯度要求较高的实验。
总的来说,实验室中制取氧气的方法有很多种,可以根据实验的需要选择合适的方法。
无论是加热过氧化氢、氯酸钾,还是电解水、过氧化锰和硫酸的反应,都可以制取到具有较高纯度的氧气,满足实验的需求。
希望以上介绍的方法可以对您在实验室制取氧气时有所帮助。
制取氧气的三种方法整理版
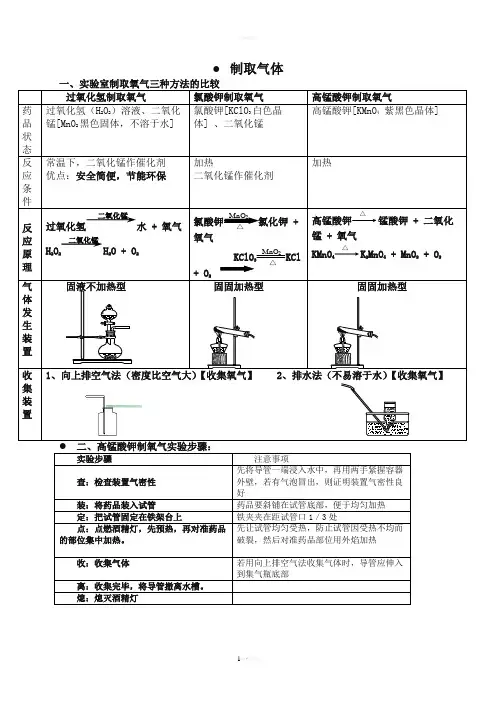
● 制取气体一、实验室制取氧气三种方法的比较 过氧化氢制取氧气 氯酸钾制取氧气 高锰酸钾制取氧气药品状态 过氧化氢(H 2O 2)溶液、二氧化锰[MnO 2黑色固体,不溶于水] 氯酸钾[KClO 3白色晶体] 、二氧化锰高锰酸钾[KMnO 4 紫黑色晶体]反应条件 常温下,二氧化锰作催化剂 优点:安全简便,节能环保 加热二氧化锰作催化剂加热反应原理 过氧化氢水 + 氧气 H 2O 2H 2O + O 2氯酸钾MnO 2△氯化钾 + 氧气 KClO 3 MnO 2 △ KCl + O 2高锰酸钾△锰酸钾 + 二氧化锰 + 氧气KMnO 4 △ K 2MnO 4 + MnO 2 + O 2气体发生装置固液不加热型 固固加热型 固固加热型 收集装置1、向上排空气法(密度比空气大)【收集氧气】2、排水法(不易溶于水)【收集氧气】 ● 二、高锰酸钾制氧气实验步骤:实验步骤 注意事项查:检查装置气密性先将导管一端浸入水中,再用两手紧握容器外壁,若有气泡冒出,则证明装置气密性良好装:将药品装入试管药品要斜铺在试管底部,便于均匀加热 定:把试管固定在铁架台上铁夹夹在距试管口1/3处点:点燃酒精灯,先预热,再对准药品的部位集中加热。
先让试管均匀受热,防止试管因受热不均而破裂,然后对准药品部位用外焰加热 收:收集气体若用向上排空气法收集气体时,导管应伸入到集气瓶底部离:收集完毕,将导管撤离水槽。
熄:熄灭酒精灯二氧化锰二氧化锰验满方法:(1)用排水法收集时,如果集气瓶口有大气泡冒出时说明收集满(2)向上排空气法,将带火星的木条放在集气瓶口若木条复燃证明集满。
操作注意事项:1.收集氧气可以用排水法的原因是什么?答:氧气不易溶于水也不与水反应2、利用固体加热制取氧气,试管口为什么要略向下倾斜?答:目的是防止冷凝水回流到试管底部而使试管炸裂。
3、伸入试管中的导气管为什么刚刚露出橡皮塞即可呢?答:导气管太长,不利于气体导出。
制取氧气的三种方法整理版
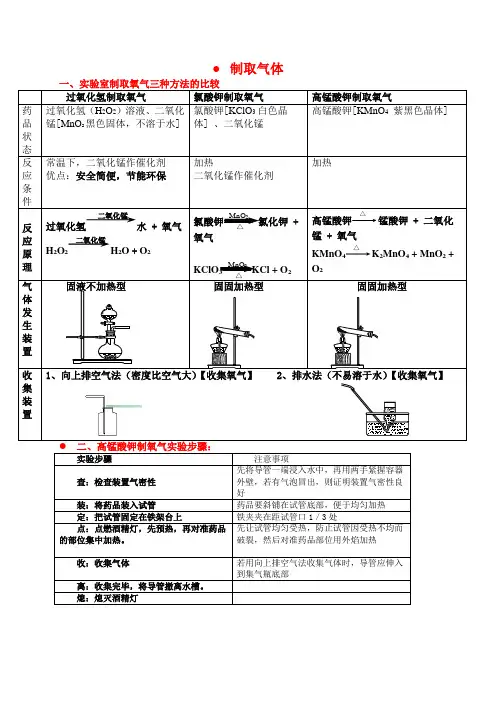
● 制取气体过氧化氢制取氧气 氯酸钾制取氧气 高锰酸钾制取氧气药品状态 过氧化氢(H 2O 2)溶液、二氧化锰[MnO 2黑色固体,不溶于水] 氯酸钾[KClO 3白色晶体] 、二氧化锰高锰酸钾[KMnO 4 紫黑色晶体]反应条件 常温下,二氧化锰作催化剂 优点:安全简便,节能环保 加热二氧化锰作催化剂加热反应原理 过氧化氢水 + 氧气 H 2O 2H 2O + O 2氯酸钾MnO 2△氯化钾 + 氧气 KClO 3 MnO 2 △ KCl + O 2 高锰酸钾△锰酸钾 + 二氧化锰 + 氧气KMnO 4△K 2MnO 4 + MnO 2 +O 2气体发生装置固液不加热型固固加热型固固加热型收集装置1、向上排空气法(密度比空气大)【收集氧气】2、排水法(不易溶于水)【收集氧气】 实验步骤 注意事项查:检查装置气密性先将导管一端浸入水中,再用两手紧握容器外壁,若有气泡冒出,则证明装置气密性良好装:将药品装入试管药品要斜铺在试管底部,便于均匀加热 定:把试管固定在铁架台上铁夹夹在距试管口1/3处点:点燃酒精灯,先预热,再对准药品的部位集中加热。
先让试管均匀受热,防止试管因受热不均而破裂,然后对准药品部位用外焰加热 收:收集气体若用向上排空气法收集气体时,导管应伸入到集气瓶底部离:收集完毕,将导管撤离水槽。
熄:熄灭酒精灯二氧化锰二氧化锰验满方法:(1)用排水法收集时,如果集气瓶口有大气泡冒出时说明收集满(2)向上排空气法,将带火星的木条放在集气瓶口若木条复燃证明集满。
操作注意事项:1.收集氧气可以用排水法的原因是什么?答:氧气不易溶于水也不与水反应2、利用固体加热制取氧气,试管口为什么要略向下倾斜?答:目的是防止冷凝水回流到试管底部而使试管炸裂。
3、伸入试管中的导气管为什么刚刚露出橡皮塞即可呢?答:导气管太长,不利于气体导出。
4、实验前,为什么要先给试管预热?答:为了使试管底部均匀受热,防止破裂。
5、加热高锰酸钾制取氧气,试管口为什么要放一团棉花?答:防止加热时,高锰酸钾颗粒随气流进入导气管。
实验室制取氧气的方法

实验室制取氧气的方法
首先,最常见的方法是通过加热含氧化金属的过氧化物来制取
氧气。
在实验室中,常用的过氧化物有过氧化钠、过氧化钾等。
当
过氧化物受热分解时,会释放氧气。
具体操作时,将过氧化物放入
烧杯中,然后用酒精灯或Bunsen燃烧器加热,通过导管收集生成的
氧气。
其次,还可以利用电解水来制取氧气。
电解水是利用电流将水
分解成氢气和氧气的过程。
在实验室中,可以使用电解池来进行电
解水实验。
在电解池中,加入适量的硫酸或氢氧化钠,然后通电分
解水,收集生成的氧气。
另外,还可以通过高温分解金属氧化物来制取氧气。
在实验室中,常用的金属氧化物有二氧化锰、二氧化铜等。
将金属氧化物置
于加热设备中,加热至一定温度,金属氧化物会分解释放出氧气,
通过收集装置收集氧气。
除了以上几种方法,实验室中还可以利用化学反应来制取氧气。
例如,可以通过过氧化氢和二氧化锰的反应来制取氧气。
过氧化氢
和二氧化锰反应生成氧气和水,通过分液漏斗等装置分离出氧气。
总的来说,实验室制取氧气的方法有多种,可以根据实际需求选择合适的方法。
在操作过程中,需要注意安全,避免氧气泄漏和火灾等意外事件的发生。
希望以上介绍的内容对大家有所帮助。
制取氧气的三种方法整理版
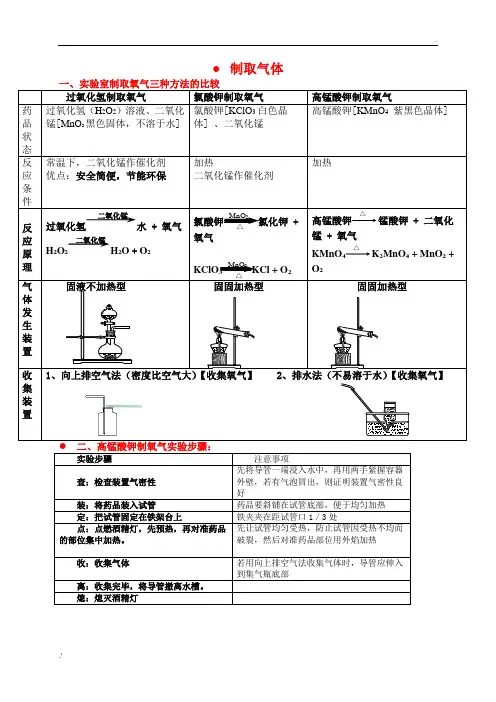
● 制取气体过氧化氢制取氧气 氯酸钾制取氧气 高锰酸钾制取氧气药品状态 过氧化氢(H 2O 2)溶液、二氧化锰[MnO 2黑色固体,不溶于水] 氯酸钾[KClO 3白色晶体] 、二氧化锰高锰酸钾[KMnO 4 紫黑色晶体]反应条件 常温下,二氧化锰作催化剂 优点:安全简便,节能环保 加热二氧化锰作催化剂加热反应原理 过氧化氢水 + 氧气 H 2O 2H 2O + O 2氯酸钾MnO 2△氯化钾 + 氧气 KClO 3 MnO 2 △ KCl + O 2 高锰酸钾△锰酸钾 + 二氧化锰 + 氧气KMnO 4△K 2MnO 4 + MnO 2 +O 2气体发生装置固液不加热型固固加热型固固加热型收集装置1、向上排空气法(密度比空气大)【收集氧气】2、排水法(不易溶于水)【收集氧气】 实验步骤 注意事项查:检查装置气密性先将导管一端浸入水中,再用两手紧握容器外壁,若有气泡冒出,则证明装置气密性良好装:将药品装入试管药品要斜铺在试管底部,便于均匀加热 定:把试管固定在铁架台上铁夹夹在距试管口1/3处点:点燃酒精灯,先预热,再对准药品的部位集中加热。
先让试管均匀受热,防止试管因受热不均而破裂,然后对准药品部位用外焰加热 收:收集气体若用向上排空气法收集气体时,导管应伸入到集气瓶底部离:收集完毕,将导管撤离水槽。
熄:熄灭酒精灯二氧化锰二氧化锰验满方法:(1)用排水法收集时,如果集气瓶口有大气泡冒出时说明收集满(2)向上排空气法,将带火星的木条放在集气瓶口若木条复燃证明集满。
操作注意事项:1.收集氧气可以用排水法的原因是什么?答:氧气不易溶于水也不与水反应2、利用固体加热制取氧气,试管口为什么要略向下倾斜?答:目的是防止冷凝水回流到试管底部而使试管炸裂。
3、伸入试管中的导气管为什么刚刚露出橡皮塞即可呢?答:导气管太长,不利于气体导出。
4、实验前,为什么要先给试管预热?答:为了使试管底部均匀受热,防止破裂。
5、加热高锰酸钾制取氧气,试管口为什么要放一团棉花?答:防止加热时,高锰酸钾颗粒随气流进入导气管。
化学实验室制取氧气的三种方法
化学实验室制取氧气的三种方法
嘿,朋友们!今天咱就来讲讲化学实验室制取氧气的三种超有趣的方法!
先来说说加热高锰酸钾制取氧气吧!就好像我们做饭,把高锰酸钾这个“食材”放在试管这个“锅”里,加上酒精灯这个“大火炉”加热,哇塞,氧气就慢慢跑出来啦!比如,你想想看,就像煮汤的时候,热气腾腾,香味扑鼻,氧气不就是这样被“煮”出来的吗!
还有分解过氧化氢制取氧气。
这就像是一场奇妙的魔法,过氧化氢在二氧化锰这个“魔法催化剂”的作用下,“噗噗”地就变出了氧气。
哎呀呀,这不是和变魔术一样神奇嘛!咱可以想象一下,过氧化氢是个小懒虫,二氧化锰就是那个催它动起来的小精灵,一下子就变出了氧气这个宝贝。
最后呢,就是加热氯酸钾制取氧气啦。
这就像是给氯酸钾这个“小家伙”洗了个热乎乎的“热水澡”,它一高兴,氧气就跑出来啦。
好比我们冬天泡个热水澡,浑身舒畅,氯酸钾也是这样呢!
总之啊,这三种方法各有各的奇妙,各有各的乐趣!实验真是太神奇啦,不是吗!。
氧气的实验室制法
氧气的实验室制法制取方法高锰酸钾制取氧气氯酸钾制取氧气过氧化氢制取氧气所用药品高锰酸钾(紫色固体)氯酸钾(白色粉末)、二氧化锰(黑色粉末)过氧化氢(无色液体)、二氧化锰(黑色粉末)反应原理2MnO42MnO4+MnO2+O2↑2ClO32Cl+3O2↑2H2O22H2O+O2↑发生装置固体加热型固固加热型固液不加热型收集装置选择依据:氧气不易溶于水且不与水反应选择依据:氧气的密度比空气大,且不与空气各成分反应优点稍加热就分解,不用催化剂;反应速度适中,便于收集反应速度适中,便于收集;和高锰酸钾相比,药品白色,仪器容易清洗;相同质量的ClO3和MnO4,ClO3生成的氧气多不用加热,节约能源;生成物只有水,利于环保;二氧化锰容易回收缺点需要加热,操作麻烦、浪费能源;使用紫色的高锰酸钾,不易清洗仪器和桌面需要加热,操作麻烦、浪费能源;反应中生成刺激性气味、污染空气的氯气作为反应物的过氧化氢不宜长时间保存且浓度太大时反应速度太快,不宜控制检验方法将一根带火星的木条伸入瓶内,如果木条复燃,证明集气瓶内的气体是氧气。
验满方法①用向上排空气法收集时,将一根带火星的木条放在瓶口,如果木条复燃,证明集气瓶内氧气已收集满。
②用排水法收集时,集气瓶口出现大气泡时,说明已收集满氧气。
总之,从是否节约能源、是否利于环保、操作是否简单等方面综合比较,最适合在实验室制取氧气的方法是用过氧化氢制取氧气的方法(1)步骤:可概括为:“查”“装”“定”“点”“收”“离”“熄”,谐音记忆为“茶庄定点收利息”。
(2)注意的问题:①药品要平铺在试管底部,均匀受热。
②试管口要略向下倾抖,防止药品中的水分或反应生成的水受热后变成水蒸气,遇冷凝结成水滴倒流回试管底部,使试管炸裂。
③铁架台上的铁夹要夹在试管的中上部(或距离管口1/3处)。
④试管内的导管稍伸出橡皮塞即可,便于气体导出。
⑤集气瓶充满水后倒放入水槽中(瓶口要在水面下)。
⑥加热时要先使试管均匀受热,然后用酒精灯外焰对准药品所在部位加热。
制取氧气的三种方法整理版
制取气体过氧化氢制取氧气 氯酸钾制取氧气 高锰酸钾制取氧气药品状态 过氧化氢(H 2O 2)溶液、二氧化锰[MnO 2黑色固体,不溶于水] 氯酸钾[KClO 3白色晶体] 、二氧化锰 高锰酸钾[KMnO 4 紫黑色晶体]反应条件 ,常温下,二氧化锰作催化剂 优点:安全简便,节能环保加热二氧化锰作催化剂加热反应原理 过氧化氢水 + 氧气 H 2O 2H 2O + O 2氯酸钾MnO 2△氯化钾 + 氧气 KClO 3 MnO 2 △ KCl + O 2高锰酸钾△锰酸钾 + 二氧化锰 + 氧气KMnO 4 △ K 2MnO 4 + MnO 2 + O 2: 气体发生装置固液不加热型 固固加热型 固固加热型 收集装置1、向上排空气法(密度比空气大)【收集氧气】2、排水法(不易溶于水)【收集氧气】 实验步骤 注意事项查:检查装置气密性/先将导管一端浸入水中,再用两手紧握容器外壁,若有气泡冒出,则证明装置气密性良好装:将药品装入试管药品要斜铺在试管底部,便于均匀加热 定:把试管固定在铁架台上铁夹夹在距试管口1/3处点:点燃酒精灯,先预热,再对准药品的部位集中加热。
先让试管均匀受热,防止试管因受热不均而破裂,然后对准药品部位用外焰加热收:收集气体 若用向上排空气法收集气体时,导管应伸入到集气瓶底部}离:收集完毕,将导管撤离水槽。
熄:熄灭酒精灯二氧化锰,验满方法:(1)用排水法收集时,如果集气瓶口有大气泡冒出时说明收集满(2)向上排空气法,将带火星的木条放在集气瓶口若木条复燃证明集满。
操作注意事项:1.收集氧气可以用排水法的原因是什么·答:氧气不易溶于水也不与水反应2、利用固体加热制取氧气,试管口为什么要略向下倾斜答:目的是防止冷凝水回流到试管底部而使试管炸裂。
3、伸入试管中的导气管为什么刚刚露出橡皮塞即可呢答:导气管太长,不利于气体导出。
4、实验前,为什么要先给试管预热答:为了使试管底部均匀受热,防止破裂。
制取氧气的三种方法整理版
制取氧气的三种方法整理版本页仅作为文档封面,使用时可以删除This document is for reference only-rar21year.March制取气体过氧化氢制取氧气氯酸钾制取氧气高锰酸钾制取氧气药品状态过氧化氢(H2O2)溶液、二氧化锰[MnO2黑色固体,不溶于水]氯酸钾[KClO3白色晶体] 、二氧化锰高锰酸钾[KMnO4紫黑色晶体]反应条件常温下,二氧化锰作催化剂优点:安全简便,节能环保加热二氧化锰作催化剂加热反应原理过氧化氢水 + 氧气H2O2H2O + O2氯酸钾MnO2△氯化钾 +氧气KClO3MnO2△KCl+ O2高锰酸钾△锰酸钾 + 二氧化锰 + 氧气KMnO4△K2MnO4+ MnO2+ O2气体发生装置固液不加热型固固加热型固固加热型收集装置1、向上排空气法(密度比空气大)【收集氧气】2、排水法(不易溶于水)【收集氧气】二、高锰酸钾制氧气实验步骤:实验步骤注意事项查:检查装置气密性先将导管一端浸入水中,再用两手紧握容器外壁,若有气泡冒出,则证明装置气密性良好装:将药品装入试管药品要斜铺在试管底部,便于均匀加热定:把试管固定在铁架台上铁夹夹在距试管口1/3处点:点燃酒精灯,先预热,再对准药品的部位集中加热。
先让试管均匀受热,防止试管因受热不均而破裂,然后对准药品部位用外焰加热收:收集气体若用向上排空气法收集气体时,导管应伸入到集气瓶底部二氧化锰离:收集完毕,将导管撤离水槽。
熄:熄灭酒精灯验满方法:(1)用排水法收集时,如果集气瓶口有大气泡冒出时说明收集满(2)向上排空气法,将带火星的木条放在集气瓶口若木条复燃证明集满。
操作注意事项:1.收集氧气可以用排水法的原因是什么答:氧气不易溶于水也不与水反应2、利用固体加热制取氧气,试管口为什么要略向下倾斜答:目的是防止冷凝水回流到试管底部而使试管炸裂。
3、伸入试管中的导气管为什么刚刚露出橡皮塞即可呢答:导气管太长,不利于气体导出。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
这几张图片都是潜水员潜水时 拍摄的 那么请问同学们你们知 道潜水员在水中是怎样呼吸的 呢?在陆地上我们大家都呼吸 着大自然通过化学反应制造的 氧气,那么实验室制取氧气我 们是怎么制取和收集的呢???
茶 庄 定 点 收 利 息
装置图
分解过氧化氢(H2O2)[加入二氧化锰 (MnO2)]
文字表达式 过氧化氢
二氧化锰
水+氧气
化学方程式 2 H2O2
MnO2
2H2O+O2
装置图
加热氯酸钾(KClO3)和二氧化锰(MnO2) 的混合物
文字表达式 氯酸钾 二氧化锰 氯化钾+氧气 化学表达式 2KCIO3
加热高锰酸钾(KMnO4)
文字表达式 高锰酸钾 锰+氧气 化学表达式 2KMnO4
加热
锰酸钾+二氧化
K2MnO4+MnO2+O2
实验步骤
1 2 3 4 5 6 7
查 装 定 点 收 离 熄
(检查装置气密性) (装药品 塞紧单孔塞) (固定试管在铁架台上) (点燃酒精灯预热后固定加热) (收集气体) (从水槽中移离导管) (熄灭酒精灯)
实验室制备氧气的三种方法
主讲人 焦静
实验室制备氧气常用的三种方法
加热高锰酸钾(KMnO4) 分解过氧化氢(H2O2)[加入二氧化锰(MnO2)] 加热氯酸钾(KClO3)和二氧化锰(MnO2)的 混合物
药品颜色及状态
KMnO4暗紫色 粉末 H2O2 无色 液体 MnO2 黑色 固体 KCLO3 白色 固体
加热 MnO2
2KCI+3O2
装置图
小结
2KMnO4 2 H2O2 2KCIO3 K2MnO4+MnO2+O2
MnO2
2H2O+O2 2KCI+3O2
MnO2
复习
ห้องสมุดไป่ตู้
氧气的性质 物理性质 在通常状况下 氧气是一种无色无味 不溶于水的气体 在标准状况下 氧气的密度是1.429g/L 比空气(1.293g/L)的密度略大 在室温下1L 水中只能溶解约30mL氧气 在压强为101kPa是,氧气在-183℃时变为 淡蓝色液体,在-218℃时变为淡蓝色雪花状的固体。 化学性质 氧气能使带火星的木条复燃,能使燃着的木条燃烧更剧烈,说明氧气 支持燃烧 氧气是一种性质非常活泼的气体 它能与很多物质发生反应(如硫 木 炭 铁等)
