【化学】:2.2.3《化学平衡与等效平衡》课件(新人教版选修4)
合集下载
人教版高中化学选修四课件2.3《化学平衡(第1课时)》ppt

③2NO2 N2O4 与 N2O4 2NO2 ④2SO2+O2催化 △剂2SO3 与 2SO3催化 △剂2SO2+O2
A.①②
B.②③
C.③④
D.②④
【解析】 可逆反应必须是在同一条件同时向两个方向进行 的反应。
【答案】 C
2.14CO2 与碳在高温条件下发生反应:14CO2+C 到平衡后,平衡混合物中含 14C 的粒子有( )
因此有 0.4≤a≤1.3,0≤b≤0.9。
【答案】 (1)a-b=0.4 (2)0.4≤a≤1.3
学生分组探究二 化学平衡的标志 第 1 步探究——问题引入,自主探究 1.化学平衡的基本标志是什么? 【提示】 v 正=v 逆与各组分的浓度保持不变。 2.若反应体系的总压强不变,该可逆反应一定达平衡了吗?
溶解 结晶
溶液中的溶质。
2.可逆反应与不可逆反应 (1)可逆反应 在 同一条件 下,既能向 正反应 方向进行又能向 逆反应 方 向进行的反应。 (2)不可逆反应 有些反应的逆反应进行程度太小因而可忽略,把几乎完全进 行的反应叫不可逆反应,用“ === ”号连接反应物和生成物。例 如:Ba2++SO24-===BaSO4↓。
【答案】 A
4.在一定条件下,可逆反应 A2(g)+B2(g) 2C(g)达到平衡 时,A2、B2 和 C 的浓度分别为 0.5 mol/L、0.1 mol/L、1.6 mol/L, 若用 a、b、c 分别表示 A2、B2、C 的初始浓度(mol/L),则:
(1)a、b 应满足的关系是__。 (2)a 的取值范围是__。 【解析】 (1)由于在建立平衡的过程中 A2、B2 的浓度变化相 同,所以二者平衡浓度之差应等于 a 与 b 的差。 a mol/L-b mol/L=0.5 mol/L-0.1 mol/L=0.4 mol/L,即 a-b =0.4。
A.①②
B.②③
C.③④
D.②④
【解析】 可逆反应必须是在同一条件同时向两个方向进行 的反应。
【答案】 C
2.14CO2 与碳在高温条件下发生反应:14CO2+C 到平衡后,平衡混合物中含 14C 的粒子有( )
因此有 0.4≤a≤1.3,0≤b≤0.9。
【答案】 (1)a-b=0.4 (2)0.4≤a≤1.3
学生分组探究二 化学平衡的标志 第 1 步探究——问题引入,自主探究 1.化学平衡的基本标志是什么? 【提示】 v 正=v 逆与各组分的浓度保持不变。 2.若反应体系的总压强不变,该可逆反应一定达平衡了吗?
溶解 结晶
溶液中的溶质。
2.可逆反应与不可逆反应 (1)可逆反应 在 同一条件 下,既能向 正反应 方向进行又能向 逆反应 方 向进行的反应。 (2)不可逆反应 有些反应的逆反应进行程度太小因而可忽略,把几乎完全进 行的反应叫不可逆反应,用“ === ”号连接反应物和生成物。例 如:Ba2++SO24-===BaSO4↓。
【答案】 A
4.在一定条件下,可逆反应 A2(g)+B2(g) 2C(g)达到平衡 时,A2、B2 和 C 的浓度分别为 0.5 mol/L、0.1 mol/L、1.6 mol/L, 若用 a、b、c 分别表示 A2、B2、C 的初始浓度(mol/L),则:
(1)a、b 应满足的关系是__。 (2)a 的取值范围是__。 【解析】 (1)由于在建立平衡的过程中 A2、B2 的浓度变化相 同,所以二者平衡浓度之差应等于 a 与 b 的差。 a mol/L-b mol/L=0.5 mol/L-0.1 mol/L=0.4 mol/L,即 a-b =0.4。
第三节 化学平衡课件 人教版高中化学选修四

t0
t1
t2
牙齿的损坏实际是牙釉质[Ca5(PO4)3OH] 溶解的结果。在口腔中存在着如下平衡:
Ca5(PO4)3OH
5Ca2+ + 3PO43- + OH-
当糖附着在牙齿上发酵时,会产生H+,试用
化学平衡理论说明经常吃甜食对牙齿的影响。
(二)压强对化学平衡的影响
450℃时N2与H2反应生成NH3的实验数据
2.意义:增大成本较低的反应物的浓度, 提高成本较高的反应物的转化率。
思考: 1、在二氧化硫转化为三氧化硫的过 程中,应该怎样通过改变浓度的方法 来提高该反应的程度?
2、可逆反应H2O(g)+C(s) CO(g)+H2(g) 在一定条件下达平衡状态,改变下列条件,
能否引起平衡移动?CO浓度有何变化?
N2 (g) + 3H2 (g)
2NH3 (g)
压强/MPa 1 5 10 30 60 100
NH3% 2.0 9.2 16.4 35.5 53.6 69.4
【讨论】分析上表数据,你能得出何结论? 随着压强的增大,NH3的含量在增大,即平衡向着生 成NH3的正反应方向移动。
2. V(正) > V(逆) 故:平衡向正反应方向移动。
增大反应物浓度 v
速率-时间关系图
V(正) 原平衡
V(逆)
V’ (正) 新平衡
V’ (逆)
0 增大反应物浓度 t
讨论:对于该反应达到平衡时,按以上方法分析以下情况, 化学平衡将如何移动?
减少反应物浓度
1. V(正)突然减小、 V(逆)瞬间不变
第二章 化学反应速率和化学平衡
§2.3 化学平衡 (第2课时)
化学平衡的移动
高中化学 第2章 第3节 化学平衡(第3课时)课件 新人教选修4

SO2 a% O2 b% SO3 c%
平衡状态
SO2 a% O2 b% SO3 c%
平衡状态
?SO2
O2 SO3
归纳总结
二、等效平衡的建成条件、判断方法及 产生结果: 1、恒温、恒容下对于气态物质反应前后 分子数变化的可逆反应等效平衡的 判断方法是:
使用极限转化的方法将各种情况变换成 同一反应物或生成物,然后观察有关物 质的物质的量是否对应相等。
0
a
•1、纪律是集体的面貌,集体的声音,集体的动作,集体的表情,集体的信念。 •2、知之者不如好之者,好之者不如乐之者。 •3、反思自我时展示了勇气,自我反思是一切思想的源泉。 •4、在教师手里操着幼年人的命运,便操着民族和人类的命运。一年之计,莫如树谷;十年之计,莫如树木;终身之计,莫如树人。 •5、诚实比一切智谋更好,而且它是智谋的基本条件。 •6、做老师的只要有一次向学生撒谎撒漏了底,就可能使他的全部教育成果从此为之失败。2022年1月2022/1/302022/1/302022/1/301/30/2022 •7、凡为教者必期于达到不须教。对人以诚信,人不欺我;对事以诚信,事无不成。2022/1/302022/1/30January 30, 2022 •8、教育者,非为已往,非为现在,而专为将来。2022/1/302022/1/302022/1/302022/1/30
a%
充 4mol 2mol 0
0
a%
入 2mol 2mol
0
0
b% (a≠b)
开始 2SO2
2mol SO2 1mol O2
4mol SO2 2mol O2
催化剂
+ O2 加热
平衡状态 SO2 a% O2 b% SO3 c%
人教版高二化学选修四化学平衡等效平衡课件
二、等效平衡的基本标志或结果
反应混合物中各组分的质量分 数、体积分数、物质的量分数均 相同
人教版高二化学选修四化学平衡等效 平衡课 件
三、等效平衡的判断方法 任何状态的体系,都用“极端状态”
来比较,通过可逆反应的化学计量数换 算成同一边物质
四、等效平衡的分类
完全等同——相同组分的分数和物质的量 都相同(等量等比) (等同等效)
等效平衡建成条件的探究二
恒温恒容下,H2 (g)+I2 (g) • 途径1起始 2 mol 1mol • 途径2起始 1mol 0 • 途径3起始 4mol 2mol • 途径4起始 3mol 1mol
2HI(g) 0
1mol 0
2mol
途径2、 3、4与 途径1 等效吗?
500℃ 1L
500℃
1L
比例相同——相同组分的分数相同、物质 的量不等(等比不等量) (等比等效)
人教版高二化学选修四化学平衡等效 平衡课 件
人教版高二化学选修四化学平衡等效 平衡课 件
探究一
恒温恒容条件下等效平衡的条件
1、反应前后气体分子数发生变化的可逆反应 也就是△n(g)≠0的可逆反应
人教版高二化学选修四化学平衡等效 平衡课 件
D.3mol C + 1mol D 2molA+1molB
E、1molA+0.5molB+1.5molC+0.5molD
(1+1)molA+ (0.5+0.5)molB
课堂练习
2、某温度下,在一个容积恒定的密闭容器中发生如下可逆 反应:CO(g)+H2O(g) CO2(g)+H2(g) △H<0 , 反应达到 平衡时,测得容器中各物质均为nmol,现欲使H2的平衡浓度 增大一倍,在其他条件不变时,下列措施可以采用的是
化学人教版高中选修4化学平衡优秀课件

v v正’ v正’= v逆’ v 平衡状态2
逆’
v正 v正= v逆 v逆 平衡状态1
t1
t2
t3
t4
t2:增大压强 t4:减小压强
t
mA(g) + nB(g) pC(g) + qD(g)
(1)m+n > p+q时 (2)m+n < p+q时 (3)m+n = p+q时
增大压强或减小压强时 平衡如何移动?新旧平 衡的速率大小比较。
下表中压强变化和NH3含量的关系,分析
压强对化学平衡的影响:
5 10 30
60
100
9.2 16.4 35.5 53.6 69.4
总结: mA(g) + nB(g)
pC(g) + qD(g)
若 m+n > p+q P↑ 平衡正向移动 新旧平衡比较:
CA ↑ 、 CB↑ 、 C↑C 、 ↑CD A的转化率↑ B的转化率 ↑ A% ↓ 、B%↓ 、C%↑ 、D↑%
讨论: 起始
N2 + 3H2 1 mol 3 mol
2NH3 (恒T、V) 达平衡状态1
③加入B,A的转化率减小 ④加入催化剂,气体总的物质的量不变
⑤加压使容器体积减小,A或B的浓度一定增大 ⑥若A的反应速率为vA,则B的反应速率vB=(n/m)vA A、①②④⑤ B、①②③⑤ C、①②③⑥ D、③④⑤⑥
压强
1
(MPa)
NH3 % 2.0
体积分数
N2(g)+3H2(g)
2NH3(g) ,试根据
故对化学平衡移动没有影响,只是能改变反应达平衡所需时间。
v
v正’= v逆’
人教版高中化学选修四2.3《化学平衡(第一课时)化学平衡状态》教学课件优秀课件PPT

止。 (4)定:当可逆反应达到平衡时,各组分的质量(或浓度)
为一 定值 。 (5)变:若外界条件改变,平衡可能发生 改变 ,并在
新条件下 建立新的平衡 。
16
人教版 ·化学 ·选修4
2.将一定量的 N2、H2 充入某密闭容器中达到化学平衡, 试画出该过程的 v-t 图象。
提示:此过程的 v-t 图象为:
和固体溶质的 质量 都保持不变,由此可知,固体物质的溶
解过程是
可逆
过程。可表示为:固体溶质
溶解 结晶
溶液中的
溶质。
3
人教版 ·化学 ·选修4
2.可逆反应
在 相同条件 下,既能向 正反应 方向进行又能向
逆反应 方向进行的反应。可表示为: 反应物 生成物
正反应 逆反应
4
人教版 ·化学 ·选修4
1.H2 和 O2 反应生成 H2O 与 H2O 分解生成 H2 和 O2 互为可逆反应吗?
9
人教版 ·化学 ·选修4
2 . 在 一 定 量 的 密 闭 容 器 中 进 行 反 应 : N2(g) + 3H2(g) 2NH3(g)。已知反应过程中某一时刻 N2、H2、NH3 的浓度分别为 0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1。当反 应达到平衡时,可能存在的数据是( )
平 衡 体 系 中 各 物 质 的 浓 度 范 围 为 N2∈(0,0.2) ,
H2∈(0,0.6),NH3∈(0,0.4)。
13
人教版 ·化学 ·选修4
知识点 化学平衡状态 [学生预习区]
1.化学平衡的建立 在一定条件下,把某一可逆反应的反应物加入固定容积 的密闭容器中。反应过程如下: 反应开始,v 正最 大 ,v 逆为 零 ,进行中反应物 浓度 减小 ,→v 正逐渐 减小 ,生成物浓度 增大 →v 逆逐 渐 增大 ,最大限度时,v 正 = v 逆,反应混合物中各 组分的浓度 不变 。
为一 定值 。 (5)变:若外界条件改变,平衡可能发生 改变 ,并在
新条件下 建立新的平衡 。
16
人教版 ·化学 ·选修4
2.将一定量的 N2、H2 充入某密闭容器中达到化学平衡, 试画出该过程的 v-t 图象。
提示:此过程的 v-t 图象为:
和固体溶质的 质量 都保持不变,由此可知,固体物质的溶
解过程是
可逆
过程。可表示为:固体溶质
溶解 结晶
溶液中的
溶质。
3
人教版 ·化学 ·选修4
2.可逆反应
在 相同条件 下,既能向 正反应 方向进行又能向
逆反应 方向进行的反应。可表示为: 反应物 生成物
正反应 逆反应
4
人教版 ·化学 ·选修4
1.H2 和 O2 反应生成 H2O 与 H2O 分解生成 H2 和 O2 互为可逆反应吗?
9
人教版 ·化学 ·选修4
2 . 在 一 定 量 的 密 闭 容 器 中 进 行 反 应 : N2(g) + 3H2(g) 2NH3(g)。已知反应过程中某一时刻 N2、H2、NH3 的浓度分别为 0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1。当反 应达到平衡时,可能存在的数据是( )
平 衡 体 系 中 各 物 质 的 浓 度 范 围 为 N2∈(0,0.2) ,
H2∈(0,0.6),NH3∈(0,0.4)。
13
人教版 ·化学 ·选修4
知识点 化学平衡状态 [学生预习区]
1.化学平衡的建立 在一定条件下,把某一可逆反应的反应物加入固定容积 的密闭容器中。反应过程如下: 反应开始,v 正最 大 ,v 逆为 零 ,进行中反应物 浓度 减小 ,→v 正逐渐 减小 ,生成物浓度 增大 →v 逆逐 渐 增大 ,最大限度时,v 正 = v 逆,反应混合物中各 组分的浓度 不变 。
人教版化学选修四化学平衡教学课件
(2)若按原反应物比例同倍数增大A和B的量,平衡右移, 达新平衡时:
①当a + b > c + d 时, A、B的转化率都增大
②当a + b < c + d 时, A、B的转化率都减小 ③当a + b = c + d 时, A、B的转化率都不变
人教版化学选修四化学平衡
人教版化学选修四化学平衡
2.特殊:反应物只有一种时,如:aA(g)
温度从T1上升到T2,由于吸增加得多,相应物质的浓度减少 得多,将使其速率减缓;而相反方向的物质浓度增加得多,将 使其速率增加,最终达到吸=放,建立新的平衡状态为止。
例. 对于达平衡的可逆反应
X+Y W+Z,增大压强则正、逆反应 速度(v)的变化如上图,分析可知X,Y, Z,W的聚集状态是
(A)Z,W为气体,X,Y中之一为气体
人教版化学选修四化学平衡
人教版化学选修四化学平衡
例3:图中表示外界条件(T、P)的变化对下列
反应的影响:L(s)+G(g) 2R(g),
△H﹥0,y 轴表示的是( B )
(A) 平衡时,混合气中R的百分含量 (B) 平衡时,混合气中G的百分含量 (C) G的转化率 (D) L的转化率
人教版化学选修四化学平衡
PCl5
①
2.T、V 2mol
减压
T、2V 2mol
PCl5
PCl5
平衡态 ③
T、V
加压
平衡态 ② T、2V
人教版化学选修四化学平衡
人教版化学选修四化学平衡
练习1:在一密闭容器中,用等物质的量的A和B发生如下反应:
A(g) +2B(g) 2C(g) ,反应达到平衡时,若混和气体中A和B
人教版高中化学选修4第二章第三节 化学平衡 课件(共14张PPT)
百分含量与原平衡相比
;②通入一定量B,平衡 移动,
达到平衡时A百分含量与原平衡相比 。
(3)保持容器容积不变,通入一定量氖气,则A的转化率
,
保持压强不变,通入氖气使体系的容积增大一倍,A的转化
率
。
(1)正向 减小 逆向 减小 (2)正向 不变 逆向 不变
2.已知一定温度和压强下,在VL的密闭容器中充有 1molA和1molB,保持恒温恒压,使反应
程式表示,其中一个只含a和c,另一个只含b和c)
a+c=4
b+5c/4=5 。
(2)在恒温恒容条件下,对反应前后气体体积x 相等的可逆反应,只要反应物(或生成物)的物 质的量的比例与原平衡相同,则两平衡等效。
特点:平衡时各组分的百分含量相同,浓度、物质的量不
同(与原用量成比例)
例题:在一个固定体积的密闭容器中,加2molA,
1molB,发生反应:
A(g)+B(g)
2C(g)达到平衡时,C
的质量分数为w%,在相同条件下按下列情况充入
物质,达到平衡时C的质量分数仍为w%的是(CD )
A、2molC
B、3molC
C、4molA,2molB D、1molA,2molC
(3)在恒温恒压条件下,改变起始时加入物质 的物质的量,只要按化学计量数换算成同一边物 质的物质的量之比与原平衡相同时,则达到平衡 后与原平衡等效。 特点:平衡时各组分的浓度、百分含量相同,物 质的量不同(与原用量成比例)
A(g)+B(g)
C(g)
达到平衡时,C的体积分数为40%。欲使温度和
压强在上述条件下恒定不变,在密闭容器中充入
2molA和2molB,则反应达到平衡时,容器的体积
为
人教化学选修4化学平衡PPT(19页)
平衡常数的数学表达式 K c p (C) • cq (D)
cm ( A) • cn (B)
【思考】平衡浓度的单位是mol·L-1,请问平衡常数K有 没有单位?
3.平衡常数的单位 ∵浓度的单位为mol·L-1 ∴K的单位为(mol·L-1)n;n=p+q-m-n
人教化学选修4化学平衡PPT(19页)
Ag+( aq)+Cl-(aq)
⑥ Cr2072-(aq)+H20 Cr042-(aq)+2H+(aq)
人教化学选修4化学平衡PPT(19页)
人教化学选修4化学平衡PPT(19页)
【思考与交流】
(1)比较①和②,分析平衡常数表达式的 书写与哪些因素有关?
(2)比较②和③,分析正、逆反应的平衡 常数之间的关系
起始时浓度mol/L
c (H2)
c(I2) c (HI)
0.0119 0.00694 0 74
平衡时浓度mol/L
c[H2]
c[I2]
c[HI]
0.00561 0.000593 0.0127
7
6
0
平衡时
c2 (HI)
c(H2) ·c(I2)
48.38
0.0122 0.00996 84
0 0.00384 0.001524 0.0168 48.61
人教化学选修4化学平衡PPT(19页)
【练习】请写出下表中各反应的平衡常数表达式并
回答问题
反应
Kc 单位
① 1/2N2(g)+3/2H2(g)
NH3(g)
② N2(g)+3H2(g)
2NH3(g)
③ 2NH3(g)
N2(g)+3H2(g)
cm ( A) • cn (B)
【思考】平衡浓度的单位是mol·L-1,请问平衡常数K有 没有单位?
3.平衡常数的单位 ∵浓度的单位为mol·L-1 ∴K的单位为(mol·L-1)n;n=p+q-m-n
人教化学选修4化学平衡PPT(19页)
Ag+( aq)+Cl-(aq)
⑥ Cr2072-(aq)+H20 Cr042-(aq)+2H+(aq)
人教化学选修4化学平衡PPT(19页)
人教化学选修4化学平衡PPT(19页)
【思考与交流】
(1)比较①和②,分析平衡常数表达式的 书写与哪些因素有关?
(2)比较②和③,分析正、逆反应的平衡 常数之间的关系
起始时浓度mol/L
c (H2)
c(I2) c (HI)
0.0119 0.00694 0 74
平衡时浓度mol/L
c[H2]
c[I2]
c[HI]
0.00561 0.000593 0.0127
7
6
0
平衡时
c2 (HI)
c(H2) ·c(I2)
48.38
0.0122 0.00996 84
0 0.00384 0.001524 0.0168 48.61
人教化学选修4化学平衡PPT(19页)
【练习】请写出下表中各反应的平衡常数表达式并
回答问题
反应
Kc 单位
① 1/2N2(g)+3/2H2(g)
NH3(g)
② N2(g)+3H2(g)
2NH3(g)
③ 2NH3(g)
N2(g)+3H2(g)
高中化学 2.3化学平衡课件1 新人教版选修4
FeCl3+3KSCN 黄色
Fe(SCN)3+3KCl 红色
1、上述实验中化学平衡状态是否改变? 2、能否推知影响化学平衡状态的影响因素?
(一)浓度对化学平衡的影响 条件变化: 增加反应物浓度
平衡移动方向: 正向移动
v
v正
v正= v逆
v 逆 平衡状态1
t1
t2
v正’ v 逆’
v正’= v 逆’
平衡状态2
讨论3:试用“浓度对化学平衡的影响”来解释“用排饱和食盐
水法 收集Cl2可以抑制Cl2的溶解”。
分析: Cl2溶解于水,存在溶解平衡。
溶解的部分Cl2能与水反应: Cl2 + H2O
H+ + Cl- + HClO
讨论4: 牙齿的损坏实际是牙釉质[Ca5(PO4)3OH]溶解的结果。在 口腔中存在着如下平衡:
充入一定量的H2,当建立新平衡时( C )
A、CO、H2 的浓度都比原平衡时小
B、CO、H2 的浓度都比原平衡时大
C、H2O(g)、H2 的浓度都比原平衡时大
D、 H2O(g)、CO 的浓度都比原平衡时大
总结: mA(g) + nB(g)
pC(g) + qD(g) 恒T、V
瞬间速率变化
CA ↑
平衡移动方向 V’正 > V正
Ca5(PO4)3OH
5Ca2+ + 3PO43- + OH-
(1)当糖附着在牙齿上发酵时,会产生H+,试用化学平衡理 论说明经常吃甜食对牙齿的影响。
(2)已知Ca5(PO4)3F的溶解度比Ca5(PO4)3OH更小,质地更坚 固。请用化学方程式表示常用含NaF的牙膏刷牙,能预防龋齿的
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
恒温恒容 (△n(g)=0) 恒温恒压
等效平衡
课 堂 小 结
1、等效平衡的概念: 百分含量一样(浓度不一定一样) 2、 计算步骤: 首先判断:气体改变是否为“0”, 若不为“0” (1)一边倒(归零) (2)若是等温等容:起始量要相等 (3) 若是等温等压:起始量的比值要相等 若为“0”,则不管是等温等容或是等温等压: 起始量的比值要相等。
1 2
0
2 4
0.5
0 0
1
a 2a
0.5a
2、恒温恒压下,在一个可变容积的容器中发生如下 反应: H2(g) + Br2(g) 2HBr (g)已知加入1molH2 和2molBr2时,达到平衡后,生成amolHBr,(见下表 “已知”项)。在相同的条件下,改变起始加入情况, 填写表中空白: 编号 已知 (1) (2) 起始状态(mol) H2 1 2 0 Br2 2 4 0.5 HBr 0 0 1 0.5a 平衡时HBr物质的 量(mol) a 2a
加热
平衡2
2SO3
平衡3 kamol SO2 kbmol O2 kcmol SO3
在同温同压下达到下述三个平衡
平衡1
amol SO2 bmol O2 cmol SO3
amol SO2 bmol O2 cmol SO3
同一平衡
(等同等效)
等效平衡 (等比等效)
二、等效平衡的概念
同一个可逆反应,在相同的条件下,无论反应从 正反应方向开始,还是从逆方向开始,都可以达到 相同的平衡状态,即两种状态各组分的百分含量均 分别相等,这样的平衡称为等效平衡。
两种情况建立的化学平衡状态等比等效。
小结
类型 恒温恒容 (△n(g)≠0)
等效平衡类型
等效条件 投料换算成相 同物质表示时 量相同 投料换算成相 同物质表示时 等比例 投料换算成相 同物质表示时 等比例 结果 两次平衡时各组分百分 含量、n、c均相同 (全等平衡) 两平衡时各组分百分含 量相同,n、c同比例变 化 (相似平衡) 两次平衡时各组分百分 含量、c相同,n同比例 变化( 相似平衡)
处理方法 把不同的起始状态,通过化学方
程式中的计量数,换算成同一边物质(反应 物一边或生成物一边),如果各反应物或生 物质的量之比 成物的_____________相等,则是等效平衡。
练习 2 在恒温、恒压的条件下,向可变容积的密闭容器中充 入3LA和2LB,发生如下反应: 3A(气)+2B(气) xC(气)+yD(气)
开始
按倍数加料形成相似平衡
催化剂 加热
2SO2 + O2
起始(mol) : 2 SO 2mol SO2 平衡(mol) :x O SO 1mol O2 平衡时体积分数: a% 若起始(mol): 4
平衡状态 a% 2 b% 3 c%
2
2SO3
0 z
c%
1 y
b%
2
SO2 a% O2 b% SO3 c%
2SO2 + O2
2SO3
2; (1)若a=0,b=0,则c= (2)若a=0.5,则b=0.25 , c= 1.5 ; (3)a、b、c 取值必须满足一般的条件是(用两个方程式表 示,其中一个只含a和c,另一个只含b和c) , b+c/2=1 。 a+c=2
探究二
恒温恒压条件下等效平衡的条件
2、恒温恒压下,
2molA+1molB
(1+1)molA+ (0.5+0.5)molB
例2、在一定的温度下,把2molSO2和1molO2通入一定容积的
密闭容器里,发生如下反应: 催化剂 加热 当此反应进行到一定的程度时,反应混合物就处于化学平衡状 态。现在该容器中,维持温度不变,令a、b、c分别代表初始 加入的SO2、O2、和SO3的物质的量(mol)。如果a、b、c取不 同的数值,它们必须满足一定的相互关系,才能保证达到平衡 时反应混合物中三种气体的百分含量仍跟上述平衡时的完全相 同。请填写下列空白:
探究三
恒温恒容条件下等效平衡的条件
3 、反应前后气体分子数不变的可逆反应
也就是△n(g)=0的可逆反应
3、恒温恒容下, △n(g)=0按倍数加料形成等效平衡
起始(mol): 1 2 1 2 开始 平衡时(mol): x 平衡状态 y 起始(mol): 1 H 平衡时体积分数: a% 2 a% 1 b% 1mol H2 平衡时(mol): xI2 b% 2 y 若起始(mol) : 2 1mol I2 平衡时体积分数: a% 若起始(mol) : 0 HI c% 0 b%
第二章
第二节 化学平衡
等效平衡
学习目标: 1.理解和掌握等效平衡的概念, 2.理解几种类型的等效平衡及分析方法
3.提高分析问题和解决问题的能力
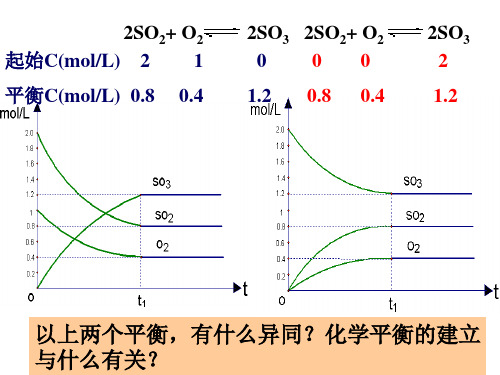
例: 2SO2+ O2 起始C(mol/L) 2 1 0.4
2SO3 0 1.2
2SO2+ O2 0 0.8 0 0.4
2SO3 2 1.2
平衡C(mol/L) 0.8
若起始(mol) :4
开始
4mol SO2 2mol O2 2mol SO2 1mol O2 2mol SO2
2
SO2 a% O2 b% SO3 c% SO2 a% O2 b% SO3 c%
1mol O2
SO2 a% 加压 SO2 <a% O2 b% O2 <b% SO3 c% SO3 >c%
2SO2 + O2
开始 2mol SO2 1mol O2 平衡状态 SO2 a% O2 b%
催化剂 加热
2SO3
相当于开始加 入1molSO2、 0.5molO2和 1molSO3
SO3 c%
开始 2mol SO3
平衡状态
SO2 a%
O2 b% SO3 c%
平衡状态
SO2 a% O2 b% SO3 c%
催化剂
2SO2 + O2
0
SO2 a% O2 b% SO3 c%
2mol SO2 1mol O2
4mol SO2 2mol O2
2mol SO2
1mol O2
SO2 a% O2 b% SO3 c%
探究二
恒温恒压条件下等效平衡的条件
2、恒温恒压条件下等效平衡的条件 请总结恒温恒压条件下的可逆反应等效平衡 的条件。 相同物质的起始物质的量之比相等
等效平衡
浓度/mol· -1 L
浓度/mol· -1 L 2.00 1.58
H2或I2 t1 时间/s 1.00 0.21 0.00 H2或I2 t2 从逆反应开始 时间/s HI
2.00 1.58
1.00 0.21 0.00
HI
从正反应开始
相当于
1molH2+1molI2
2molHI
催化剂
2SO2 + O2
0 H2 a% I2 b% HI c%
0
平衡状态
1mol H2 1mol I2
H2 a% I2 b% HI c%
探究三
恒温恒容条件下等效平衡的条件
请总结恒温恒容条件下(△n(g)=0)等效平 衡的条件。 3、反应前后气体计量数之和相等(△n(g)=0) 的可逆反应的等效平衡的条件
相同物质的起始物质的量之比相等。
加热
2SO3 0 2amol 2amol zmol
起始: 2mol 1mol Δt内改变:2amol amol t时后: (2-2a)mol (1-a)mol t1时刻后平衡:xmol ymol
分析:在同温同体积密闭容器中,起始时加入 (1)2molSO2+1molO2
(2) (2-2a)molSO2+(1-a)molO2+2amolSO3 达到平衡时 所建立平衡全等,即等同等效
(2)若开始时放入3molA和3molB,到达平衡后, 生成C的物质的量为 3a mol
(3)若开始时放入xmolA、2molB和1molC,到达 平衡后,C的物质的量是3amol,x= 2 mol。 (4)若在(3)的平衡混合物中再加入3molC,待再次 到达平衡后,C的物质的量是 6a mol.
探究一
恒温恒容条件下等效平衡的条件
请总结恒温恒容条件下( △n(g)≠0 )等效平 1、反应前后气体计量数之和不等( △n(g)≠0 ) 衡的条件。 的可逆反应的等效平衡的条件 相同物质的起始物质的量相等。
一边倒
处理方法 把不同的起始状态,通过化学方程
式中的计量数,换算成同一边物质(反应物一 边或生成物一边),如果各反应物或生成物的 物质的量 _______________相等,则是等效平衡。
恒温恒容
B.2mol A + 1mol B + 3mol C + 1mol D (2+2)molA+(1+1)molB C.3mol C + 1mol D +1mol B D.3mol C + 1mol D 2molA +(1+1)molB
E、1molA+0.5molB+1.5molC+0.5molD
处理方法 把不同的起始状态,通过化学方程
式中的计量数,换算成同一边物质(反应物一 边或生成物一边),如果各反应物或生成物的 物质的量之比 _______________相等,则是等效平衡。
例如,恒温恒容时H2(g) + Br2(g) ① ② 1mol 2mol 1mol 2mol
2HBr (g) 0mol 1mol
以上两个平衡,有什么异同?
一、化学平衡状态建立的途径:
催化剂
加热
2SO2 + O2
起始(1) 2 mol 起始(2) 0 起始(3) 1mol
