物理化学第九章课后题答案
物理化学答案——第九章-化学动力学基础
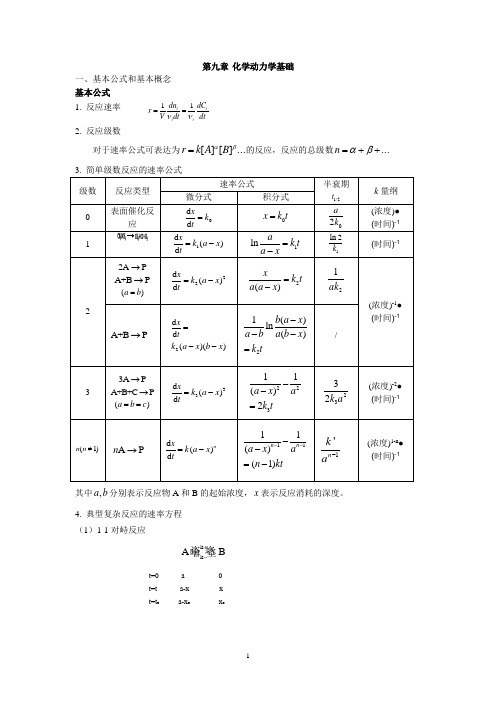
第九章 化学动力学基础一、基本公式和基本概念 基本公式 1. 反应速率 11i ii i dn dC r V dtdtνν==2. 反应级数对于速率公式可表达为...][][βαB A k r =的反应,反应的总级数...++=βαn 3. 简单级数反应的速率公式 级数 反应类型 速率公式半衰期 1/2tk 量纲微分式积分式0 表面催化反应0d d x k t =0x k t = 02a k (浓度)● (时间)-1 11d ()d x k a x t=-1lna k t a x=-1ln 2k(时间)-122A P→A +B P →()a b =22d ()d x k a x t=-2()x k t a a x =-21ak(浓度)-1●(时间)-1A +B P →2d d ()()xtk a x b x =--21()ln()b a x a b a b x k t---=/33A P→A +B +C P→()a b c ==33d ()d x k a x t=-22311()2a x a k t --=2332k a(浓度)-2● (时间)-1(1)n n ≠A P n →d ()d nx k a x t=-1111()(1)n n a x an kt----=-1'n k a-(浓度)1-n ● (时间)-1其中,a b 分别表示反应物A 和B 的起始浓度,x 表示反应消耗的深度。
4. 典型复杂反应的速率方程 (1)1-1对峙反应k k A B +-t=0 a 0 t=t a-x x t=t e a-x e x e速率方程: ()kk te e x x x e +--+-=(2)平行反应最简单的平行反应是由两个一级基元反应组成的平行反应:x=x 1+x 2速率方程:tk k aex a )(21+-=-产物B 和C 的浓度比由竞争反应的速率决定:2121k k x x = (3)连续反应最简单的连续反应是两个单向连续的一级反应:C B A kk −→−−→−21t=0 a 0 0 t=t x y z 速率方程:1k tx ae-=)(21121tk tk eek k a k y ----=]1[21121122tk tk ek k k ek k k a z ---+--=中间产物B 的浓度在反应过程中出现极大值:122)(21k k k m k k a y -=,出现极大值的时间为:2121)ln(k k k k tm-=5. 温度对反应速率的影响 (1)阿累尼乌斯经验公式2ln RTE dTk d a =阿累尼乌斯公式的指数函数式: RTE a Aek -=k 1k 2A a-xCx 2 B x 1(2)阿累尼乌斯活化能基元反应的活化能是活化分子的平均能量与所有分子平均能量之差。
物理化学第九章课后答案完整版

第九章 统计热力学初步1.按照能量均分定律,每摩尔气体分子在各平动自由度上的平均动能为2RT 。
现有1 mol CO气体于0 ºC 、101.325 kPa 条件下置于立方容器中,试求: (1)每个CO 分子的平动能ε; (2)能量与此ε相当的CO 分子的平动量子数平方和()222xy y nn n ++解:(1)CO 分子有三个自由度,因此,2123338.314273.15 5.65710 J 22 6.02210RT L ε-⨯⨯===⨯⨯⨯(2)由三维势箱中粒子的能级公式()(){}2222223223222222221233426208888828.0104 5.6571018.314273.15101.325106.626110 6.022103.81110x y zx y z h n n n ma ma mV m nRT n n n h h h p εεεε-=++⎛⎫∴++=== ⎪⎝⎭⨯⨯⨯⨯⨯⎛⎫= ⎪⨯⎝⎭⨯⨯⨯=⨯2.2.某平动能级的()45222=++zy xn n n,使球该能级的统计权重。
解:根据计算可知,x n 、yn 和z n 只有分别取2,4,5时上式成立。
因此,该能级的统计权重为g = 3! = 6,对应于状态452245425254245,,,,ψψψψψ542ψ。
3.气体CO 分子的转动惯量246m kg 1045.1⋅⨯=-I ,试求转动量子数J 为4与3两能级的能量差ε∆,并求K 300=T 时的kT ε∆。
解:假设该分子可用刚性转子描述,其能级公式为()()J 10077.31045.1810626.61220 ,81224623422---⨯=⨯⨯⨯⨯-=∆+=πεπεI h J J J22210429.710233807.130010077.3--⨯=⨯⨯⨯=∆kT ε4.三维谐振子的能级公式为()νεh s s ⎪⎭⎫ ⎝⎛+=23,式中s 为量子数,即,3 ,2 ,1 ,0=++=z y x s v v v 。
(完整版)中南大学物化课后习题答案9章可逆原电池

s e第9章 可逆原电池1.写出下列原电池中各电极反应、电池反应及E 的计算公式。
①② Pt,H 2(101325Pa)|KOH(a )|O 2(101325Pa),Pt③④解:(1) 负极 Pb(s)+(a) → PbSO 4(s)+2e正极 Cu 2+() + 2e →Cu(s)电池反应 Pb(s)+SO 4(a) + Cu 2+ (a Cu 2+) ==== PbSO 4(s)+Cu(s)(2) 负极 H 2( p Θ ) -2e → 2H + (a H +)正极 O 2( p Θ ) + H 2O +2e → 2OH -(a OH -)电池反应 H 2(p Θ)+ O 2(p Θ) → H 2O(l)(3) 负极 3H 2(p H2) - 6e → 6H +(aq)正极 Sb O (s) + 6e + 6H +(aq) → 2Sb(s) +3H O(l)电池反应 Sb2O3O(l)+3H2 (p H2) → 2Sb(s) + 3H2(4) 负极 Ag(s) + I -(a I -) → AgI(s) + e正极 AgCl(s) + e → Ag(s) + Cl - (a Cl-)-)电池反应 Agl(s) + I-(a I -) → Ag(s) + Cl - (a Cl2.试将下列化学反应设计成原电池(1)Zn(s) + H2SO4(a1) === ZnSO4(a2) + H2(p H2);(2)Ni(s) + H2O ==== NiO(s) + H2(p H2)(3)H2(p H2) + O2(p O2) ==== H2O(l);(4)H2(p H2) + HgO(s) ==== Hg(l) + H2O(l)解:(1)负极 Zn(s) -2e → Zn2+(a2)正极 2H+(a1) + 2e → H2(P H2)电池反应 Zn(s) +2H+(a1) ==== Zn2+(a2)+ H2(p H2)电池符号 Zn(s) | ZnSO4(a2) || H2SO4(a1) | H2(p H2),Pt(2) 负极 Ni(s) + 2OH -→NiO(s) + H2O +2e正极 2H2O + 2e →H2(p H2) +2OH -电极反应 Ni(s) + H2O==== NiO(s) + H2(p H2)电池符号 Ni(s),NiO(s) | KOH(稀) | H2(p H2), Pt(3)负极 H2(p H2) + 2OH -→ 2H2O + 2e正极 2H2O +2e → 2OH - + O2(p O2)电池反应 H2(p H2) + O2(p O2) ==== H2O(l)电池符号 Pt,H2(p H2) | NaOH(稀) | O2(p O2),Pt(4) 负极 H2(p H2) + 2OH -→2H2O +2e正极 HgO(s) + H2O +2e → Hg(l) +2OH -电池反应 H2(p H2) + HgO(s) ==== Hg(l) + H2O(l)电池符号 Pt ,H2(p H2) | KOH(稀) | HgO(s),Hg(l)3.工业上用铁屑加入硫酸铜溶液中以置换铜,试设计原电池;计算该反应在298.15K时的平衡常数,并说明此置换反应进行的完全程度。
【通用】《物理化学(第五版)》第九章复习题答案.ppt
演示课件
复习题
7.在公式ΔrGmΘ=-zEΘF中,ΔrGmΘ是否表示 该电池各物都处于标准态时,电池反应的 Gibbs自由能变化值?
答:在公式ΔrGmΘ=-zEΘF中,ΔrGmΘ表示该 电池各物都处于标准态时,在T,p保持不变 的条件下,按电池反应进行1mol的反应时 系统的Gibbs自由能变化值。
ln
m m'
高价型:Mz+Az-(m1)|Mz+Az-(m2)
E
j=
t z
- t- z 演示课-件
RT F
ln
m1 m2
基本公式
用可逆电池的测定值计算热力学函数变化
值
rGm zFE , rGm zFE
E
RT zF
ln
K
a
r Sm
( r Gm T
)p
E zF (T ) p
E
QR
T rSm
答:可逆电极有三种类型: (1)金属气体电极 如Zn(s)|Zn2+ (m) Zn2+(m) +2e- = Zn(s) (2)金属难溶盐和金属难溶氧化物电极 如:
Ag(s)|AgCl(s)|Cl-(m) AgCl(s)+ e- = Ag(s)+Cl-(m) (3)氧化还原电极 如: Pt|Fe3+(m1),Fe2+(m2) Fe3+(m1) +e- = Fe2+(m2) 对于气体电极和氧化还原电极,在书写时要标明电极
反应所依附的惰性金属。
演示课件
复习题
2.什么叫电池的电动势?用伏特表侧得的电 池的端电压与电池的电动势是否相同?为何 在测电动势时要用对消法?
物理化学傅献彩(下册)第五版课后习题答案解析精选全文完整版

专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
欢送您的光临,Word文档下载后可修改编辑.双击可删除页眉页脚.谢谢!你的意见是我进步的动力,希望您提出您珍贵的意见!让我们共同学习共同进步!学无止境.更上一层楼。
专ቤተ መጻሕፍቲ ባይዱ技术资料整理分享
可编辑修改精选全文完整版
WORD格式可编辑
物理化学傅献彩下册第五版课后习题答案
第九章可逆电池的电动势及其应用
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
专业技术资料整理分享
WORD格式可编辑
(完整word版)《物理化学》高等教育出版(第五版)第九章

第九章电解质溶液练习题一、判断题:1.溶液是电中性的,正、负离子所带总电量相等,则正、负离子离子的迁移数也相等。
2.离子迁移数与离子速率成正比,某正离子的运动速率一定时,其迁移数也一定。
3.离子的摩尔电导率与其价态有关系。
4.电解质溶液中各离子迁移数之和为1。
5.电解池通过l F电量时,可以使1mol物质电解。
6.因离子在电场作用下可以定向移动,所以测定电解质溶液的电导率时要用直流电桥。
7.无限稀电解质溶液的摩尔电导率可以看成是正、负离子无限稀摩尔电导率之和,这一规律只适用于强电解质。
8.电解质的无限稀摩尔电导率Λ∞m可以由Λm作图外推到c1/2 = 0得到。
下列关系式是否正确:(1) Λ∞,1<Λ∞,2<Λ∞,3<Λ∞,4(2)κ1=κ2=κ3=κ4(3)Λ∞,1=Λ∞,2=Λ∞,3=Λ∞,4(4)Λm,1=Λm,2=Λm,3=Λm,410.德拜—休克尔公式适用于强电解质。
11.对于BaCl2溶液,以下等式成立:(1) a = γb/b0;(2) a = a+·a - ; (3) γ± = γ+·γ - 2;(4) b = b+·b-;(5) b±3 = b+·b-2; (6) b± = 4b3。
12.若a(CaF2) = 0.5,则a(Ca2+) = 0.5 ,a(F-) = 1。
二、单选题:1.下列溶液中哪个溶液的摩尔电导最大:(A) 0.1M KCl水溶液;(B) 0.001M HCl水溶液;(C) 0.001M KOH水溶液;(D) 0.001M KCl水溶液。
2.对于混合电解质溶液,下列表征导电性的量中哪个不具有加和性:(A) 电导;(B) 电导率;(C) 摩尔电导率;(D) 极限摩尔电导。
3.在一定温度和较小的浓度情况下,增大强电解质溶液的浓度,则溶液的电导率κ与摩尔电导Λm变化为:(A) κ增大,Λm增大;(B) κ增大,Λm减少;(C) κ减少,Λm增大;(D) κ减少,Λm减少。
物理化学傅献彩(下册)第五版课后习题答案解析

专业技术资料整理分享
word格式可编辑专业技术资料整理分享物理化学傅献彩下册第五版课后习题答案第九章可逆电池的电动势及其应用word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享欢迎您的光临word文档下载后可修改编辑
《物理化学(第五版)》第九章复习题答案
复习题
8.有哪些求算标准电动势EΘ的方法?在公式E zF ln K 中,EΘ是否是电池反应达平衡时的电动势?KΘ是否是
zE F K exp RT
a
复习题
(8).醋酸的解离平衡常数。 电池:Pt|H2(pΘ)|HAc(mHAc),Ac-(mAc-),Cl-(aCl)|AgCl(s)|Ag(s) 净反应:AgCl(s)+H2(pΘ)→H+(aH+)+Cl-(aCl-) +Ag(s
1.可逆电极有哪些主要类型?每种类型试举一例,并写 出该电极的还原反应。对于气体电极和氧化还原电极 在书写电极表示式时应注意什么问题? 答:可逆电极有三种类型: (1)金属气体电极 如Zn(s)|Zn2+ (m) Zn2+(m) +2e- = Zn(s) (2)金属难溶盐和金属难溶氧化物电极 如: Ag(s)|AgCl(s)|Cl-(m) AgCl(s)+ e- = Ag(s)+Cl-(m) (3)氧化还原电极 如: Pt|Fe3+(m1),Fe2+(m2) Fe3+(m1) +e- = Fe2+(m2) 对于气体电极和氧化还原电极,在书写时要标明电极 反应所依附的惰性金属。
RT a H aCl E E ln zF a 1 2 H2 E RT ln m zF m
复习题
(6)Ag2O(s)的标准摩尔生成焓ΔfHmΘ 和分解压。 电池:Ag(s)+Ag2O(s)|OH-(aOH-)|O2(pΘ )|Pt 净反应:Ag2O(s)→1/2O2(pΘ )+2Ag(s) E r H m zE F zFT T p
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
9.14 已知气体2I 相邻振动能级的能量差J 20
10
426.0-⨯=∆ε,试求300K 时2I 分子的
0,,v v v v f q q 及Θ。
解:J h 20
10
426.0-⨯=∆=εν
K k
h v 5.308==Θν
当T=300K 时,9309.0)(1
22=-=-Θ-ΘT T
v v
v
e
e
q
557.1)1(10
=-=-Θ-T
v v
e
q
557.10
==v v q f
9.16已知气态I 原子的20,=e g ,21,=e g 电子第一激发态与基态能量之差
J e 2010510.1-⨯=∆ε,
试计算1000K 时气态I 原子的电子配分函数0
e q 以及在第一激发态的电子分布数1n 与总电子数N 之比。
解:
kT
e kT
e kT
i
i e e e e i
e e
g e
g e
g q 1
,0
,,1,0,,εεε---+==∑
67.2)exp(
221
,0,/0
0,=-+=⋅=kT
q e
q e e e kT
e e εεε
2509.00/1,11
,==-e
kT
e q e g N n e ε
9.17 1mol 2O 在298.15K ,100kPa 条件下,试计算 (1)2O 分子的平动配分函数t q ;
(2)2O 分子的转动配分函数r q ,已知2O 分子的平衡核间距m R 100102037.1-⨯=;
(3)2O 分子的振动配分函数v q 及0v q 。
已知2O 分子的振动频率1
1310666.4-⨯=s ν; (4)2O 分子的电子配分函数0e q ,已知电子基态30,=e g ,电子激发态可忽略。
解:(1)平动配分函数t q : m p
nRT h mkT V h mkT q t 3023
2
23210345.4)2()2(⨯===ππ (2)转动配分函数r q :
Ik
h r 2
28π=Θ 2
0R I μ= m R 100102037.1-⨯= 05.72=Θ=
σ
r r T
q (3)k
h v ν
=Θ
0234.0)(1
22=-=-Θ-ΘT T
v v
v
e
e
q
0005.1)1(10
=-=-Θ-T
v v
e
q
(4)由于电子激发态可以忽略,则 30,/0
0,===e e kT
e g q e
q e ε
9.21利用9.17题的结果计算25℃时氧气的标准摩尔熵Θm S (298.15K )。
解:e m v m r m t m m S S S S S ,,,,+++=Θ
Θ 其中⎭
⎬⎫⎩⎨⎧+-+
=Θ
723.20ln ln 25ln 23
,p T M R S t m ⎥⎦
⎤⎢⎣⎡Θ=σr r m T
R S ln ,+R 111,)1()1ln(-Θ--Θ-
-Θ+-=T
v T
v m v v
e
T R e
R S
,ln e
e m q R S = 那么11034.205--Θ
⋅⋅=K mol J S m
9.25用标准摩尔吉布斯自由能函数及标准摩尔焓函数计算下列合成氮反应在1000K 时的标准平衡常数,
)(2)(3)(322g NH g H g N →+
1311.46)15.298,(-Θ
⋅-=∆mol kJ K NH H m f
解:由上述已知条件可得
1322.92)15.298,(2)15.298(-Θ
Θ
⋅-=∆=∆mol kJ K NH H K H m f m r
{}{}∑-Θ
Θ
⋅-=-=-∆B
B m B m B m
m r mol kJ U K H U K H 1,,0,,0241.14)15.298
()15.298(ν 利用上述两式结果可以得
{}1,0,0979.77)15.298()15.298(-Θ
Θ
⋅-=-∆-∆=∆mol kJ U K H K H U m
m r m r m r
那么1000K 时反应的标准摩尔吉布斯自由能函数变为
1,,0,,,0179.202)1000)(()1000)((-Θ
Θ⋅=-=-∆∑mol kJ K T U G K T U G B
m B T m B
B m m r ν
那么
938
.141
)1000)((1ln ,0,0=∆+-∆=-Θ
Θ
m r m m r U RT
K T U G R K 则 710255.3-Θ
⨯=K。
