物理化学课后思考题习题答案
物理化学实验所有课后习题和思考题答案

物理化学实验所有课后习题和思考题答案Revised final draft November 26, 2020实验一燃烧热的测定1. 在本实验中,哪些是系统哪些是环境系统和环境间有无热交换这些热交换对实验结果有何影响如何校正提示:盛水桶内部物质及空间为系统,除盛水桶内部物质及空间的热量计其余部分为环境,系统和环境之间有热交换,热交换的存在会影响燃烧热测定的准确值,可通过雷诺校正曲线校正来减小其影响。
2. 固体样品为什么要压成片状萘和苯甲酸的用量是如何确定的提示:压成片状有利于样品充分燃烧;萘和苯甲酸的用量太少测定误差较大,量太多不能充分燃烧,可根据氧弹的体积和内部氧的压力确定来样品的最大用量。
3. 试分析样品燃不着、燃不尽的原因有哪些提示:压片太紧、燃烧丝陷入药片内会造成燃不着;压片太松、氧气不足会造成燃不尽。
4. 试分析测量中影响实验结果的主要因素有哪些本实验成功的关键因素是什么提示:能否保证样品充分燃烧、系统和环境间的热交换是影响本实验结果的主要因素。
本实验成功的关键:药品的量合适,压片松紧合适,雷诺温度校正。
5. 使用氧气钢瓶和氧气减压器时要注意哪些事项?提示:阅读《物理化学实验》教材P217-220实验二凝固点降低法测定相对分子质量1. 什么原因可能造成过冷太甚若过冷太甚,所测溶液凝固点偏低还是偏高由此所得萘的相对分子质量偏低还是偏高说明原因。
答:寒剂温度过低会造成过冷太甚。
若过冷太甚,则所测溶液凝固点偏低。
根据公式和可知由于溶液凝固点偏低,T f偏大,由此所得萘的相对分子质量偏低。
2. 寒剂温度过高或过低有什么不好?答:寒剂温度过高一方面不会出现过冷现象,也就不能产生大量细小晶体析出的这个实验现象,会导致实验失败,另一方面会使实验的整个时间延长,不利于实验的顺利完成;而寒剂温度过低则会造成过冷太甚,影响萘的相对分子质量的测定,具体见思考题1答案。
3. 加入溶剂中的溶质量应如何确定加入量过多或过少将会有何影响?答:溶质的加入量应该根据它在溶剂中的溶解度来确定,因为凝固点降低是稀溶液的依数性,所以应当保证溶质的量既能使溶液的凝固点降低值不是太小,容易测定,又要保证是稀溶液这个前提。
物理化学实验思考题答案(精心整理)

物理化学实验思考题答案(精心整理)实验11.不能,因为溶液随着温度的上升溶剂会减少,溶液浓度下降,蒸气压随之改变。
2.温度越高,液体蒸发越快,蒸气压变化大,导致误差愈大。
实验3实验5 T----X图1蒸馏器中收集气相冷凝液的袋状部的大小对结果有何影响?答:若冷凝管下方的凹形贮槽体积过大,则会贮存过多的气相冷凝液,其贮量超过了热相平衡原理所对应的气相量,其组成不再对应平衡的气相组成,因此必然对相图的绘制产生影响。
2若蒸馏时仪器保温条件欠佳,在气相到达平衡气体收集小槽之前,沸点较高的组分会发生部分冷凝,则T—x图将怎么变化?答:若有冷凝,则气相部分中沸点较高的组分含量偏低,相对来说沸点较低的组分含量偏高了,则T 不变,x 的组成向左或向右移(视具体情况而定)3 在双液系的气-液平衡相图实验中,所用的蒸馏器尚有那些缺点?如何改进?答:蒸馏器收集气相、液相的球大小没有设计好,应根据实验所用溶液量来设计球的规格;温度计与电热丝靠的太近,可以把装液相的球设计小一点,使温度计稍微短一点也能浸到液体中,增大与电热丝的距离;橡胶管与环境交换热量太快,可以在橡胶管外面包一圈泡沫,减少热量的散发。
4本实验的误差主要来源有哪些?答:组成测量:(1)工作曲线;(2)过热现象、分馏效应;(3)取样量。
温度测量:(1)加热速度;(2)温度计校正。
5.试推导沸点校正公式:实验12蔗糖水解速率常数的测定1蔗糖的转化速率常数k 与哪些因素有关?答:温度、催化剂浓度。
2在测量蔗糖转化速率常数的,选用长的旋光管好?还是短的旋光管好?答:选用较长的旋光管好。
根据公式〔α〕=α×1000/Lc ,在其它条件不变情况下,L 越长,α越大,则α的相对测量误差越小。
3如何根据蔗糖、葡萄糖和果糟的比旋光度计算α0和α∞?答:α0=〔α蔗糖〕D t ℃L[蔗糖]0/100α∞=〔α葡萄糖〕D t ℃L[葡萄糖]∞/100+〔α果糖〕D t ℃L[果糖]∞/100式中:[α蔗糖]D t ℃,[α葡萄糖]D t ℃,[α果糖]D t ℃分别表示用钠黄光作光源在t ℃时蔗糖、葡萄糖和果糖的比旋光度,L(用dm 表示)为旋光管的长度,[蔗糖]0为反应液中蔗糖的初始浓度,[葡萄糖]∞和[果糖]∞表示葡萄糖和果糖在反应完成时的浓度。
物理化学第二版课后思考题答案

第一章气体1.如何使一个尚未破裂而被打瘪的乒乓球恢复原状?采用了什么原理?答:将打瘪的乒乓球浸泡在热水中,使球的壁变软,球中空气受热膨胀,可使其恢复球状。
采用的是气体热胀冷缩的原理。
2.在两个密封、绝热、体积相等的容器中,装有压力相等的某种理想气体。
试问,这两容器中气体的温度是否相等?答:不一定相等。
根据理想气体状态方程,若物质的量相同,则温度才会相等。
3.两个容积相同的玻璃球内充满氮气,两球中间用一根玻管相通,管中间有一汞滴将两边的气体分开。
当左边球的温度为273K,右边球的温度为 293K时,汞滴处在中间达成平衡。
试问: (1) 若将左边球的温度升高 10K,中间汞滴向哪边移动? (2) 若将两个球的温度同时都升高 10K,中间汞滴向哪边移动?答:(1)左边球的温度升高,气体体积膨胀,推动汞滴向右边移动。
(2)两个球的温度同时都升高10K,汞滴仍向右边移动。
因为左边球的起始温度低,升高 10K所占的比例比右边的大,283/273大于 303/293,所以膨胀的体积(或保持体积不变时增加的压力)左边的比右边的大。
4.在大气压力下,将沸腾的开水迅速倒入保温瓶中,达保温瓶容积的0.7左右,迅速盖上软木塞,防止保温瓶漏气,并迅速放开手。
请估计会发生什么现象?答:软木塞会崩出。
这是因为保温瓶中的剩余气体被热水加热后膨胀,当与迅速蒸发的水汽的压力加在一起,大于外面压力时,就会使软木塞崩出。
如果软木塞盖得太紧,甚至会使保温瓶爆炸。
防止的方法是,在灌开水时不要灌得太快,且要将保温瓶灌满。
5.当某个纯的物质的气、液两相处于平衡时,不断升高平衡温度,这时处于平衡状态的气-液两相的摩尔体积将如何变化?答:升高平衡温度,纯物质的饱和蒸汽压也升高。
但由于液体的可压缩性较小,热膨胀仍占主要地位,所以液体的摩尔体积会随着温度的升高而升高。
而蒸汽易被压缩,当饱和蒸汽压变大时,气体的摩尔体积会变小。
随着平衡温度的不断升高,气体与液体的摩尔体积逐渐接近。
物理化学实验思考题及参考答案

物理化学实验思考题及参考答案物理化学实验思考题及参考答案在物理化学实验中,我们经常会遇到一些思考题,这些问题旨在帮助我们深入理解实验原理和现象。
在本文中,我们将讨论一些常见的物理化学实验思考题,并给出参考答案。
1. 为什么在酸碱滴定实验中,我们需要使用指示剂?在酸碱滴定实验中,我们使用指示剂来确定滴定终点。
指示剂是一种能够在酸碱溶液中显示颜色变化的物质。
这是因为指示剂分子的结构会随着溶液的酸碱性发生变化,从而导致颜色的改变。
通过观察颜色的变化,我们可以确定滴定终点,即酸碱溶液的摩尔比例达到了化学计量比。
2. 在电化学实验中,为什么我们需要使用盐桥?在电化学实验中,我们常常使用盐桥来连接两个电解池。
盐桥是由浸泡在盐水中的玻璃棒或纸条组成的。
它的作用是维持两个电解池中离子的平衡。
当电解池中的离子发生反应时,会产生正负电荷的不平衡。
盐桥通过离子的迁移来平衡这种电荷差异,使得电解池中的反应能够持续进行。
3. 在溶解度实验中,为什么我们需要加热?在溶解度实验中,加热可以增加溶质与溶剂之间的碰撞频率和能量,从而促进溶质的溶解。
根据热力学原理,加热可以增加系统的熵,使得溶解过程更加有利。
此外,加热还可以减小溶质与溶剂之间的相互作用力,从而降低溶质的溶解度。
4. 在气体收集实验中,为什么我们需要使用水槽?在气体收集实验中,我们通常会使用水槽来收集气体。
这是因为水槽中的水可以起到密封容器的作用,防止气体泄漏。
另外,水槽中的水还可以使得气体在收集过程中与空气隔离,避免与空气中的氧气或其他气体发生反应。
5. 在红外光谱实验中,为什么我们需要使用KBr片?在红外光谱实验中,我们通常会使用KBr片来制备样品。
这是因为KBr是一种透明的无机盐,它可以将样品均匀地分散在红外光谱仪的光束中。
此外,KBr本身在红外光谱范围内没有吸收峰,不会干扰样品的红外光谱图谱。
总结起来,物理化学实验中的思考题可以帮助我们更好地理解实验原理和现象。
物理化学课后思考题答案

第一章 热力学第一定律 1、 = 2、 升高 3、 =,=,= 5、=,=,=,> 12、降低 13、 0 0 0 0 < > 0 0 0 > > > < <或≈ < < ><或≈>>第二章 热力学第二定律1、不违反,该过程体系本身的压力、体积发生了变化。
2、不对,只有在孤立或绝热条件下熵增加原理才成立。
3、不对,⎰=∆TQ S Rδ,理想气体等温膨胀时有0ln 12>==∆V VnR T Q S R 。
6、系统若发生了绝热不可逆过程,是否可以设计一个绝热可逆过程来计算它的熵变?答:不可。
7、不一样。
绝热可逆才等熵。
10、 与0的关系 U ∆H ∆S ∆F ∆G ∆(1) = < > < < (2) > > > < = (3) = = > < < (4) < < = - - (5)==><<第三章 化学势与平衡 2、对3、错,溶剂遵从拉乌尔定律,溶质遵从亨利定律。
4、>5、错。
沸点升高要求非挥发性溶质,凝固点降低要求该过程溶质不析出。
6、错。
食盐在水中解离后使溶质的浓度发生改变。
15、C第四章 化学动力学 1、(1)错、(2)错、(3)错、(4)对、(5)错、(6)错、(9)催化剂只能改变反应速率,而不能改变化学反应的标准平衡常数。
对 (10)错 3、一级:1:2; 二级1:3。
4、如果想获得更多的产物B ,应该升温。
10、不变第五章 电化学2、不一样。
强电解质完全电离,可测定一系列不同浓度稀溶液的电导率,计算摩尔电导率,然后用公式()c m m β-Λ=Λ∞1线性拟合来求。
而弱电解质部分电离,只能由离子独立移动定律,通过强电解质的极限摩尔电导率来求。
3、1203907.0-⋅⋅mol m S 5、原电池的正极与阴极相对应,发生还原反应;负极与阳极相对应,发生氧化反应。
物理化学思考题含答案
比较以上两式得
B =b− a , C = b2 RT
7. 某系统由 A 态变到 B 态,经历两条不同途径,热、功、热力学 能变化、焓变化分别为 Q1、W1、 ΔU 1 、 ΔH 1 和 Q2、W2、 ΔU 2 、 ΔH 2 。 试指出下列表达式中,何者是正确的,何者不正确。(1) Q1 = Q2,W1 = W2 ; (2) ΔU 1 = ΔU 2 , ΔH 1 = ΔH 2 ; (3) Q1 +W1 = Q2 + W2 ; (4) ΔH 1 + ΔU 2 = ΔH 2 + ΔU 1 。 解:Q 和 W 是过程变量,U 和 H 是状态函数,并且 ΔU = Q + W , 所以表达式(2)、(3)、(4)正确,(1)不正确。 8. (1) 1 MPa 的气体反抗真空膨胀为 0.1 MPa, 见图 1-28; (2) 玻泡 中封有液体水, 在真空中破碎后变为 0.1 MPa 的水蒸气, 见图 1-29, 问: W > 0,W < 0,还是 W = 0。 解:(1) 取气体为系统, W = 0 。 (2) 取容器及其中的所有物质为系统, W = 0 。 9. (1) 烧杯中盛有 NaOH 水溶液,另有一玻泡封有 HCl 水溶液, 亦置于烧杯中。整个烧杯放在绝热箱内的冰水混合物中,见图 1-30。设
3 −6 −1
[
(
)]
严格服从范德华方程。 6. 如果气体服从范德华方程,试证明第二、第三维里系数与范德 华参数间存在如下关系: B = b − a / RT , C = b 2 。 证:由范德华方程得 ⎞ a RT a RT ⎛ RT ⎛ b b2 ⎞ a 1 ⎜ ⎜ ⎟ − 2 = − ≈ + + 2⎟ p= 1 2 ⎟ ⎜ ⎟− 2 Vm − b Vm Vm ⎜ ⎝ 1 − b Vm ⎠ Vm Vm ⎝ Vm Vm ⎠ Vm
物理化学实验课后思考题答案
实验五 燃烧热的测定
1、在本实验中,哪些是体系,哪些是环境?体系和环境通过哪些途径进行热交换?这些热交 换对结果的影响怎样? 答:氧弹、内筒及氧弹周围的水支架等是体系;恒温夹套、夹套与内筒之间的空气层以及外 界大气是环境;体系通过热辐射、热传导以及热对流的方式向环境中传递热量。这些热交换 可能会造成量热出现偏差,造成测量值不准(总热交换的形式不可知,故无法断定测量值是 偏大还是偏小)。 2、量热容器内的水温为什么要比恒温夹套内水温低?低多少为合适?为什么? 答:这样可以抵消与外部热交换的热量,减小实验误差。低 0.7-1℃合适,因为实验造成的水 温变化仅仅为 1.5-2.0℃,故低 0.7-1℃足以抵消热交换造成的偏差。
Kc
1.936 105
[H ]2 0.01 1 0.0404
[H ] 4.31 104 mol dm 3 pH
lg[H ] 3.4
同理可以计算 0.10.01mol·dm-3 时的 pH,假设结果为 2.8,比较两个 pH 可以发现,当浓度变 化 10 倍时,它们的 pH 变化不大,因为 Kc 在一定的温度 T 下式定值,溶液浓度 c 对氢离子浓 度[H+]影响很小,即溶液浓度的变化所引起的溶液中导电离子浓度的变化较小,从而对电导率 的影响不大;但是 NaCl 完全电离,其浓度的变化会直接影响溶液中导电离子浓度的变化,故 对电导率的影响较大。 4、各种难溶盐的 Ksp 数量级范围多大?哪一类盐的 Ksp 容易测准? 答:10-9~10-50,强电解的难溶盐,且阴阳离子相互作用小的难溶盐的 Ksp 容易测准。 5、测定 NaCl 无限稀释摩尔电导率所用的系列溶液浓度范围是否合适?此浓度范围如何选 定?在求无限稀释稀释摩尔电导率时用作图法和最小二乘法各有什么优缺点?在什么条件下 用最小二乘法准确度才较高? 答:恰当;所选的 NaCl 浓度应当较小并且应该形成倍数梯度;作图法数据处理量小,但是准 确度较差,最小二乘法准确度较高,但是数据处理量大。最小二乘法适用于对实验结果精确 度要求较高的情况,或者希望找出两个变量之间明确的函数关系的情况。 6、如果电导池常数标签丢失或者电导池长时间未使用,怀疑常数发生变化,如何校定? 答:测定高纯水的电导率。因为高纯水的电导率是已知的,不断调整校正旋钮,然后在测量 档位测量高纯水的电导率值。直到测得的示数与高纯水的电导率相当,那么再调至校正档位, 此时显示的值就是电导池常数。即电导池常数为:调整校正旋钮使测量示数与κ(水)相同时的 校正值。
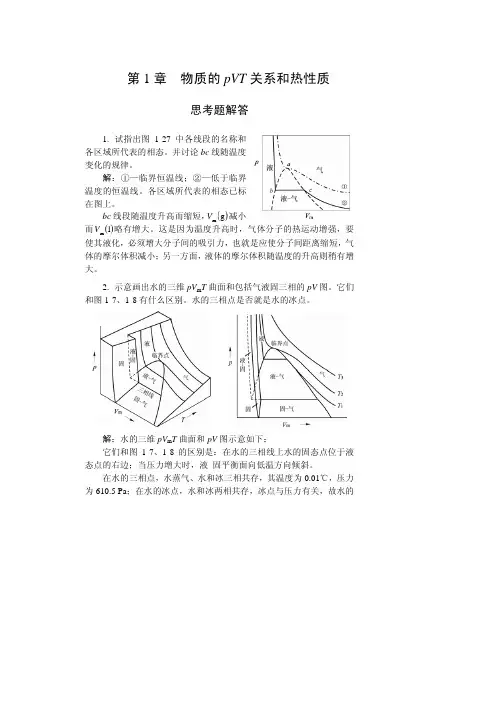
物理化学课后习题答案(全)
第1章 物质的pVT 关系和热性质习 题 解 答1. 两只容积相等的烧瓶装有氮气,烧瓶之间有细管相通。
若两只烧瓶都浸在100℃的沸水中,瓶内气体的压力为0.06MPa 。
若一只烧瓶浸在0℃的冰水混合物中,另一只仍然浸在沸水中,试求瓶内气体的压力。
解: 21n n n +=2212112RT V p RT V p RT V p +=⋅2111121222112p T p T T p T T T T =+⎛⎝⎜⎞⎠⎟=+ ∴112222p T T T p ⋅+=MPa0.0507=MPa 06.02)15.273100()15.2730(15.2730⎥⎦⎤⎢⎣⎡××++++=2. 测定大气压力的气压计,其简单构造为:一根一端封闭的玻璃管插入水银槽内,玻璃管中未被水银充满的空间是真空,水银槽通大气,则水银柱的压力即等于大气压力。
有一气压计,因为空气漏入玻璃管内,所以不能正确读出大气压力:在实际压力为102.00kPa 时,读出的压力为100.66kPa ,此时气压计玻璃管中未被水银充满的部分的长度为25mm 。
如果气压计读数为99.32kPa ,则未被水银充满部分的长度为35mm ,试求此时实际压力是多少。
设两次测定时温度相同,且玻璃管截面积相同。
解:对玻璃管中的空气,p V p V 2211=kPa 0.96=kPa )66.10000.102(35251212−×==p V V p ∴ 大气压力 = kPa 28.100kPa )96.032.99(=+·28· 思考题和习题解答3. 让20℃、20 dm 3的空气在101325 Pa 下缓慢通过盛有30℃溴苯液体的饱和器,经测定从饱和器中带出0.950 g 溴苯,试计算30℃时溴苯的饱和蒸气压。
设空气通过溴苯之后即被溴苯蒸气所饱和;又设饱和器前后的压力差可以略去不计。
(溴苯Br H C 56的摩尔质量为1mol g 0.157−⋅)解:n pV RT 131013252010831452027315==×××+⎡⎣⎢⎤⎦⎥−().(.) mol =0.832 mol n m M 209501570==..mol =0.00605mol p py p n n n 22212101325732==+=×= Pa 0.006050.832+0.00605 Pa4. 试用范德华方程计算1000 g CH 4在0℃、40.5 MPa 时的体积(可用p 对V 作图求解)。
物理化学实验所有课后习题和思考题答案完整版
物理化学实验所有课后习题和思考题答案集团标准化办公室:[VV986T-J682P28-JP266L8-68PNN]实验一燃烧热的测定1. 在本实验中,哪些是系统哪些是环境系统和环境间有无热交换这些热交换对实验结果有何影响如何校正提示:盛水桶内部物质及空间为系统,除盛水桶内部物质及空间的热量计其余部分为环境,系统和环境之间有热交换,热交换的存在会影响燃烧热测定的准确值,可通过雷诺校正曲线校正来减小其影响。
2. 固体样品为什么要压成片状萘和苯甲酸的用量是如何确定的提示:压成片状有利于样品充分燃烧;萘和苯甲酸的用量太少测定误差较大,量太多不能充分燃烧,可根据氧弹的体积和内部氧的压力确定来样品的最大用量。
3. 试分析样品燃不着、燃不尽的原因有哪些提示:压片太紧、燃烧丝陷入药片内会造成燃不着;压片太松、氧气不足会造成燃不尽。
4. 试分析测量中影响实验结果的主要因素有哪些本实验成功的关键因素是什么提示:能否保证样品充分燃烧、系统和环境间的热交换是影响本实验结果的主要因素。
本实验成功的关键:药品的量合适,压片松紧合适,雷诺温度校正。
5. 使用氧气钢瓶和氧气减压器时要注意哪些事项?提示:阅读《物理化学实验》教材P217-220实验二凝固点降低法测定相对分子质量1. 什么原因可能造成过冷太甚若过冷太甚,所测溶液凝固点偏低还是偏高由此所得萘的相对分子质量偏低还是偏高说明原因。
答:寒剂温度过低会造成过冷太甚。
若过冷太甚,则所测溶液凝固点偏低。
根据公式和可知由于溶液凝固点偏低,T f偏大,由此所得萘的相对分子质量偏低。
2. 寒剂温度过高或过低有什么不好?答:寒剂温度过高一方面不会出现过冷现象,也就不能产生大量细小晶体析出的这个实验现象,会导致实验失败,另一方面会使实验的整个时间延长,不利于实验的顺利完成;而寒剂温度过低则会造成过冷太甚,影响萘的相对分子质量的测定,具体见思考题1答案。
3. 加入溶剂中的溶质量应如何确定加入量过多或过少将会有何影响?答:溶质的加入量应该根据它在溶剂中的溶解度来确定,因为凝固点降低是稀溶液的依数性,所以应当保证溶质的量既能使溶液的凝固点降低值不是太小,容易测定,又要保证是稀溶液这个前提。
物理化学思考题及答案
物理化学思考题及答案物理化学思考题第⼀章⽓体第⼆章热⼒学第⼀定律第三章热⼒学第⼆定律6 第四章多组分系统热⼒学参考答案第⼀章⽓体1.理想⽓体模型是分⼦间____相互作⽤,分⼦____占有体积。
2.真实⽓体在____条件下,与理想⽓体状态⽅程偏差最⼩。
A ⾼温⾼压B ⾼温低压C 低温⾼压D 低温低压 3.判断这种说法对否:在临界点有:(PV)T=0 4.在100oC 下将CO2⽓体加压,能否使之液化?为什么? 5.有关纯⽓体临界点性质的描述中,下⾯的说法不正确的是: A 临界温度TC 是⽓体加压可以使之液化的最⾼温度; B 在临界参数TC ,PC ,VC 中,VC 是最易测定的;C 在临界点有(V P ??)T=0,(22VP)r=0; D 在临界点⽓体和液体有相同的摩尔体积Vm 。
6.符合范德华⽅程的⽓体称为范德华⽓体,该⽓体分⼦间是相互____A 吸引B 排斥C ⽆相互作⽤7.判断对否:范德华常数b 与临界体积VC 成正⽐关系。
8. 101.325KP a ,100℃的⽔蒸⽓的压缩因⼦Z____1。
(〈,=,〉)9. 1molA ⽓体(理想⽓体)与1molB ⽓体(⾮理想⽓体)分别在两容器中,知PAVA=PBVB ,其温度均低于临界温度。
TA____TB (〈,=,〉)10.抽取某液体的饱和⽓体,体积V 。
;恒温下使压⼒降低⼀半,则其体积为V1。
V 。
与V1的关系为____。
A 2 V 。
= V1 B 2 V 。
> V1 C 2 V 。
< V111.101.325KPa,100℃的1mol 理想⽓体体积为30.6dm 3,该温度压⼒下的1mol ⽔蒸⽓的体积Vm____30.6dm 3(〈,=,〉)12.在临界点(rP Z)T r=____(0,1,∞) 13.⾼温⾼压下实际⽓体适合的状态⽅程是____ A PV=bRT B PV=RT+b C PV=RT-b D PV=RT+bP E PV=RT-bP (b 为正常数)14.氧⽓钢瓶是____⾊,钢瓶的螺扣,表头不能⽤____密封,钢瓶内的⽓体能否⽤到压⼒表指⽰为零____,压⼒表指⽰为1.0MPa 时,钢瓶内⽓体的绝对压⼒等于____。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《物理化学》课后思考题习题详解王海荣主编同济大学出版社二零一七年十二月第一章 热力学第一定律思考题:1、什么是状态函数?p 、V 、T 、Q 、W 、U 、H 是否都是状态函数? 答:略2、什么是热力学?热力学的优点和局限性分别是什么?答:略3、判断下列说法是否正确,并阐述判断的依据。
(1)状态给定后,状态函数就有定值;状态函数固定后,状态也就固定了。
(2)状态改变后,状态函数一定都改变。
(3)因为∆U =v Q ,∆H =p Q ,所以v Q 和p Q 是特定条件下的状态函数。
(4)根据热力学第一定律,因为能量不能无中生有,所以一个系统若要对外做功,必须从外界吸收热量。
(5)在等压下,用机械搅拌某绝热容器中的液体,使液体的温度上升,这时∆H=p Q =0。
(6)某一化学反应在烧杯中进行,热效应为1Q ,焓变为1H ∆。
若将化学反应设计成反应相同的可逆电池,使化学反应和电池反应的始态和终态都相同,这时热效应为2Q ,焓变为2H ∆,则1H ∆=2H ∆。
答:(1)正确。
因为状态函数是状态的单值函数,状态固定后,所有的状态函数都有定值;反之,状态函数都有定值,状态也就被固定了。
(2)错误。
虽然状态改变后,状态函数会改变,但不一定都改变。
例如,系统发生了一个等温过程,体积、压力等状态函数发生了改变,系统的状态已与原来的不同,但是温度这个状态函数没有改变。
(3)错误。
热力学能U 和焓H 是状态函数,而U ∆和H ∆仅是状态函数的变量。
v Q 和p Q 仅在特定条件下与状态函数的变量相等,所以v Q 和p Q 不可能是状态函数。
(4)错误。
系统可以减低自身的热力学能来对外做功,如系统发生绝热膨胀过程。
但是,对外做功后,系统自身的温度会下降。
(5)错误。
因为环境对系统节能性机械搅拌,做了机械功,这时1W ≠0,所以不符合H ∆=p Q 的使用条件。
使用H ∆=p Q 这个公式,等压和1W 0≠这两个条件一个也不能少。
(6)正确。
因为焓H 是状态函数,只要反应的始态和终态都相同,则焓变的数值也相同,与反应具体进行的途径无关,这就是状态函数的性质,“异途同归,值变相等”。
但是,两个过程的热效应是不等的,即1Q 2Q ≠。
4、列出下列三个公式的适用条件:①H ∆=p Q ;②U ∆=v Q ;③21ln V V nRT W =。
答:①适用于不做非体积功膨胀(f W =0)的等压过程(dp=0)。
②适用于不做非体积功(f W =0)的等容过程(dV=0)。
③适用于理想气体不做膨胀功(f W =0)的等温可逆过程。
5、在相同的温度和压力下,一定量氢气和氧气从四种不同的捷径生成水:① 氢气在氧气中燃烧;②爆鸣反应;③氢、氧热爆炸,氢-氧燃料电池。
在所有反应过程中,保持反应方程式的始态和终态都相同,这四种变化途径的热力学能和焓的变化值是否相同?答:应该相同。
因为热力学能和焓是状态函数,只要始、终态相同,无论经过什么途径,其变化值一定相同。
这就是状态函数的性质:“异途同归,值变相等。
”6、化学热力学中所说的“标准状态”意指什么?对于单质、化合物和水合离子所规定的标准摩尔生成焓有何区别?答:略7、反应的标准摩尔焓变在什么情况下等于产物的标准摩尔生成焓?答:略8、热力学可逆过程的定义、条件、特征是什么?它有什么意义?化学反应中的可逆反应是否就是热力学中的可逆过程?答: 略,见课本。
化学反应中的可逆反应和热力学中的可逆过程是两个不同的概念,化学反应的可逆反应通常指正反应和逆反应在一定条件下都可以进行,即反应物可以转变为产物,产物也可以转变为反应物,只是物质上的可逆,不考虑能量。
热力学的可逆过程指变化发生后回到始态时,不仅物质能够复原,能量也能够复原。
9、凡系统温度升高就一定吸热,而温度不变时,则系统既不吸热也不放热,这种说法对吗?为什么?答:错误。
系统温度升高不一定吸热,温度升高系统热力学能增大,按照热力学第一定律,热力学能的增大还可能来自于环境对系统做功 ,从而造成系统温度升高。
温度不变,如相变,在恒定温度下,水由液态变成气态或者由固态变成液态都要吸热,而由气态变成液态或由液态变成固态要放热。
10、由同一始态出发分别进行等温可逆压缩和绝热可逆压缩,当两过程终态压力相同时,哪个过程的终态温度高?为什么?答:在绝热可逆压缩过程中,Q =0,W =ΔU =nC v ,m (T 终-T 始),由于是压缩,所以功W >0,则T 终>T 始,即可逆压缩的终态温度要高于始态温度。
因此由同一始态出发绝热可逆压缩过程的终态温度要高于等温可逆压缩的温度。
11、为什么对于理想气体,公式dT nC U T T m v ⎰=∆21,可用来计算任意变温过程的U ∆并不受定容条件的限制?答:理想气体的热力学能只与温度有关,而与体积无关。
习题:1、298.15 K 、101.325 kPa 时有0.5 mol Zn 与过量稀硫酸反应,生成H 2和ZnSO 4,已知此反应放热为47.15510J ⨯,试计算:(1)上述过程中Q ,W ,U ∆,H ∆的值;(2)若上述反应在密闭容器中发生,求Q ,W ,U ∆,H ∆的值。
解:(1) 该反应属于恒压过程 47.15510 J p H Q ∆==-⨯;将氢气看作理想气体,氢气膨胀做功W=- p ΔV= - n H2RT = - 1239.5 J ;47.2810 J U Q W ∆=+=-⨯(2) 密闭容器中的反应属于恒容过程,W=0,状态函数改变量同上:47.2810 J U ∆=-⨯;47.2810 J V Q U =∆=-⨯;47.15510 J H ∆=-⨯2、礼堂的体积是1000 m 3,室温是283 K ,气压是51.01310Pa ⨯。
欲将温度升至293 K ,需热多少kJ ?(设空气的-1-1,29.29J K mol p m C =)解:可以把此礼堂墙壁看成是不导热的,则Q p =⎰21m p,T T dT nC 要保持1.013×105Pa ,则n 要变化Q p =()⎰21m p,T T dT pV/RT C =⎰21T T dT TpV C R mp, =(C p,m pV /R )ln(T 2/T 1)=1.24×104kJ3、如右图所示,一系统由状态1沿途径21→→a 变到状态2时,从环境吸热3.14 J ,同时对环境做功117J 。
试问:(1)当系统沿21→→b 变化时,系统对环境做功44J ,此过程Q 为多少?系统是吸热还是放热?(2)若沿途径c 由状态2回到状态1,环境对系统做功80 J ,则Q 为多少?系统是吸热还是放热? 解:(1)系统沿21→→a 的变化中,ΔU =3.14-117= - 113.86J故当系统沿21→→b 变化中,Q = - 113.86 -( - 44)= - 69.86J 系统放热(2)当系统沿途径c 由状态2回到状态1,ΔU =113.86JQ =113.86+80=193.86 J 系统吸热4、在373K 的恒温条件下,1mol 理想气体从始态25 dm 3,分别按下列四个过程膨胀到终态体积为100 dm 3;①向真空膨胀;②等温可逆膨胀;③在外压恒定为气体终态压力下膨胀;④先外压恒定为体积等于50 dm 3时气体的平衡压力下膨胀,当膨胀到50 dm 3以后,再在外压等于100 dm 3时气体的平衡压力下膨胀。
分别计算各个过程中所做的膨胀功。
这说明了什么问题?解: ①向真空膨胀,外压为零,所以W 1=0。
②理想气体的恒温可逆膨胀:212lnV V nRT W == - 4.30kJ ③恒外压膨胀:p e =p 2=,)V (V p W e 123--== - 2.33kJ④分两步的恒外压膨胀:设从p 1V 1变化为p 2V 2,再到p 3V 3,W 4= —p e .1(V 2-V 1)—p e.2(V 3-V 2) = - 3.10kJ5、n mol 理想气体由1p 1V 恒温膨胀到2p 2V ,求过程的焓变H ∆,结果能说明什么? 解:ΔH =06、1 mol 单原子分子理想气体B ,由300 K 、100 kPa 经一可逆过程到达终态,压力为200 kPa ,过程的1000J Q =,2078.5J ∆H =(1)计算终态的温度、体积及过程的W ,U ∆。
(2)假设气体先经恒压可逆过程,然后经恒温可逆过程到达终态,此过程的Q ,W ,U ∆,H ∆是多少?解:(1)C p,m =5/2R C V ,m =3/2R ΔH =nC p,m (T 2-T 1)即 2078.5=1×5/2×8.314×(T 2-300) T 2=400K则 V 2=nRT 2/p 2=1×8.314×400/(200.0×103)=16.63dm 3ΔU =nC V ,m (T 2-T 1)=1×3/2×8.314×100=1247.1JW=ΔU -Q=1247.1-1000.0=247.1J(2) 300K 恒压可逆 400K 恒温可逆 400K100kPa 100kPa 200kPa气体始终态与(1)相同, ΔU =1247.1 J ΔH =2078.5 JW 1=- p(V 2-V 1)=-nR(T 2-T 1)= - 831.4 JW 2=-nRT ln(V 3/V 2)=-nRT 2ln(p 2/p 3)= 2305.1 JW=W 1+W 2 = -1×8.314×(400 – 300)-1×8.314×400×㏑100/200=1474JQ=ΔU -W =1247.1-1474=-226.6J7、容积为3200d m 的容器中的某理想气体,其温度为20℃、压力为52.510Pa ⨯。
已知其m p C ,为m V C ,的1.4倍,试求其m V C ,。
若该气体的热容近似为定值,试求加热该气体至80℃所需的热。
解:对理想气体R C C m V m p =-,,,故 m V C , =20.79 J ⋅mol -1⋅K -1;恒容过程中,⎰=∆=21,T T m V V dTnC U Q ,故25.59 kJ V Q = 8、在298K 时,计算反应2C(s)+2H 2(g)+O 2(g)=CH 3COOH(l)的标准摩尔反应焓变)K 15.298(Θ∆m r H 。
已知下列反应在298K 时的标准摩尔反应焓变分别为(1)CH 3COOH(l)+2O 2=2CO 2(g)+2H 2O(l) r m H θ∆ (l)=-870.3kJ∙mol -1(2)C(s)+O 2(g)=CO 2(g) r m H θ∆ (2)= -393.5kJ∙mol -1(3)H 2(g)+1/2O 2(g)=H 2O(l) r m H θ∆ (3)= -285.8kJ∙mol -1解:所求反应是由2×(2)+2×(3)-(1)组成,根据Hess 定律,有 r H m θ∆ (298K)=[2×(-393.5)+2×(-285.8)-(-870.3)] kJ ˙mol -1=- 488.3 kJ ˙mol -19、用附录Ⅴ中f (298.15K)m H Θ∆数据,求下列反应的)K 15.298(Θ∆m r H 及r (298.15K)m U Θ∆。
