第四章 分子结构——分子间的作用力、氢键、离子极化理论汇总
第四章 分子结构——分子间的作用力、氢键、离子极化理论

•
•
•
•
•
•
• •
键的极性的增大 离子键向共价键的过渡 图4-55 由离子键向共价键的过渡
(1) 离子的极化力和变形性 离子的极化力 极化力和
极化力( 极化力(φ )—— 一种离子使邻近的异性离子极化而
变形的能力,通常阳离子极化力占主导 阳离子极化力占主导。 变形的能力,通常阳离子极化力占主导。
Z* φ 极化力 ∝ r
表4-14 分子间的作用能 ⋅mol-1)的分配 分子间的作用能(kJ⋅ 的分配
范德华力对共价化合物物理性质的影响: 范德华力对共价化合物物理性质的影响: 物理性质的影响
分子间范德华力的大小可说明共价化合物间 分子间范德华力的大小可说明共价化合物间 范德华力的大小可说明共价化合物 的物理性质差异: 的物理性质差异: 熔点、沸点的高低,溶解度的大小, 如,熔点、沸点的高低,溶解度的大小, 液化、 等等。 液化、结晶现象及相似相溶原理 ••• 等等。
d→偶极长→正电荷重心和负电荷重心的距离。偶极长 、 →偶极长→正电荷重心和负电荷重心的距离。偶极长d、 偶极子电荷q 是无法测定的, 偶极子电荷 是无法测定的,但偶极矩 µ 可通过实验测得
µ 的单位为 德拜 , 1D = 3.33×10-30 C·m。 的单位为D(德拜 德拜), × 。
因为一个电子的电量是1.6× 因为一个电子的电量是 ×10-19C,分子的直径在 -10 m ,分子的直径在10 数量级,所以,分子电偶极矩大小数量级为10 数量级,所以,分子电偶极矩大小数量级为 -30(C·m)。 。
极性分子的这种 固有偶极叫做 叫做永久偶 固有偶极叫做永久偶 极矩µ 。 外电场影响下所 外电场影响下所 产生的偶极叫 产生的偶极叫诱导偶 诱导偶极矩(∆ 极。诱导偶极矩 ∆µ) 的大小与外电场强度 成正比。 成正比。
分子结构价键和杂化轨道理论

无法解释甲烷分子实测的立体构造是正四面体, 4个C-H键是等同的。因碳原子的3个2p轨道相互正交 (90 ), 而2s轨道是球形的。
为了解决许多分子构型的理论分析和实验不符 的矛盾, 更好的解释分子的实际空间构型和稳定性, 1931年由鲍林等人在价键理论的根底上提出了杂化 轨道理论。
晶格: 面心立方; 配位比: 6 : 6
0.732 > r+/r- > 0.414
体心立方晶型 配位比: 8 : 8
r+/r- = 0.732
三、离子键的强度 ——用晶格能〔Lattice Energy, U〕表示.
〔通常不用“键能〞表示〕。 晶格能定义 ——互相远离的气态正、负离子结合生成1 mol 离子晶体的过程所释放的能量的绝对值。
(三) 共价键的类型
按成键方式划分: 键, 键 1. 键: 原子轨道以“头碰头〞(head to head)
方式重叠成键
(三) 共价键的类型 (续) 2. 键:“肩并肩〞 (side by side) 成键。
键轨道较 键重叠程度小, 键能小 于后者, 所以 键的稳定性低于 键, 键电子活性较高, 是化学反响的积 极参加者。
(五) 杂化轨道理论 (hybrid orbital theory) —开展了的VB法
20世纪30年代, 由L.Pauling提出,
1.要点:
(1) 原子轨道杂化: 同一原子的能量相近的原子轨道可以互相叠加, 重新 组成能量相等的杂化原子轨道 (Hybrid Orbitals);
(2) 轨道数目守恒: 参与“杂化〞的原子轨道数目=组成的杂化轨道数目;
(9 - 17)e: Fe2+, Fe3+ , Mn2+[(n-1)s 2(n-1)p 6(n-1)d 1-9]
分子结构

7.1 Ionic Bond Theory
3)原子间发生电子的转移而 形成具有稳定结构的正、负离 子时,从能量的角度上看,一 定会有能量的吸收和放出,而 且新体系的能量最低。
· · · · Na·+ :Cl· → Na+[:Cl:] · · · ·
·
Na(g) – e
Na+(g) I = 496KJ.mol-1
经典Lewis学说遇到的问题: 1 电子对的共享和提供电子的原子轨道间
有什么关系?
2 怎样解释双键和叁键的形成?
3 能否用原子轨道在空间取向解释分子几何形状?
7.2 Valence Bond Theory
1 共价键的形成(以H2为例分析)
↑↑
↓↑
De基态R0核间距R 排斥态在稳态H2分子中,氢原子所以能形成共价键,是因为自旋相反 的两个电子的电子云密集在两个原子核之间,从而是体系的能 量降低。排斥态不能成键,是因为自旋相同的两个电子的电子 云在核间稀疏,使体系能量升高。
7.2 Valence Bond Theory
1 共价键的形成
共价键的形成,从本质上讲,是由于原子轨道的重叠,产生了加强 性干涉效应,使两核间电荷密度增大,密集在两核间的电子云,同 时受到两个核的吸引,把两核联系在一起,使体系能量降低,形成 了共价键.
7.2 Valence Bond Theory
晶格能对离子晶体物理性质的影响
MgO R
U 熔点 硬度 小 大
CaO
SrO
BaO
大 小 低
高
大
小
7.1 Ionic Bond Theory
影响晶格能的因素
① 离子的电荷 ② 离子的半径
U
138940 AZ1Z 2 R0
分子结构理论-总结 PPT
6. 共轭大π键
采用 b 为大π键的符号,其中a表示平行p(或d a
)轨道的数目,b表示p(或d)轨道里的电子数。
一、形成大π键的条件: 1. 有相互平行的p轨道(或d轨道,或p, d轨道)。 2. 参与成键的电子数目小于轨道数目的2倍。 3. 形成大 键的原子轨道能量应相近。
如苯 C6H6 平面正六边形
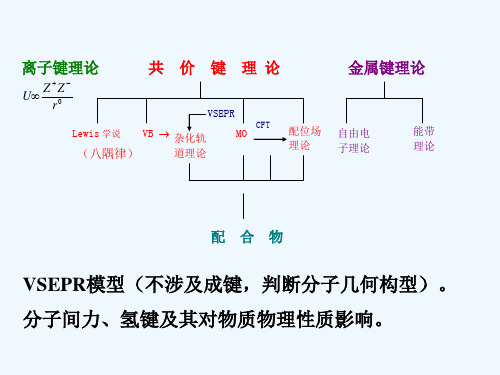
离子键理论
共 价 键 理论
U
Z
Z r0
VSEPR
Lewis 学说 VB 杂化轨
CFT
MO
(八隅律)
道理论
配位场 理论
金属键理论
自由电
能带
子理论
理论
配合物
VSEPR模型(不涉及成键,判断分子几何构型)。 分子间力、氢键及其对物质物理性质影响。
Ⅰ. 离子键理论 1. 离子键的定义 由正、负离子依靠静电引力结合的化学键。 2. 离子键的特点
孤电子对-孤电子对 > 孤电子对-成键电子对 > 成键电子对-成键电子对
3. 双键、叁键或单个电子均按单键处理;对成键电 子对排斥作用:
单键 < 双键 < 叁键
二、推断ABn分子或离子空间构型的步骤 (A-中心原子,B-配位原子)
1. 确定中心原子价层电子对数 价层电子对数 = (中心原子价电子数 + 配位 原子提供的电子数 离子电荷代数值) / 2 电子总数为奇数时,则电子对商进位 。例如电
子总数为 9, 则电子对数为 5 。
① H和(X)卤原子作为配位原子时,各提供一个价 电子,O和S作为配位原子时提供的电子数为0。
② 卤素作为中心原子时,提供的价电子数为7。 ③ O、S作为中心原子时,提供的价电子数为6。
例:
无机及分析化学第4章化学键与物质结构

Cs + F
Cs+ + F
➢ 正负离子靠静电引力相互吸引而形成离子晶体。
6
离子键的要点
➢由于离子键是正负离子通过静电引力作用相 连接的,从而决定了离子键的特点是没有方向 性和饱和性。
*若A﹑B两原子各有一未成对电子且自旋反平行, 则互相配对构成共价单键,如H—H单键。如 果A、B两原子各有两个或三个未成对电子,则 在两个原子间可以形成共价双键或共价三键。 如N≡N分子以三键结合,因为每个N原子有3个 未成对的2p电子。
*成键原子轨道最大程度重叠,重叠越多,越牢 固。
18
3. 共价键的特征
离子半径越小,正、负离子间的引力越大,离子键的强度越
强,其熔、沸点越高,硬度越大。
11
4.2 共价键
离子键理论能很好解释电负性差值较大的离 子型化合物的成键与性质,但无法解释其 他类型的化合物的问题。
美国化学家路易斯(G N Lewis)提出了共价键 (covalent bond)的电子理论:原子间可共用 一对或几对电子,以形成稳定的分子。这 是早期的共价键理论。
两个同元素原子间形成的共价键不具有极性,称为 非极性键。
32
键的极性的大小可以用键矩( )来衡量: = q l
q:电量
l:通常取两个原子的核间距 :单位为库仑米(Cm)。
键矩是矢量,其方向是从正电荷中心指向负电 荷中心。
键矩也叫“偶极矩”
33
键的类型小结:
成键原子间电负性差值的大小一定程度上反映了 键的离子性的大小。
107.3 109.5°
分子结构(思维导图)

分子结构
离子键
正负电子之间的静电引力形成的化学键
无饱和性、方向性,但受空间限制,不能无限作用力通常很强
1
大小用晶格能衡量
离子
离子半径
决定引力的重要因素
离子半径越小,离子间引力越大,化合物熔点越高
电子构型
共价键
价键理论
轨道杂化理论分子轨道理论
金属键
改性共价键理论金属键不具有方向性和饱和性
能带理论
2
分子间力和氢键
分子间力=范德华力
色散力
诱导力取向力
分子的极性
大小用偶极矩衡量
偶极矩越大,分子极性越大
氢键具有饱和性和方向性
晶体结构
离子晶体
正负离子通过离子键形成的晶体
NaCl型CsCl型ZnS型
离子所带电荷与离子半径
离子极化力
离子(主要阳离子)使其他粒子极化变形的能力
原子晶体
共价键的结合力较强,大硬度,高熔点
熔融态不易导电
分子晶体
结合力弱,熔点低,硬度小
固态、熔融态都不导电
金属晶体
体心立方晶格面心立方密堆积晶格
六方密堆积晶格过渡型晶体
链状结构晶体
层状结构晶体
备注:
1. 晶格能:气态正离子和气态负离子结合成1mol 离子晶体时所释放的能量
2. 化学键>氢键>范德华力。
分子间作用力包括静电、氢键、离子偶极

分子间作用力包括静电、氢键、离子偶极
分子间作用力是指分子之间的相互作用力,它们是维持分子结构和化学反应的基础。
分子间作用力包括静电、氢键、离子偶极等多种类型,下面我们将分别介绍它们的特点和作用。
静电作用力是指由于电荷之间的相互作用而产生的力。
当两个分子中的电荷不平衡时,它们之间就会产生静电作用力。
例如,当两个分子中一个带正电荷,一个带负电荷时,它们之间就会产生吸引力。
静电作用力在分子间的相互作用中起着重要的作用,它可以影响分子的构象和化学反应。
氢键是一种特殊的分子间作用力,它是由于氢原子与氮、氧、氟等元素形成的强电负性差而产生的。
氢键的作用力比静电作用力弱,但是它在生物分子的结构和功能中起着重要的作用。
例如,DNA分子中的氢键可以保持DNA的双螺旋结构,从而维持DNA的稳定性。
离子偶极是指分子中存在正负电荷分布不均的情况。
当分子中的正负电荷分布不均时,就会形成离子偶极。
离子偶极的作用力比静电作用力弱,但是它在分子间的相互作用中也起着重要的作用。
例如,当两个分子中一个带正电荷,一个带负电荷时,它们之间就会产生离子偶极作用力。
分子间作用力是维持分子结构和化学反应的基础,它们包括静电、氢键、离子偶极等多种类型。
这些作用力在分子间的相互作用中起
着重要的作用,它们可以影响分子的构象和化学反应,从而影响生物分子的结构和功能。
因此,研究分子间作用力对于理解生物分子的结构和功能具有重要的意义。
中学化学 分子间力、氢键王 课件

4、分子变形性: ➢由于外电场的作用,会使分子中的电子和原子核发生 相对位移,使分子发生变形,分子中原有的正负电荷中 心发生改变,分子的极性也随之改变,这种过程称分子 的极化。 ➢即分子中因电子与原子核发生相对位移而使分子外形 发生变化的性质,叫做分子的变形性。 ➢分子变形性的大小可用极化率来衡量。
分子极性的判断: ➢同原子组成的双原子分子—非极性分子。 ➢异原子组成的分子: •双原子分子—必是极性分子 •多原子分子—取决于分子构型。如NH3是极性分子,而 BF3是非极性分子。
多原子分子的极性与构型
分子 杂化形式 分子构型 分子极性 示例
AB
线形
极性
AB2 sp
线形
非极性
AB3 sp2
平面三角 非极性
角形 四面体 直线形
O3
1.67 角形
HF
6.47 直线形
HCl 3.60 直线形
HBr 2.60 直线形
HI
1.27 直线形
BF3
0 平面正
三角形
二.分子的极化和变形
q
+-
μ= 0 极性分子
d
μ=q·d
1、固有偶极矩:极性分子在没有外电场作用下所具有的 偶极。只有极性分子才有固有偶极矩。(也称永久偶极)
▪若分子的电偶极矩为0,分子为非极性分子,若大于 0,分子为极性分子,电偶极矩越大,极性越大,电 偶极矩还可以判断分子的空间构型 。
如:
NH3, μ>0,三角锥型; BCl3, μ=0,平面三角形;
CO2, μ=0,直线形;
SO2, μ>0,V型。
测定分子电偶极矩是确定分子构型的一种重要实验 方法,德拜因此而获得1936年诺贝尔化学奖。
非极性分子
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
如,熔点、沸点的高低,溶解度的大小, 液化、结晶现象及相似相溶原理 ••• 等等。
问题: 决定物质熔点、沸点的因素还有哪些? 如:离子晶体;金属晶体;原子晶体。
4-3 离子的极化
来自异号离子的电场作用使离子的电子云偏 离球对称,产生诱导偶极矩的过程称离子极化。
(b) 阳离子的壳层结构对极化力大小的影响:
> > 18e 、(18+2)e 、氦(Li+)
壳层结构的阳离子
(9~17)e 不规则 构型的离子(d 区)
8e稀有气体 构型的离子
(c) 复杂阴离子的极化作用通常较小(如 SCN-),但电荷高 的复杂阴离子有一定的极化作用(如 SO42-和 PO43- )。
分子间力是一种较弱的相互作用力,其结合能一般 小于40kJ·mol-1,比化学键能小1~2个数量级。
但范德华力是决定共价化合物的熔点、沸点高低、 溶解度大小等物理性质的一个重要因素。
分子间力的性质属于电学性质,分子间力的产生与分 子的极化有关。对于范德华力本质的认识是随着量子力学 的出现而逐步深入的。
范德华力一般包括三个部分:
取向力(极极):
永久偶极而产生的相互作用力。
- + +-+ -+
取向力 - +- +
诱导力(极非极,极极): 诱导偶极同极性分子的永久偶 极间的作用力叫做诱导力。
+
++ 诱导力
色散力(所有分子间均存在): 由于存在“瞬间偶极”而产生 的相互作用力。
色
散
力
分子间范德华引力的特点:
一些分子的偶极矩:
表4-13 一些分子的偶极矩
分 子 µ/ D 分 子 µ/ D
H2
0
N2
0
BCl3
0
CO2
0
CS2
0
H2S 1.1
SO2 1.6
H2O
1.85
HCl 1.03
HBr 0.79
HI
0.38
NH3
1.66
CO
0.12
HCN 2.1
极性分子的这种 固有偶极叫做永久偶
极矩 。
外电场影响下所 产生的偶极叫诱导偶
分子极性的大小 可由偶极矩来衡量:
偶极矩 = q ·d
- q• -
d
+ q•+
µ是一个矢量,方向在化学中是从正极到负极。
d偶极长正电荷重心和负电荷重心的距离。偶极长d、
偶极子电荷q 是无法测定的,但偶极矩 可通过实验测得
µ的单位为D(德拜), 1D = 3.33×10-30 C·m。
因为一个电子的电量是1.6×10-19C,分子的直径在10-10 m 数量级,所以,分子电偶极矩大小数量级为10-30(C·m)。
§4-4 分子间作用力
4-1 极性分子与非极性分子
(1)键的极性
键的极性由两元素的电负性差x决定或由键矩决定。 x越大,键的极性越大。
(2)分子的极性
极性分子:正电荷重心和负电荷重心不互相重合的分子。 非极性分子:两个电荷重心互相重合的分子。
由非极性键构成的分子 一定是非极性分子。 如,单质多原子分子:H2、Cl2、S8、 P4 •••等。
(a) 永远存在于分子或原子间的一种静电作用力。 (b) 它是吸引力,其大小比化学键能小1~2个数量级。 (c) 一般没有方向性和饱和性。 (d) 作用范围只有几pm。 (e) 范德华力有三种。除强极性分子外,色散力永远是主要的。
表4-14 分子间的作用能(kJmol-1)的分配
范德华力对共价化合物物理性质的影响:
(3)离子的变形性的一般规律
(a) 大半径、高电荷的简单阴离子变形性大。 如:S2-、 I-、 Se2- ••• 等等。
(b) 18e、(18+2)e 壳层结构的低电荷阳离子,其变形性比 相近半径的稀有气体构型阳离子大得多。
由极性键构成的分子是否一定是极性分子?
由极性键构成的分子,分子是否 有极性,还与分子的空间构型有关。 若键的极性在分子中可相互抵消,则为非极性分子。
如:BF3、CH4、CCl4、CO2 •••等。 若键的极性在分子中不能相互抵消,则为极性分子。
如:NH3、H2O、PCl3、SO2 •••等。
(3)偶极矩(dipole moment)
离子的极化作用实际上是一种诱导力。
未极化
正负离子都有极化对方的能力和被对方极化的可能。 但通常把正离子视为极化者、负离子为被极化者。
离子极化的结果:
正、负离子的电子云发生变形,变成非球状离子, 电子云发生部分重叠,表现出一定的共价性,正、负离 子间的引力增强。
极化导致键长缩短,键能、晶格能增加;配位数下降, 结构向层型、链型、岛型过渡;溶解度降低,等等。
离子相互极化的增强
• • • • • • ••
键的极性的增大 图4-55 由离子键向共价键的过渡
(1)离子的极化力和变形性
极化力( )—— 一种离子使邻近的异性离子极化而
变形的能力,通常阳离子极化力占主导。
极化力
Z* r
高电荷、小半径的阳离子 有强的极化力。如:Al3+、 B3+、Si4+、Cu2+、Fe3+ 等。
分子在外电场中(或正、负离子本身的电场中)发生变形,产生 诱导偶极的过程叫分子的极化。
即使没有外电场存在,在某一瞬间,分子的正电荷重心和负电 荷重心也会发生不重合现象,这时产生的偶极称瞬间偶极。
4-2 分子间作用力——范德华(Van der Waals)力
气体能凝结成液体,固体表面有吸附现象,毛细管内 的液面会上升,粉末可压成片等,这些现象都证明分子与 分子之间有引力存在,通常把分子间力叫做范德华力。
极。诱导偶极矩()
的大小与外电场强度 成正比。
(4)分子的极化与瞬间偶极:
分子的正、负电荷重心在外电场的影响下会发生变化:
非极性分子
µ=0
极性分子
µ
无外电场时∆µ源自µ+∆µ有外电场时
图4-51 外电场对分子极性的影响示意图
非极性分子被极化 后,产生诱导偶极
极性分子在电场的 诱导下,也能产生 诱导偶极,且总偶 极矩增大。
变形性——受异性离子极化而发生电子云变形的能力。
阴离子变形性占主导,变形性的大小用极化率衡量。
正离子因电荷高、半径小,通常不易被极化变形; 负离子因半径较大,故容易受阳离子电场影响而变形。
(2)离子的极化作用的一般规律
(a) 高电荷、小半径的阳离子有强的极化力。 如:H+、Li+、Be2+、Sn4+、Fe3+ 等; Fe3+ Fe2+ ,Sn4+ Sn2+ ; Be2+ Mg2+ Ca2+ Ba2+ 。
