三草酸合铁(III)酸钾的制备和性质复习过程
三草酸合铁(Ⅲ)酸钾的制备、组成测定及表征 预习

4和15mL去离子水,微热溶解,加热至75-85℃(即液面冒水蒸气),趁热用0.0200 mol•L-1 KMnO
4标准溶液滴定至粉红色为终点(保留溶液待下一步分析使用)。根据消耗KMnO
4溶液的体积,计算产物xxC
2O
42-的质量分数。
(3)铁质量分数的测量在上述保留的溶液中加入一小匙锌粉,加热近沸,直到黄色消失,将Fe3+还原为Fe2+即可。趁热过滤除去多余的锌粉,滤液收集到另一锥形瓶中。继续用0.0200mol•L-1 KMnO
实验预习八三草酸合铁(Ⅲ)酸钾的制备、组成测定及表征
一、实验目的
1、初步了解配合物制备的一般方法。
2、掌握用KMnO
4法测定C
2O
42-与Fe3+的原理和方法。
3、培养综合应用基础知识的能力。
4、了解表征配合物结构的方法。
二、实验原理
1、三草酸合铁(Ⅲ)酸钾性质
三草酸合铁(Ⅲ)酸钾K
3[Fe(C
2O
铁质量分数计算过程:
配合物的化学式
六、思考题
1、氧化FeC
2O
4·2H
2O时,氧化温度控制在40℃,不能太高。为什么?
2、KMnO
4滴定C
2O
42-时要加热,又不能使温度太高(75-85℃),为什么?
预习
1、查阅资料,三草酸合铁(Ⅲ)酸钾的制备及组成测定方法还有什么?
2、KMnO
4标准溶液的配制和标定。
仪器:
托盘天平,电子分析天平,烧杯(100mL,250mL),量筒(10mL ,100mL),玻璃棒,布氏漏斗,吸滤瓶,真空泵,表面皿,称量瓶,干燥器,烘箱,锥形瓶(250 mL),酸式滴定管(50mL)
三草酸合铁酸钾的合成

➢反应方程式:
(1)
(NH4)2Fe(SO4)2 + H2C2O4 + 2H2O
===FeC2O4·2H2O↓+ (NH4)2SO4 + H2SO4
(2) 2FeC2O4·2H2O + H2O2 + 3K2C2O4 + H2C2O4
===2K3[Fe(C2O4)3]·3H2O
精品课件
实验试剂
(NH4)2Fe(SO4)2·6H2O, H2SO4 (1mol·L-1), H2C2O4(饱和), K2C2O4(饱和),
精品课件
② 三草酸合铁(III)酸钾的制备: a: 氧化
向草酸亚铁沉淀中,加入10mL饱和K2C2O4溶液,水浴 加热至40℃,恒温下慢慢滴加3%的H2O220mL,沉淀转为深棕 色。边加边搅拌,加完后将溶液加热至沸(注意:防止爆 沸), b: 生成配合物
逐滴加入7-10mL饱和草酸溶液至沉淀完全溶解,此时, 溶液转为黄绿色。继续滴加饱和草酸溶液2-3mL,溶液变为 翠绿色。然后加入95%的乙醇15 mL,混匀后冷却,可以看 到烧杯底部有晶体析出。完全析出后,抽滤。晶体用 10mL95%的乙醇分两次洗涤,得K3[Fe(C2O4)3].3H2O晶体。称 重,计算产率。
乙醇(95%), H2O2 (3%)。
精品课件
实验步骤
1.三草酸合铁(III)酸钾的制备
硫酸亚铁 铵溶液
+ 饱和草酸 溶液。
草酸 亚铁 沉淀
+
饱和草酸 钾溶液
+
3% 双氧 水溶液
深棕 色沉 淀
&
精品课件
三草酸合 铁(Ⅲ) 酸钾晶体
1.三草酸合铁(III)酸钾的制备
三草酸合铁酸钾的合成及分析

三草酸合铁酸钾的合成及分析一、三草酸合铁酸钾的合成方法:1.合成三草酸铁:将适量的氢氧化铁固体加入到约100mL的蒸馏水中,加热至沸腾溶解。
然后,将草酸二钠固体溶解在50mL蒸馏水中,加入到氢氧化铁溶液中。
搅拌反应物溶液,直到得到澄清的混合溶液。
将澄清溶液过滤并冷却,最后得到三草酸铁晶体。
2.合成三草酸合铁酸钾:将约2g的三草酸铁溶解在20mL的蒸馏水中,加入适量的氢氧化钾固体,直到溶液中不再产生气泡。
继续加热溶液,直至溶液变得澄清。
最后,对溶液进行冷却、过滤和干燥,得到三草酸合铁酸钾晶体。
二、三草酸合铁酸钾的分析方法:1.紫外可见光谱法:利用紫外可见光谱仪测量三草酸合铁酸钾在不同波长下的吸光度,并画出吸收光谱图。
通过比较吸收峰位置和强度,可以确定样品的组成和浓度。
2.X射线衍射分析法:将样品放入X射线衍射仪中,通过测量样品对X射线的衍射情况,分析样品的晶体结构和组成。
3.火焰原子吸收光谱法:将样品溶解在适当的溶剂中,使用火焰原子吸收光谱仪测量溶液的吸光度。
根据吸光度与样品浓度的关系,确定三草酸合铁酸钾的浓度。
4.离子色谱法:通过离子色谱仪测量样品中铁离子和钾离子的浓度。
根据测量结果,计算三草酸合铁酸钾中铁和钾的含量。
总结:三草酸合铁酸钾是一种重要的无机化合物,通过合成和分析方法可以得到该化合物的纯品以及对其进行质量控制。
其中,紫外可见光谱法、X 射线衍射分析法、火焰原子吸收光谱法和离子色谱法是常用的分析方法。
通过这些方法,可以得到三草酸合铁酸钾的结构、浓度以及含量等重要信息。
实验八 三草酸合铁(Ⅲ)酸钾的合成和组成分析

实验二十五、三草酸合铁(Ⅲ)酸钾的合成和组成分析[实验目的]1. 了解三草酸合铁(III )酸钾的合成方法。
2. 掌握确定化合物化学式的基本原理和方法。
3. 巩固无机合成、滴定分析和重量分析的基本操作[实验原理]制备:(1) (NH 4)2Fe(SO 4)2+H 2C 2O 4=FeC 2O 4(S)+(NH 4)2SO 4+H 2SO 4(2) 过量K 2C 2O 4情况下,用H 2O 2氧化FeC 2O 46FeC 2O 4+ 6H 2O 2 +6K 2C 2O 4=4K 3[Fe(C 2O 4)3]+2Fe(OH)3(s)(3) 反应过程中生成的Fe(OH)3可加入适量的H 2C 2O 4将其转化为产物Fe(OH)3+3H 2C 2O 4+3K 2C 2O 4=K 3[Fe(C 2O 4)3]+6H 2O 2组成分析:(1)用重量分子法测定结晶水含量将一定量产物在110℃下干燥,根据失重可以计算结晶水含量。
(2)用高锰酸钾法测定草酸根含量5C 2O 42-+2MnO 4-+16H +=2Mn 2++10CO 2+8H 2O (3)用高锰酸钾法测定铁含量Zn 粉还原Fe 3+为Fe 2+,然后用KMnO 4标准溶液滴定Fe 2+MnO 4-+5Fe 2++8H+=5Fe 3++Mn 2++4H 2O (4)确定钾含量配合物减结晶水、C 2O 42- ,Fe 3+含量即为K +含量 [实验内容与步骤](一)三草酸合铁(III )酸钾的合成(1)Fe C 2O 4的合成 (NH 4)2Fe(SO 4)2.6H 2O (5g) 溶液静置 FeC 2O 4(二) K 3[Fe(C 2O 4)3].3H 2O 的合成20ml H 2O 5d H 2SO4酸化,△ 25ml 饱和K 2C 2O 4, 搅拌 △至沸倾去清液 洗涤沉淀FeC 2O 410ml 饱和K 2C 2O 4 水浴△ 40℃滴加12ml H 2O 2 搅拌棕色Fe (OH )3沉淀水浴△ 75℃-85℃ 8ml H 2C 2O 4 亮绿色透明溶液(2)组成分析1.结晶水称量产物在110℃下干燥,根据失重可以计算结晶水含量。
实验十一 三草酸合铁(III)酸钾的制备及组成分析

三草酸合铁(III)酸钾的制备方法
• 1、以铁为原料制备硫酸亚铁铵,加草酸钾 制备草酸亚铁后经氧化制得。 • 2、以硫酸亚铁为起始原料,与草酸钾直接 合成。 • 3、以三氯化铁为起始原料,与草酸钾直接 合成。 • 4、以硫酸亚铁铵为起始原料,经氧化、水 解制备氢氧化铁,再与草酸氢钾配位制得。
二、实验原理
2FeSO 4 ( NH 4 ) 2 SO 4 6H 2 O 4NH 3 H 2 O H 2 O 2 2Fe(OH ) 3 4( NH 4 ) 2 SO 4 12H 2 O
KOH H2C2O4 KHC2O4
Fe(OH)3 3KHC2O4 K3[Fe(C2O4 )3 ] 3H2O
g; m(KOH)= g; m(草酸)= ; 产品质量=
g g;
②检定C2O42-:
2滴0.5mol/L 少量0.2mol/L FeCl3于试管中 少量产品溶液于试管中
六、注意事项
• ①严格控制制备反应的温度低于40℃。 • ② 氢氧化铁的沉淀要完全,加热煮沸的目的在于 使胶体状沉淀转化为易于过滤、洗涤的沉淀。 • ③ 减压过滤要规范。尤其注意在抽滤过程中,勿 用水冲洗粘附在烧杯和布氏滤斗上的少量绿色产 品,否则,将大大影响产量。
实验十一
三草酸合铁(III)酸 钾的制备及组成分析
一、实验目的
掌握无机制备的一般方法。
了解三草酸合铁(III)酸钾的性质和制备方法。
三草酸合铁(III)酸钾的性质
• 1 、 性 质 : 三 草 酸 合 铁 ( III ) 酸 钾
K3[Fe(C2O4)3]· 3H2O 为翠绿色单斜晶体,溶 于水,难溶于乙醇。 110℃失去三分子结晶 水, 230℃分解。该化合物对光敏感,光照 即发生分解。
三草酸合铁酸钾的制备与分析

三草酸合铁酸钾的制备与分析
一、三草酸合铁酸钾的制备方法:
1.氢氰酸法:
将氢氰酸加入到含铁离子的溶液中,然后加入过量的氢氧化钾溶液,
搅拌均匀并加热,得到三草酸合铁酸钾的沉淀。
反应方程式如下:6KOH+6HCN+FeCl3→K4[Fe(CN)6]+3KCl+6H2O
反应的温度和反应时间会影响产率和纯度。
2.氯化铁法:
将氯化铁溶液加入过量的氰化钾溶液中,搅拌均匀并加热,得到三草
酸合铁酸钾的沉淀。
反应方程式如下:
6KCN+FeCl3→K4[Fe(CN)6]+3KCl
该方法操作简单,但是氯化铁的溶液对皮肤有刺激性,需要注意安全。
二、三草酸合铁酸钾的分析方法:
1.离子交换色谱法:
离子交换色谱法可以用于分离和测定三草酸合铁酸钾。
将样品溶解在
适当的溶剂中,通过离子交换柱分离出三草酸合铁酸钾,并用紫外光谱仪
测定其吸收峰。
2.原子吸收光谱法:
原子吸收光谱法可以用于测定三草酸合铁酸钾中的铁离子含量。
将样品溶解在适当的溶剂中,然后经过适当的稀释,用原子吸收光谱仪测定其吸收峰。
3.毛细管电泳法:
毛细管电泳法可以用于分离和测定三草酸合铁酸钾。
将样品溶解在适当的溶剂中,通过毛细管电泳仪分离出三草酸合铁酸钾,并用紫外光谱仪测定其吸收峰。
无机化学实验3三草酸合铁酸钾的制备和性质
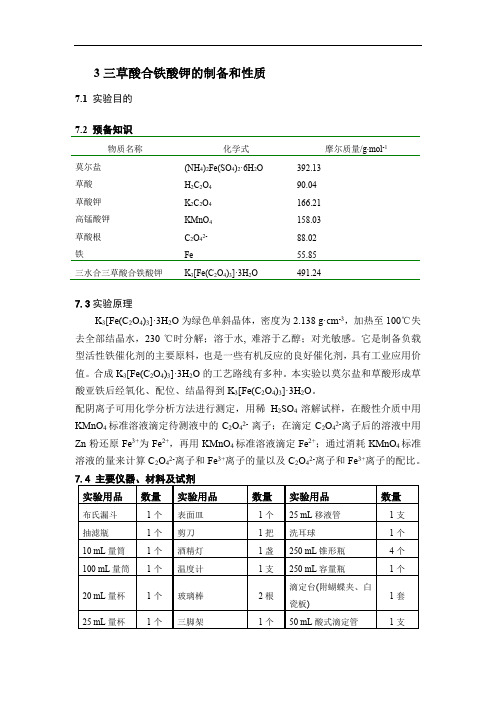
3三草酸合铁酸钾的制备和性质7.1 实验目的7.2 预备知识物质名称化学式摩尔质量/g∙mol-1莫尔盐(NH4)2Fe(SO4)2·6H2O392.13草酸H2C2O490.04草酸钾K2C2O4166.21高锰酸钾KMnO4158.03草酸根C2O42- 88.02铁Fe55.85三水合三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O491.247.3实验原理K3[Fe(C2O4)3]·3H2O为绿色单斜晶体,密度为2.138 g·cm-3,加热至100℃失去全部结晶水,230 ℃时分解;溶于水, 难溶于乙醇;对光敏感。
它是制备负载型活性铁催化剂的主要原料,也是一些有机反应的良好催化剂,具有工业应用价值。
合成K3[Fe(C2O4)3]·3H2O的工艺路线有多种。
本实验以莫尔盐和草酸形成草酸亚铁后经氧化、配位、结晶得到K3[Fe(C2O4)3]·3H2O。
配阴离子可用化学分析方法进行测定,用稀H2SO4溶解试样,在酸性介质中用KMnO4标准溶液滴定待测液中的C2O42-离子;在滴定C2O42-离子后的溶液中用Zn粉还原Fe3+为Fe2+,再用KMnO4标准溶液滴定Fe2+;通过消耗KMnO4标准溶液的量来计算C2O42-离子和Fe3+离子的量以及C2O42-离子和Fe3+离子的配比。
公用仪器、材料、试剂试剂名称位置试剂名称位置(NH4)2Fe(SO4)2·6H2O本实验桌Zn粉(A.R)本实验桌饱和草酸钾溶液本实验桌去离子水中间实验桌饱和草酸溶液本实验桌无水乙醇本实验桌标准浓度KMnO4溶液中间实验桌灯用酒精中间实验桌小纸条本实验桌及分析天平室真空系统实验桌正前上方冰块实验室临时提供称量纸本实验桌电子台秤(0.01g)本实验桌乙醇-丙酮1:1本实验桌H2O2 (w=5%)本实验桌水浴锅(用于分析)两人共用1套(本实验桌)注:实验结束后多余的产品回收到实验室指定的容器中。
三草酸根合铁(Ⅲ)酸钾的制备与分析

配合物的纯度可用氧化还原滴定法测定草酸根的含量或Fe 3+ 的含量来确定。
草酸根含量的测定可用高锰酸钾法,铁含量的测定可用重铬酸钾法。
重铬酸钾测定铁的含量,先用还原剂TiCl3将Fe 3+ 还原为Fe 2+,稍微过量的 TiCl3溶液将六价钨部分还原为五价钨(俗称钨蓝),使溶液呈蓝色。当钨蓝 刚好褪色时,于硫—磷混合酸介质中用 K2Cr2O7 标准溶液测定 Fe 2+ 含量, 主要反应如下: Fe 3+ + Ti 3+ + H2O == Fe 2+ + TiO 2+ + 2 H+ Cr2O7 2- + 6Fe 2+ + 14H+ == 2Cr 3+ + 6 Fe 3+ + 7H2O 根据滴定所用 K2Cr2O7 的浓度和体积,可计算 Fe 3+ 的含量。
学习动物精神
• 11、机智应变的猴子:工作的流程有时往往是一成不变的, 新人的优势在于不了解既有的做法,而能创造出新的创意 与点子。一味 地接受工作的交付, 只能学到工作方法 的皮毛,能思考应 变的人,才会学到 方法的精髓。
学习动物精神
• 12、善解人意的海豚:常常问自己:我是 主管该怎么办才能有助于更好的处理事情 的方法。在工作上善解人意, 会减轻主管、共 事者的负担,也 让你更具人缘。
2 O7
溶液至钨蓝刚好消失。加入硫磷混合酸溶液(附注3)10ml、
二苯胺磺酸钠指示剂5滴,立即用K2Cr 2O7 标准溶液滴定至出现紫色,
即为终点。计算Fe 3+含量。
思 考 题
1.在合成过程中加入3%H2O2后,为什么要加热煮沸溶液? 2.最后在溶液中加入10ml乙醇的作用是什么? 3.为什么K2Cr2O7可以直接配成标准溶液?KMnO4溶液也能直接配制吗?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
过滤
用倾析法将上层清液倾出,抽滤,滤渣 用20cm3 1mol·dm-3 H2SO4浸洗抽滤,弃 去滤渣,将溶液倒在一起。
返回
氧化
将翠绿色滤液加热至近沸,向热滤液中 慢慢加入1g KClO3晶体,并不断搅拌, 至滤液变为黄近沸。在维持近 沸的温度(90~95°C)下,逐滴加入 6mol·dm-3 NaOH溶液,不断搅拌,并随 时用pH试纸检验溶液的酸度,要求水解 反应在pH=1~2下进行,直至有砖红色沉 淀析出,保持90~95°C 0.5h,停止加热。
从废钒催化剂中回收五氧化二 钒
目的要求 实验原理 实验用品 实验步骤 思考题
目的要求
进一步锻炼设计实验的能力 了解钒(V)的性质 练习分离、沉淀、过滤等基本操作
返回
实验原理
ClO3- + 6VO2+ + 3H2O = 6VO2+ + Cl- + 6H+ 2VO2+ +H2O=V2O5 + 2H+
返回
实验用品
仪器:研钵、抽滤瓶、布氏漏斗、蒸发 皿、烧杯、量筒
药品:废钒催化剂、H2SO4溶液 (1mol·dm-3,2mol·dm-3)、KClO3(晶 体)、NaOH溶液( 6mol·dm-3 )
材料:pH试纸
返回
实验步骤
浸出 过滤 氧化 水解 分离
返回
浸出
称取50g研细的废钒催化剂,加入 120cm3 2mol·dm-3 H2SO4溶液,充分搅 动1h。
返回
分离
将所得砖红色沉淀抽滤,用少量蒸馏水 洗涤,抽干,称重。
返回
思考题
写出各步实验现象和反应的化学方程式。
返回
