卤代烃和醇方程式默写 (震川 山地之人)
醇和卤代烃

液态
能与水以任意比 比水小 率互溶,是常见 的有机溶剂
三、卤代烃和醇的化学性质 • 1、消去反应定义:
• 在一定条件下,从一个 有机物分子 中脱去一个或几个 小分子 生成 不饱和化合物 的反应。
反应方程式
H H
H C
H
C
Br
H + NaOH
醇
△
CH2=CH2 +H2O+NaBr
溴和氢脱去结合成溴化氢
50 0
醇羟基越多 沸点越高。
2 3
羟基数
1
小结三
• ①能够发生催化氧化生成醛的醇,结构特点是 有2个α氢原子 ,即结构通式为 R-CH2OH ; • ②能够被催化氧化生成酮的醇,结构特点是 有1个α氢原子,即结构通式为 R-CH(OH)-R'; • ③不能被催化氧化的醇,结构特点是 没有α氢原子,即结构通式为R-C(OH)-R'
醇 1、醇的分类: 饱和一元醇: CnH2n+1OH 一元醇 不饱和一元醇 醇 多元醇 :如乙二醇、丙三醇等 2、同系物的物理性质比较:
表3-2图 沸点/℃
● ● ●
醇
●
氢键
200
150 乙醇
● ●
氢键数 目增多
0
-50 -100
30 40 50 60相对分子质量 100
●
●
丙醇
● ●
烷
●
醇的沸点远 高于烷烃。
卤代烃和醇
一、卤代烃和醇的结构特点 通式
卤代烃 醇类 R-X R-OH
官能团
-X
代表物
CH3CH2Br
-OH CH3CH2OH
*X——指F、Cl、Br、I等卤族 元素原子。
新教材高中化学第3章烃的衍生物阶段突破3卤代烃醇酚pptx课件新人教版选择性必修3

1.掌握卤代烃、醇、酚等的化学性质,会熟练书写有关化学方程 式。
2.能由官能团判断有机物的性质,形成“结构”决定性质的思维。 3.掌握有关有机物性质的实验。
科学态度和社会责任:关注反应条件,指导化工生产,尽可能减小 对环境影响。
一、化学方程式的书写
书写下列反应的化学方程式,并注明反应条件。
___________________________2_N__a_C_l_+__2_H_2_O__;___________________。
二、卤代烃、醇、酚相关实验
1.卤代烃中卤素原子的检验 一般思路:水解、酸化、加AgNO3溶液。 具 体 过 程 : 少 量 卤 代 烃 ―N―a―O―H的― △水――溶―液→ ―冷―却→ ―稀―硝―酸――酸―化→ ―A―g―NO―3―溶―液→观察沉淀颜色。
(2)可以替代酸性KMnO4溶液的试剂是__溴__的__四__氯__化__碳__溶__液___,此时 如果去掉盛水的试管,对实验结果_无____(填“有”或“无”)影响。
(3)在另一支试管中取少量溴乙烷与NaOH的水溶液混合,加热,充
分反应后,向混合液中滴加AgNO3溶液,结果产生沉淀。化学实验小组 的同学由此得出结论:溴乙烷与NaOH的水溶液发生取代反应,生成了 溴化钠。该实验方案的错误之处是_滴__加__A_g_N__O_3_溶__液__前__没__有__用__稀__硝__酸__中__ _和__过__量__的__N_a_O__H_溶__液____,原因是_N__a_O_H__溶__液__会__和__A_g_N__O_3_溶__液__反__应__生__成___ _沉__淀__,__影__响__B__r_-_的__检__验____。
2.实验室常用浓硫酸和乙醇混合加热制取乙烯,下列说法中正 确的个数是( B )
卤代烃和醇

2、CH3CH=CH2+HBr
3、CH2=CH2+Br2
CH2£ CH2 Br Br
4、
5、
CH CH 2Br Cl
2
+
官能团种类的转化
1.引入羟基 CH2£ CH2 水解的化学方程式 例1、写出 Br Br
H2C Br H2C Br
+
2NaOH
水
△
H2C OH H2C OH
+ 2 NaBr
2.引入碳碳双键 例2、写出2—溴丙烷与 NaOH乙醇溶液共热的化学方程式 CH3CHCH3 + NaOH Br 醇
分子结构:
H H
①
H
④
C—C—O—H H
③
H
②
官能团-羟基(-OH)
主要化学 性质:
1、跟金属钠反应。 (断①键) 2、跟氢卤酸反应。 (断②键) 3、分子间脱水--取代。 (断①或②键) 4、分子内脱水--消去。 (断②和④键) 5、氧化反应。 (断①和③键) 6、酯化反应。 (断①键)
1、跟金属钠反应。
请根据已知条件,设计由CH3CHBr CH3合成CH3CH2CH2Br CH3CHBr CH3 CH3CH2CH2Br
消去 NaOH 醇 CH3CH=CH2
△
HBr
加成
过氧化物, 适当溶剂
醇
饱和一元醇通式:CnH2n+1OH( CnH2n+2O) 官能团:羟基 -OH
代表物质: C2H5OH
物理性质:俗名酒精,无色具有特殊香味的液体, 沸点低,易挥发,与水以任意比互溶, 密度比水小(浓度越大,密度越小)
①取少量卤代烃 ,②加氢), ⑥加入硝酸
2024届高考化学一轮复习:卤代烃、醇、酚

第61讲卤代烃醇酚[课程标准]1.掌握卤代烃的结构与性质,理解卤代烃在有机合成中的“桥梁”作用。
2.掌握醇、酚的结构、性质及应用。
考点一卤代烃1.概念(1)卤代烃是烃分子里的氢原子被卤素原子取代后生成的化合物。
通式可表示为R—X (其中R—表示烃基)。
(2)官能团是—X 。
2.物理性质(1)状态:通常情况下,除一氯甲烷、氯乙烷、氯乙烯等少数为气体外,其余为液体或固体;(2)沸点:比同碳原子数的烃沸点要高;(3)溶解性:水中不溶,有机溶剂中易溶;(4)密度:一般一氟代烃、一氯代烃比水小,其余比水大。
[JP][HT]3.化学性质(以溴乙烷为例)[HT](1)水解反应(取代反应)CH 3CH 2Br +NaOH A――→H 2O△CH 3CH 2OH +NaBr 。
(2)消去反应有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H 2O 、HX 等),而生成含不饱和键(如双键或三键)化合物的反应。
CH 3CH 2Br +NaOH ――→乙醇△CH 2===CH 2↑+NaBr +H 2O 。
4.对环境的影响氟氯烃在平流层中会破坏臭氧层,是造成臭氧空洞的主要原因。
[正误辨析](1)CH 3CH 2Cl 的沸点比CH 3CH 3的沸点高()(2)溴乙烷与NaOH 乙醇溶液共热生成乙烯()(3)在溴乙烷中加入AgNO 3溶液,立即产生淡黄色沉淀()(4)取溴乙烷水解液,向其中加入AgNO 3溶液,可观察到淡黄色沉淀(5)所有卤代烃都能够发生水解反应和消去反应()答案:(1)√(2)√(3)×(4)×(5)×学生用书第294页1.在卤代烃RCH2CH2X中化学键如图所示,则下列说法正确的是()A.发生水解反应时,被破坏的键是①和③B.发生消去反应时,被破坏的键是①和④C.发生水解反应时,被破坏的键是①D.发生消去反应时,被破坏的键是②和③答案:C2.有两种有机物Q()与P(),下列有关说法正确的是()A.二者的核磁共振氢谱中均只出现两种峰且峰面积之比为3∶2B.二者在NaOH醇溶液中均可发生消去反应C.一定条件下,二者在NaOH溶液中均可发生取代反应D.Q的一氯代物只有1种,P的一溴代物有2种C[Q中两个甲基上有6个等效氢原子,苯环上有2个等效氢原子,峰面积之比应为3∶1,A项错误;Q中苯环上的卤素原子无法发生消去反应,P中与卤素原子相连的碳原子的邻位碳原子上缺少氢原子,无法发生消去反应,B项错误;在适当条件下,Q、P中的卤素原子均可被—OH取代,C项正确;Q中苯环上的氢原子、甲基上的氢原子均可被氯原子取代,其一氯代物有2种,D项错误。
有机方程式默写单答案

有机化学方程式汇总1、甲烷及烷烃(易燃烧、易取代、可裂解)2、乙烯及烯烃 (易氧化、能使酸性高锰酸钾褪色、易加成、易加聚)1乙烯的制备CH 3CH 2OH C︒−−→−170浓硫酸CH 2===CH 2↑+H 2O 2乙烯的燃烧反应 CH 2=CH 2+3O 2−−→−点燃2CO 2+2H 2O3乙烯能使酸性高锰酸钾褪色 5CH 2=CH 2+12KMnO 4+18H 2SO 4―→10CO 2+12MnSO 4+6K 2SO 4+28H 2O4乙烯与溴水加成CH 2==CH 2+Br 2−−→−4CCl CH 2Br —CH 2Br5乙烯与水加成CH 2==CH 2+H 2O 加热、加压催化剂−−→−CH 3CH 2OH 6乙烯与氯化氢加成CH 2==CH 2+HCl ∆−−→−催化剂CH 3CH 2Cl 7乙烯与氢气加成CH 2==CH 2+H 2∆−→−NiCH 3—CH 3 8乙烯的加聚反应n CH 2==CH 2−−→−催化剂9丙烯与溴水加成CH 2==CHCH 3+Br 2−−→−4CCl CH 2Br —CHBrCH 310丙烯和溴化氢加成CH 2==CHCH 3+HBr −−→−催化剂CH 3—CHBrCH 311烯烃的燃烧通式 C n H 2n +3n2O 2−−→−点燃n CO 2+n H 2O 121,3—丁二烯与溴水的1,2加成131,3—丁二烯与溴水的1,4加成141,3—丁二烯与溴水的1:2加成 CH 2=CHCH=CH 2+2Br 2―→CH 2BrCHBrCHBrCH 2Br151,3—丁二烯的加聚16异戊二烯的加聚烯烃与酸性高锰酸KMnO方程式)R 1—CH==CH —R 2OH Zn O23/−→−R 1CHO +R 2CHO 3、乙炔及炔烃 (易氧化、能使酸性高锰酸钾褪色、易加成、易加聚)1实验室制乙炔CaC 2+2H 2O ―→C 2H 2↑+Ca(OH)22乙炔的燃烧反应2CH≡CH +5O 2−−→−点燃4CO 2+2H 2O3乙炔与氢气加成HC≡CH +H 2∆−→−NiCH 2==CH 2,CH 2==CH 2+H 2∆−→−NiCH 3—CH 34乙炔与溴水加成HC≡CH +Br 2―→CHBr ==CHBrCHBr==CHBr +Br 2―→CHBr 2—CHBr 25乙炔与氯化氢加成HC≡CH +HCl ∆−−→−催化剂CH 2==CHC l (氯乙烯) 6乙炔与水加成HC≡CH +H 2O −−→−催化剂CH 3CHO 7氯乙烯的加聚反应nCHCl =CH 2−−→−催化剂8乙炔的加聚反应n HC≡CH −−→−催化剂9 乙炔自身加成2CH≡CH―→CH 2==CH —C≡CH4、苯及苯的同系物 (苯能氧化、易取代,难加成,不能使酸性高锰酸钾褪色)1苯的燃烧反应2C 6H 6+15O 2――→点燃12CO 2+6H 2O2苯与液溴的取代3苯与浓硝酸的取代CC SO H NO HO ︒︒−−−→−-+60~55242浓NO 2O H 2+4苯环的磺化反应HSO 3−−−→−-+C80~C 703..H SO HO OH 2+5苯与氢气加成6甲苯的燃烧反应 C 7H 8+9O 2−−→−点燃7CO 2+4H 2O 7甲苯被酸性高锰酸钾氧化 +−−→−HKMnO 48乙苯被酸性高锰酸钾氧化(与苯环直接相连的碳上必须有氢原子,无论侧链有多长,均将烃基氧化为羧基)9甲苯与浓硝酸的取代10甲苯与液溴的取代11甲苯与氯气的光照取代5、卤代烃 (易水解、能消去)1溴乙烷水解成醇CH 3CH 2—Br +NaOH ∆−→−水CH 3CH 2—OH +NaBr 2溴乙烷消去成烯CH 3CH 2Br +NaOH ∆−−→−乙醇CH 2==CH 2↑+NaBr +H 2O 3R —X 水解R —X +NaOH ∆−−→−O H 2R —OH +NaX 4一氯乙烷的水解 CH 3CH 2—Cl +NaOH ∆−→−水CH 3CH 2—OH +NaCl 51,2—二溴乙烷的水解 CH 2Br —CH 2Br +2NaOH ∆−→−水+2NaBr6 苄基溴的水解反应7溴苯水解反应 (较难进行) CH 2Br —CH 2Br +2NaOH ∆−→−水+2NaBr8R -CH 2CH 2X 的消去反应R -CH 2CH 2X +NaOH ∆−−→−乙醇RCH=CH 2+NaX +H 2O 9的消去反应103—甲基—3—溴己烷的消去反应11的消去反应12 1,2—二溴乙烷发生消去反应成双键或者三键13 CH 3—CH 2—CHCl 2的消去反应(成三键)CH 3—CH 2—CHCl 2+2NaOH ∆−−→−乙醇CH 3—C≡CH↑+2NaCl +2H 2O6、乙醇及醇类 (易氧化、易取代、能消去)1乙醇和钠的置换反应2CH 3CH 2OH +2Na ―→2CH 3CH 2ONa +H 2↑2乙醇和镁的置换反应2CH 3CH 2OH +Mg ―→(CH 3CH 2O)2Mg +H 2↑3乙醇的燃烧反应CH 3CH 2OH +3O 2−−→−点燃2CO 2+3H 2O4乙醇的催化氧化2CH 3CH 2OH +O 2∆−−→−AgCu /2CH 3CHO +2H 2O5正丙醇催化氧化2CH 3CH 2CH 2OH +O 2∆−−→−AgCu /2CH 3CH 2CHO +2H 2O 6异丙醇催化氧化 2+O 2∆−−→−AgCu /2+2H 2O7乙醇直接被氧化成乙酸CH 3CH 2OH −−−−−−−→−酸性重铬酸钾酸性高锰酸钾/CH 3COOH8乙醇分子间脱水成醚C 2H 5OH +HOC 2H 5 C︒−−→−140浓硫酸C 2H 5OC 2H 5+H 2O 9乙醇与浓氢卤酸的取代CH 3CH 2OH +HBr −→−∆CH 3CH 2Br +H 2O10乙醇与酸的酯化反应CH 3COOH +CH 3CH 2OH CH 3COOC 2H 5+H 2O11 乙醇的消去反应CH 3CH 2OH C︒−−→−170浓硫酸CH 2==CH 2↑+H 2O 12R —CH 2OH 的催化氧化13的催化氧化14的消去反应15 乙二醇与钠反应16 丙三醇与硝酸反应7、苯酚及酚类(易氧化、易取代、能加成)1 苯酚的弱电离C6H5OH C6H5O-+H+2 苯酚与金属钠的反应OH2→+Na22ONa ↑+2H3 苯酚与氢氧化钠的反应OH2→+Na22ONa ↑+2H4 苯酚与碳酸钠的反应5 向苯酚钠溶液中通入少量CO2气体OH→+32CONa ONa3NaHCO+`向苯酚钠溶液中通入过量量CO2气体OH→+32CONa ONa3NaHCO+`6 向苯酚钠溶液加入盐酸7 苯酚与浓溴水的取代反应8 苯酚与浓硝酸的硝化反应9 酚类的显色反应10 苯酚与乙酸酯化反应11 苯酚与氢气的加成反应12 苯酚与甲醛的缩聚反应8、乙醛及醛类 (易氧化、能加成)1乙醛与氢气的加成CH 3CHO +H 2∆−→−NiCH 3CH 2—OH2乙醛的催化氧化2CH 3CHO +O 2∆−−→−催化剂2CH 3COOH 3乙醛的银镜反应 CH 3CHO +2Ag(NH 3)2OH CH 3COONH 4+2Ag↓+3NH 3+H 2O4乙醛与新制Cu(OH)2悬浊液反应 CH 3CHO +2Cu(OH)2+NaOHCH 3COONa +Cu 2O↓+3H 2O5乙醛与酸性高锰酸钾溶液反应 CH 3CHO −−−−→−+)(4H KMnO CH 3COOH6乙醛与溴水反应CH 3CHO +Br 2+H 2O ―→CH 3COOH +2HBr7乙醛的燃烧反应2CH 3CHO +5O 2−−→−点燃4CO 2+3H 2O8甲醛与氢气的加成HCHO +H 2 ∆−→−NiCH 3OH 9甲醛的银镜反应 HCHO +4Ag(NH 3)2OH (NH 4)2CO 3+4Ag↓+6NH 3+2 H 2O10甲醛与Cu(OH)2反应HCHO +4Cu(OH)2+2NaOH −→−∆Na 2CO 3+2Cu 2O↓ +6H 2O11丙酮与氢气的加成+H 2∆−→−Ni12 乙醛与HCN 加成CH 3CHO +HCN ―→13羟醛缩合(两分子乙醛)9、乙酸及羧酸 (酸性、酯化反应)1乙酸与金属钠反应 2Na +2CH 3COOH ―→2CH 3COONa +H 2↑2与某些金属氧化物(CaO)反应 CaO +2CH 3COOH ―→(CH 3COO)2Ca +H 2O3乙酸与NaOH 反应 CH 3COOH +NaOH ―→CH 3COONa +H 2O4乙酸与弱碱 (NH 3·H 2O)反应CH 3COOH +NH 3·H 2O ―→CH 3COONH 4+H 2O5乙酸与Na 2CO 3反应 2CH 3COOH +Na 2CO 3―→2CH 3COONa +CO 2↑+H 2O 6乙酸与NaHCO 3反应CH 3COOH +NaHCO 3―→CH 3COONa +CO 2↑+H 2O7乙酸与乙醇的酯化反应CH 3COOH +CH 3CH 2OH CH 3COOC 2H 5+H 2O8乙醇与硝酸的酯化反应C 2H 5OH +HONO 2∆−−→−浓硫酸C 2H 5—O —NO 2(硝酸乙酯)+H 2O 9乙醇与硫酸的酯化反应C 2H 5OH +HO —SO 3H −−→−C。
有机化学方程式默写

有机化学方程式默写
九、有机化学方程式默写(答案)
CH4 + Cl2CH3Cl + HCl
CH3Cl+ Cl2CH2Cl2 + HCl
CH2Cl2 + Cl2CHCl3 + HCl
CHCl3 + Cl2CCl4 + HCl
炔烃的化学性质(可加成、加聚,可使酸性高锰酸钾褪色)
苯酚(易被氧气氧化成粉红色,有毒,沾到皮肤时,应立即用酒精清洗;
℃以上时与水混溶;能使高锰酸钾褪色)
(可用于
除去苯中混有的少量苯酚)
(紫色,可用于检验酚类物质)
醛的化学性质(甲醛是室内装修的主要污染物,其水溶液叫福尔马林,可使高锰酸钾、溴水
酯的化学性质(有催化剂及加热情况下才会水解;碱存在时完全水解,反应不可逆;酸存在时,部分水解,反应可逆)
(皂化反应)。
高二烃与卤代烃-方程式默写

天津学大教育信息咨询有限公司
TIANJIN XUEDA EDUCATION INFORMATION CONSULTING CO.,LTD
烃与卤代烃-方程式默写
新戊烷的一溴取代反应甲苯在光照条件下的一氯取代反应
对二甲苯在铁作催化剂的的一溴取代反应制取TNT的反应方程式
2-氯-2-甲基丙烷的水解反应1,2-二溴丙烷的水解反应
丙炔与足量氯水的反应方程式邻二甲苯与足量的氢气的反应方程式
氯乙烯的加聚反应乙烯与丙烯1:1的加聚反应
2-溴-2-甲基丙烷的消去反应1,2-二溴乙烷的完全消去反应
甲烷的二溴取代反应邻二甲苯的一溴见光取代反应
苯以铁作催化剂的溴代反应对二甲苯以铁作催化剂的一溴代反应
苯的硝化反应CH3CHBrCH3的水解反应
1,2-二氯丙烷的水解反应苯乙烯与溴水的加成反应
2-丁烯与水的加成反应苯乙炔与足量氢气的加成反应
制取的反应2,3-二氯-2,3-甲基丁烷的完全消去反应
1。
高二高中化学方程式(烃卤代烃醇苯醛酸酯糖类)
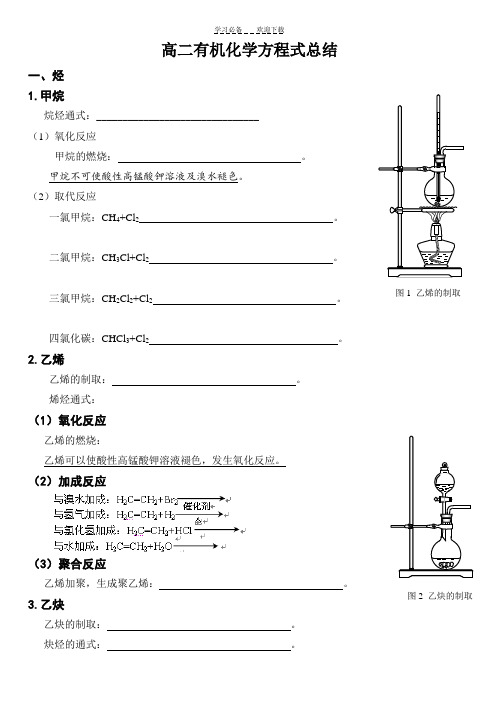
高二有机化学方程式总结一、烃1.甲烷烷烃通式:_______________________________(1)氧化反应甲烷的燃烧:。
甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH4+Cl2。
二氯甲烷:CH3Cl+Cl2。
三氯甲烷:CH2Cl2+Cl2。
四氯化碳:CHCl3+Cl2。
2.乙烯乙烯的制取:。
烯烃通式:___________________________(1)氧化反应乙烯的燃烧:___________________________________乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应(3)聚合反应乙烯加聚,生成聚乙烯:。
3.乙炔乙炔的制取:。
图1 乙烯的制取图2 乙炔的制取(1)氧化反应乙炔的燃烧: 。
乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC CH+Br 2 →CHBr=CHBr+Br 2 → 与氢气加成:_______________________________与氯化氢加成:_________________________________(3)聚合反应氯乙烯加聚,得到聚氯乙烯: 。
乙炔加聚,得到聚乙炔: 。
4.苯苯的同系物通式:__________________________________(1)氧化反应苯的燃烧: 。
苯不能使溴水和酸性高锰酸钾溶液褪色。
(2)取代反应①苯与溴反应________________________________________________________________________②硝化反应_________________________________________________________________________(3)加成反应注意:制取乙烯、乙炔均用排水法收集;乙烯、乙炔的加成反应一般都需要催化剂(溴除外)。
5.甲苯(1)氧化反应甲苯的燃烧:。
