核外电子分层排布示意图
合集下载
原子核外电子的排布 课件

54 氙 Xe 2 8 18 18 8
86 氡 Rn 2 8 18 32 18 8
原子核外电子的排布规律 (1)各电子层最多能容纳___2_n_2__个电子(n为电子层 数)。 (2)最外层电子数不超过___8__个(当K层为最外层时 不超过___2 _个)。 (3)次外层电子数不超过__1_8__个。 (4) 电子总是尽量先排布在能量____最_低__的电子层里, 然后由里向外,依次排布在能量逐步______升_的高电 子层。
第一章 《物质结构 元素周期律》
第二节 《元素周期律》
核外电子排布规律
① 分层排布:一分、别原用子n 核= 1外、电2、子3、的4、排5布、6、7来表示从
内到外的电子层,并分别用符号K、L、M、N、O、P、Q来表 示); ② 在离核较近的区域运动的电子能量较低,在离核较远的 区域运动的电子能量较高,原子核外的电子总是尽可能地
小结: (1)比较微粒半径大小: 三看
一看电子层数
二看核电荷数
三看核外电子数或 最外层电子数
(2)对于同种元素:①阳离子半径<原子半径
②阴离子半径 > 原子半径 (3)对于电子层结构相同的离子:
核电荷数越大,则离子半径越小。 如 O2- > F-> Na+ > Mg2+>Al3+; S2- > Cl- > K+ >Ca2+
0.186 0.160 0.143 0.117 0.110 0.102 0.099 ----
原子序数
原子半径的变化
3~9
逐渐减小
11~17
逐渐减小
结论:随着原子序数的递增,元素原 子半径呈现 周期性 变化。
如何比较简单微粒 半径大小?
原子核外电子的排布

2.根据下列各组元素的原子结构示意图分析,
具有相似化学性质的一组是( A )
由于金属、非金属的原子最外层电 子都没有达到相对稳定结构,在化学反 应中容易得、失电子,从而达到相对 稳定结构。那么,得失电子的结果是怎 样的呢?形成的粒子又是什么呢?
二. 离子
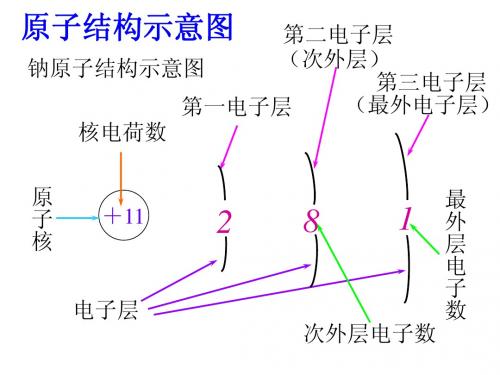
钠和氯的原子结构示意图
+11 2 8 1
3.非金属元素的原子最外层电子数一般 ≥ 4 ,在化学反 应中,容易 得到 电子,化学性质 不稳定 。
元素的化学性质主要由原子的 最外层电子数 决定的。
【练习2】1.下列原子的结构示意图中,化学性
质最稳定的是 B ,易失去电子的是 C , 易得到电子的是 AD,属于金属元素的是_C__, 属于非金属元素的是__A__D__,属于稀有气体元 素的是____B_____。
练习
某原子的原子结构示意图为
,该原
子的核电荷数为 ,核外有 个电子层,第
二层上有 个电子,最外电子层上有 个电
子。
【亲手尝试】根据氧原子的结构图画出结构示意图
第一层(2个) 第二层(6个)
(最外层)
+8 2 6
3. 核外电子的排布规律:
⑴第一层最多容纳__2_个电子,第二层最多容纳__8_个电子。 (2)最外层不超过 8 个电子,只有1层的不超过__2_个电子。 ⑶电子先排满第__1_层,再排第__2_层,排满第__2_层,再 排第_3__层。(按照能量由低到高的顺序分层排布)
【讨论与分析】金属元素与非金属元素原子的最 外层电子数分别有什么特点?在化学反应中,为 了达到相对稳定结构,它们得失电子的情况是怎 么的?请举例说明。
最外层电子数 ﹤4
易失电子 不稳定
最外层电子 ≥ 4
1-1-1原子核外电子排布
原子的还原性很强,这种微粒的符号是__________。 (4)该微粒的还原性很弱,失去1个电子后变为原子, 原子的氧化性很强,这种微粒的符号是_____。
解析
(1)该微粒为中性微粒,即核电荷数等于核外
电子数,为18号元素氩。 (2)该微粒能使溴水褪色,即为还原性微粒,且出现 浑浊,即有难溶性的非金属单质。符合条件的为硫 元素。 (3)该微粒得到一个电子可变成原子,故为19号元素 钾。 (4)该微粒失去一个电子可变成原子,故为17号元素 氯。
( A )
C.a=b+m-n D.a=b-m-n 解析 在原子中,核电荷数等于核外电子数;在
阳离子中,核电荷数减去离子所带电荷数等于核 外电子数;在阴离子中,核电荷数加上离子所带 电荷数等于核外电子数。因为Xm+和Yn-具有相同 的核外电子排布,所以,Xm+和Yn-具有相同的核 外电子数,aXm+的核外电子数等于a-m,bYn-的 核外电子数为:b+n,则:a-m=b+n。
3.在下列所表示的微粒中,得电子能力最强的是 ( B )
解析
四个选项的示意图分别表示碳原子、氟原
子、钠离子、铝离子。钠离子和铝离子都形成最外 电子层为8个电子的稳定结构,则它们很难得到电 子。氟原子比碳原子的核电荷数大,最外层电子数 多,原子半径小,原子核对核外电子的吸引力大, 因此氟原子比碳原子更易得电子。
答案
(1)Ar
(2)S2-
(3)K+
(4)Cl-
8.A、B、C三种元素,其中有一种金属元素,A、 B原子的电子层数相同,B、C原子的最外层电子 数相同。又知这三种元素原子的最外层电子数之 和为17,原子核中的质子数之和为31。试通过计 算确定这三种元素的名称。 解析 设元素A、B原子最外层电子数分别为y和x,
解析
(1)该微粒为中性微粒,即核电荷数等于核外
电子数,为18号元素氩。 (2)该微粒能使溴水褪色,即为还原性微粒,且出现 浑浊,即有难溶性的非金属单质。符合条件的为硫 元素。 (3)该微粒得到一个电子可变成原子,故为19号元素 钾。 (4)该微粒失去一个电子可变成原子,故为17号元素 氯。
( A )
C.a=b+m-n D.a=b-m-n 解析 在原子中,核电荷数等于核外电子数;在
阳离子中,核电荷数减去离子所带电荷数等于核 外电子数;在阴离子中,核电荷数加上离子所带 电荷数等于核外电子数。因为Xm+和Yn-具有相同 的核外电子排布,所以,Xm+和Yn-具有相同的核 外电子数,aXm+的核外电子数等于a-m,bYn-的 核外电子数为:b+n,则:a-m=b+n。
3.在下列所表示的微粒中,得电子能力最强的是 ( B )
解析
四个选项的示意图分别表示碳原子、氟原
子、钠离子、铝离子。钠离子和铝离子都形成最外 电子层为8个电子的稳定结构,则它们很难得到电 子。氟原子比碳原子的核电荷数大,最外层电子数 多,原子半径小,原子核对核外电子的吸引力大, 因此氟原子比碳原子更易得电子。
答案
(1)Ar
(2)S2-
(3)K+
(4)Cl-
8.A、B、C三种元素,其中有一种金属元素,A、 B原子的电子层数相同,B、C原子的最外层电子 数相同。又知这三种元素原子的最外层电子数之 和为17,原子核中的质子数之和为31。试通过计 算确定这三种元素的名称。 解析 设元素A、B原子最外层电子数分别为y和x,
核外电子排布的初步知识

核外电子的排布规律:
先排内层,后排外层。 第一层上最多排2个电子。 第二层上最多排8个电子。 最外层上最多排8个电子。
1—18号元素的 +1 1 原子结构示意图
氢(H)
+2 2 氦(He)
+3 2 1 +4 2 2 +5 2 3 +6 2 4 +7 25 +8 26 +9 27 +102 8
锂(Li) 铍(Be) 硼(B) 碳(C) 氮(N) 氧(O) 氟(F) 氖(Ne)
硼(B) 碳(C) 氮(N) 氧(O) 氟(F)
+14 2 8 4 +15 2 8 5 +16 2 8 6 +17 2 8 7
硅(Si) 磷(P) 硫(S)氯(Cl)
+11 2 8 1
失去一个电子
+11 2 8
钠原子(Na) 易失电子
失去二个电子 +12 2 8 2
+12 2 8
镁原子(Mg) 易失电子
+11 2 8 1 +12 2 8 2 +13 2 8 3 +14 2 8 4 +15 2 8 5 +16 2 8 6 +17 2 8 7+18 2 8 8 钠(Na) 镁(Mg)铝(Al)硅(Si) 磷(P) 硫(S) 氯(Cl)氩(Ar)
试分析它们的原子结构(电子层数、
最外层电子)请指出 :
(1)纵行中,元素的相同点
1—18号元素的 +1 1 原子结构示意图
氢(H)
+2 2 氦(He)
+3 2 1 +4 22 +5 2 3 +6 2 4 +7 25 +8 26 +9 27 +102 8
电子的核外排布

≥4个
稳定(不得失)
在化学反应中 易失去电子
在化学反应中 易得到电子
总结:元素的性质,特别是化学性质,跟它的原
子的 最外层电子数
关系密切。
练习:
下面的结构示意图正确的是:( )
+3 2 1 A
+3 3 B
+11 2 8 1 +11 2 9
C
D
练习:
画出下列原子的结构示意图:
7N
12Mg
17Cl
部分金属元素的原子结构示意图
3、下列具有相似化学性质的元素组别
是: C、D
。
A.
B.
C.
D.
同学们有没有想过电子是 怎样围绕原子核做高速运
动的呢?
三、原子核外电子的不同运动区域
多电子原子核外电子的分层运动状况
核外电子分层排布
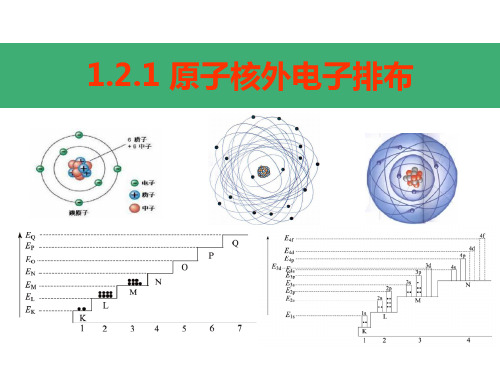
电子按能量高低在核外分层排布。 1234567 K LMNOPQ
由内到外,能量逐渐升高
核外电子的分层排布(又叫分层运动)
电子层符号 K L M N O P Q
电子层序数(n) 1 2 3 4 5 6 7
电子离核的距离 近
远
电子具有的能量 低
高
2、原子结构示意图
如: Na
核内质子数
电子层
原子核
每个电子层上的电子数
称有气体元素原子电子层排布
各电子层的电子数
核电 元素名 元素
荷数 称 符号 K
L
M
N
O
P
最外层电子 数
2
氦
He
2
2
10
氖
Ne
2
8
8
18
氩
Ar
1.2.1 原子核外电子排布
元素的金属性、非金属性。
二、元素周期律
1、概念:
元素的性质随着原子序数的递增而呈现周期性 的变化的规律叫做元素周期律。
2、本质:
元素性质的周期性变化规律是元素原子核外 电子排布周期性变化的必然结果。
随堂练习:
1、R元素形成的化合物RH3,其中R的化合价是其 最低负化合价,则R元素最高价氧化物的化学式是:
111
88
77
N(氮) O(氧) F(氟)
70
66
64
Ne(氖) —
11~17 号元素 Na(钠) Mg(镁) Al(铝) Si(硅) P(磷)
原子半
径/pm
186
160
143
117
110
S(硫) 104
Cl(氯) Ar(氩)
99
—
提示:(1)稀有气体元素原子半径的测定依据与其它元素不同,没有可比性。 (2)表中数据的单位是pm(皮米),1pm=10-12m。
1.2.1 原子核外电子排布
一、原子核外电子排布 原子结构示意图
一、原子核外电子排布
各电子层排布的电子数
电子层(从里到外为K、L、M······层) 核电荷数
原子核
一、原子核外电子排布
1、原子核外电子排布
(1)核外电子按能量高低分层排布(运动)
电子层: 根据电子的能量差异和通常运动区域离核
(能层)
〔观察思考2〕观察下表:原子序数为3~9、11~17的元素的原子 半径。用横坐标表示元素原子核外最外层电子数,以纵坐标表 示原子半径,根据数据表作图,表示出3~9、11~17的元素的 原子最外层电子数与原子半径的函数图像。
3~9号 元素
原子半 径/pm
第4单元第14讲_核外电子的排布和周期律

【点拨】根据核外电子的排布情况可以推测元素的 种类及元素可能性质。 前18号元素的原子结构的特殊性 ①原子核中无中子的原子 。
②最外层有1个电子的元素:H、Li、Na。 ③最外层有2个电子的元素:Be、Mg、He。 ④最外层电子数等于次外层电子数的元素:Be、 Ar。
⑤最外层电子数是次外层电子数2倍的元素:C; 是次外层电子数3倍的元素:O;是次外层电子数 4倍的元素:Ne。 ⑥电子层数与最外层电子数相等的元素:H、Be、 Al。 ⑦电子总数为最外层电子数2倍的元素:Be。 ⑧次外层电子数是最外层电子数2倍的元素:Si。 ⑨内层电子数是最外层电子数2倍的元素:Li、P。
要熟悉周期表的结构,记住各周期的元素 种数,记住各族的排列顺序,能分析常见元素 在周期表的位置,能根据周期律分析元素的可 能性质。
四、元素的“位、构、性”关系 1.化合价与原子结构、周期表位置的关系 元素的化合价与原子的电子层结构,特别是与最外 电子层中电子的数目有密切关系,因此,元素原子 的最外电子层中的电子,也叫做价电子。有些元素 的化合价与它们原子的次外层或倒数第三层的部分 电子有关,这部分电子也叫价电子。总之,价电子 就是指那些与化合价关系密切的电子。
【典例3】有X、Y两种元素,原子序数≤20,X的 原子半径小于Y,且X、Y原子的最外层电子数相 同(选项中m、n均为正整数)。下列说法正确的是 ( ) A.若X(OH)n为强碱,则Y(OH)n也一定为强碱 B.若HnXOm 为强酸,则X的氢化物溶于水一定显 酸性 C.若X元素形成的单质是X2 ,则Y元素形成的单 质一定是Y2 D.若Y的最高正价为+m,则X的最高正价一定为 +m
3.核外电子排布的表示方法:原子或离子结构示意图 圆圈表示原子核,圆圈内标示出核电荷数,用弧线表 示电子层,弧线上的数字表示该电子层的电子数。要 注意无论是阳离子还是阴离子,圆圈内的核电荷数是 不变的,变化的是最外层电子数。
3.2原子结构(第2课时原子核外电子的排布离子)课件九年级化学人教版(2024)上册

硫离子 得2个电子,
带负电
氯离子 得1个电子,
带负电
探究新知
书写
1.右上角“+” “-”表电性; 2.有数字的, 数字在前,正 负号在后; 3.若只带1个 单位电荷,“1” 省略不写。
Mg2+ 2 Cl-
一个镁离子 数字“2” 表示每个镁离子带2个 单位的正电荷。
一两个氯离子 表示每个氯离子带1个单位的负 电荷。
电子层 一 二 三 四 五 六 七
离核远近: 近
远
能量高低: 低
高
离核近的电子能量较低, 离核越远,电子的能量越高。
探究新知
➢ 核外电子运动经常出现的区域叫电子层。 ➢ 核外电子运动的特点:分层、无规则、高速。
电子在不同的区域内运动的现象叫做核外电子的分层 排布。如何形象地把核外电子排布情况表述出来呢?
1个
3个
Cl +17 2 8 7 ①
Cl +17 2 8 7 ②
Cl +17 2 8 7 ③
探究新知
Na +11 2 8 1
失去 1个电子
Na+ +11 2 8
Cl +17 2 8 7
得到 1个电子
Cl- +17 2 8 8
Na+ Cl-
课题活动
学以致用
Mg +12 2 8 2
失去 2个电子
Mg2+ +12 2 8
探究新知
元素最外层电子数与原子性质的关系
最外层电子数一般小于4; 最外层电子数为8(He为2);
化学反应中易失电子。
相对稳定。
探究新知
元素最外层电子数与原子性质的关系
最外层电子数一般大于4; 化学反应中易得电子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(1)x表示该元素原子核内的质子,数 该粒子有 3 个电 子层,y与粒子的 化学性质 关系非常密切。
(2)当x-y=10,该粒子为 原子 别)。
(填类
(3)y=8时,该粒子带有2个单位的负电荷,该
粒子的符号为 S2-
。
(4)当y=1的中性原子与y=7的中性原子化合 时,形成的化合物属于 离子 化合物。
非金属元 一般多于等于 易得电子,形成 不稳定
素
4个
阴离子
决定元素化学性质的是:最外层电子数
钠+氯气
点燃
氯化钠
钠与氯气反应形成氯化钠
二、离子的形成
1、离子:带电的原子或原子团 阳离子
离子 阴离子
离子符号:
2、离子化合物:由阴阳离子相互化合而形成的 化合物,如NaCl
离子与原子的区别和联系
粒子种类
9.某原子结构示意图可表示为
,回答下列问题:
(1)结构示意图中,x表示质子数; y表示 最外层电子。数
(2)当x=16时,y= 6 ; 当y=8时,x= 18 。
10.将H、Li、Na、Mg、Al排成下图形式,根据空行的原子 结构可以得出如下规律:
(1)纵行中,三种元素的原子在结构上的相同点
是最外层电子数相同,不同点是 电子层数不同
最外层最多容纳8个电子
原子核
原子结构示意图
质子数(核电荷数)
要点:
圆圈标核电,
正号写在前,
电子数
弧线呈扇面, 数字一条线。
电子层
3、元素性质与元素最外层电子数的关系
元素分类 最外层电子数 得失电子倾向 化学性质
稀有气体 8个(He为2个) 不易得失、相对 稳定
元素
稳定
金属元素 一般少于4个 易失电子 ,形成 不稳定 阳离子
,该原子的
核电荷数为 11 ,在化学反应中易 失 (填
“得”或“失”)电子,金属属
元素(填
“金属”或“非金属”)。
8.已知铝元素的原子结构示意图为Al
(1)
表示的意义 原子核内有13个质子
, ;
(2)铝元素原子核外共有 3
数是 3
;
个电子层,最外层电子
(3)铝元素的原子在化学反应中易(填“得”或“失失”)
(1)A、B、C、D、E、F共表示 元素。
(2)表示原子的粒子是 ACF 下同)。
(3)表示离子的粒子是 BDE
四
种
(填序号,
。
[例2]铜是由 铜元素 组成 的,由 铜原子 构成的;水
是由 氢元素和氧元素组成的,
由 水分子 构成的;氯化钠 是由 氯元素和钠元素组成的, 由 钠离子和氯离子构成的。
[例3]某粒子结构示意图为
课堂练习
1.对于同种元素的原子和离子,一定具有相同的 (A )
A.质子数
B.电子数
C.电子层数
D.最外层电子数
2.元素的化学性质取决于原子结构中的 ( D )
A.电子层数
B.中子数
C.核外电子数
D.最外层电子数
3.下列符号表示阳离子的是 ( C )
4.下列各对微粒中,质子数相同,电子数 也相同的是 ( C )
。
(2)横行中,三种元素的原子在结构上的相同点是
电子层数相同
,不同点是 最外层电子数不同 。
A.S和S2-
B.F-和Mg2+
C.Ne和H2O
D.Na和Na+
5.右图是钠原子的结构示意图:
弧线表示 电子层 。 原子核内的质子数 是 11 。第二层上的电子数是 8 。
6.金属元素在化学反应中一般较易 失去 电
子,变成 阳
离子,这是因为金属原
子最外层电子数目一般 少于
4个。
7.某种原子结构简图为
电
子,形阳成
离子(填“阴”或“阳3”),带
个正单位的
电荷(填“正”或“负”),铝离子的符号表示
为
。
(4)由此可以看出:原子在失去最外层电子或在①最③外⑤层⑨得到电
子达到稳定结构后,一般不会发生改变的有
。
①元素的种类 ②元素的化学性质 ③相对原子质量 ④粒子的 电性 ⑤原子核 ⑥最外层电子数 ⑦电子层数 ⑧核外电子层 数 ⑨质子个数
粒子结构 区 粒子电性 别
符号
联系
原子
阳离子
离子
阴离子
质子数=核外电子数 质子数>核外电子数 质子数<核外电子数
不显电性
用表示如 用阴离子符号表示如
Na+、Mg2+
Cl-、S2-
阳离子
原子
阴离子
物质与其构成粒子间的关系
[例1]六种粒子结构示意图分别为:
课题3 离子
核外电子分层排布示意图
一、核外电子的排布
1、核外电子是分层排布的
电子层:1 2 3 4 5 6 7
离核:近
远
能量:低
高
能量低的在离核近的区域运动,能量高的 在离核远的区域运动
2、电子在电子层上的分布规律
第一层最多容纳2个电子 第二层最多容纳8个电子 第三层最多容纳18个电子 第n层最多容纳 2n2 个电子
