一、原子核外电子排布及表示方法1能层、能级及其最多容纳培训资料
原子核外电子排布规律

3
原子核外电子在能量相同的各个轨道上排布时 ①电子尽可能分占不同的原子轨道, ②自旋状态相同
洪特规则特例
全满(s2、p6、d10、f14) 半满(s1、p3、d5、f7) 全空(s0、p0、d0、f0)时比较稳定。
原子核外电子排布遵循的原理
1 1.能量最低原理
排布 规律
2 2.泡利不相容原理
3 3.洪特规则
4,轨道表示式 原子核外电子不同运动状态
2
1,(2009)以下表示氦原子结构的化学用语中,对电子运动 状态描述最详尽的是
A.:He
B.
C.1s2
D.
2,短周期元素中,原子基态时具有1个未成对电子的元素共有( )
A.5
B.6
C.7
D.8
2
写出24Cr原子的轨道表示式 和电子排布式
1s22s22p63s23p63d54s1
能级交错
E(4s) < E(5s) < E(6s) <
E(3d) E(4d) E(5d)
2
5, 什么是基态,激发态光谱是如何产生的
原子的发射与吸收光谱
低能量轨道电子
吸收能量 原子吸收光谱
高能量轨道电子
释放能量 原子发射光谱
低能量轨道电子
2
6, 同一能级电子排布是如何排布的遵循什么规律
2
每个原子轨道上最多只能容纳两个自旋状态不同的电子。 在同一个原子中没有也不可能有运动状态完全相同的两 个电子存在 。
(2)原子外围电子排布式:
①原子实:将原子内层已达到稀有气体结构 的部分写成原子实,以稀有气体的元素符号 外加方括号表示。
②在化学反应中,原子外围电子发生变化, 而原子实不受影响。
③也可以省去原子实,直接写出原子外围电 子排布式。
原子结构与原子核外电子能级分布

原子结构与原子核外电子能级分布1.了解原子核外电子的分层排布,掌握能层、能级及其表示。
2.掌握构造原理及核外电子排布规律,掌握1-36号元素的核外电子排布式3.了解电子云与原子轨道概念,掌握原子轨道数目的判断方法4.了解能量最低原子、基态、激发态、光谱一、能层与能级对多电子原子的核外电子,按将其分成不同的能层(n);对于同一能层里能量不同的电子,将其分成不同的;能级类型的种类数与能层数相对应;同一能层里,能级的能量按的顺序升高,即E(s)<E(p)<E(d)<E(f)。
由表中可知:①各能层最多容纳的电子数为。
②能级类型的种类数与数相对应③s p d f 能级所含轨道数分别为,与能级所在能层无关。
二、电子云与原子轨道1.电子云:电子在原子核外出现的概率密度分布。
电子云是核外电子运动状态的形象化描述,小黑点的疏密表示。
2.原子轨道:不同能级上的电子出现概率约为%的电子云空间轮廓图。
s电子的原子轨道呈对称,ns能级各有个原子轨道;p电子的原子轨道呈,n p能级各有个原子轨道,相互垂直(用p x、p y、p z表示);n d能级各有个原子轨道;n f能级各有个原子轨道。
各轨道的的形状与所处的能层无关。
三、核外电子排布规律1.构造原理:绝大多数基态原子核外电子的排布都遵循下列顺序:1s、2s、2p、3s、3p、、、4p、5s、4d、5p、6s、4f……构造原理揭示了原子核外电子的能级分布。
从中可以看出,不同能层的能级有交错现象,如E(3d)>E(4s)、E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。
构造原理是书写基态原子电子排布式的依据,也是绘制基态原子电子排布图(即轨道表示式)的主要依据之一。
思考:如何快速判断不同能级的能量高低?2.能量最低原理:能量最低原理:原子核外电子遵循构造原理排布时,原子的能量处于最低状态。
即在基态原子里,电子优先排布在的能级里,然后排布在能量逐渐升高的能级里。
第十三章 学案63 原子结构与性质

第十三章 物质结构与性质(选考)学案63 原子结构与性质[考纲要求] 1.了解原子核外电子的能级分布,能用电子排布式表示常见元素(1-36号)原子核外电子的排布。
了解原子核外电子的运动状态。
2.了解元素电离能的含义,并能用以说明元素的某些性质。
3.了解原子核外电子在一定条件下会发生跃迁,了解其简单应用。
4.了解电负性的概念,知道元素的性质与电负性的关系。
知识点一 原子核外电子排布及表示方法第1电子层:只有s 第2电子层:有s 、p 两种轨道。
第3电子层:有s 、p 、d 三种轨道。
3.构造原理 构造原理:多电子原子的核外电子排布遵循构造原理,根据构造原理可以写出元素基态原子的电子排布式。
随着__________的递增,基态原子的核外电子按照右图中箭头的方向依次排布,即1s,2s,2p ,____,____,____,____,____,____,4d,5p ……该原理适用于绝大多数基态原子的核外电子排布。
4.原子核外电子排布规律(1)能量最低原理①原子的电子排布遵循构造原理能使整个原子的能量处于最低状态。
②基态原子:______________。
当基态原子________能量后,电子会______________,变成__________原子。
(2)泡利原理一个原子轨道最多容纳____个电子,并且____________相反。
(3)洪特规则当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先________________,并且__________相同。
问题思考1.电子按构造原理排布时,先排在4s轨道,再排3d轨道,为什么?而失电子时,是先失4s轨道上的,还是先失3d轨道上的?知识点二元素周期表中元素及其化合物的性质递变规律1.电离能(1)第一电离能:气态电中性基态原子____________转化为气态基态正一价离子所需要的最低能量。
(2)元素第一电离能的意义:元素的第一电离能可以衡量元素的原子失去一个电子的难易程度。
第一章 第一节 第3课时 原子核外电子排布规则(教师版)

第3课时 原子核外电子排布规则[核心素养发展目标] 宏观辨识与微观探析:能从原子的微观层面理解原子的组成、结构等,能根据核外电子的排布规则熟知核外电子排布的表示方法,并能根据电子排布式(图)、结构示意图等推导出对应的原子或离子。
一、基态原子核外电子的排布原则1.能量最低原理原子核外的电子应优先排布在能量最低的能级里,然后由里到外,依次排布在能量逐渐升高的能级里。
能级的能量高低顺序如构造原理所示(对于1~36号元素来说,应重点掌握和记忆“1s →2s →2p →3s →3p →4s →3d →4p ”这一顺序)。
2.泡利原理 (1)原理内容:在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋状态相反,用方向相反的箭头“↑↓”表示。
(2)电子排布图 ①将每一个原子轨道用一个方框表示,在方框内标明基态原子核外电子分布的式子。
②以铝原子为例,电子排布图中各符号、数字的意义为3.洪特规则(1)内容:当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同。
(2)特例在等价轨道(同一能级)上的电子排布处于全充满、半充满和全空状态时,具有较低的能量和较大的稳定性。
相对稳定的状态⎩⎪⎨⎪⎧ 全充满:p 6、d 10、f 14全空:p 0、d 0、f 0半充满:p 3、d 5、f 7如24Cr 的电子排布式为1s 22s 22p 63s 23p 63d 54s 1,为半充满状态,易错写为1s 22s 22p 63s 23p 63d 44s 2。
判断正误(1)基态多电子原子中,可以存在两个运动状态完全相同的电子( )(2)若将15P 原子的电子排布式写成1s 22s 22p 63s 23p 2x 3p 1y ,它违背了泡利原理( )(3)2p 3x 只违背了洪特规则( ) (4)某原子的最外层电子排布式为3s 23p 2,其有14种不同运动状态的电子( )答案 (1)× (2)× (3)× (4)√1.以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断,哪些违反了泡利原理,哪些违反了洪特规则。
第一章 第一节 第3课时 原子核外电子排布规则(学生版)

第3课时 原子核外电子排布规则一、基态原子核外电子的排布原则1.能量最低原理原子核外的电子应优先排布在 的能级里,然后由里到外,依次排布在 的能级里。
能级的能量高低顺序如构造原理所示(对于1~36号元素来说,应重点掌握和记忆“1s → →4p ”这一顺序)。
2.泡利原理(1)原理内容:在一个原子轨道里,最多只能容纳 个电子,而且它们的自旋状态 ,用方向相反的箭头“↑↓”表示。
(2)电子排布图 ①将每一个原子轨道用一个方框表示,在方框内标明基态原子核外电子分布的式子。
②以铝原子为例,电子排布图中各符号、数字的意义为3.洪特规则(1)内容:当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同。
(2)特例在等价轨道(同一能级)上的电子排布处于全充满、半充满和全空状态时,具有 的能量和 的稳定性。
相对稳定的状态⎩⎪⎨⎪⎧全充满:p 6、d 10、f 14全空:p 0、d 0、f 0半充满:p 3、d 5、f 7如24Cr 的电子排布式为 ,为半充满状态,易错写为1s 22s 22p 63s 23p 63d 44s 2。
判断正误(1)基态多电子原子中,可以存在两个运动状态完全相同的电子( )(2)若将15P 原子的电子排布式写成1s 22s 22p 63s 23p 2x 3p 1y ,它违背了泡利原理( )(3)2p 3x 只违背了洪特规则( ) (4)某原子的最外层电子排布式为3s 23p 2,其有14种不同运动状态的电子( )深度思考1.以下列出的是一些原子的2p 能级和3d 能级中电子排布的情况,试判断,哪些违反了泡利原理,哪些违反了洪特规则。
(1) (2)(3)(4)(5)(6)违反泡利原理的有______,违反洪特规则的有______________。
2.用规范的化学用语表示下列基态原子核外电子电子排布情况。
(1)画出硼的电子排布图___________________,核外电子共有____种运动状态。
1.2.1 原子核外电子排布
元素的金属性、非金属性。
二、元素周期律
1、概念:
元素的性质随着原子序数的递增而呈现周期性 的变化的规律叫做元素周期律。
2、本质:
元素性质的周期性变化规律是元素原子核外 电子排布周期性变化的必然结果。
随堂练习:
1、R元素形成的化合物RH3,其中R的化合价是其 最低负化合价,则R元素最高价氧化物的化学式是:
111
88
77
N(氮) O(氧) F(氟)
70
66
64
Ne(氖) —
11~17 号元素 Na(钠) Mg(镁) Al(铝) Si(硅) P(磷)
原子半
径/pm
186
160
143
117
110
S(硫) 104
Cl(氯) Ar(氩)
99
—
提示:(1)稀有气体元素原子半径的测定依据与其它元素不同,没有可比性。 (2)表中数据的单位是pm(皮米),1pm=10-12m。
1.2.1 原子核外电子排布
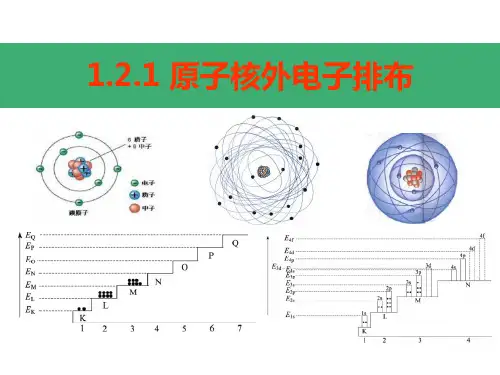
一、原子核外电子排布 原子结构示意图
一、原子核外电子排布
各电子层排布的电子数
电子层(从里到外为K、L、M······层) 核电荷数
原子核
一、原子核外电子排布
1、原子核外电子排布
(1)核外电子按能量高低分层排布(运动)
电子层: 根据电子的能量差异和通常运动区域离核
(能层)
〔观察思考2〕观察下表:原子序数为3~9、11~17的元素的原子 半径。用横坐标表示元素原子核外最外层电子数,以纵坐标表 示原子半径,根据数据表作图,表示出3~9、11~17的元素的 原子最外层电子数与原子半径的函数图像。
3~9号 元素
原子半 径/pm
第一章 第一节 第3课时 原子核外电子排布规则(学生版)
第3课时 原子核外电子排布规则一、基态原子核外电子的排布原则1.能量最低原理原子核外的电子应优先排布在 的能级里,然后由里到外,依次排布在 的能级里。
能级的能量高低顺序如构造原理所示(对于1~36号元素来说,应重点掌握和记忆“1s → →4p ”这一顺序)。
2.泡利原理(1)原理内容:在一个原子轨道里,最多只能容纳 个电子,而且它们的自旋状态 ,用方向相反的箭头“↑↓”表示。
(2)电子排布图 ①将每一个原子轨道用一个方框表示,在方框内标明基态原子核外电子分布的式子。
②以铝原子为例,电子排布图中各符号、数字的意义为3.洪特规则(1)内容:当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同。
(2)特例在等价轨道(同一能级)上的电子排布处于全充满、半充满和全空状态时,具有 的能量和 的稳定性。
相对稳定的状态⎩⎪⎨⎪⎧全充满:p 6、d 10、f 14全空:p 0、d 0、f 0半充满:p 3、d 5、f 7如24Cr 的电子排布式为 ,为半充满状态,易错写为1s 22s 22p 63s 23p 63d 44s 2。
判断正误(1)基态多电子原子中,可以存在两个运动状态完全相同的电子( )(2)若将15P 原子的电子排布式写成1s 22s 22p 63s 23p 2x 3p 1y ,它违背了泡利原理( )(3)2p 3x 只违背了洪特规则( ) (4)某原子的最外层电子排布式为3s 23p 2,其有14种不同运动状态的电子( )深度思考1.以下列出的是一些原子的2p 能级和3d 能级中电子排布的情况,试判断,哪些违反了泡利原理,哪些违反了洪特规则。
(1)(2)(3)(4)(5)(6)违反泡利原理的有______,违反洪特规则的有______________。
2.用规范的化学用语表示下列基态原子核外电子电子排布情况。
(1)画出硼的电子排布图___________________,核外电子共有____种运动状态。
高中物理:原子核外电子排布原理知识点
高中物理:原子核外电子排布原理知识点1.能层、能级与原子轨道(1)能层(n):在多电子原子中,核外电子的能量是不同的,按照电子的能量差异将其分成不同能层。
通常用K、L、M、N……表示,能量依次升高。
(2)能级:同一能层里电子的能量也可能不同,又将其分成不同的能级,通常用s、p、d、f等表示,同一能层里,各能级的能量按s、p、d、f的顺序依次升高,即:E(s)<E(p)<E(d)<E(f)。
(3)原子轨道:电子云轮廓图给出了电子在核外经常出现的区域。
这种电子云轮廓图称为原子轨道。
【特别提示】(1)任一能层的能级总是从s能级开始,而且能级数等于该能层序数。
(2)以s、p、d、f……排序的各能级可容纳的最多电子数依次为1、3、5、7……的二倍。
(3)构造原理中存在着能级交错现象。
由于能级交错,3d轨道的能量比4s轨道的能量高,排电子时先排4s轨道再排3d轨道,而失电子时,却先失4s轨道上的电子。
(4)前四周期的能级排布(1s、2s、2p、3s、3p、4s、3d、4p)。
第一能层(K),只有s能级;第二能层(L),有s、p两种能级,p能级上有三个原子轨道p x、p y、p z,它们具有相同的能量;第三能层(M),有s、p、d三种能级。
(5)当出现d轨道时,虽然电子按ns,(n-1)d,np顺序填充,但在书写电子排布式时,仍把(n-1)d放在ns前。
(6)在书写简化的电子排布式时,并不是所有的都是[X]+价电子排布式(注:X代表上一周期稀有气体元素符号)。
2.基态原子的核外电子排布(1)能量最低原理电子尽可能地先占有能量低的轨道,然后进入能量高的轨道,使整个原子的能量处于最低状态。
如图为构造原理示意图,即基态原子核外电子在原子轨道上的排布顺序图。
注意:所有电子排布规则都需要满足能量最低原理。
(2)泡利原理每个原子轨道里最多只能容纳2个电子,且自旋状态相反。
(3)洪特规则当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且自旋状态相同。
2020高中化学 第二课时 原子核外电子的排布讲义+测试(含解析)
第二课时原子核外电子的排布[学习目标] 1。
了解原子核外电子排布所遵循的原理,知道原子轨道能量顺序。
2.能用电子排布式表示1~36号元素原子的核外电子排布。
3。
知道原子核外电子在一定条件下会发生跃迁,了解其简单应用。
自主学习区一、原子核外电子的排布及表示方法1.原子核外电子排布遵循的原理2.原子核外电子排布的轨道能量顺序3。
原子核外电子排布的表示方法(1)电子排布式①碳原子的电子排布式为错误!1s22s22p2。
②钠原子的电子排布式为错误!1s22s22p63s1或错误![Ne]3s1。
(2)轨道表示式①碳原子的轨道表示式为错误!错误!。
②钠原子的轨道表示式为错误!错误!。
(3)外围电子排布式和轨道表示式氯原子的外围电子排布式为错误!3s23p5,外围电子轨道表示式为。
二、电子跃迁、光谱与光谱分析1。
基态与激发态基态原子:处于错误!能量最低的原子叫做基态原子。
激发态原子:基态原子的电子错误!吸收能量后,电子会跃迁到较高原子轨道,变为激发态原子。
从错误!较高能量的激发态跃迁到错误!较低能量的基态时,将错误!释放能量。
基态原子激发态原子.2。
光谱不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的原子的错误!发射光谱或错误!吸收光谱,总称原子光谱.3。
光谱分析在现代化学中,人们可通过错误!原子发射光谱或吸收光谱来检测元素,称为光谱分析。
1.21号元素钪的核外电子填充顺序和其电子排布式的书写顺序是否一致?提示:不一致。
电子进入原子轨道的顺序是优先进入能量低的原子轨道,后进入能量高的原子轨道。
由于4s和3d轨道有原子轨道交错现象,所以21号元素钪的核外电子填充顺序为1s22s22p63s23p64s23d1.电子排布式的书写是按照能层序数的高低顺序排列的,所以钪的电子排布式为1s22s22p63s23p63d14s2.2。
请说出下列3个电子排布图各违背了哪些原理,并写出正确的电子排布图。
原子核外电子排布 高考化学一轮复习(新教材新高考)
二、短周期常见原子的12个核外电子排布规律
次外层电子数是最外层电子数2倍的原子有Li、Si; 内层电子总数是最外层电子数2倍的原子有Li、P 电子层数与最外层电子数相等的原子有H、Be、Al 电子层数为最外层电子数2倍的原子有Li 1 最外层电子数是电子层数2倍的原子有He、C、S 2 最外层电子数是电子层数3倍的原子有O
同一能层各能级的能量顺序__E_(_n_s_)<_E_(_n_p_)<_E_(_n_d_)<_E__(n_f__
)
能层 K L
M
N
O
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 5s 5p ...
最多电 子数
2
2
6
2
6 10 2
6 10 14 2
6
1×2
3×2
5×2
7×2
一、能层、能级与原子轨道
3s23p63d7 4s2
构 造
× 3s23p63d8 4s2
原
3s23p63d910 44ss21
理
被 理 想 化
30 锌 Zn 1s2 2s22p6 3s23p63d10 4s2
的
二、原子核外电子排布规律
3.泡利原理
电子除空间运动状态外,还有一种状态叫做自旋 电子自旋在空间有顺时针和逆时针两种取向,简称自旋相反 ,常用上下箭头(↑和↓)表示自旋相反的电子。 在一个原子轨道里,最多只能容纳2个电子,它们的自旋相反, 这个原理被称为泡利原理(也称泡利不相容原理)。
)。
三、“两原理,一规则”的正确理解
原子核外电子排布符合能量最低原理、洪特规则、泡利原理, 若违背其一,则电子能量不处于最低状态。
微提醒 在写基态原子的电子排布图时,常出现以下错误:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(3)判断微粒半径大小的规律 ①同周期从左到右,原子半径依次减小(稀有气体元素除 外). ②同主族从上到下,原子或同价态离子半径均增大. ③阳离子半径小于对应的原子半径,阴离子半径大于对 应的原子半径,如r(Na+)<r(Na),r(S)<r(S2-). ④电子层结构相同的离子,随核电荷数增大,离子半径 减小,如r(S2-)>r(Cl-)>r(K+)>r(Ca2+). ⑤不同价态的同种元素的离子,核外电子数多的半径大, 如r(Fe2+)>r(Fe3+),r(Cu+)>r(Cu2+).
④金属的电负性一般小于1.8,非金属的电负性一般大于1.8. 而位于非金属三角区边界的“类金属”的电负性则在1.8左 右,它们既有金属性,又有非金属性. ⑤用电负性判断化学键的类型 一般认为:如果两个成键元素原子间的电负性差值大于1.7, 它们之间通常形成离子键;如果两个成键元素原子间的电负 性差值小于1.7,它们之间通常形成共价键.
3.原子核外电子排布原理 (1)能量最低原理:原子的核外电子排布遵循构造原理,使
整个原子的能量处于最低状态.原子轨道能量由低到 高的顺序为1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、 5p、6s、4f、5d、6p、7s、5f、6d…… (2)泡利原理:1个原子轨道里最多容纳2个电子,且自旋方 向相反. (3)洪特规则:当电子排布在同一能级的不同轨道时,总是 优先单独占据一个轨道,且自旋方向相同.
非金属性 非金属性逐渐增强 非金属性逐渐减弱
4.对角线规则 在元素周期表中,某些主族元素与右下方的主族元
素的有些性质是相似的,如
.
[例1] 有四种短周期元素,它们的结构、性质等信息如 下表所述.
元素
结构、性质等信息
是短周期中(除稀有气体外)原子半径最大的元素,该
A
元素的某种合金是原子反应堆的导热剂
(4)特例
有少数元素的基态原子的电子排布对于构造原理有1个电子
的偏差.因为能量相同的原子轨道在全充满(如p6和d10)、半
充满(如p3和d5)和全空(如p0和d0)状态时,体系的能量较低,
原子较稳定.
4.基态原子核外电子排布的表示方法
(1)原子结构示意图(或称原子结构简图)可表示核外电子分层排
布和核内质子数,如
3.元素性质递变规律
项目
同周期(从左→右) 同主族(从上→下)
电子层数相同,最外层 原子核外电
电子数逐渐增多, 子排布
1→7(第一周期1→2)
最外层电子数相 同,电子层数递 增
原子半径 逐渐减小(0族除外)
逐渐增大
项目
同周期(从左→右)
同主族(从上→下)
最高正价=主族序数, 元素主要 最高正价由+1→+7,
2.电离能、电负性 (1)第一电离能:气态电中性基态原子失去1个电子转化为
气态基态正离子所需要的最低能量. ①电离能是衡量气态原子失去电子难易程度的物理量, 元素的电离能越小,表示气态时越容易失电子,还原 性越强. ②镁和铝相比,镁第一电离能大,磷与硫相比,磷第 一电离能大.
(2)电负性:用来描述不同元素的原子对键合电子吸引力的大 小. ①电负性越大,非金属性越强,反之越弱. ②电负性的变化规律是:同周期从左到右,元素的电负性 逐渐变大,同主族从上到下,元素的电负性逐渐变 小.因此电负性大的元素集中在元素周期表的右上角, 电负性小的元素位于元素周期表的左下角. ③在元素周期表中,电负性最大的元素是氟,电负性最 小的元素是铯.短周期元素中电负性最小的是钠.
(n-2)f0~14(n-1)d0~2ns2
三、元素周期律 1.原子半径 (1)原子半径的周期性变化
元素周期表中的同周期主族元素从左到右,原子半径 逐渐减小(稀有气体元素除外),同主族元素从上到下, 原子半径逐渐增大.
(2)微粒半径比较 在中学要求的范围内可按“三看”规律来比较微粒半径 的大小. “一看”电子层数:当电子层数不同时,电子层数越多, 半径越大. “二看”核电荷数:当电子层数相同时,核电荷数越大, 半径越小. “三看”核外电子数:当电子层数和核电荷数均相同时, 核外电子数越多,半径越大.
一、原子核外电子排布及表示方法 1.能层、能级及其最多容纳电子数的关系
能层(n) 一 二
三
四
五…
符号 K L
M
N
O…
能级(l) 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s … …
最多容纳 2 2 6 2 6 10 2 6 10 14 2 … …
电子数 2 8
18
32
… 2n2
.
(2)电子式 可表示原子最外层电子数目,如 .
(3)电子排布式 ①用数字在能级符号右上角表明该能级上排布的电子数, 如K:1s22s22p63s23p64s1. ②为了避免电子排布式书写过于繁琐,把内层电子达到稀 有气体元素原子结构的部分以相应稀有气体的元素符号外 加方括号表示,如K:[Ar]4s1.
(4)轨道表示式(电子排布图) 每个方框代表一个原子轨道,每个箭头代表一个电子, 如第二周期元素基态原子的电子排布如下图所示.
二、原子结构与元素周期表的关系
1.元素周期表中每周期所含元素种数的变化规律
周期 元素数目
一
2
二
8
三
8
四
18
五
18
六
32
七
26
(未完)
对应的原子轨道 1s
2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d (未完)
B
B与A同周期,其最高价氧化物的水化物呈两性
非金属最低负价=主族 化合价 最低负价由-4→-1
序数-8
原子得、 失
电子能力
得电子能力逐渐增强 失电子能力逐渐减弱
得电子能力逐渐减弱 失电子能力逐渐增强
项目
同周期(从左→右) 同主族(从上→下)
元素的第一电 离能
呈增大的趋势
逐渐减小
元素的电负性
逐渐增大
逐渐减小
元素金属性、 金属性逐渐减弱
金属性逐渐增强
电子最大容量 2 8 8 18 18 32
未满
2.周期表的分区与原子的价电子排布的关系
分区
元素分布
外围电子排布
s区
ⅠA、ⅡA族
ns1~2
p区 ⅢA族~ⅦA族、0族
ns2np1~6
d区 ⅢB族~ⅦB族、Ⅷ族
(n-1)d1~9ns1~2 (除钯外)
ds区 ⅠB族、ⅡB族
(n-1)d10ns1~2
f区
镧ቤተ መጻሕፍቲ ባይዱ、锕系
