化学反应工程教案2(化工13)-胡江良
化学反应工程教案3(化工13)-胡江良

原物料的组成相同。这种混合不会影响反应过程的进行。 返混:流动反应器内,处于不同进料时间的两股物料之间发生的混合。 • 由于物料在反应器内的停留时间不同,则反应程度不同,二者的组
成也不相同,混合后形成的新物料其组成将与原物料的组成不同,化学反 应速率也将随之发生变化。 与正常通过反应器的物料相比,返混存在死角、短路/近路和回流等工 程因素。 原因: (1) 机械搅拌引起物料运动方向与主体流动方向相反; (2)反应器结构造成物料流速不均匀,例如死角、分布器等 2、按物料在反应器内返混情况进行分类: (1)间歇反应器 (2) 理想置换反应器
(2)、能量衡算 描述温度的变化规律。 温度对化学反应速率有着显著作用,为了确定某一时间每一点的温度 和组成,必须将物料衡算方程和热量衡算方程结合起来。 对反应器中的体积元进行热量衡算,有:
单位时间内 单位时间内 单位时间内与 单位时间内 单位时间内 输入的热量 输出的热量 环境交换的热量 关键组分 关键组分 关键组分 输入速率 输出速率 转化速率 累积速率
Fin Fout Fr Fb
间歇反应 稳态连续
Fr Fb 0
Fin Fout Fr
参考资料(含参考书、文献等)
《化学反应工程》 (第二版) ,郭 锴, 化学工业出版社, 2015 年出版; 《化学反应工程》 (第三版) ,陈甘棠, 化学工业出版社, 2011 年出版; 《反应工程》 (第三版) ,李绍芬 主编,化学工业出版社 ,2013 年出版。
教学反思:
5
3
持续时间。 主要用于间歇反应器,其中不包括装料、卸料、升温、降温等非反 应的辅助时间。 2、停留时间 t 和平均停留时间 t 停留时间 流体微元从反应器入口到出口所经历的时间,又称为接触时间,主要 用于连续流动反应器。 在反应器中,由于流动状态和化学反应的不同,物料微元体在反应器 中的停留时间是各不相同的,存在一个分布,称为停留时间分布。 平均停留时间 各流体微元从反应器入口到出口所经历的平均时间。 3、空间时间 反应器有效容积与流体特征体积流率之比值。
化学反应工程教案12(化工13)-胡江良

化学反应工程课程教案
2、内扩散影响的消除
基本原则:改变催化剂粒度,缩短扩散距离,减小内扩散阻力。
当催化剂粒度(尺寸)的变化对反应动力学不产生影响时,即可认为消除了内扩散的影响
实验测定:在恒定条件下(反应器入口气体组成、温度和停留时间等)
本征动力学测试的基本要求
(1)反应气体需高度净化,严格控制有害杂质含量
(2)测试用反应器应严格控温(等温或绝热)
(3)根据物系特性,选取适宜分析和流量计量方法
(4)严格消除内、外扩散过程的影响
4.4.2 本征动力学测试常见的反应器。
化学反应工程教案5(化工13)胡江良

化学反应工程课程教案
从本质上说,物理过程不改变反应过程的动力学规律。
也就是说,反应的动力学方程并不因为物理过程的存在而发生变化。
但是,流体的流动、传质、传热过程会影响实际反应场所的浓度和温度在时间、空间上的分布,从而影响实际反应场的浓度和温度在时间、空间上的分布,从而影响反应的最终结果。
对某个具体反应,选择反应器、操作条件和操作方式主要考虑化学反应本身的特征与反应器特征,最终选择的依据将取决于所有过程:一是反应器的大小,二是产物分布济性。
过程的经济性主要受两个因素影响;而对于复合反应,首先要考虑产物分布。
2.1单一不可逆反应过程与反应器
2.1.1单一不可逆反应过程平推流反应器与全混流反应器的比较
在反应器设计评比中,只考虑如何有利于反应速率的提高。
当然,其中一个重要因素是,考察反应器的大小.
一、理想流动反应器的体积比较
基本条件:
和反应温度均相同;等容过程。
V R ,V RP ,V RM 分别表示间歇反应器体积、平推流反应器
体积和全混流反应器体积,则:
当转化率越大,则两者的差距
较大,所以可采用低转化率操作。
1、对同一单一的正级
数反应,在相同工艺
00,,A Af V C x Af A 0A00A x R dx V V C r =⎰Af A 0A00A x Rp
dx V V C r =⎰00()A Af RM A f
V C x V
r =0000[]
[]
Rp A RM A V V C OABD V V C OCBD ==1
<RM RP
V V。
化学反应工程教案17化工13胡江良
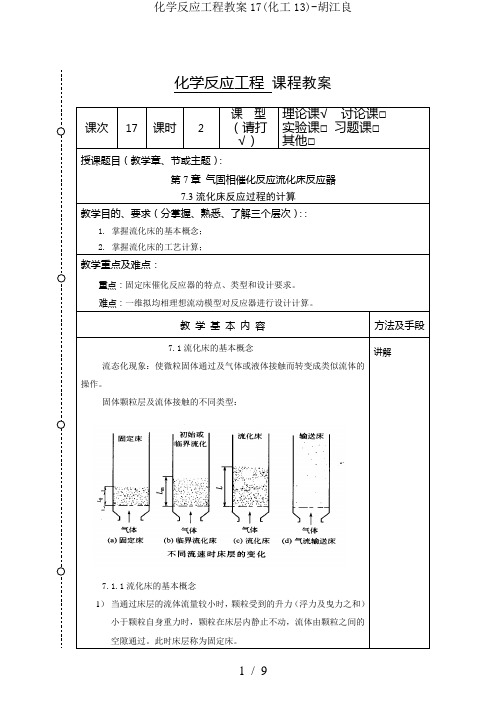
化学反应工程课程教案课次17课时 2 课型(请打√)理论课√讨论课□实验课□习题课□其他□授课题目(教学章、节或主题):第7章气固相催化反应流化床反应器7.3流化床反应过程的计算教学目的、要求(分掌握、熟悉、了解三个层次)::1. 掌握流化床的基本概念;2. 掌握流化床的工艺计算;教学重点及难点:重点:固定床催化反应器的特点、类型和设计要求。
难点:一维拟均相理想流动模型对反应器进行设计计算。
教学基本内容方法及手段7.1流化床的基本概念流态化现象:使微粒固体通过及气体或液体接触而转变成类似流体的操作。
固体颗粒层及流体接触的不同类型:7.1.1流化床的基本概念1)当通过床层的流体流量较小时,颗粒受到的升力(浮力及曳力之和)小于颗粒自身重力时,颗粒在床层内静止不动,流体由颗粒之间的空隙通过。
此时床层称为固定床。
讲解2)随着流体流量增加,颗粒受到的曳力也随着增大。
若颗粒受到的升力恰好等于自身重量时,颗粒受力处于平衡状态,故颗粒将在床层内作上下、左右、前后的激烈运动,这种现象被称为固体的流态化,整个床层称为流化床。
曳力(表面曳力、形体曳力)曳力是流体对固体的作用力,而阻力是固体壁对流体的作用力,两者是作用力及反作用力的关系。
表面曳力由作用在颗粒表面上的剪切力引起,形体曳力由作用在颗粒表面上的压强力扣除浮力部分引起。
3).流化床类似液体的性状(a)轻的固体浮起;(b)表面保持水平;(c)固体颗粒从孔中喷出;(d)床面拉平;(e)床层重量除以截面积等于压强流化床的优点(1) 颗粒流动类似液体,易于处理、控制;(2) 固体颗粒迅速混合,整个床层等温;(3) 颗粒可以在两个流化床之间流动、循环,使大量热、质有可能在床层之间传递;(4) 宜于大规模操作;(5) 气体和固体之间的热质传递较其它方式高;(6) 流化床及床内构件的给热系数大。
mf mfu mf:初始流态化速度d P:颗粒平均粒径ρ,ρP:流体密度,颗粒密度L mf:初始流态化时的浓相段床高D e:流体的扩散系数μ:流体粘度浓相段和稀相段(P185-186)1).当流体通过固体床层的空塔速度值高于初始流化速度但低于逸出速度(p188),颗粒在气流作用下悬浮于床层中,所形成的流固混合物称为浓相段。
化学反应工程教案10_胡江良

化学反应工程教案10_胡江良教案:化学反应工程教案一、基本信息1.教学对象:高中化学学生2.授课内容:化学反应工程3.教学目标:了解化学反应工程的基本概念、原理和应用二、教学方法1.讲授法:通过讲解概念、原理和应用,深入理解化学反应工程的内容;2.实验法:进行一些简单的实验,帮助学生理解反应工程的实际操作;3.讨论法:组织学生进行小组讨论,共同解决实际问题;4.案例分析法:通过一些典型案例的分析,帮助学生理解反应工程的具体应用。
三、教学内容1.化学反应工程的概念和基本原理A.反应工程的定义和分类B.化学反应的热力学和动力学基础C.反应的速度方程和速率常数D.反应的平衡和反应热2.化学反应的实际操作A.反应的热平衡和控制B.反应的物质平衡和控制C.反应的高效与高选择性控制D.反应的安全控制3.化学反应工程的应用A.化学反应的工业应用B.化学反应的环境应用C.化学反应的能源应用四、教学过程第一节:化学反应工程的概念和基本原理1.介绍反应工程的定义和分类2.介绍反应的热力学和动力学基础3.介绍反应的速度方程和速率常数4.介绍反应的平衡和反应热第二节:化学反应的实际操作1.讲解反应的热平衡和控制方法2.讲解反应的物质平衡和控制方法3.讲解反应的高效与高选择性控制方法4.讲解反应的安全控制方法第三节:化学反应工程的应用1.介绍化学反应的工业应用案例2.介绍化学反应的环境应用案例3.介绍化学反应的能源应用案例五、教学评估1.参与讨论2.完成小组作业3.完成实验报告六、教学资源1.教材:高中化学教材2.实验设备:反应瓶、试管、温度计等3.实验药品:氢氧化钠、盐酸、过氧化氢等七、教学反思化学反应工程是一个很重要的学科,它是化学技术和工程技术的基础。
通过本节课的教学,学生可以了解化学反应工程的基本概念、原理和应用。
通过实验和案例分析,可以帮助学生更好地理解反应工程的实际操作和应用。
此外,通过小组讨论和评估,可以帮助学生更好地掌握反应工程的知识和技能。
化学反应工程教案5(化工13)-胡江良(精编文档).doc

【最新整理,下载后即可编辑】
A
当转化率越大,则
两者的差距较大,所
以可采用低转化率操
作。
⏹ 1、对同一单一的正级数反应,在相同工艺条件
下,为达到相同的转化率,PFR 所需的反应器
体积最小,而CSTR 所需的反应器体积最大。
(若反应器体积相同,则PFR 可达的转化率最大,
而CSTR 可达的转化率最小。
)
⏹ 2、当转化率很小时,反应器性能受流动状况影
响较小。
随着转化率增加,二者体积差距逐渐
增大。
⏹ 3、当转化率一定时,随着反应级数增加,CSTR
体积与PFR 体积之比迅速增大,而对于0级反
应,流动状况对所需反应体积大小没有影响,
二者之比等于1;
⏹ 4、如果反应密度降低(即体积膨胀),会增加
二者体积比率,即导致CSTR 的效率下降;反
之则反。
然而密度变化对反应器大小的影响与
流动状况对其影响小得多,为次要影响因素。
⏹ 因而,确定反应器型式,不但要考虑反应级数,
还要考虑转化率高低。
⏹ 如果反应级数高、要求的转化率也高,应采用
PFR ;
00()A Af
RM A f V C x V r =0000[][]
Rp A RM A V
V C OABD V V C OCBD ==1<RM
RP V V。
化学反应工程教案4(化工13)-胡江良

7
《反应工程》 (第三版) ,李绍芬 主编,化学工业出版社 ,2013 年出版。
教学反思:
8
2、平推流反应器的设计方程 • • • • • 反应器体积 VR 衡算对象:关键组分 A 衡算基准:微元体积 dVR 在单位时间内对 A 作物料衡算: [A 流入量]-[A 流出量]-[A 反应量]=[A 累积量]
或:进入量-排出量-反应量=累积量
FA ( FA dFA ) (rA )dVR 0
三、全混流反应器的热量衡算 • 衡算基准:反应器的有效容积 VR
Gc p (T1 T2 ) KA(Tw T2 ) (rA )(H r )VR 0 Tw T2 1 [Gc p (T1 T2 ) (rA )(H r )VR ] KA
结合物料衡算及化学反应动力学方程便可求解非等温条件下 CSTR 的设 计计算问题。
•
对于恒容过程 :
x A 2 dx VR A c A0 x A1 (r ) V0 A
c A 2 dc c A1 dc VR A A c c A1 ( r ) A 2 (r ) V0 A A
3、等温变容过程 1)、膨胀因子 定义: 每转化 1mol 的 A 时反应混合物增加或减少的量为化学膨胀因子。
•
同样也可作出 1/rA~cA 曲线,然后求取 cA0~cAf 之间曲线下的面积 即为反应时间 t.
2
BR 中,达到一定转化率所需反应时间,只是动力学方程式的直接积分, 与反应器大小及物料投入量无关,故动力学方程常在间歇反应器内进 行测定。 • 1.4.2 平推流反应器(理想置换反应器 Piston/Plug Flow Reactor
间接操作的充分搅拌反应器又称为间歇反应器,通常都设有夹套或盘 管以便加热或冷却釜内的反应物料,控制反应温度。
化学反应工程教学案2[化工13]_胡江良
![化学反应工程教学案2[化工13]_胡江良](https://img.taocdn.com/s3/m/f48575367cd184254b3535cf.png)
化学反应工程课程教案
反应时间∙
(反应区
(
)
)
为了求取活化能E ,可再选若干温度,作同样的实验,得到各温度下的等温、恒容均相反应的实验数据,并据此求出相应的k 值。
故以ln k 对1/T 作图,将得到一条直线,其斜率即为-E /R ,可求得可将n 次实验所求得k 和与之相对应的1/T 取平均值作为最后结果。
1-1 等温条件下进行醋酸 (A)和丁醇(B)的醋化反应: COOH+C 4H 9OH=CH 3COOC 4H 9+H 2O
醋酸和丁醇的初始浓度分别为0.2332和1.16kmolm -3。
测得不同时间下醋酸转化量如表所示。
试求反应的速率方程。
解:由于题目中给的数据均是醋酸转化率较低时的数据,可以忽略逆
t/hr 0 1 2 3 4 5 6 7 醋酸转化量 /kmol.m -3
0 1.636 2.732 3.662 4.525 5.405 6.086 6.833。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学反应工程课程教案
其定义为:
• 组分A 的选取的原则: A 必须是反应物,它在原料中的量按照化学计量方程计算应当可以完全反应掉(与化学平衡无关),即转化率的最大值应当可以达到100%,如果体系中有多于一个组份满足上述要求,通常选取重点关注的、经济价值相对高的组分定义转化率。
转化率与反应程度的关系 • 结合
• 得到:
注意:
1、目前普遍使用关键组分的转化率来表示反应进行的程度 ;
2、关键组分只针对反应物而言;
3、针对不同的反应物,计算出来的转化率不一样。
4、计算转化率的基准,也即初始状态的选择问题。
连续反应器:进口处的状态; 间歇反应器:开始反应时的状态;
串联反应器:可以进入第一个反应器的原料为准(总转化率),也可以某一反应器入口进料组成为基准(分段转化率)。
1.1.4化学反应速率
反应程度是一个广度量,不能代表速度。
反应速率:
严格定义:单位反应物系中反应程度随时间的变化率。
在反应系统中,在单位反应时间内,单位反应区中反应物的反应量或产物的生成量(浓度、分压、摩尔数)。
注意:
反应速率是对于某一物质而言的:如果是反应物,其总量总是随反
A0
A
0A A A n n n A x -=
=
组分的起始量组分量转化了的0
A A A0A n n n x -=
ξ
αI 0I I +=n n ξαA0
A
A n x -=
dt
d V r ξ1=
)
()(反应区反应时间反应量
反应速率•=
直接积分,可获得化学反应动力学方程的积分形式。
对一级不可逆反应,恒容过程,有:
由上式可以看出,对于一级不可逆反应,达到一定转化率所需要的时间与反应物的初始浓度c A0无关。
半衰期
• 定义反应转化率达到50%所需要的时间为该反应的半衰期。
除一级反应外,反应的半衰期是初始浓度的函数。
• 例如,二级反应(恒容过程)
建立动力学方程的方法
动力学方程表现的是化学反应速率与反应物温度、浓度之间的关系。
而建立一个动力学方程,就是要通过实验数据回归出上述关系。
对于一些相对简单的动力学关系,如简单级数反应,在等温条件下,回归可以由简单计算手工进行。
主要方法有积分法、微分法和最小方差分析法。
1、积分法
(1)首先根据对该反应的初步认识,先假设一个不可逆反应动力学方程,如(-r A )=kf' (c A ),经过积分运算后得到,f (c A )=kt 的关系式。
例如,一级反应
(2)将实验中得到的t i 下的c i 的数据代入f (c i )函数中,得到各t i 下的
f (c i )数据。
(3)以t 为横座标,f (c i )为纵座标,将t i -f (c i )数据标绘出来,如果得到过原点的直线,则表明所假设的动力学方程是可取的(即假设的级数是正确的),其直线的斜率即为反应速率常数k 。
否则重新假设另一动力学方程,再重复上述步骤,直到得到直线为止。
A A A d d kc
t
c r =-=-A
A 0A 11
ln ln
x c c kt -==⎪
⎪⎭
⎫ ⎝⎛-=-=A A 0A 0
A A 1111x x c c c kt 0
A 2
11kc t =
kt C C A
A =0
ln
为了求取活化能E ,可再选若干温度,作同样的实验,得到各温度下的等温、恒容均相反应的实验数据,并据此求出相应的k 值。
故以ln k 对1/T 作图,将得到一条直线,其斜率即为-E /R ,可求得E 。
可将n 次实验所求得k 和与之相对应的1/T 取平均值作为最后结果。
例1-1 等温条件下进行醋酸 (A)和丁醇(B)的醋化反应: CH 3COOH+C 4H 9OH=CH 3COOC 4H 9+H 2O
醋酸和丁醇的初始浓度分别为和。
测得不同时间下醋酸转化量如表所示。
试求反应的速率方程。
解:由于题目中给的数据均是醋酸转化率较低时的数据,可以忽略逆反应的影响,而丁醇又大大过量,反应过程中丁醇浓度可视为不变。
所以反应速率方程为:
• 将实验数据分别按0、1和2级处理并得到t -f (c A )的关系
t/hr 0 1 2 3 4 5 6 7 8 醋酸转化量 ×102
/kmol.m -3
0 1.636 2.732 3.662 4.525 5.405 6.086 6.833 7.398
()n n m c k c kc t
c r A
A B A
A d d '==-=-t/hr
c A
c A0-c A
⎪⎪⎭
⎫ ⎝⎛A A0ln c c ⎪⎪⎭⎫ ⎝⎛-0A A
11c c 0
0.2332 0 0 0 1 0.2168 0.01636 0.07298 0.3244 2 0.2059 0.02732 0.1245 0.5686 3 0.1966 0.03662 0.1707 0.7983 4 0.1879 0.04525 0.2160 1.03375 5 0.1792 0.05405 0.2630 1.2922 6 0.1723 0.06086 0.3030 1.5157 7 0.1649 0.06833 0.3470 1.7761 8
0.1592
0.07398
0.3820
1.9932。
