聚合物溶剂的选择
选择聚合物溶剂的原则

选择聚合物溶剂的原则
在合成聚合物的过程中,选择适当的溶剂对于聚合反应的进行和最终产品的性能具有重要影响。
正确选择聚合物溶剂可以提高聚合物产率、优化反应条件,并控制聚合物的分子量和分布。
以下是选择聚合物溶剂的一些原则:
1. 相溶性
选择的溶剂应该与聚合物单体相溶,以确保单体可以均匀地溶解在溶剂中。
相溶性好的溶剂有助于提高聚合反应的效率,避免聚合单体聚集或析出,确保聚合物的成品质量。
2. 溶解度
溶剂应该具有足够的溶解度,能够溶解所需的聚合物单体和反应产物。
过低的溶解度会导致单体无法充分溶解,影响聚合反应的进行;而过高的溶解度可能导致高分子链断裂或溶剂拉脱造成的污染。
3. 选择性
对于复杂的聚合物系统,可以选择具有选择性的溶剂帮助提取目标产物。
选择性溶剂有助于减少杂质的引入,提高产品的纯度和收率。
4. 挥发性
溶剂的挥发性会影响聚合反应的温度和速度。
一般而言,挥发性较弱的溶剂在反应过程中不易快速挥发,有利于反应的控制和操作。
5. 安全性
选择溶剂时需考虑其安全性,避免选择具有毒性或腐蚀性的溶剂,以确保实验操作的安全性和职业健康。
6. 成本
溶剂的成本也是选择的考量因素之一。
应当综合考虑溶剂的价格、回收利用率以及对操作的影响,选择性价比较高的溶剂。
7. 环境友好
优先选择对环境影响较小的溶剂,避免使用对环境造成污染或危害的有机溶剂。
在选择合适的聚合物溶剂时,需根据聚合物的特性、反应条件和实验目的等因素进行综合考虑,以确保最终的聚合产物符合要求,同时实验过程安全有效。
第三章 (1) 高分子材料的物理化学性质

19
(ii)pH敏感水凝胶 :pH敏感性水凝胶是体积随环境pH值、 离子强度变化的高分子凝胶。这类凝胶大分子网络中具有可解 离成离子的基团,其网络结构和电荷密度随介质pH值的变化而 变化,并对凝胶的渗透压产生影响;同时因为网络中添加了离 子,离子强度的变化也引起体积变化。 一般来说,具有pH值响应性的水凝胶都是含有酸性或碱性侧 基的大分子网络,即聚电解质水凝胶。随着介质pH值、离子强 度的改变,酸、碱基团发生电离,导致网络内大分子链段间氢 键的解离,引起不连续的溶胀体积变化。
18
热可逆性水凝胶 有些聚合物水溶液在室温下呈自由流动的液态 而在体温下呈凝胶态,即形成热可逆性水凝胶(TGR)。这一体系 能够较容易地对特定的组织部位注射给药,在体内环境下很快形 成凝胶。而且这种给药系统的制备较简单,只需将药物与聚合物 水溶液进行简单地混合。 如:聚环氧乙烷(PEO)与聚环氧丙烷(PPO)嵌段共聚物是已被批 准用于药用辅料的高分子,商品名叫普流罗尼(Pluronic)或泊洛沙 姆(Poloxamer),依据其结构和浓度,这类聚合物存在两个临界相 转变温度,即溶液-凝胶转变温度(相当于LCST)和凝胶-溶液转变 温度,在这两个温度之间其水溶液呈现凝胶状态。利用这类共聚 物水溶液低温溶液状态混合药物,尤其是生物类药物,注人体内 形成凝胶,从而实现控制药物释放同时保护药物活性的功能。
常用溶剂的溶度参数及溶剂对聚合物溶解能力的判定方法
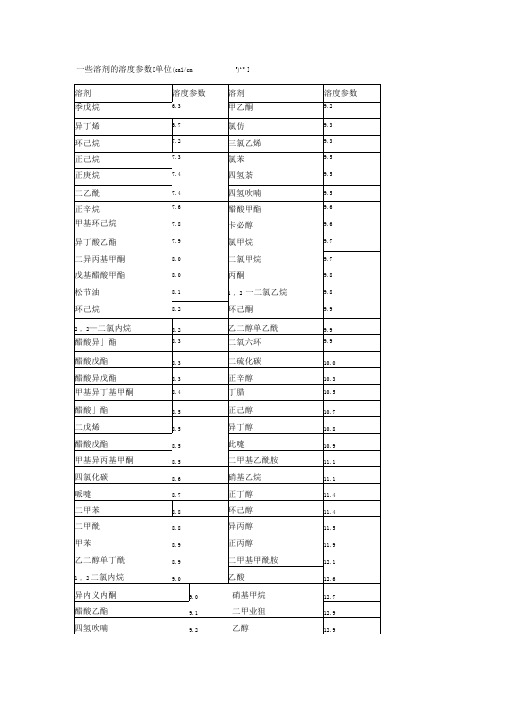
溶剂对聚合物溶解能力的判定
(一)极性相近”原则
极性大的溶质溶于极性大的溶剂;极性小的溶质溶于极性小的溶剂,溶质和溶剂的极性
越相近,二者越易溶。
例如:未硫化的天然橡胶是非极性的,可溶于气油、苯、甲苯等非极性溶剂中;聚乙烯醇是极性的,可溶于水和乙醇中。
(二)内聚能密度(CED)或溶度参数相近”原则
a越接近,溶解过程越容易。
1、非极性的非晶态聚合物与非极性溶剂混合
聚合物与溶剂的&或a相近,易相互溶解;
2、非极性的结晶聚合物在非极性溶剂中的互溶性
必须在接近Tm温度,才能使用溶度参数相近原则。
例如:聚苯乙烯a =8.9,可溶于甲苯(a =8.9)、苯(a =9.2)、甲乙酮(a =9.2)、乙酸乙酯(a =9.2)、氯仿(a =9.2)、四氢吹喃(a =9.2),但不溶于乙醇(a =12.92和甲醇(a =14.5)中以及脂肪炷(溶度参数较低)。
混合溶剂的溶度参数a的计算:
8混=a 1①廿a 2①2
例如:丁苯橡胶(a =8.10),戊烷(a 1=7.08)和乙酸乙酯(a 2=9.20)
用49.5%所戊烷与50.5%的乙酸乙酯组成混合溶剂
a混为8.10 ,可作为丁苯橡胶的良溶剂。
但是当聚合物与溶剂之间有氢键形成时,用溶度参数预测结果很不准确,这是因为氢键
对溶解度影响很大,此时需要三维溶度参数的概念。
纯丙烯酸酯在聚合反应中如何控制分子量

纯丙烯酸酯在聚合反应中如何控制分子量纯丙烯酸酯(HPMA)是一种常用的单体,在生产聚合物时具有广泛的应用。
其特点是反应速度快、工艺简单,并可通过合成工艺的调整来获得不同分子量的聚合物。
然而,有时候我们需要得到特定的分子量,这时候就需要控制聚合反应中的分子量。
本文将介绍纯丙烯酸酯在聚合反应中如何控制分子量。
一、选择适当的引发剂在聚合反应中,引发剂是非常重要的一环。
引发剂不仅可以控制反应的速率,而且可以影响聚合产物的分子量分布。
对于纯丙烯酸酯,常用的引发剂有过氧化苯甲酰、过氧化二异丙苯(BPO)、有机过氧化物(如环氧丙烷过氧化物)、过硫酰氯等。
BPO是最常用的引发剂之一,因为它的自由基极易于与丙烯酸酯反应,反应速率快。
但是,如果使用过多的BPO,会导致产物分子量分布过广,因此需要对其添加量进行控制。
此外,用于分子量控制的引发剂还有过氧化乙酸酯、过氧化丙酮酯等。
二、选择适当的溶剂溶剂是聚合反应中一个可调控分子量的因素。
在选择溶剂时,需要考虑到以下几点:1. 需要能够完全溶解聚合物单体和引发剂。
2. 不能与引发剂和单体发生反应,并且可以保持反应体系的稳定性。
3. 对聚合物的生长速率和分子量分布有一定的影响。
对于纯丙烯酸酯,适当的溶剂是那些能够促进低聚物的解离,提高聚合物生成速率的物质。
一些合适的溶剂包括丙酮、甲苯、四氢呋喃和二甲基甲酰胺等。
三、控制温度在聚合反应中,温度也是一个重要的因素。
温度过高会加速反应速度,但同时也会导致产物分子量分布过广。
因此,需要将反应温度控制在一个适当的范围内。
在纯丙烯酸酯的聚合反应中,通常采用60-80℃的反应温度。
四、使用调控剂在聚合反应中,使用调控剂可以控制聚合产物的分子量分布。
纯丙烯酸酯聚合反应中常用的调控剂包括三丁基硼和三苯基硼等。
这些调控剂能够促进自由基的重组,从而控制聚合物的分子量和分子量分布。
五、采用不同的聚合方式在聚合反应中,不同的聚合方式也会影响产物的分子量和分子量分布。
乳液聚合 助溶剂

乳液聚合助溶剂(实用版)目录1.乳液聚合的概念和原理2.乳液聚合中助溶剂的作用3.乳液聚合中助溶剂的选择4.乳液聚合中助溶剂的影响因素5.乳液聚合中助溶剂的案例分析正文一、乳液聚合的概念和原理乳液聚合是一种在液滴分散体系中进行的聚合反应,形成的聚合物具有独特的结构和性能。
乳液聚合的原理主要是通过引入表面活性剂和/或保护胶来稳定液滴,使得分散相和连续相能够共存,并在其中进行聚合反应。
二、乳液聚合中助溶剂的作用在乳液聚合过程中,助溶剂起到了至关重要的作用。
助溶剂可以提高聚合物在溶剂中的溶解度,促进聚合反应的进行,同时还可以改善聚合物的性能。
助溶剂的种类和用量对聚合物的结构和性能有着重要的影响。
三、乳液聚合中助溶剂的选择在乳液聚合中,助溶剂的选择主要取决于聚合物的种类和性能要求。
一般来说,助溶剂应该具有良好的溶解性和稳定性,且与聚合物具有良好的相容性。
此外,助溶剂的沸点、溶解度和毒性等性质也需要考虑。
四、乳液聚合中助溶剂的影响因素乳液聚合中助溶剂的影响因素主要包括以下几个方面:1.助溶剂的种类和用量:不同的助溶剂对聚合物的性能影响不同,而助溶剂的用量也会影响聚合物的结构和性能。
2.聚合物的种类和性能要求:不同的聚合物对助溶剂的需求不同,助溶剂的选择需要根据聚合物的种类和性能要求进行。
3.聚合反应的条件:聚合反应的温度、压力和时间等条件也会影响助溶剂的选择和效果。
五、乳液聚合中助溶剂的案例分析以聚丙烯酸酯乳液聚合为例,常用的助溶剂包括甲醇、乙醇、丙酮等。
这些助溶剂可以提高聚丙烯酸酯在溶剂中的溶解度,促进聚合反应的进行,同时还可以改善聚合物的性能。
聚合物的分离与提纯

聚合物的分离与提纯聚合物的分离与提纯是化学领域中重要的研究课题之一。
聚合物是由许多重复单元组成的高分子化合物,广泛应用于材料科学、药物研发、生物医学等领域。
然而,在制备和应用聚合物材料的过程中,往往需要对聚合物进行分离与提纯,以获得纯度较高的产品。
聚合物的分离与提纯方法多种多样,根据聚合物的性质和应用需求选择合适的方法非常重要。
下面将介绍几种常见的聚合物分离与提纯方法。
一、溶剂沉淀法溶剂沉淀法是一种常用的聚合物分离与提纯方法。
该方法基于聚合物在不同溶剂中的溶解度差异,通过溶剂的加入或去除实现对聚合物的分离和提纯。
一般来说,选择与聚合物溶解度较低的溶剂,使聚合物发生沉淀,然后通过离心或过滤等操作将聚合物与溶剂分离。
这种方法适用于聚合物与溶剂之间的相溶性差异较大的情况。
二、凝胶渗透色谱法(GPC)凝胶渗透色谱法是一种常用的聚合物分子量分布测定方法,同时也可以用于聚合物的分离与提纯。
该方法利用聚合物在凝胶柱中的渗透特性,根据聚合物分子量的大小,使得不同分子量的聚合物在柱中的滞留时间不同,从而实现对聚合物的分离。
通过收集柱中不同滞留时间的聚合物部分,可以得到纯度较高的聚合物。
三、萃取法萃取法是一种将聚合物从混合物中分离出来的常用方法。
该方法基于聚合物在不同溶剂中的溶解度差异,通过溶剂的选择和萃取操作,将聚合物从混合物中分离出来。
萃取法可以用于从聚合物反应体系中去除杂质或分离不同组分的聚合物。
四、析出法析出法是一种将聚合物从溶液中分离出来的方法。
该方法通过改变聚合物溶液中的条件,如温度、浓度等,使聚合物发生析出,然后通过离心或过滤等操作将聚合物与溶液分离。
析出法适用于聚合物在特定条件下易于析出的情况,可以获得较高纯度的聚合物。
以上介绍了几种常见的聚合物分离与提纯方法,不同的方法适用于不同的聚合物和应用需求。
在实际操作中,还需要考虑到成本、效率、安全性等因素,选择合适的方法进行分离与提纯。
聚合物的分离与提纯是聚合物研究和应用中不可或缺的环节。
高分子物理第三章溶液13要点

而破坏晶格,使溶解得以进行。可在常温下溶解。
3.非极性晶态聚合物 因结晶在常温下不能被破坏,所以 常温下不能溶解。只能升温至熔点以上才能溶解.如
;PE\PP\...
二、高聚物溶液特点
高分子溶液是真溶液
溶解过程比小分子缓慢
几小时——几天甚至几星期
高分子溶液的粘度大得多
比同浓度的小分子溶液粘度大一个或几个数量级 1)分子链由于有内摩擦不易流动 2)大分子链之间作用力使体系相对稳定,不易流动
PVA膜、人造丝
高分子溶液遵循宏观热力学的规律,
但比小分子溶液复杂,达到平衡的时 间特别长。
三、聚合物 溶剂的选择
高聚物/良溶剂体系
良溶剂-链单元间的相互作用力>链单元间的内聚 力, 线团扩张.
高聚物/劣溶剂体系
内聚力使线团收缩,高分子线团塌缩。 当内聚力达到一定程度时,高分子聚集,甚至从溶 剂中沉淀出来。
一、高聚物的溶解过程
高聚物的溶解过程缓慢,包括两个阶段
1 非晶态高聚物的溶解
பைடு நூலகம்
溶胀:溶剂分子渗入高聚物中,聚合物链与溶剂分子大 小相差悬殊,溶剂分子向聚合物渗透快,而聚合物分 子向溶剂扩散慢,结果溶剂分子向聚合物分子链间的 空隙渗入,使之体积胀大,但整个分子链还不能做扩 散运动
溶解:分子链摆脱了其它链段的束缚进入溶液 线性高聚物——溶解
2 结晶高聚物的溶解过程:
结晶的熔融—熔融的高聚物+溶剂—溶解
对同种聚合物而言,结晶使聚合物溶解度降低,结晶度越 高,溶解越困难。
非极性结晶Polymer:
常温下不溶,在Tm附近溶解: 由于非极性晶态聚合物中分子链之间排列紧密, 相互作用强,溶剂分子难以渗入,因此在室温条件下只能微弱溶胀;只 有升温到其熔点附近,使其晶态结构熔化为非晶态,才能溶胀-溶解。
复凝聚法制备微囊的工艺要点

复凝聚法制备微囊的工艺要点
1. 选择合适的原料:选择合适的原料是制备微囊的关键,一般选择聚合物和聚合物衍生物,如聚乙烯,聚丙烯,聚氨酯,聚氯乙烯,聚丁二醇,聚乳酸,聚甲基丙烯酸甲酯等。
2. 溶剂选择:选择合适的溶剂,使聚合物的溶解度和囊泡的稳定性最大化,常用的溶剂有乙醇,乙醚,丙酮,丁醇,氯仿等。
3. 选择合适的囊泡形状:根据应用需要,可以选择球形,柱形,肾形,椭圆形等不同形状的囊泡。
4. 调节溶剂浓度:一般来说,溶剂浓度越高,聚合物溶解度越高,囊泡形状越稳定,但是溶剂浓度过高,会影响囊泡形状的稳定性。
5. 添加表面活性剂:表面活性剂可以改善囊泡的稳定性,一般使用的表面活性剂有聚乙二醇,十二烷基硫酸钠,十二烷基磺酸钠等。
6. 调节pH值:调节pH值可以改变聚合物的溶解度,影响囊
泡形状的稳定性,一般使用碱性溶液(如氢氧化钠溶液)或酸性溶液(如硫酸钠溶液)调节pH值。
7. 加热:加热可以提高聚合物的溶解度,增加囊泡的稳定性,一般加热温度在50-90℃,加热时间一般在1-2小时。
8. 冷却:冷却可以使聚合物凝聚,形成微囊。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
聚合物溶剂的选择
1、相似相溶规则
这是人们在长期研究小分子物质溶解时总结出来的规律,对高分子溶液也适用。
组成和结构相似的物质可以互溶,极性大的溶质溶于极性大的溶剂,极性小的溶质溶于极性小的溶剂。
例如聚丙烯腈能溶于二甲基甲酰胺等极性溶剂,聚乙烯醇能溶于水,有机玻璃能溶于丙酮、及自身单体,而不溶于汽油和苯中。
非极性聚合物溶于非极性溶剂中,例如天然橡胶、丁苯橡胶能溶于汽油、苯、甲苯等非极性溶剂。
聚苯乙烯可溶于非极性的苯及乙苯中,也可以溶于弱极性的丁酮等溶剂。
2、内聚能密度或溶度参数(δ)相近规则
高分子溶液是热力学的平衡体系,可用热力学方法来研究。
在恒温恒压下,溶解过程自发进行的必要条件是Gibbs混合自由能ΔG M<0,Gibbs混合自由能是溶解过程的动力,即
ΔG M=ΔH M-TΔS M
式中:T——溶解时的温度;ΔH M——混合热;ΔS M——混合焓。
ΔH由溶解时的热效应来确定,如果溶解时放热则ΔH是负值,有利于溶解的进行。
溶解过程中存在三种不同的分子间作用能,即溶剂分子间的作用能、聚合物大分子间的作用能和聚合物—溶剂分子间的作用能。
前两种作用均阻止溶解过程的进行,只有聚合物—溶剂分子间的作用能大于前者时,其混合热ΔH才能为负值。
若高分子和溶剂间存在相互作用,如氢键等力的作用,则发生强的溶剂化作用而放热,ΔH<0,则有利于溶解。
但当聚合物和溶剂为非极性时,其溶解过程一般是吸热的ΔH>0,例如聚苯乙烯的苯溶液,两者之间仅有色散力的作用,高分子和溶剂之间的作用能小,在这种情况下要使ΔG M为负值必须满足∣ΔH M∣<TΔS M,其混合热ΔH M可以借用小分子的溶度公式来计算,按照Hildebrand理论,溶质和溶剂的混合热正比于它们溶解度参数差的平方,即
ΔH M=V(δ1一δ2)2φ1φ2
式中:V——溶液的总体积;φ1和φ2——溶剂和聚合物的体积分数;溶解度参数δ为内聚能密度的平方根。
因为内聚能密度是分子间力强度的标志,溶解时必须克服溶质分子间和溶剂分子间引力,故可用内聚能密度来预测溶解性。
δ=(ΔE/V)0.5
聚合物的内聚能密度就是单位体积的摩尔蒸发能。
混合热总是正值,溶解过程中ΔS M增大,所以溶解过程发生的条件是混合热ΔH M尽可能小,即溶剂和溶质的内聚能密度或溶解度参数应相近或相等。
一般地说,当聚合物的溶度参数δ2和溶剂的溶度参数δ1差值δ1一δ2小于±1.5时,两种物质可以互溶。
聚合物和溶剂的溶度参数δ1和δ2列于表1和表2。
30.5
30.5
在选择聚合物的溶剂时,除了使用单一溶剂外,还经常使用混合溶剂。
混合溶剂对聚合物的溶解能力往往比使用单一溶剂时为好。
甚至两种非溶剂的混合物也会对某种聚合物有很好的溶解能力。
混合溶剂的溶度参数占可由纯溶剂的溶度参数δ可由纯溶剂的溶度参数δ1、δ2及体积分数φ1、φ2的线性加和计算。
δ=δ1十δ2
例如聚苯乙烯的δ=8.6,我们可以选用一定组成的丁酮(δ=9.04)和正己烷(δ=7.24)的混合溶剂,使其溶度参数与聚苯乙烯接近,从而具有良好的溶解性能。
3、溶剂化规则
所谓溶剂化规则就是极性定向和氢键规则,此规则表明含有极性基团的聚合物和溶剂之间的溶解性有一定的内在联系。
溶剂有极性大小之分,并且极性又有正负偶极,溶度参数相近的两物质,正负极性相吸是有利于互溶的。
如果聚合物分子链上(主链或侧基)含有某种极性基团,则可按基团性质把聚合物也分成如表:I类为弱亲电子性聚合物,包括聚烯烃及含氯聚合物(例如聚氯乙烯)等;Ⅱ类为给电子性聚合物,包括聚醚、聚酯、聚酰胺等;Ⅲ类为强亲电子性及氢键聚合物,包括聚乙烯醇、聚丙烯腈及含COOH、SO3H基团的聚合物。
溶剂化规则为:
(1)聚合物作为溶质与溶度参数相近的溶剂接触时,凡属亲电子性的I、Ⅲ类溶剂能和给电子性的Ⅱ类聚合物进行溶剂化作用而有利于溶解;溶剂和聚合物基团之间能生成氢键时,也有利于溶解。
(2)给电子性的Ⅱ类溶剂,能和亲电子性的I、Ⅲ类聚合物进行溶剂化作用而有利于溶解。
(3)亲(给)电子性相同,都属亲电子或都属给电子的溶剂与聚合物不能进行溶剂化作用,故不利于互溶。
换言之,即使溶度参数相接近,I类极性溶剂不易溶解I类极性聚合物;Ⅱ类溶剂也不易溶解Ⅱ类聚合物。
总之,第(1)规则是定性的,第(2)规则是半定量的,但溶度参数值判断聚合物溶解性的可能性只适用于非极性分子混合时无热或吸热的体系,对于分子极性较强、生成氢键或混合时放热的体系则不适用,所以第(3)规则是第(2)规则的补充。
以上讨论的是溶剂的溶解能力,它是选择溶剂首先要考虑的问题.其次还要考虑溶剂必须是化学惰性的,不和聚合物起作用,难燃、毒性腐蚀性小、容易回收以及资源供应、挥发性等问题。
