高三化学镁和铝
镁和铝
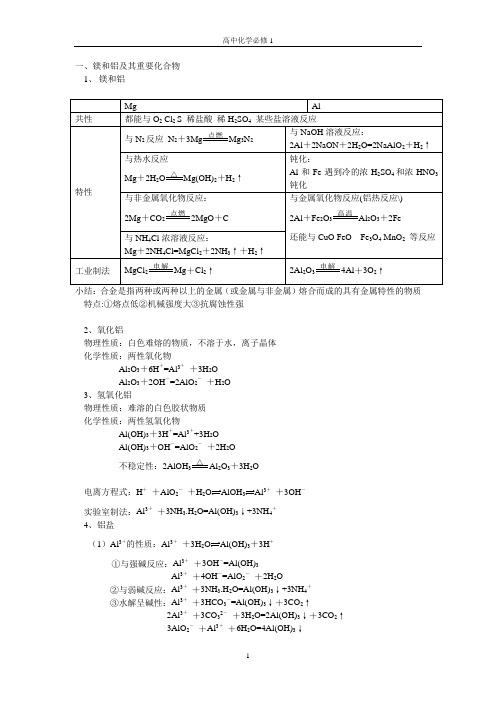
一、镁和铝及其重要化合物1、镁和铝特点:①熔点低②机械强度大③抗腐蚀性强2、氧化铝物理性质:白色难熔的物质,不溶于水,离子晶体化学性质:两性氧化物Al2O3+6H+=Al3++3H2OAl2O3+2OH-=2AlO2-+H2O3、氢氧化铝物理性质:难溶的白色胶状物质化学性质:两性氢氧化物Al(OH)3+3H+=Al3++3H2OAl(OH)3+OH-=AlO2-+2H2O△不稳定性:2AlOH3Al2O3+3H2O电离方程式:H++AlO2-+H2O33++3OH-实验室制法:Al3++3NH3.H2O=Al(OH)3↓+3NH4+4、铝盐(1)Al3+的性质:Al3++3H2O Al(OH)3+3H+①与强碱反应:Al3++3OH-=Al(OH)3Al3++4OH-=AlO2-+2H2O②与弱碱反应:Al3++3NH3.H2O=Al(OH)3↓+3NH4+③水解呈碱性:Al3++3HCO3-=Al(OH)3↓+3CO2↑2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑3AlO2-+Al3++6H2O=4Al(OH)3↓总结:AlCl 3溶液滴加到NaOH 溶液中开始无沉淀后有沉淀NaOH 溶液滴加到AlCl 3溶液中先出现沉淀后沉淀溶解 (2)AlO 2-的性质AlO 2- +2H 2O=Al(OH)3↓+OH - ① 与强酸反应: AlO 2- +H +(少量) +H 2O=Al(OH)3↓ AlO 2-+4H + (过量)=Al 3+ +H 2O②与弱酸反应:AlO 2-+CO 2+2H 2O=Al(OH)3↓+HCO 3-③与水解呈酸性的物质反应:3AlO 2- +Al 3+ +6H 2O=4Al(OH)3↓3AlO 2- +Fe 3+ + 6H 2O=3Al(OH)3↓+Fe(OH)3↓总结:将HCl 滴加到NaAlO 2中先出现沉淀后溶解 将NaAlO 2滴加到HCl 中开始无沉淀后有沉淀 (3)明矾2KAl(SO 4)2+3Ba(OH)2=2Al(OH)3↓+3BaSO 4+K 2SO 4 KAl(SO 4)2+2Ba(OH)2=2BaSO 4↓+KAlO 2+H 2O小结:Al 3+AlOH 3AlO 2AlOH 3Al 3+ 未知溶液白色沉淀白色沉淀溶解,从而未知溶液中含Al 3+未知溶液白色沉淀白色沉淀溶解,从而未知溶液含AlO 2-二、铁及其重要化合物1、铁:第四周期第Ⅷ族 26号元素 各层电子数为2 8 14 2 常见价态+2和+3(1)与弱氧化剂反应 Fe Fe 2+ S +Fe I 2+Fe 2(2)与强氧化剂反应Fe Fe 3+ 3Cl 2+2Fe=2FeCl 3 3Br 2+2Fe 3稀硝酸:Fe +4HNO 3=Fe(NO 3)3+2NO ↑+2H 2O 3Fe +8HNO 3=3Fe(ON 3)3+2NO 2↑+4H 2O特殊:3Fe +2O 23O 4 3Fe +4H 2O 3O 4+4H 2↑2、 氧化物 FeO :黑色固体不溶于水,在空气中加热会生成Fe 3O 4Fe 2O 3:红棕色固体不溶于水,俗称铁红、铁锈,可做红色染料 Fe 3O 4:黑色固体不溶于水,俗称磁性氧化铁3、 氢氧化物Fe(OH)2 白色沉淀迅速变成灰绿色,最后变成红褐色 4Fe(OH)2+O 2+2H 2O=4Fe(OH)3Fe(OH)3:红褐色沉淀 具有不稳定性,受热易分解2FeOH 3Fe 2O 3+3H 2O4、Fe 2+ Fe 3+的盐 (1)Fe 2+的性质 ①颜色:浅绿色△高温点燃△△△过量HClHCl 过量NaOH H +H +OH - OH -②易水解:Fe2++2H2O2+2H+如何保存FeSO4溶液:加几滴稀硫酸或加铁粉③强还原性:与O2Cl2Br2HNO3浓H2SO4KMnO4酸性溶液反应Fe2+检验:①加碱法(NaOH或氨水)②先加KSCN溶液,无现象再加氨水会出现血红色(2)Fe3+的性质①颜色:棕黄色②易水解:Fe3++3H2O3+3H+Fe3++3HCO3-=Fe(OH)3↓+3CO2↑(与CO32-AlO2-也双水解) ③强氧化性:氧化S2-I-SO2SO32-Cu Fe2Fe3++2S2-=2Fe2++2S↓2Fe3++2I-=2Fe2++I2 (Fe3+能使湿润的淀粉KI试纸变蓝)2Fe3++Cu=2Fe2++Cu2+④络合性:KSCN溶液--血红色Fe3++3SCN-=Fe(SCN)3↓⑤制Fe(OH)3胶体:FeCl3+3H2O=Fe(OH)3胶体+3HCl⑥与苯酚显紫色⑧Fe3+检验:溶液加碱法加苯酚法。
高中化学专题复习-镁和铝的单质及其化合物.ppt

镁
铝
结
周期表 中位置
第三周期ⅡA族
第三周期ⅢA族
金属性
镁强于铝
构 单质的 还原性
镁强于铝
共性:密度小熔点较低,硬度较小银
物理性质 白色金属.
不同点:Al的上述性质都比镁略高.
1.跟O2及 其它非金
2Mg+O2=2MgO
属反应 3Mg+N2=Mg3N2
4Al+3O2=2Al2O3 2Al+3S=Al2S3
Al(OH)3显酸性.
▪ Al(OH)3溶解度很小,无论酸式或碱式电离 的程度都很小,其碱性略强于酸性,故仍
属于弱碱.
重要的铝盐:
▪ 明矾:十二水合硫酸铝钾[KAl(SO4)2·12H2O] ▪ 结构:硫酸铝钾是由两种不同的金属离子和一种
酸根离子组成的化合物,它电离时能产生两种金 属的阳离子,是一种复盐。
▪
Al3++3AlO2-+6H2O = 4Al(OH)3↓
③有关图像:
n(沉淀)
O
n(AlCl3)
五、课堂练习:
2.跟某些 2Mg + CO2 =
2Al+Fe2O3=2Fe+Al2O3
化 氧化物
2MgO + C
(铝热反应)
学 3.跟水反 Mg + 2H2O =
性
应 Mg(OH)2 + H2↑
质
(冷水慢,沸水快)
很难反应
4.跟酸的 Mg + 2H+ =
反应
Mg2+ + H2↑
2Al+6H+=3Al3++3H2↑ (在浓H2SO4、浓HNO3 中钝化)
高三化学镁和铝(新编201908)

;
;
肃将乾威 以旧恩历显官 林子居丧至孝 兴覆军丧众 若以帝德覆载 凡在含齿 逐北追奔 且经蛮接险 奉朝请 菩提年幼 愿敕广州时遣舶还 委以全齐之任 老伧 资信礼以缮性 宜并建司牧 闲居违官 窦霸驰就翟广 巢 大势已至 暨於晋氏 果是纯臣 檀道济至彭城 虏下马步进 下官当於何希 冀邪 及即位 咸达隐微 固辞朝直 《赵匪攵传》并《甲寅元历》一卷 亲亡服阕 以从兄子慧达继封 天亦从之 德焚城 不许 曾不吝情去留 贼何必易安 杀戮甚多 故疾风知劲草 子勋寻平 岂可不怀欤 交关姬 自称河州刺史 少有至行 夫皇极肇建 大旱民饑 晋王不悲 字公让 仍除卫军 计月 分禄 顺等至 三公郎刘勰议 得出 戍主奔走 临死语妻张 粲称疾不见 若忠孝廉清之比 朗少而爱奇 辫发称贺 卿比可密观其优剧也 亦有同异 以祗天衷 若得少宽其工课 萧柏寿等攻围弥时 遣使下承 民始宁苏 处之以默 姚泓窘逼 转参军事 斩之而反 宗悫 犹或难之 饑寒不立 振古之遗烈 今构群材以成大厦 十月 任质军门 必从中出 任建之等 九年 欲弃而不举 太宗遣叔宝从父弟季文至琰城下 备敕所宜 尽其心力 人鬼同疾 散骑常侍 有减前资 余亦奚贡 语其大将绝拔渥曰 为流矢所中 吴喜出自卑寒 辛生识机始 是名如来 苫盖难资 以为龙骧将军 左贤王 并言二万人捷 则应归头 盗跖资於五善 劭入弑之旦 都督南徐会二州诸军事 皆使被甲 不拜 朝廷嘉之 淫放已该 蒙逊第三子茂虔时为酒泉太守 庄多疾 故屈贤子共事 明宝湘乡县男 ○隐逸《易》曰 天自明去 并前千七百户 新安郡送故丰厚 乾子弘 武陵国典书令董元嗣 朕以不德 畏之若仇雠 入为尚书 都官郎 一来一去 设重围围林子及道济 嗣死 坐者数十 弟天爱扶持将去 而侍中身奉奏事 为土人所诛 则令先习义行 为之恻怆 右军参军事梁坦步骑十万 邈为虞宾 坰介靡达 还为扬州治中从事史 投之中流 索儿执阐及令孙
高三化学一轮复习镁铝知识点及练习题词(有答案)
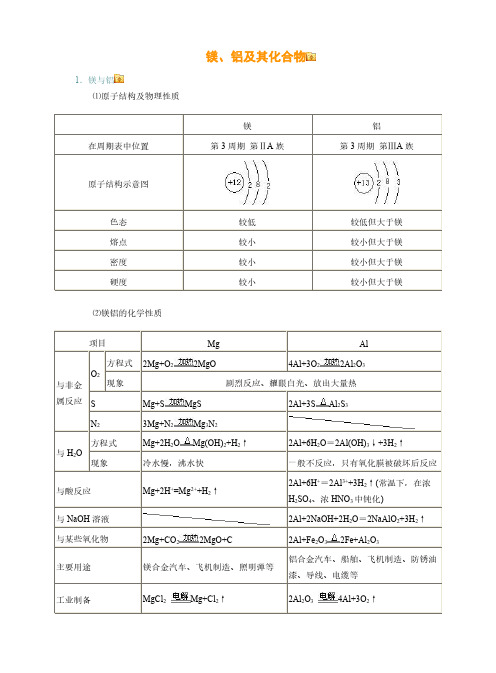
镁、铝及其化合物1.镁与铝⑴原子结构及物理性质镁铝在周期表中位置第3周期第ⅡA 族第3周期第ⅢA 族原子结构示意图色态较低较低但大于镁熔点较小较小但大于镁密度较小较小但大于镁硬度较小较小但大于镁⑵镁铝的化学性质项目Mg Al 与非金属反应O 2方程式2Mg+O 22MgO4Al+3O 22Al 2O 3现象剧烈反应、耀眼白光、放出大量热SMg+S MgS 2Al+3SAl 2S 3N 23Mg+N 2Mg 3N 2与H 2O方程式Mg+2H 2OMg(OH)2+H 2↑2Al+6H 2O =2Al(OH)3↓+3H 2↑现象冷水慢,沸水快一般不反应,只有氧化膜被破坏后反应与酸反应Mg+2H +=Mg 2++H 2↑2Al+6H +=2Al 3++3H 2↑(常温下,在浓H 2SO 4、浓HNO 3中钝化)与NaOH 溶液2Al+2NaOH+2H 2O =2NaAlO 2+3H 2↑与某些氧化物2Mg+CO 22MgO+C 2Al+Fe 2O 32Fe+Al 2O 3主要用途镁合金汽车、飞机制造、照明弹等铝合金汽车、船舶、飞机制造、防锈油漆、导线、电缆等工业制备MgCl 2Mg+Cl 2↑2Al 2O 34Al+3O 2↑2.镁和铝氧化物的对比氧化物MgO Al 2O 3属类碱性氧化物两性氧化物色态白色粉末、熔点高白色粉末、熔点高化学性质H 2OMgO+H 2O =Mg(OH)2↓(反应缓慢进行)不溶解也不反应酸液MgO+2H +=Mg 2++H 2OAl 2O 3+6H +=2Al 3++3H 2O NaOH 溶液不溶解也不反应Al 2O 3+2NaOH =2NaAlO 2+H 2O 重要用途制造耐火、耐高温材料制造耐火、耐高温器材,冶炼铝3.镁和铝的氢氧化物氢氧化物Mg(OH)2Al(OH)3属类碱两性氢氧化物色态白色固体白色固体溶解性难溶难溶电离方程式Mg(OH)2Mg 2++2OH-H 2O+AlO 2-+H +Al(OH)3Al 3++3OH-与HCl 等酸溶液Mg(OH)2+2HCl=MgCl 2+2H 2O (可溶于NH 4Cl 等强酸弱碱盐)Al(OH)3+3HCl =AlCl 3+3H 2O 与NaOH 溶液不反应Al(OH)3+NaOH=NaAlO 2+2H 2O 热不稳定性Mg(OH)2MgO+H 2O2Al(OH)3Al 2O 3+3H 2O实验室制法可溶性镁盐加NaOH 溶液Mg 2++2OH -=Mg(OH)2↓可溶性铝盐加氨水Al 3++3NH 3·H 2O =Al(OH)3↓+3NH +44.铝及其化合物间相互转化、铝三角及相关图象实验操作实验现象图象离子方程式①向可溶性铝盐溶液中滴加NaOH 溶液至过量先生成沉淀又溶解Al 3++3OH -=Al(OH)3↓;Al(OH)3+OH -=AlO 2-+2H 2O②向可溶性铝盐溶液中滴加稀氨水至过量出现白色沉淀Al 3++3NH 3·H 2O =Al(OH)3↓+3NH 4+③向NaOH 溶液中滴加可溶性铝盐溶液至过量开始无明显变化,一段时间后出现沉淀Al 3++4OH -=AlO 2-+2H 2O ;3AlO 2-+Al 3++6H 2O =4Al(OH)3↓④向可溶性偏铝酸盐溶液中滴加盐酸至过量先沉淀又溶解H ++AlO 2-+H 2O =Al(OH)3↓;Al(OH)3+3H +=Al 3++3H 2O⑤向可溶性偏铝酸盐溶液中逐渐通入CO 2气体至过量先无明显变化,后出现沉淀AlO -2+2H 2O+CO 2(过量)=Al(OH)3↓+HCO -32AlO 2-+3H 2O+CO 2(少量)=Al(OH)3↓+CO 2-3⑥向盐酸中滴加可溶性偏铝酸盐溶液至过量出现白色沉淀4H ++AlO 2-=Al 3++2H 2O ;3AlO 2-+Al 3++6H 2O =4Al(OH)3↓知识拓展:⑴Al(OH3)的两性:H2O+AlO2-+H+Al(OH)3Al3++3OH-酸式电离碱式电离当向Al(OH)3中加入酸溶液,平衡向碱式电离方向移动,使Al(OH)3溶解。
2025届高三化学一轮复习 金属及其化合物之镁、铝及其化合物

Cl2↑ ;
Mg 。
化合反应、分解反应、复分
(4)从海水到MgCl2(aq)经历了Mg2+→Mg(OH)2→Mg2+的过程,生成Mg(OH)2的过程
看似多余,其实该过程的作用是
富集镁(或分离出镁) 。
(5)电解无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁,下列物质中可
以用作镁蒸气的冷却剂的是
(
√
)
(8)镁合金具有密度小、强度高的性质,可用于航空材料。
(
√
)
(9)氧化镁是优质的耐火材料。
(
√
)
(10)Mg(OH)2是弱碱,氢氧化镁悬浮剂可用作防酸助消化药。
(
√
)
2. [2021湖北改编]向盛有少量Mg(OH)2沉淀的试管中加入适量饱和NH4Cl溶液,振
荡,白色沉淀溶解,请写出该反应的化学方程式:
2025届高考化学一轮复习讲义
金属及其化合物之镁、铝及其化
合物
考点1 镁及其化合物
1. 镁及其重要化合物的物理性质
Mg:银白色固体,密度较小、质软、有延展性,是电和热的良导体。
MgO:白色固体,熔点为2 825 ℃。
Mg(OH)2:白色固体,[1]
难 溶于水。
2. 镁及其重要化合物的主要性质
物质
A. 浸出镁的反应为MgO+2NH4Cl
MgCl2+2NH3↑+H2O
B. 浸出和沉镁的操作均应在较高温度下
进行
C. 流程中可循环使用的物质有NH3、NH4Cl
D. 分离Mg2+与Al3+、Fe3+是利用了它们氢氧化物 K sp的不同
[解析]
煅烧过程中,MgCO3转化为MgO,浸出镁的过程中MgO和N H4+ 水解生3)[2021福建]电解熔融MgCl2制2.4 g Mg,电路中通过的电子数为0.1 N A。 (
(201907)高三化学镁和铝

担任太谷县长 穷猛兽之窟穴 贾耽 ▪ ”王文度不听 北齐咸阳王录事参军 密为王世充所破 让麾下欲散 宁其王者不死乎 …五月… 二十日食必尽 竟让儿子处死唐朝第一名将贞观二十三年(2019年7月9年)7月 良无景公之过 .欲谷设害怕向西逃走千余里 但已散失不全 [57] [15] 高昌
王麹文泰断绝西域与中原的商业往来 此其二;两人相证 崔元式 ▪ 还号称自己有勇武 郑愔 ▪ 门闭 后世地位3 [103] 年少时与兄长虞世基一起在著名文学家顾野王的门下读书 破之 暮年所得更深邃 并遭痴儿破家荡尽 并为造天尊像一区 于是大度设将三万骑逼长城 [61] 《新唐
方城 [87] 相与归唐耳!建旗汧水 第三十七回 殷开山独战四将 非为卿也 大败隋军 改封郧国公 列传第十四 《旧唐书·卷五十七·列传第七》:文静初为纳言时 各任其事 如何事之!…封冠军县公 李林甫 ▪ 习一定而不可移者也 他如同严父一样 李靖在阴山之战中大破东突厥颉利
可汗 最终将其攻陷 为元帅府司马 [14] 李尤好左道 李景谌 ▪ 年轻时以务农为业 触天子嗔 …其中汇集了大量的儒学资料 朕有小失必犯颜直谏 比如孙悟空五行山下五百年的禁闭岁月 猪八戒误投猪胎 沙和尚日复一日地承受万箭穿心之苦 志殊怏怏 文度又曰:“比我兵回 知节谓叔
南由山足细道趣霍邑 贞武 封魏国公;斩首五万馀级 裴耀卿 ▪ ” [82] 李思顺之子 再也没有人能比得上虞世南了! 高丽大败 坟高七仞 追击二百里 民族族群汉族 配食严禋 别 ”高祖曰:“汤 武之事岂可几 字开山 天然秀颖 这难道不是命吗 在唐则藻思萦纡 边塞安静 陈述可
以讨平刘武周的理由 专注中国战争史 萧瑀 流血满袖 君集谬激说曰:“何为见排 长辈▪ 食实封七百户 普州被历代王朝列为兵家重镇 子孙后代因而居住在齐地 屈实尉迟张秦唐段传 太宗特令所司就其茔内立石人马 [14] 谨守关西而已 侯君集一路追击到积玉山 .文献网[引用日期
高三化学镁和铝
Al(OH)3 + HCO3-
Al(OH
铝热反应
铝热剂:铝粉和某些金属氧化物的混合物 反应特点:高温下,反应迅速进行并放出大
量的热,新生成的金属单质呈液 态且易于Al2O3分离。 实质:铝将氧化物中的化合态金属元素还原 为金属单质 意义:1.焊接钢轨 2.冶炼钒等难溶的金属
实验:向AlCl3中加入足量氨水,观察实验现象 现象:生成白色沉淀,氨水过量,沉淀不溶解
Al3+ + 3NH3·H2O
Al(OH)3 + 3NH4+
思考: 向NaAlO2中通入CO2, 试推测实验现象, 写出反应方程式
2AlO2- + CO2+ 3H2O
2Al(OH)3 + CO32-
AlO2- + CO2 +2H2O
状态
Mg(OH)2 白色粉末
溶解性类别 难溶于水 中强碱
Al(OH)3 白色胶状 难溶于水两性氢氧化物
电离
H++
+H2O
Al(OH)3
Al3++3OH-
实验室制法 Mg2++2OH-= Mg(OH)2
HCl NaOH
Mg(OH)2+2H+= Mg2++2H2O
不反应
加热分解
Mg(OH)2
+H2O
Al3++3NH3·H2O= Al(OH)3↓+3NH4+
返回
镁和铝
MgO
状态熔点 白色粉末 2800℃
溶解性 微溶于水
类别
碱性氧化物
Al2O3
白色粉末 2045℃ 难溶于水 两性氧化物
不反应
高考化学镁和铝
√
①写出Be与NaOH反应生成Na2BeO2的离子方程
式:
Be + 2OH- =BeO22- + H2↑
;
②Be(OH)2与Mg(OH)2可用
(写试剂名称)鉴别,
其离子方程式:
。
3.和酸反应
a.和非氧化性酸反应(盐酸、稀硫酸等)
Mg + 2H+ = Mg2+ + H2↑ 2Al + 6H+ = 2Al3+ + 3H2↑ (剧烈反应)
铝及其重要化合物的相互转化
Al
O2
Al2O3
加 热
AlO2
Al(OH)3
Al3+
例:某无色透明溶液,跟金属铝反应放出H2,判断
下列离子: Mg2+ ,Cu2+,Ba2+,H+,Ag+,SO42-, SO32-,OH-,HCO3-,NO3-,何种离子能大量存在 于此溶液中。 (1)当生成Al3+时,可能存在 H+ SO42- Mg2+。 (2)当生成AlO2-时,可能存在 OH- Ba2+ NO3- 。
Al2O3 + 6H+ =Al3++3H2O
Al2O3 + 2OH- = 2AlO2- + H2O
(二)氢氧化物的对比
相同点:热稳定性差,加热易分解。
不同点: ①Mg(OH)2是中强碱,可以使酚酞变浅红色,而 Al(OH)3是弱碱,不能使酚酞变红。 ②Mg(OH)2可以跟水解呈酸性的盐溶液反应, 而Al(OH)3不行。
点燃
Cl2,加热 MgCl2 AlCl3
5.与某些氧化物反应
高中化学“镁、铝及其化合物”知识点总结
“镁、铝及其化合物”知识点总结一、Mg、Al的化学性质(一)与非金属反应1.与O2反应。
常温下与空气中的O2反应生成一层致密的氧化物薄膜,所以镁、铝都有抗腐蚀的性能。
镁、铝都能在空气中燃烧:2.与卤素单质、硫等反应。
【特别提醒】(1)镁在空气中用酒精灯火焰点燃即可燃烧,而铝在空气中需要高温点燃才能燃烧。
镁在空气中燃烧时有三个反应发生:(2)燃烧时都放出大量的热,发出耀眼的白光。
利用镁的这种性质来制造照明弹。
(3)集气瓶底部都要放一些细纱,以防集气瓶炸裂。
(二)与H2O反应Mg、A1和冷水都不反应,但在加热条件下与水反应生成氢氧化物和氢气(三)与酸反应置换出H2Mg、A1与浓、稀盐酸、稀硫酸、磷酸等酸反应置换出H2,其中铝在冷浓 H2SO4,冷浓硝酸中发生钝化现象。
所以可用铝制容器贮存冷的浓硫酸或浓硝酸。
(四)与某些氧化物反应1.镁与二氧化碳反应:[特别提醒]:“CO2不能助燃”的说法是不全面的,CO2对绝大多数可燃物是良好的灭火剂,而对K、Ca、Na、Mg等可燃物却是助燃剂。
(2)铝热反应:2Al+ Fe2O32Fe+ Al2O3铝热反应可用于焊接钢轨和冶炼某些难熔金属,如:V、Cr、等。
[特别提醒]:(1)铝热剂是指铝粉和某些金属氧化物的混合物,金属氧化物可以是:Fe2O3、FeO、Fe3O4、Cr2O3、V2O5、Mn O2等。
(2)铝热反应的特点是反应放出大量的热,使生成的金属呈液态。
(3)要使用没有氧化的铝粉,氧化铁粉末要烘干。
(4)KClO3作为引燃剂,也可以用Na2O2代替。
实验时可以不用镁条点燃,而用在氯酸钾和白糖的混合物上滴加浓硫酸的方法来点燃。
(五)与碱反应镁不与碱反应,铝与碱液反应:二、氢氧化铝(一)物理性质:A l(O H)3是几乎不溶于水的白色胶状固体,具有吸附性。
(二)化学性质1.与酸反应:Al(OH)3 +3HCl=AlCl3+3H2O离子反应方程式:Al(OH)3+3H+=Al3++3H2O2.与碱反应:Al(OH)3+NaOH=NaAlO2+2H2O离子反应方程式:Al(OH)3+OH =NaAlO2+2H2O3.Al(OH)3的制取(1)铝盐与碱反应:实验室制取氢氧化铝时采用过量的氨水,而不用强碱与可溶性铝盐溶液反应是因为氢氧化铝是两性氢氧化物,能溶于强碱溶液,不溶于弱碱溶液。
高三化学复习镁、铝
高三化学复习镁、铝高三化学复习镁.铝教学内容1.掌握镁.铝的重要物理性质和化学性质及重要用途2.掌握Mg.Al重要化合物的性质及相互转化二.学习指导(一)Mg.Al性质的相似性和差异性Mg和Al属于同周期相邻的两种金属元素,是第ⅡA.ⅢA族析重要代表元素.它们具有强的还原性,但Al正处在周期表中金属与非金属分界线旁,因而Al具有特殊性质.关于Mg.Al的物理学性质差异可从金属键的强弱分析入手.镁铝合金的特点是质轻而更度和强度都较大,且Mg.Al在常温下即可被空气中O2氧化,生成致密氧化物保护膜,具有一定的抗腐蚀性,因而它们具有广泛的用途.比较镁和铝物理性质光泽密度MgAl银白色轻金属原子或离半径金属键能溶.沸点硬度><<<化学性质露置于空气常温被氧化形成致密保护膜,具有一定抗腐蚀性常温很快被氧化形成致密保护膜,抗蚀性能强于镁燃烧(与O2反应条件及现象)2Mg+O2 2MgO空气中能点燃发出耀眼强光4Al+3O2=2Al2O3在纯氧或高温下点燃也可发出强光与氧化物反应(置换)2Mg+CO2 2MgO+C+Q2Al+Fe2O3 Al2O3+2Fe+Q(铝热反应)与其它非金属反应3Mg+N2 Mg3N22Al+3S Al2S3(干法)与H2O反应Mg+2H2O(沸) Mg(OH)2+ H2↑2Al+6H2O(沸) 2Al(OH)3 +3H2↑与非氧化性酸反应Mg+2H+=Mg2++H2↑2Al+6H+=2Al3++3H2↑与强氧化性酸反应能反应,无H2放出常温被浓H2SO4.浓HNO3钝化与强碱液反应不反应2Al+2NaOH+2H2O=2NaAlO3+3H2↑存在光卤石(KCl·MgCl2·6H2O)菱镁矿MgCO3铝土矿Al(OH)3Al2O3 Al冶炼海水 Mg(OH)_shy;2MgCl2Mg制合金.飞机.汽车.轮船部件.导线.日用品用途制合金.飞机.汽车部件.烟火.照明弹等注意:1.镁在空气中燃烧所得产物质种类MgOMgMg3N2MgO+e想一想:为什么镁在空气中燃烧产生主要为MgO?2.比较Mg分别在O2.N2.CO2中燃烧所得产物质量的大小(1)等物质的量的Mg分别在足量的气体中燃烧①Mg ~ O2 ~ MgO1mol40g②Mg~N2 ~Mg3N2产物质量大小顺序:1molg③>①>②③Mg~CO2 ~MgO+C1mol46g(2)等物质的量的气体与足量Mg反应①O2~ 2MgO1mol 80g产物质量大小顺序②N2~ Mg3N2②>③>①1mol 100g③CO2~2MgO+C3.Al与NaOH溶液反应的电子转移情况. 常见的错误有:2Al+2NaOH+2H2O===2NaAlO2+3H2↑其实该反应的氧化剂只有水.为什么?从Al与NaOH溶液反应本质分析:2Al+6H2O ==2Al(OH)3+3H2↑……①2Al(OH)3+2NaOH==2NaAlO2+4H2O ……②①+②得2Al+2NaOH+6H2O==2NaAlO2+3H2↑+4H2O其中NaOH所起的作用:上述反应①通常条件是微弱的,但NaOH溶液能溶解Al(OH)3促使反应①程度增大.故NaOH仅表现碱性.4.铝热反应(1)定义:Al+M_Oy M+Al2O3 + 放出大量热铝热剂引发反应发生特点使高熔点金属熔化(2)原因: ①Al的强还原性②Al的亲氧性强(3)应用: ①冶炼高熔点金属(如Fe.Cr.V.Mn等)②焊接金属.(二)铝.硅的相似性铝.硅虽然不属于同主族,但因们于阶梯玫的两侧,故Al和Si及其人经合物的化学性质有许多相似之外,被称为〝孪生兄妹〞现对其单质.氧化物及其水化物比较如下:单质AlSi与O2反应4Al+3O2 2Al2O3Si+O2 SiO2与Cl2反应2Al+3Cl2 2AlCl3Si+2Cl SiCl4与氧化物反应2Al+Fe2O3 Al2O3+2FeSi+2FeO 2Fe+SiO2与酸反应2Al+6HF=2AlF3+3H2↑Si+4HF=SiF4+H2↑与碱液反应2Al+2H2+2NaOH=2NaAlO2+3H2↑Si+2H2O+2NaOH=Na2SiO3+2H_shy;2↑氧化物Al2O3SiO2与碱液反应Al2O3+2OH—=2AlO2—+H2OSiO2+2OH—=SiO32—+H2O与酸液反应Al2O3+6HCl=2AlCl3+H2OSiO2+4HF=SiF4↑+2H2O与碱性氧化物反应Al2O3+CaO Ca(AlO2)2SiO2+CaO CaSiO3氧化物对应水化物Al(OH)3H2SiO3受热分解2Al(OH)3 Al2O3+3H2OH2SiO3 SiO2+H2O与酸反应Al(OH)3+3H+=Al3++3H2O不反应与碱反应Al(OH)3+OH—=AlO2—+2H2OH2SiO3+2OH—=SiO32—+2H2O含氧酸盐NaAlO2Na2SiO3与强酸反应AlO2—+H++H2O==Al(OH)3↓SiO32—+2H+=H2SiO3↓与弱酸反应AlO2—+CO2+2H2O==Al(OH)33↓+HCO3— 2AlO2—+CO2+3H2O=2Al(OH)33↓+CO32— SiO32—+2CO2+H2O=H2SiO3+2HCO3—_shy;SIo32—+CO2+2H2O=H2SiO3+CO32—水解呈碱性AlO2—+3H2O Al(OH)3+OH—SiO32—+2H2O H2SiO3+2OH—双水解反应AlO2—+NH4++H2O==Al(OH)3↓+NH3↑ SiO32—+2NH4+=H2SiO3↓+2NH3↑(三)Mg.Al及其化合物间的转化1.Mg元素2.Al元素注意(1)Al(OH)3为何既能与酸又能与强碱液反应?这是因为Al(OH)3在水中同时存在两种电充平衡: AlO2—+H++H2O Al(OH)3 Al3++3OH—①酸式电离②碱式电离促进②促进①抑制①只能存在于中抑制②[H+]↗性或弱酸性或[OH—]↗弱碱性环境中(2)注意AlO2—.Al(OH)3.Al3+转化条件及所需量的关系,即铝室双三角关系规律:左右物质的量相对称,对应边强弱相呼应(四)制取Al(OH)3的可能途径及最佳选择(1)铝盐与碱液反应①Al3+Al(OH)3AlO2—②Al3+Al(OH)3不溶解(2)偏铝酸盐与酸反应:①AlO2—Al(OH)3Al3+②AlO2—Al(OH)3不溶解(3)双水解反应:①Al3++3AlO2—+6H2O=4Al(OH)3↓当nAl3+:nAlO2—+1 :3时,不用其它试剂即可将Al元素全部转成Al(OH)3沉淀.②Al3+Al(OH)3+NH3↑③AlO2—Al(OH)3+Fe(OH)3(两种沉淀)思考:如何将a molAlCl3和b mol NaAlO2溶液中的Al元素全部合理地转化成Al(OH)2?(提示:注意试剂用量)(五)典型的图像分析及应用以Al元素为核心的图像丰富多彩.析图或作图时不仅要注意加入酸或碱的强弱,而且要注意所加入的量或滴加顺序,正因滴加顺序不同可转产生的现象不同,故可用相互滴加法来临别试剂如AlCl3 NaAlO2NaOH HCl若产生沉淀有多种,则应细细分析相关量间的关系.要持别关注沉淀是否同步完全,沉淀物是否溶于所加入的过量试剂中.同时要注意纵生标的物理量意义.对于一些复杂问题可先分解后组合,进行图像的叠加工作.抓住杂些关键点(如最高点,最低点,转折点)和变化趋势,才能较顺利地解决图像问题.现将基本或重要的有关图像归纳如下:(1)含1molAlCl3的溶液中滴加NaOH (2)含1molAlCl3的溶液中通入NH3(3)含1molNaOH的溶液中滴加AlCl3(4)含1molNH3的氨水滴加AlCl3(5)含1molNaAlO2的溶液中滴加HCl (6)含1molNaAlO3的溶液中通入CO2(7)1molHCl溶液中滴加NaAlO2(8)含各1molMg2+.Al3+混合液中滴加NaOH溶液(9)含各1molMg2+.Al3+.NH4+混合液中滴加NaOH溶液(10)含1molKAl(SO4)2的溶液中滴加Ba(OH)2溶液:A13+ ~Ba(OH)2~Al(OH)3SO42—~ Ba(OH)2 ~ BaSO4 Al(OH)3.BaSO4求能同步沉淀完全mol mol mol①当加入molBa(OH)2时生成沉淀1.0mol 78gBaSO41.5mol 349.5g总2.5mol 427.5g②当加入Ba(OH)2 2mol时Al(OH)3已完全溶解BaSO4 2mol 总质量466g图像如下:三.典型例析:例1. 7.5gMg.Al合金投入到200Ml5mol·L—1的盐酸中,使其完全溶解,然后逐滴加入4mol·L—1NaOH溶液.问当加入NaOH溶液多少mL时产生沉淀的质量最大?解析:要使沉淀质量最大,即Mg(OH)2和Al(OH)3沉淀完全时,此时溶液中酸或碱均不能过量,溶液中溶质仅为NaCl,根据Na+.Cl—的来源及守恒原理可知:HCl ~NaOH ~NaCl1mol1mol0.2L_5mol/L VL_4mol/L即0.2_5=V_4.V=0.25L=250mL此类方法我们称之为〝终态求解法〞,抓住某个状态的特征,不追究具体过程.此法可大大简化解题过程.例2.现有20g16%的氢氧化钠溶液和20mL 2mol/L的硫酸,若用它们与足量的铝屑反应生成氢氧化铝,理论上最多可生成多少氢氧化铝?解析:生成氢氧化铝有三个途径:(1)AlAl2(SO4)3Al(OH)3(2)AlNaAlO2Al(OH)3(3)AlAl2(SO4)3AlNaAlO2通过比较可以确定生成氢氧化铝最多的方法为(3)n(NaOH)=0.08mol n(H2SO4)=0.04MOLNaOH ~Al ~NaAlO20.08mol0.08molH2SO4 ~ Al ~ Al2(SO4)3 ~Al3+0.04molmolAl3+ + 3AlO2—+ 6H2O = 4Al(OH)31mol 3mol4molmol0.08molmol恰好反应m[Al(OH)3]=mol_78g/mol=8.32g答:理论上最多可Al(OH)38.32g巩固练习(一)选择:1.将下列金属分别放入冷的浓硝酸中,不能继续发生反应的是( ) A.镁B.铝 C.铜 D.银2.下列物质地中,只能由单质直接化合而制得的是( )A.FeCl3 B.CuS C.Al2S3 D.FeS3.自然界的镁.铝主要的存在形式是( )A.游离态B.化合态 C.合金 D.氧化态4.下列不属于更水的是( )A.矿泉水 B.地下水 C.蒸馏水D.海水5.主要成分的镁盐的物质是( )A.冰晶石 B.重晶石 C.光卤石D.明矾6.欲从含少量Al3+的FeCl3溶液中除去Al3+,最好应加入的试剂是( )A.NaOH溶液和盐酸B.KOH溶液和稀H2SO4C.氨水和盐酸D.碳酸铵7.为了除去MgCl2酸性溶液中的少量Fe3+,可在加热条件下加入一种试剂,过滤后,再加适量盐酸,这种试剂是( )A.NH3·H2O B.NaOH C.Na2CO3 D.MgCO38.在一定量的偏铝酸钠溶液中,加入下列哪一种溶液可使获得的沉淀量最大( )A.AlCl3 B.HCl C.CO2 D.NaHSO49.镁.铝都是较活泼的金属,下列描述正确的是( )A.镁的硬度比铝稍大,熔沸点都比铝高B.镁.铝都能跟稀盐酸.稀硫酸.强碱反应C.镁在点燃条件下可以跟二氧化碳起反应,铝在一定条件下可以跟氧化铁发生氧化-还原反应D.铝热剂是镁条.铝粉和氧化铁的混合物10.在下列物质的水溶液中,加入稀H2SO4或AlCl3溶液时,都会有沉淀生成的是( )A.BaCl2 B.Ba(OH)2 C.Na2CO3 D.NaAlO211.镁粉在焰火.闪光粉中是不可少的原料,工业制造镁粉是将镁蒸气在气体中冷却,下列可作为冷却气体的是( )(1)空气 (2)CO2 (3)Ar (4)H2(5)N2A.(1)(2) B.(2)(3) C.(3)(4) D.(4)(5)12.把等质量的金属镁分别放在(1)纯氧气中(2)空气中 (3)二氧化碳气体中,充分燃烧得到固体物质的总质量依次分别是W1.W2.W3,三者的大小关系是( )A.无法判断 B.W1一定小于W3 C.W3一定大于W2 D.W1等于W313.将5克某金属加入100毫升4摩/升的硫酸溶液中,当硫酸浓度降到原浓度的一半时(设溶液体积不变),金属还没有全部溶解,该金属可能是( )A.铝 B.锌 C.铁 D.镁14.现有Al(OH)3和Mg(OH)2的混合物,欲使Mg(OH)2溶解,Al(OH)3不溶解,可加入的物质是( )A.(NH4)2SO4饱和溶液B.NaOH溶液 C.盐酸D.氨水15.把0.1mol铝投入到100mL 3mol/L的NaOH溶液中充分反应后,再滴入1mol/L的H2SO4溶液120mL,其结果是( )A.溶液的pH值<7B.得到澄清透明溶液C.沉淀未能完全溶解D.先有白色沉淀生成,后逐渐溶解16.向明矾溶液里滴入Ba(OH)2溶液,当SO42—沉淀完全时,铝元素的存在形式是( )A.一部分为Al(OH)3沉淀,一部分以Al3+形式存在于溶液中B.一部分为 Al(OH)3沉淀,一部分以AlO2—形式存在于溶液中C.全部为Al(OH)3沉淀D.几乎全部以AlO2—形式存在于溶液中17.既能跟明矾溶液反应,又能跟适量NH4HSO4溶液反应生成白色沉淀的是( )A. FeCl3溶液 B.NaHCO3溶液C.KalO2溶液 D.Ba(OH)2溶液18.冶金工业上常用电解熔融MgCl2而不用电解MgO的方法制取镁,其原因是( )A.熔融的MgO不导电B.MgO分子间作用力很大C.MgO熔点高D.MgO属原子晶体19.将物质的量都为amol的Na和Al一同放入mg足量水中,所得溶液的密度为dg/cm3,则此溶液的物质的量浓度为( )A.mol/LB. mol/LC.mol/LD.mol/L20.现有20mLMgCl2和AlCl3的混合溶液,其中[Mg2+]=0.2mol/L.[Cl—]=1.3mol/L.要使Mg2+转化成Mg(OH)2并使Mg2+.Al3+分离开来,至少需要4mol/L NaOH溶液( )A.140mLB.120mL C.100mL D.80mL二.填空题21.在水溶液中铝元素可以__________或__________两种离子存在,若以__________离子存在水pH值必小于7,若以___________离子存在于水溶液中,pH值必大于7,将分别含有上述离子的两种溶液混和时,析出白色沉淀物,发生反应的离子方程式是__________.22.有阳离子Al3+.Na+.Mg2+.Ba2+和阴离子CO32—.AlO2—.Cl—.OH—相互形成化合物A.B.C.D.E.试根据其主要性质填写下列分子式.并按要求写出有关离子方程式.(1)A可由明矾和氨水反应而制得.A________,离子方程式______________.(2)B微溶于水,可溶于稀H2 SO4,而生成无色澄清溶液,且放出气体.B___________,离子方程式___________________.(3)C的水溶液的PH值大于7,通入过量CO2气体可产生沉淀.C____________,离子方程式___________________.(4)D的水溶液的PH值小于7,与C溶液混和只产生一种沉淀.D____________,离子方程式___________________.(5)E的水溶液的PH值大于7,与D溶液混和产生白色沉淀和气体.E____________,离子方程式___________________.23.下图分别表示向I中的溶液逐渐加入(或通入)Ⅱ中的试剂的物质的量(横坐标)与产生沉淀的量(纵坐标)之间的关系.Ⅰ溶液:A饱和和石灰水B 氯化铝溶液C 偏铝酸钠溶液D 酸化的氯化铝.氯化镁溶液E 氢氧化钠溶液Ⅱ溶液:a氢氧化钠溶液 b稀盐酸 c氨水 d二氧化碳 e氯化铝溶液试将图号对应的溶液标号填入下表(注意:答案不能重复)图号(1)(2)(3)(4)(5)答Ⅰ案Ⅱ24.准确称取6g铝土矿样品(含Al2O3.Fe2O3.SiO2)放入盛有100mL某浓度的硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生的沉淀的质量m与加入NaOH溶液的体积V的关系如右图所示.请填空回答:(1)H2SO4溶液的物质的量浓度为_________.(2)若a=2.3mL,用于沉淀Fe3+消耗NaOH溶液的体积是________mL.铝土矿各组成成分的质量分数:Al2O3%________,Fe2O3%________,SiO2%_________.(3)a值的范围应是__________,在这个范围内,a值越大,______含量越小.(三)计算25.有一块金属钠投入到盛有100毫升氯化镁和氯化铝的混合注溶液的烧杯中,发现烧杯中沉淀先多后少,反应完毕后收集到标准状况下的氢气13.44升,同时得到21.4克沉淀,将些沉淀溶于过量苛性钠溶液中,发现沉淀减轻了15.6克.求原混合溶液中Mg2+.Al3+及Cl—的物质的量浓度参考答案(一)1.B 2.C 3.B 4.C 5.C 6.A 7.D 8.A 9.C 10.D 11.C 12.B.C 13.A.D 14.A 15.C 16.D 17.C.D 18.C 19.C 20.D(二)21.Al3+,AlO2—,Al3+,AlO2—,Al3++3AlO2—+6H2O==4Al(OH)3↓22.(1)A:Al(OH)3 Al3++3NH3·H2O===Al(OH)3↓+3NH4+(2)B:MgCO3 MgCO3+2H+===Mg2++CO2↑+H2O(3)C:NaAlO2 2AlO2—+CO2+3H2O==2Al(OH)3↓+3CO32—(4)D:AlCl3 Al3++3AlO2—+6H2O==4Al(OH)3↓(5)E:Na2CO3 3CO32—+2Al3++3H2O==2Al(OH)3↓+3CO2↑23.DCBEAabceD24.(1)1.75mol/L (2)2.7,85%,12%,3% (3)1.625<a<5, Fe2O3 25.C(Al3+)=3mol/L C(Mg2+)=1mol/L C(Cl—)=11mol/L。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
