默写铜元素名称、符号及序号
铜

铜是一种过渡元素,化学符号Cu,英文copper,原子序数29。
纯铜是柔软的金属,表面刚切开时为红橙色带金属光泽,单质呈紫红色。
延展性好,导热性和导电性高,因此在电缆和电气、电子元件是最常用的材料,也可用作建筑材料,可以组成众多种合金。
铜合金机械性能优异,电阻率很低,其中最重要的数青铜和黄铜。
此外,铜也是耐用的金属,可以多次回收而无损其机械性能。
二价铜盐是最常见的铜化合物,常呈蓝色或绿色,是蓝铜矿和绿松石等矿物颜色的来源,历史上曾广泛用作颜料。
铜质建筑结构受腐蚀后会产生铜绿(碱式碳酸铜)。
装饰艺术主要使用金属铜和含铜的颜料。
铜是人类最早使用的金属之一。
早在史前时代,人们就开始采掘露天铜矿,并用获取的铜制造武器、式具和其他器皿,铜的使用对早期人类文明的进步影响深远。
铜是一种存在于地壳和海洋中的金属。
铜在地壳中的含量约为0.01%,在个别铜矿床中,铜的含量可以达到3%~5%。
自然界中的铜,多数以化合物即铜矿石存在。
铜的活动性较弱,铁单质与硫酸铜反应可以置换出铜单质。
铜单质不溶于非氧化性酸。
铜是与人类关系非常密切的有色金属,被广泛地应用于电气、轻工、机械制造、建筑工业、国防工业等领域,在中国有色金属材料的消费中仅次于铝。
铜是一种红色金属,同时也是一种绿色金属。
说它是绿色金属,主要是因为它熔点较低,容易再熔化、再冶炼,因而回收利用相当地便宜。
古代主要用于器皿、艺术品及武器铸造,比较有名的器皿及艺术品如司母戊鼎、四羊方尊。
电器和电子市场电器和电子市场约占总数的28%。
1997年,这两个市场成为铜消耗的第二大终端用户,拥有25%的市场份额。
在许多电器产品中,(例如:电线、母线、变压器绕组、重型马达、电话线和电话电缆)铜的使用寿命都相当地长,只有经过20到50年以后,里面的铜才可以进行回收利用。
其他含铜的电器和电子产品(比如:小型电器和消费电子产品)使用寿命则比较短,一般是5-10年。
商业性电子产品和大型电器产品通常要回收的,因为它们除含有铜以外,还有其他珍贵的金属。
初中化学元素默写资料

初中化学元素默写资料元素氢(H):元素氢是化学元素中最简单的一种,原子数为1,原子序数为1,属于非金属元素。
氢气是一种无色、无味、无毒的气体,在自然界中以分子的形式存在。
氢气具有极强的可燃性,可以与氧气反应产生水,并释放大量的能量。
氢气也是一种重要的工业原料,在合成氨、石油加工、化学品制备等过程中广泛使用。
元素氧(O):元素氧是化学元素中最常见的一种,原子数为8,原子序数为16,属于非金属元素。
氧气是一种无色、无味、无毒的气体,在大气中占据约21%的体积比例。
氧气是人类呼吸和维持生命所必需的气体,也是许多燃烧反应和氧化反应的必需品。
此外,氧气还被广泛应用于氧焊、氧割等工业生产中。
元素碳(C):元素碳是化学元素中非常重要的一种,原子数为6,原子序数为12,属于非金属元素。
碳是生命的基础,所有有机物都是由碳元素组成的。
除了在生物体中存在,碳也广泛存在于地壳、化石燃料中。
在工业生产中,碳被用于制造钢铁、合成化学品以及生产人造纤维等。
元素氮(N):元素氮是化学元素中很重要的一种,原子数为7,原子序数为14,属于非金属元素。
氮气是一种无色、无味、非常稳定的气体,在大气中占据约78%的体积比例。
氮气主要被用于工业生产中的氮气干燥、氮气保护、氮气吹扫等过程。
元素铁(Fe):元素铁是化学元素中重要的一种,原子数为26,原子序数为56,属于过渡金属元素。
铁是地壳中含量最多的元素之一,也是人类使用最早的金属之一、铁能与氧反应形成氧化铁,常见的就是赤铁矿和磁铁矿。
铁被广泛应用于制造钢铁、铁器具等。
元素铜(Cu):元素铜是化学元素中一种重要的金属,原子数为29,原子序数为63,属于过渡金属元素。
铜具有良好的导电性和导热性,广泛应用于电子、电器、制铜合金等领域。
常用的铜合金有黄铜、青铜等。
元素氦(He):元素氦是化学元素中一种惰性气体,原子数为2,原子序数为2,属于稀有气体元素。
氦气是一种无色、无味、无毒的气体,具有很低的沸点和很低的密度。
铜元素

晶
理
密度: 8920kg/m^sup3;
体
性
比 热/J/gK :0.38
结
质
蒸发热/KJ/mol : 300.3 熔化热/KJ/mol: 13.05
构
导电率/106/cm :0.596 导热系数/W/cmK:4.01
化 学 性 质ຫໍສະໝຸດ 丰 度 滞留时间/年: 3000
地
太阳(相对于 H=1×1012):1.15 × 104
元素 铜
名称
元素符号 英文名称
Cu Copper
原子 29
序数
相对原子量 (12C = 12)
原子半径(计算值)/pm: 135(145) 原
原子体积/cm3/mol: 7.1 子
共价半径/Å: 1.17 结
电子构型: [Ar]3d104s1 构
离子半径/Å: 0.73 氧化态: 2,1
电子 模型
63.546
古代就已经知道。 发
现
纯铜很少存在于自然界,通常存
用途很广泛,用于合金,电线,
在的矿物有:蓝铜矿、孔雀石、
塑像,硬币的铸造,等等。
来
斑铜矿,硫化物矿有:黄铜矿 用
源
(CuFeS2)、coveline (CuS)和辉 途
铜矿(Cu2S), 氧化物矿有:赤铜
矿(Cu2O)。
状态:红橙色过渡金属。
物
熔 点(℃):1084.4 沸 点(℃): 2567
质
海水中/p.p.m.
数
地壳/p.p.m.: 50 大西洋表面:8.0 × 10-5 太平洋表面:8.0 ×
据
10-5
大气/p.p.m.(体积): 大西洋深处: 12 × 10-5 太平洋深处:28 × 10-5
金属铜化学式

金属铜化学式
金属铜化学式:Cu 。
铜是一种金属元素,也是一种过渡元素,化学符号Cu,英文copper,原子序数29。
纯铜是柔软的金属,表面刚切开时为红橙色带金属光泽,单质呈紫红色。
延展性好,导热性和导电性高,因此在电缆和电气、电子元件是最常用的材料,也可用作建筑材料,可以组成众多种合金。
铜合金机械性能优异,电阻率很低,其中最重要的数青铜和黄铜。
此外,铜也是耐用的金属,可以多次回收而无损其机械性能。
物理性质
纯铜是外观呈玫瑰红色、有光泽、有延展性、无气味的金属,表面氧化时呈紫红色,常温下为固体,其密度为8.89 g/cm³
(20 ℃),熔点为1083 ℃,具有优良的导电性、导热性、耐腐蚀性。
延展性好,可进行各种冷、热加工。
液态的铜密度为7.81 g/cm³(1200 ℃),并且液态铜能够吸收H₂、O₂、SO₂、CO ₂、CO等气体。
化学性质
铜在常温、干燥的空气中不发生变化,温度高于185 ℃时开始氧化,350 ℃以下生成红色的氧化亚铜,350-1500 ℃生成黑色氧化铜。
铜在潮湿的空气中会生成铜绿(CuCO₃·Cu(OH)₂)。
铜不与单独的盐酸、稀硫酸反应,能与硝酸、浓硫酸等氧化性的酸反应生成相应的铜盐和水。
铜红热状态与氨气反应生成氮化物。
在碳酸盐参与的条件下,铜能与氨水反应生成配盐。
铜
治疗
急性中毒:反复洗胃,服用牛奶、蛋清保护胃黏膜, 急性中毒:反复洗胃,服用牛奶、蛋清保护胃黏膜, 输液保护肝、 输液保护肝、肾 慢性中毒:服用铜螯合剂 慢性中毒: 可的松加速肾对铜的清除 白蛋白加速腹膜透析疗法---可使体内 白蛋白加速腹膜透析疗法 可使体内 铜排除量增加10倍 铜排除量增加 倍。
典型事例
葡萄园喷洒工长期接触农药—波尔多液(硫酸铜) 葡萄园喷洒工长期接触农药 波尔多液(硫酸铜) 波尔多液 导致肺和肝组织铜含量明显高于普通人。 导致肺和肝组织铜含量明显高于普通人。 -------职业性中毒 职业性中毒 印度曾发生大面积的儿童肝硬化 联合国专家组调查发现:儿童摄铜过量( 联合国专家组调查发现:儿童摄铜过量(喜用铜 器烹调食物)。 器烹调食物)。
缺铜
多铜
含铜食物
与铜有关的药物
1、硫酸铜 收敛、消毒药、 收敛、消毒药、催吐作用 用于沙眼、结膜炎、创面腐蚀、 用于沙眼、结膜炎、创面腐蚀、P中毒催吐 2、铜末散 主要成分铜屑 筋骨折伤、外伤出血等 筋骨折伤、 3、碧霞丹 主要成分 铜绿
祛痰、 中医 祛痰、镇惊
铜(Cu) Cu)
是血、 是血、肝、脑铜蓝蛋白的组成部分; 脑铜蓝蛋白的组成部分;
功能
是几种重要酶的活性成分; 是几种重要酶的活性成分; 参与造血, 参与造血,影响铁的代谢 杀菌…… 杀菌 引起贫血; 引起贫血; 毛发色素丧失; 毛发色素丧失; 生长速度减缓、智力发育不全; 生长速度减缓、智力发育不全; 精神状态紊乱; 精神状态紊乱; 能影响到头发、骨骼、大脑、心脏、肝脏、 能影响到头发、骨骼、大脑、心脏、肝脏、中枢神经和免疫 系统的功能; 系统的功能; 会导致血浆胆固醇升高,增加动脉粥样硬化的危险; 会导致血浆胆固醇升高,增加动脉粥样硬化的危险; 营养性贫血、白癜风、骨质松脆症、 营养性贫血、白癜风、骨质松脆症、胃癌及食道癌等疾病的 产生也都与人体的缺铜有关。 产生也都与人体的缺铜有关。 …… 引起肝炎,小脑运动失常 引起肝炎,小脑运动失常…… 动物肝、干果、豆类、牡蛎、水果、蔬菜 动物肝、干果、豆类、牡蛎、水果、蔬菜……
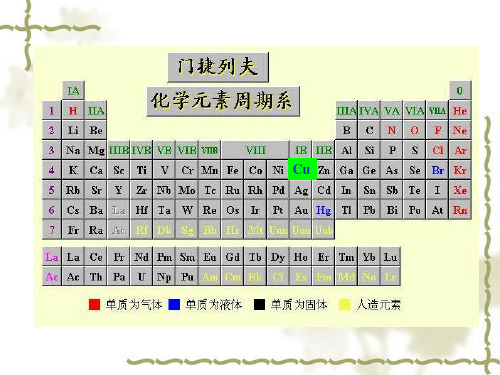
铜元素在元素周期表中的位置

铜元素在元素周期表中的位置1、铜在周期表的位置:第四周期、第IB族。
2、铜是一种过渡元素,化学符号Cu,英文copper,原子序数29。
纯铜是柔软的金属,表面刚切开时为红橙色带金属光泽,单质呈紫红色。
延展性好,导热性和导电性高。
3、铜是一种存在于地壳和海洋中的金属。
铜在地壳中的含量约为0.01%,在个别铜矿床中,铜的含量可以达到3%~5%。
自然界中的铜,多数以化合物即铜矿石存在。
铜的活动性较弱,铁单质与硫酸铜反应可以置换出铜单质。
铜单质不溶于非氧化性酸。
铜是我们非常熟悉的元素,青铜器时代使用的各种农具、兵器、礼器都含有铜元素。
人们用铜和铜合金制造出了无数的文明载体,如司母戊鼎、四羊方尊等。
人类使用铜及其合金已有数千年历史,即使后来进入铁器时代,铜仍然是使用较为广泛的一种金属。
纯铜是一种柔软的金属,表面刚切开时为红橙色带金属光泽,延展性、导热、导电性能都很好。
因为铜的化学性质较稳定,不与非氧化性酸发生反应,所以非常容易回收再利用,也无损它的机械性能,因此垃圾分类千万别把它随便扔了,它属于废品回收站的主打回收产品,也被称为绿色金属(对环境没有害处的金属)。
在交通、化工、国防、建筑等领域,铜元素都是不可或缺的。
不过有一种溶液需要我们小心对待:将美丽迷人的蓝色硫酸铜溶液混合一定量石灰和水,就形成了天蓝色胶状悬浊液,它有一个好听的名字叫做“波尔多液”,是一种无机铜素杀菌剂,1882年由法国植物学教授米拉德在波尔多城发现。
他发现用这种溶液或者混合干粉喷洒过的葡萄树,不会发生霉叶病。
于是这一发现最终使波尔多地区成为了全世界有名的“葡萄园世界”,“波尔多液”也一炮走红。
但这种杀菌剂对人算不上友好,最初农场主们为了防止路人偷吃才洒上去的。
这种低毒性和广谱的抗菌性能,使其成为历史上应用最长的一种杀菌剂。
在科研舞台上,人们发现了铜在生物体中重要且性命攸关的功能,那就是铜能完成以下三种不同的化学过程:路易斯酸催化、单电子转移和双电子转移反应。
铜元素化学用语

铜元素化学用语铜元素是一种常见的金属元素,在化学和工业领域中有着广泛的应用。
下面将详细介绍铜元素的化学用语。
一、铜元素的符号铜元素的化学符号是Cu。
这个符号来源于拉丁词“Cuprum”,这是铜的拉丁名。
在化学元素表中,铜位于周期表中的第四周期,属于过渡金属中的一种。
二、铜元素的原子结构铜原子具有29个核外电子,其原子结构中的电子排布遵循能量最低原理和泡利不相容原理。
电子排布式为1s2 2s2 2p6 3s2 3p6 3d10 4s1。
在这个电子排布式中,最后一个电子位于4s轨道上,这使得铜原子具有较高的化学活性。
三、铜的离子化学式铜元素可以形成多种离子,其中最常见的是+1和+2价离子。
铜离子的化学式分别是Cu+和Cu2+。
这些离子在化学反应中起着重要的作用,可以与其他元素形成化合物。
四、铜的化合物铜元素可以与多种元素形成化合物,其中一些常见的化合物包括:1.氧化铜(CuO):这是一种黑色固体,具有较高的化学稳定性。
氧化铜常用于制备铜盐和其他化合物。
2.硫酸铜(CuSO4):这是一种蓝色晶体,通常用于制备其他铜化合物、电镀和杀菌剂等。
3.氯化铜(CuCl2):这是一种绿色晶体,常用于制备其他铜化合物、电镀和颜料等。
4.氢氧化铜(Cu(OH)2):这是一种蓝色固体,具有较高的化学稳定性。
氢氧化铜常用于制备其他铜化合物和电镀等。
除了以上常见的化合物外,铜元素还可以与其他元素形成多种化合物,如碳酸铜、醋酸铜、草酸铜等。
这些化合物在化学研究和工业生产中都有广泛的应用。
五、铜的配位化学铜元素具有较高的配位能力,可以与多种配体形成配合物。
这些配合物在化学反应中起着重要的作用,可以用于制备新的化合物和材料。
常见的铜配合物包括:1.硫酸铜配合物:硫酸铜可以与多种配体形成配合物,如胺类、氨基酸类等。
这些配合物常用于制备新的材料和催化剂等。
2.氯化铜配合物:氯化铜可以与多种配体形成配合物,如胺类、酚类等。
这些配合物常用于制备新的药物和材料等。
化学1-36号元素符号和名称

一、引言化学是自然科学的一个重要分支,它研究物质的性质、结构、变化以及相关的能量变化。
在化学中,元素是构成物质的基本单位,它们由原子组成,具有特定的化学性质和物理性质。
本文将介绍化学周期表中1-36号元素的符号和名称,希望能够为读者深入了解化学元素提供帮助。
二、1-36号元素符号和名称1. 氢(Hydrogen,H)2. 氦(Helium,He)3. 锂(Lithium,Li)4. 铍(Beryllium,Be)5. 碳(Carbon,C)6. 氮(Nitrogen,N)7. 氧(Oxygen,O)8. 氟(Fluorine,F)9. 氖(Neon,Ne)10. 钠(Sodium,Na)11. 镁(Magnesium,Mg)12. 铝(Aluminium,Al)13. 硅(Silicon,Si)14. 磷(Phosphorus,P)15. 硫(Sulfur,S)16. 氯(Chlorine,Cl)17. 氩(Argon,Ar)18. 钾(Potassium,K)19. 钙(Calcium,Ca)20. 钪(Scandium,Sc)21. 钛(Titanium,Ti)22. 钒(Vanadium,V)23. 铬(Chromium,Cr)24. 锰(Manganese,Mn)25. 铁(Iron,Fe)26. 钴(Cobalt,Co)27. 镍(Nickel,Ni)28. 铜(Copper,Cu)29. 锌(Zinc,Zn)30. 镓(Gallium,Ga)31. 锗(Germanium,Ge)32. 砷(Arsenic,As)33. 硒(Selenium,Se)34. 溴(Bromine,Br)35. 氪(Krypton,Kr)36. 铷(Rubidium,Rb)三、结语本文介绍了化学周期表中1-36号元素的符号和名称,这些元素是构成物质的基本成分,对于我们了解物质的性质和变化具有重要意义。
希望通过本文的介绍,读者能够对这些化学元素有更深入的认识,进一步学习化学知识。
