三液系相图的绘制.
实验2 三组分液—液相图的绘制

实验2 三组分液—液相图的绘制实验目的1熟悉相律,掌握由三角形坐标法表示的三组分系统相图。
2 用溶解度法作出具有一对共轭溶液的正戊醇—醋酸—水系统的相图。
基本原理三组分系统组分数K=3, 当系统处于恒温恒压条件时,根据相律, 系统的条件自由度为:φ-=*3f式中φ为系统的相数。
系统最大条件自由度为213max =-=*f , 因此,浓度变量最多只有两个, 可用平面图表示系统的状态和组成间的关系, 称三组分相图。
通常用等边三角形坐标表示,如图1所示。
等边三角形顶点分别表示纯物质A 、B 、C, AB 、BC 、CA 三条边分别表示A 和B 、B 和C 、C 和A 所组成的二系统组成, 三角形内任何一点都表示三族分系统的组成。
将三角形的每一边分为100等份, 通过三角形内任何一点O 引平行各边直线, 根据几何原理,a+b+c=AB=BC=CA=100%, 因此O 点组成可用a 、b 、c 来表示。
即O 点表示的三个组成的百分组成为B%=b, C%=c, A%=a 。
如果已知三组分中任两个百分组成,只须作两条平行线,其交点就是被测系统的组成点。
在正戊醇—醋酸—水三组分系统中, 正戊醇和水几乎完全不互溶的,而醋酸和正戊醇及醋酸和水都是互溶的, 在正戊醇和水系统中加入醋酸则可促使正戊醇和水的互溶。
由于醋酸在正戊醇层和水层中非等量分配,因此,代表两层浓度的a 、b 点的连线并不一定与底边平行(如图2) 。
设加入的醋酸后系统总组成为c, 平衡共存的两相叫共轭溶液,其组成由通过c 的连线上的a 、b 两点表示 。
图中曲线以下区为两相共存区,其余部分为单相区。
图1 图2 图3 现有一个正戊醇和水的二组分系统,其组成为k 。
于其中逐渐加入醋酸,则系统总组成沿kB 变化(正戊醇和水比例保持不变),在曲线以下区域内则存在互不混溶的两共轭相,将溶液振荡时则出现混浊状态。
继续滴加醋酸直到曲线上的d 点, 系统将由两相区进入单相区,液体将由混浊转为清澈, 继续加醋酸至e 点,液体仍为清澈的单相。
实验一、三组分液-液体系相图的绘制

3.求出反应的半衰期。
21
实验四、最大气泡压力法测定溶 液表面张力
22
【实验目的】
➢测定不同浓度正丁醇溶液的表面张力,考察吸 附量与浓度的关系。
➢了解表面张力、表面自由能的意义以及与溶液 界面吸附的关系。
➢掌握最大气泡压力法测定表面张力的原理和技 术,由Gibbs公式用图解法求算不同浓度溶液 的界面吸附量。
11
【数据记录与处理】 • 记录室温及大气压。
• 设计数据记录表格,并用lgCA对lgCB作图, 由直线的斜率和截距计算出分配系数K,缔 合度n。
12
【注意事项】 • 实验中所用苯对环境有较大污染,废液应
倒入回收瓶中,统一处理。 【思考题】 • 分配系数的影响因素有哪些?
13
实验三、 旋光法测定蔗糖转化反应 的速率常数
10.00
0.80 10.00
20.00
25.00
6
【注意】
– 使用的三角瓶必须事先干燥。 – 当 Nhomakorabea体由浊变清时,须小心,勿使乙醇过量加入。 – 相变点的判断。
【思考题】
– 当体系总组成在曲线内与曲线外时,相数有何不同? 总组成点通过曲线时发生什么变化?
– 用相律说明当温度、压力恒定时,单相区的自由度是 多少?
三组分体系中浓度独立变量最多只有2个。这样就可用 平面图形来表示体系的状态和组成的关系。
– 通常用等边三角形来表示三组分体系中各组分的组成。 三角形的3个顶点分别代表纯组分A、B和C,三条边AB、 BC、CA分别代表A和B、B和C、C和A所组成的二组分 体系的组成,而三角形内任何一点表示三组分体系的 组成。
三元相图的绘制详解

三元相图的绘制详解在材料科学、化学等领域,三元相图是一种非常重要的工具,它能够直观地展示三种组分在不同条件下的相态变化和平衡关系。
三元相图的绘制并非易事,需要对相关的理论知识有深入的理解,并掌握一定的实验技巧和数据处理方法。
下面,就让我们一起来详细了解三元相图的绘制过程。
要绘制三元相图,首先得明确什么是三元相图。
简单来说,三元相图是表示在恒压和恒温下,由三种组分构成的系统中,各相的状态与成分之间关系的图形。
它通常由等边三角形组成,三角形的三个顶点分别代表三种纯组分。
绘制三元相图的第一步是确定研究的体系和实验条件。
这包括选择要研究的三种物质,设定温度、压力等参数。
在确定了体系和实验条件后,接下来就是进行实验获取数据。
实验方法多种多样,常见的有热分析法、金相法、X 射线衍射法等。
以热分析法为例,我们将不同成分的样品加热或冷却,通过测量样品的温度随时间的变化,来确定相变点。
在实验过程中,需要精确控制温度变化的速率,以确保测量结果的准确性。
同时,要对多个不同成分的样品进行测试,以获得足够的数据来绘制相图。
当我们获得了大量的实验数据后,就可以开始着手绘制相图了。
绘制的过程中,需要将实验得到的相变温度和成分数据标注在等边三角形的坐标上。
在标注数据时,要注意坐标的转换和计算。
因为在三元相图中,成分通常用质量分数或摩尔分数来表示,而不是直接用实验中测量得到的数值。
比如说,如果我们知道了三种组分 A、B、C 的质量分数分别为 wA、wB、wC,那么在等边三角形坐标中,对应的坐标点可以通过以下公式计算:对于 A 组分,横坐标 xA = wA /(wA + wB + wC) ×边长对于 B 组分,纵坐标 yB = wB /(wA + wB + wC) ×边长通过这样的计算,我们就可以将实验数据准确地标注在相图上。
标注完数据点后,接下来就是连接这些点,形成相区的边界线。
这需要根据相律和热力学原理来判断。
绘制正己烷-乙醇-水的三组分液系相图

绘制正己烷-乙醇-水的三组分液系相图孟晓燕;胡小燕【摘要】The n-hexane-alcohol-water ternary liquid phase diagram was obtained through the solubility curves of the ternary determined by cloud-piont-titration method.It showed that at room temperature 10.0 ℃, in then-hexane-al-cohol-water ternary liquid phase diagram, at the isothermal consolute D point, the mass fraction of alcohol and n-hex-ane was 73.0% and 14.1%, respectively.Two conjugate ternary solutions were formed inthe binodal solubility curve BDC, and at the system point O, the mass ratio of the two conjugate solutions was mG: mH=|OH|:|OG|.%采用浊点滴定法测定各组分的溶解度曲线,绘制出了正己烷-乙醇-水的三组分液系相图.结果表明,在室温为10.0℃时,正己烷-乙醇-水的三组分液系相图中,等温会溶点D点处,乙醇、正己烷的质量分数分别为73.0%、14.1%;双结点溶解度曲线BDC内,形成了两个共轭的三组分溶液;物系点 O 时,两共轭溶液数量的比值为mG:mH=|OH|:|OG|.【期刊名称】《上饶师范学院学报》【年(卷),期】2016(036)006【总页数】4页(P74-77)【关键词】浊点滴定法;溶解度曲线;正己烷-乙醇-水;三组分液系相图【作者】孟晓燕;胡小燕【作者单位】上饶师范学院化学化工学院,江西上饶 334001;安远县塘村学校,江西赣州 342113【正文语种】中文【中图分类】O625.61在油脂工业中,溶剂浸提是最常用的有效提取油脂的过程。
三相图的绘制(氯化钾、盐酸、水)

Ⅰ、目的要求1.掌握用三角坐标表示三组分相图的方法;2.能正确利用溶解度方法绘制KCl-HCl-H2O三组分系统的相图;3.了解湿固相法的原理,学会确定溶液中纯固相组成点的方法。
Ⅱ、基本原理为了绘制相图就需要通过实验获得平衡时各相间的组成及二相的连接线,即先使体系达到平衡,然后把各相分离,再用化学分析法或物理方法测定达成平衡时各相的组成。
但体系达到平衡的时间,可以相差很大。
对于互溶的液体,一般平衡达到的时间很快;对于溶解度较大,但不生成化合物的水盐体系,也容易达到平衡。
对于一些难溶的盐,则需要相当长的时间,如几个昼夜。
由于结晶过程往往要比溶解过程快得多,所以通常把样品置于较高的温度下,使其较多溶解,然后将其移至温度较低的恒温槽中,使之结晶,加速达到平衡。
另外,摇动、搅拌、加大相界面也能加快各相间的扩散速度,加速达到平衡。
由于在不同温度时的溶解度不同,所以系统所处的温度应该保持不变。
湿固相法的基本原理:在等边三角形相图中凡带有饱和溶液的固相组成点,必定处于饱和溶液组成点和纯固相点的连结线上,测定一组饱和溶液和湿固相(饱和溶液所对应的固相)的组成,它们的连结延长线将交于一点,即纯固相组成点。
本实验是测定在一定温度和压力下,KCl-HCl-H2O三组分体系中各组分的质量百分组成,从而绘制出三组分相图(体系中KCl处于饱和状态,溶解的KCl与KCl固体处于平衡状态)。
由KCl、HCl、H2O组成的三组分体系,在HCl的含量不太高时,HCl完全溶于水而成盐酸溶液,与KCl有共同的负离子Cl-。
所以当饱和的KCl水溶液中加入盐酸时,由于同离子效应使KCl的溶解度降低。
本实验即是研究在不同浓度的盐酸溶液中KCl的溶解度,通过此实验熟悉盐水体系相图的构筑方法和一般性质。
为了分析平衡体系各相的成分,可以采取各相分离方法。
如对于液体可以用分液漏斗来分离。
但是对于固相,分离起来比较困难。
因为固体上总会带有一些母液,很难分离干净,而且有些固相极易风化潮解,不能离开母液而稳定存在。
三液系相图绘制

三液系(三氯甲烷~醋酸~水)相图的绘制薛念华一.实验目的:1.熟悉相律和用三角形坐标表示三组分相图的方法。
2.用溶解度法绘制具有一对共轭溶液的三组分相图。
二.实验原理:在定温定压下,三组分体系的状态和组成之间的关系通常可用等边三角形坐标,如下图所示。
等边三角形三顶点分别表示三个纯物A、B、C。
AB、BC、CA三边分别表示A和B、B和C、C和A所组成的二组分体系的组成。
三角形内任一点则表示三组分体系的组成。
如O点的组成为A%=Cc’,B%=Aa’,C%=Bb’。
具有一对共轭溶液的三组分体系相图,在该三液系中,A和B、A和C完全互溶,而B和C只能有限度的互溶,B和C的浓度在Ba和Cd之间可以完全互溶,介于ad 之间体系分为两层,一层是B在C中的饱和溶液(d点),另一层是C在B中的饱和溶液(a点),这对溶液称为共轭溶液。
曲线abd为溶解度曲线。
曲线外是单相区,曲线内是二相区。
物系点落在两相区内即分成二相,如O点分成组成为E和F的二相,EF 线称为连结线。
绘制溶解度曲线的方法较多。
本实验是先在完全互溶的两个组分(如A和C)以一定的比例混合所成的均相溶液(如图II上的N点)中滴加入组分B,物系点则沿NB 线移动,直至溶液变浑,即为L点,然后加入A,物系点沿LA上升至N’点而变清。
如再滴加B,则物系点又沿N’B移动,当移至L’点时溶液再次变浑。
再滴加A使之变清……。
如此重复,最后连接L,L’,L’’……,即可绘出溶解度曲线。
三.仪器与药品:滴定管(50mL,酸式)×1,滴定管(50mL,碱式)×1,有塞锥形瓶(100mL)×2,有塞锥形瓶(25mL)×4,锥形瓶(100mL)×2,移液管(2mL,胖肚)×4,移液管(5mL,刻度)×2,移液管(10mL,刻度)×1,分液漏斗(60mL)×2,漏斗架×1,氯仿(分析纯),冰醋酸(分析纯),0.5mol/L标准NaOH溶液。
三液系(2)

三液系(三氯甲烷-醋酸-水)相图的绘制姓名:冯妍慧学号20125053021 班级:2012级化工班指导老师:栗印环日期: 成绩:一实验目的1.熟悉相律和三角形坐标表示三组分相图的方法.2.用溶解度法绘制具有一对共轭溶液的三组分相图.二实验原理在定温定压下,三组分体系的状态和组分之间的关系通常可用等边三角形坐标表示,如图所示:等边三角形三顶点分别表示三个纯物A,B,C。
AB,BC,CA三边分别表示A和B,B 和C,C和A所组成的而组分体系的组成。
三组分内任一点则表示三组分体系的组成。
如O点的组成为A%=Cc'、B%=Aa'、c%=Bb'。
具有一对共轭溶液的三组分体系的相图如图6-2所示.该三液系中,A和B 及A和C完全互溶,而B和C部分互溶。
曲线abd为溶解度曲线。
曲线外是单相区,曲线内是两相区。
物系点落在两相区内,即分成两相,如O点分成组成为E 和F的两相,EF线称为连结线。
绘制溶解度曲线方法较多。
本实验是先在完全互溶的两个组分(如A和C)以一定的比例混合所成的均相溶液(如图6-2上的N点)中滴加入组分B,物系点则沿NB线移动,直至溶液变浑,即为L点。
然后加入A,物系点沿LA上升至N’点而变清。
如再加入B,则物系点又沿N’B由N’点移至L’点而再次变浑。
再滴加A使变清......。
如此反复,最后连接L,L’,L’’......,即可绘出其溶解度曲线。
三仪器与试剂1.仪器滴定管(50ml,酸式) 1支移液管(2ml,胖肚) 4支滴定管(50ml,碱式) 1支移液管(5ml,刻度) 2支有塞锥形瓶(100ml) 2只移液管(10ml,刻度) 1支有塞锥形瓶(25ml) 4只分液漏斗(60ml) 2只锥形瓶(100ml) 2只漏斗架 1只2.药品氯仿(分析纯),冰醋酸(分析纯),0.5M标准NaOH溶液四实验步骤在碱式滴定管滴定管内装满水移取6ml氯仿及1ml醋酸于干燥的100ml磨口锥形瓶中,然后慢慢滴入水,切不停的振摇,至溶液由清变浑,即为终点,记录水的体积。
三元体系相图的绘制
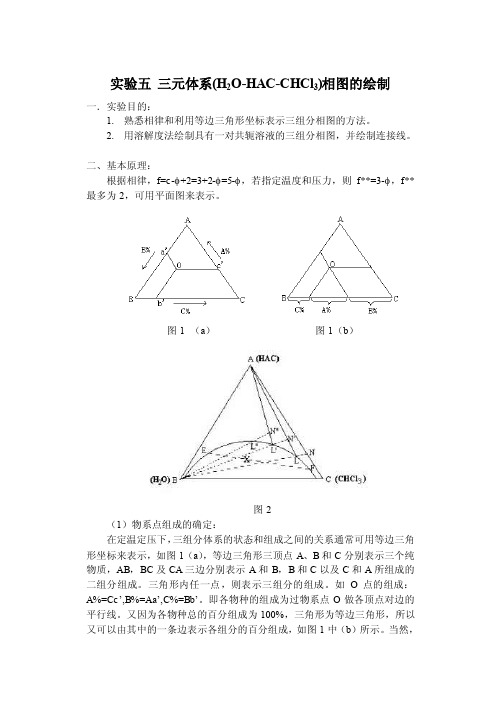
实验五三元体系(H2O-HAC-CHCl3)相图的绘制一.实验目的:1.熟悉相律和利用等边三角形坐标表示三组分相图的方法。
2.用溶解度法绘制具有一对共轭溶液的三组分相图,并绘制连接线。
二、基本原理:根据相律,f=c-φ+2=3+2-φ=5-φ,若指定温度和压力,则f**=3-φ,f**最多为2,可用平面图来表示。
图1 (a)图1(b)图2(1)物系点组成的确定:在定温定压下,三组分体系的状态和组成之间的关系通常可用等边三角形坐标来表示,如图1(a),等边三角形三顶点A、B和C分别表示三个纯物质,AB,BC及CA三边分别表示A和B,B和C以及C和A所组成的二组分组成。
三角形内任一点,则表示三组分的组成。
如O点的组成:A%=Cc’,B%=Aa’,C%=Bb’。
即各物种的组成为过物系点O做各顶点对边的平行线。
又因为各物种总的百分组成为100%,三角形为等边三角形,所以又可以由其中的一条边表示各组分的百分组成,如图1中(b)所示。
当然,给出一定组成的溶液百分比,按照上述表示方法,也应该能找出对应的物系点。
(2)溶解度曲线的绘制对于具有一对共轭溶液的三液系相图,如图2,该三液系相图中A和B,A和C为完全互溶而B和C为部分互溶,曲线abc为溶解度曲线。
曲线上方为单相区,曲线下方为二相区,物系点落在二相区内,即分为二相,如X 点则分成组成为E和F的二相,而EF线称为连接线。
对于溶解度曲线的绘制,本实验是先以完全互溶的两个组分(如A和C),以一定的比例混合所组成的均相溶液,如图2上的N点,滴加入组分B,根据平衡相图的直线规则,物系点则沿着NB移动,直至溶液变混,即为L点。
再加入A,物系点由LA上升至N’点而变清。
再加入B,此时物系点又沿着N’B由N’移动至L’而再次变混,再滴加A使变清……,如此反复,最后连接L,L’,L’’……即可画出溶解度曲线。
(3)连接线的绘制由于连接线是表示在两相区内呈平衡两相的组成(或A在两相中的分配),所以可以在两相区内配制溶液,待平衡后分析每相中的任何一种组成的含量,连接在溶解度曲线上该两含量的组成点而得出。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验三氯甲烷—醋酸—水三液系相图的绘制
一.实验目的
1.掌握用三角坐标表示三组分相图的方法;
2.用溶解度法绘制具有一对共轭溶液的三组分相图。
二.实验原理
为了绘制相图就需要通过实验获得平衡时各相间的组成及二相的连接线,即先使体系达到平衡,然后把各相分离,再用化学分析法或者物理方法确定达成平衡时各相的组成。
但体系达到平衡的时间,可以相差很大。
对于互溶的液体,一般平衡达到的时间很快;对于溶解度较大但不生成化合物的水盐体系,也容易达到平衡。
对于一些难溶的盐,则需要相当长的时间,如几个昼夜。
由于结晶过程往往要比溶解过程快得多,所以通常把样品置于较高的温度下,使其溶解较多,然后将其移至温度较低的恒温槽中,使之结晶,加速达到平衡,另外,摇动、搅拌、加大相界面也能加快各相间的扩散速度,加速达到平衡。
水和氯仿的相互溶解度很小,而醋酸却与水、氯仿互溶。
在水和氯仿组成的两相混合物中加入醋酸,能增大水和氯仿间的互溶度,醋酸增多,互溶度越大,当加入醋酸到某一数量时,水和氯仿能完全互溶,原来由两相组成的混合体系由混变清。
在温度恒定的情况下,使两相体系变成均匀的混合物所需要的醋酸量,取决于原来混合物中水和氯仿的比例。
同样,把水加到醋酸和氯仿的均相混合物中时,当水达到一定数量,原来的均相体系变成水相和氯仿相的两相混合体系,体系由清变混。
使体系变成两相所需要的水量,取决于醋酸和氯仿的起始成分。
因此利用体系在相变化时的浑浊和清亮现象的出现。
可以判断体系中各组分间互溶度的大小。
一般由清到浊,肉眼比较容易分辨。
所以实验由均相样品中加入第三物质使变成二相的方法,测定两相间的相互溶解度。
当二相共存并达到平衡时,将二相分离,测得二相的成分,然后用直线连接这二点,即得连接线。
用等边三角形的方法表示三元相图。
等边三角形的三个定点各代表纯组分,三角形三条边AB、BC和CA分别代表A和B,B和C,C和A所组成的二组分的组成,而三角形内任意一点表示三组分的组成。
如上图。
经过P点作平行于三边的直线,并交于三边于a,b,c三点。
若将三边均匀分成100等分,则P点的A、B、C组成分别为:
A%=Cb B%=AC C%=Ba
对共轭的三组分体系,即三组分中二对液体AB及AC完全互溶,而另一对BC不互溶或部分互溶的相图,如上所示。
图中DEFHIJKL是互溶度曲线,EI和DJ是连接线。
互溶度曲线下是两相区,上面是一相区。
绘制溶解度曲线的方法有许多种,本实验采用的方法是:将将完全互溶的两组分(如氯仿和醋酸)按照一定的比例配制成均相溶液(图中N点),再向清亮溶液中滴加另一组分(如水),则系统点沿BN线移动,到K点时系统由清变浑。
再往体系里加入醋酸,系统点则沿AK上升至N’点而变清亮。
再加入水,系统点又沿BN’由N’点移至J点而再次变浑,再滴加醋酸使之变清……如此往复,最后连接K、J、I……即可得到互溶度曲线。
三.仪器与药品
滴定管(50ml、酸式)1支滴定管(50ml、碱式)1支
磨口锥形瓶(100ml)2只磨口锥形瓶(25ml)4只
锥形瓶(200ml)2只移液管(2ml)2支
移液管(5ml)2支移液管(10ml)2支
氯仿(A.R)冰醋酸(A.R)0.5mol/dm-3左右NaOH 酚酞指示剂
四.实验步骤
1.将磨口锥形瓶洗净,烘干。
2.在洁净的酸式滴定管中装入蒸馏水。
3.移取6ml氯仿、1ml醋酸于干燥洁净的100ml磨口锥形瓶中(标记1号),混合均匀。
然后慢慢滴入水,边滴边摇动,直至溶液由清亮变浑,即为终点,记录水的体积。
再向体系中加入2ml醋酸,系统又成均相,继续用水滴定,使体系再次由清变浑,分别记录此时系统中氯仿、醋酸及水的总毫升数。
然后依次加入3.5ml、6.5ml醋酸,同上方法用水滴定,
并记录体系中各组分的含量。
最后加入40ml的水,盖紧瓶塞,每隔5min振摇一次,约30min 后将此溶液作测量连接线使用。
4.取另一100ml磨口锥形瓶(标记2号),移入1ml氯仿和3ml醋酸,用水滴定至终点。
然后再依次添加2ml、5ml、6ml醋酸,分别用水滴定至终点。
记录各次各组分的用量。
最后加入9ml氯仿和5ml醋酸,混合均匀,每隔5min振摇一次,约30min后作为测量另一根连接线使用。
5.将2只25ml磨口锥形瓶称重,待用。
将溶液1和溶液2静置,待溶液分层后,用干燥洁净的移液管吸取溶液1上层2ml,下层2ml,分别放入已经称重的25ml磨口锥形瓶中,再称其重量。
然后用水洗入200ml锥形瓶中,滴入酚酞,用已知浓度的NaOH溶液滴定,以测定其中醋酸含量。
6.同步骤5,移取溶液2上层液2ml和下层液2ml,称重并滴定。
五.实验注意事项
1.体系组分之一是水,所用锥形瓶和移液管都需干燥。
2.滴定时要一滴一滴加入,特别是醋酸含量比较少时(1号溶液),更应特别注意(第一点所需水的体积很小),并不断振摇。
在醋酸含量比较多时(溶液2),开始时可以滴得快一点,接近终点时要慢慢滴定,因为这时溶液已经接近饱和,溶解平衡需要较长时间,因此更要多加振荡。
由于分散的“油珠”颗粒能散射光线,所以只要体系出现浑浊并在2、3min 内不消失,即可认为已达到终点。
3.溶液1开始滴定时要一滴加入,整个过程终点都比较明显;溶液2开始滴定时可以适当放快,但是滴定终点的判断一定要小心分辨,通常可拿一瓶水进行观察对比。
最后1、点(低温时最后2点)比较难以辨别。
4.采用酸式滴定管时注意手指应该将活塞往左推,注意不要用手心挤活塞,以防滴定过程中活塞漏水。
六.数据记录与处理
1.记录(表1、表2)
2.溶解度曲线的绘制
根据表一数据,在三角坐标纸上,绘制各次滴定的组成点,然后用曲线板拟合成一条光滑曲线,即为水-氯仿在醋酸存在情况下的互溶度曲线。
其中在BC边上的相点为实验温度、压力条件下,水在氯仿或氯仿在水中的溶解度。
3.连接线的绘制
(1)计算瓶1、2中最后的氯仿、醋酸和水的含量,在三角相图中绘制相应的物系点O1、O2。
(2)由所取各相当重量及滴定用NaOH的体积,计算醋酸在各相中的百分数,并将点画在互溶度曲线上。
描述水层内(上)的醋酸含量画在含水成分多的一边;描述氯仿层(下)内醋酸含量的点画在含氯仿成分多的一边。
(3)连接(2)所得的两个平衡液层的组成点,即为连接线,该连接线应该通过由(1)所得的系统物系点。
七.讨论
1.滴定过程中若不小心超过终点,可以再滴加几滴醋酸(记录加入量),至刚由浑变清作为终点,记录实际各组分的用量。
无需返工。
2.不同温度时各物质的密度:
32639()10()10()10273.2T s s s s s d d T T T T T T T K
αβγ---=+-⨯+-⨯+-⨯=
0.0
0.1
0.2
0.3
0.4
0.5
0.6
0.7
0.8
0.9
1.0
H 2
O C H 3
C O O H CHCl 3
三元液系相图(压力101.45Kpa 、温度:13.7℃)
温度
表1压力
5
6
3.氯仿与水的互溶度
4.本实验受温度的影响,醋酸在低温时容易凝固,影响操作;但是温度高时,氯仿在水中的溶解度随着温度的升高而降低,则在实验温度高时,由于共轭区域变小,使得溶液2在滴定操作判断滴定终点越难。
如下图:组成为N的醋酸和氯仿混合溶液,加水由清变浑到I点,再加醋酸变清亮到I’,但是无论加多少水,体系已经进入单相区,也不可能变浑。
改变方法:改变三组分体系为水—乙醇-氯仿体系,能让溶液2滴定终点明显;溶解度曲线的左半支改为将醋酸和水溶液中滴加氯仿,初始组成水多、醋酸少。
但缺点是氯仿易于挥发。
八.思考
1.实验所得的连接线未通过物系点,原因主要是溶液振荡分层平衡不够,多振荡,让醋酸水溶液与醋酸氯仿溶液充分分层。
2.若用水饱和的氯仿或含水的醋酸也可以作此实验,等边三角形的三条边均可。
水饱和的氯仿,左半支滴加醋酸,溶液由浑变清,然后滴加氯仿,溶液由清变浑……;而右半支醋酸置清,然后滴加水变清……。
若为含水的醋酸溶液,则滴加氯仿使溶液由清变浑,然后加入醋酸,溶液变清亮……
3.具有一对共轭溶液的三组分体系的相图对确对各区的萃取条件极为重要:(如图)将组成为N的混合溶液加入B后,体系沿NB线向B方向变化,当总组成为O点时,此时体系为两相x1,y1。
如果把这两层溶液分开,分别除去B,得由S、F点代表的两个溶液(S在Bx的反向延长线上,F在By的反向延长线上)。
这就是说经过一次萃取除去溶剂后,能把原来组成为N的原溶液分成S和F两个溶液,其中S含C较多、F含A较多。
如果对浓度为x的溶液再加入溶剂B进行第二次萃取,此时物系点将沿xS向S方向变化,设
达到o’点时,体系为两相,组成为x’和y’点。
除去x’和y’点中的溶剂B,到S’和F’点,其中S’中C的含量比S高、F’中A的含量比F的高。
如此反复多次,最终可以得到纯A和C。
萃取过程示意图。
