最新化学竞赛辅导.ppt
高中化学竞赛辅导全套课件

化学基础知识回顾
原子结构
化学反应速率与化学平衡
包括原子核、电子排布、量子数等基 本概念。
涵盖速率概念、速率方程、平衡常数 等基本知识。
分子结构
涉及分子极性、化学键、分子间作用 力等知识点。
重点概念解析与拓展
氧化还原反应
从电子转移角度深入剖析氧化还原反应的本质。
离子反应与离子方程式
重点掌握离子反应的条件、离子方程式的书写技巧。
实验设计与实施方案展示
实验目的与原理
明确实验的目的和原理,理解实 验的设计思路和科学依据。
实验步骤与操作
详细介绍实验的步骤和操作方法, 包括实验器材的准备、实验操作的 具体步骤、实验数据的记录等。
实验结果与结论
展示实验结果,对实验结果进行分 析和讨论,得出相应的结论。
实验结果分析与讨论
实验误差分析
电离平衡与水解平衡
对电离平衡常数、水解平衡常数进行深入探讨。
常见问题解答与注意事项
01
02
03
化学计量问题
涉及物质的量、摩尔质量 、气体摩尔体积等计量概 念及计算方法。
有机化学基础
简要介绍有机物的通性、 烷烃、烯烃、炔烃等基本 概念及性质。
实验操作规范
强调实验操作规范性,如 试剂取用、仪器使用、实 验安全等注意事项。
高中化学竞赛辅导全套课件
汇报人: 202X-12-22
• 竞赛概述与准备 • 基础知识梳理与巩固 • 实验技能培养与实践操作指导 • 解题方法与技巧提升训练 • 心理素质培养与应对策略指导 • 模拟试题与答案解析
01
竞赛概述与准备
竞赛背景与目的
化学竞赛背景
高中化学竞赛是一项由学校或地区组织、学生自愿参加的课外竞赛活动,旨在 提高学生对化学知识的掌握和应用能力,培养其创新思维和实践能力。
高中化学无机化学竞赛辅导课件.ppt
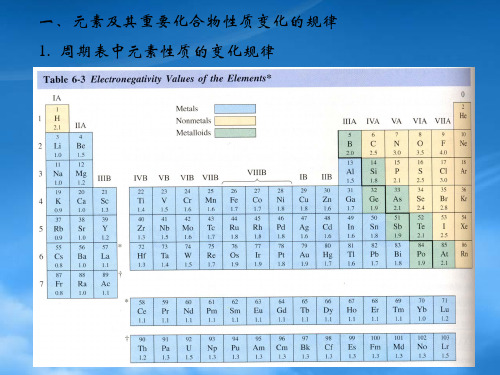
• d区元素的化合物
• 离子极化对ds区元素化合物性质的影响
•
颜色
•
溶解
•
HgF2 HgCl2 HgBr2 HgI2 水解性质
• Hg2+ 与卤素及拟卤离子形成的配合物 HgX42-
• HgNH2X
4) 常见配位化合物及配位数 Cu(I) Cu(NH3)2+ CuCl3- Cu(CN)43Cu(II) 配位数通常为4 CuCl42- Cu(NH3)42+ Cu(CN)42Ag(I) 配位数通常为2 Ag(NH3)2+ Ag(S2O3)23- Ag(CN)2Zn(II) 配位数为4和6 ZnCl42- Zn(NH3)42+ Zn(NH3)62+ Cd(II) 常见配位数为4 Hg(II) 配位数为4 与卤素和类卤离子
• 氢键
•
强弱次序:
F—H ···F > O—H ···O > O—H ···N &g ···Cl > O—H ···S
特点: 是特殊的分子间作用力
具有方向性和饱和性
晶体结构
1. 晶格和点阵、晶胞 晶系:立方 四方 正交 单斜 三斜 三方 六方
2. 金属晶体—堆积 非密置层的堆积:简单立方和体心立方 密堆积:立方密堆—面心立方 六方密堆—六方晶胞 空间利用率及配位数
• 离子晶体 • CsCl 负离子成简单立方堆积,正离子占据立方体间隙。
NaCl 负离子成面心立方堆积,正离子占据八面体体间隙。
ZnS 负离子成面心立方堆积,正离子占据四面体间隙。
• 分子晶体
• 共价晶体
•
金刚石和石墨的结构
• 离子极化 • 离子的极化能力 • 离子的变形性 • 离子极化对键型和晶型的影响
化学竞赛培训元素化学部分第10章f区元素

水体污染
通过地表径流和地下水渗透,f区元素可能进入水体,造成水体污 染。
大气污染
某些f区元素在大气中不易分解,可长时间悬浮,造成大气污染。
使用时的注意事项与安全性
防护措施
使用f区元素时,应穿戴防护服、手套、口罩等防护用品,以减少 与有害物质的直接接触。
1940s
通过核反应和粒子加速 器等手段,科学家成功 合成了一些超重元素, 进一步证实了f区元素的 存在。
制备方法
高能核反应
通过高能核反应合成超重元素,如使用粒子加速 器轰击重元素靶。
放射性衰变
某些长寿命f区元素可以由放射性衰变产生,如铹 元素。
高温高压合成
在极端条件下合成超重元素,如使用激光或离子 束技术。
新材料探索
利用f区元素的特性,探索和开发具有优异性能的新材料, 如超导材料、磁性材料、发光材料等,为科学技术进步做 出贡献。
生命科学研究
某些f区元素(如镧系元素和锕系元素)具有与生物活性相 关的特性,在生物标记、药物设计和生物成像等领域有潜 在应用价值。
日常生活中的应用
1 2
照明和显示技术
利用某些f区元素的发光特性,制造高效、环保 的照明和显示产品,如LED灯具、液晶显示器等。
03 f区元素的化合物
氧化物
定义
f区元素氧化物是指该元素与氧元 素结合形成的化合物。
特性
f区元素氧化物大多数具有较高的 熔点和沸点,因为它们是离子型化 合物,且f区元素的离子半径较小, 使得离子键更加强健。
举例
例如,镧的氧化物La2O3是一种白 色固体,熔点高达2465°C。
氢氧化物
定义
f区元素的氢氧化物是指该元素与 氢和氧结合形成的化合物。
化学竞赛课件

有机反应类型ቤተ መጻሕፍቲ ባይዱ
01
02
03
04
取代反应
有机物分子中的某些原子或基 团被其他原子或基团取代的反
应。
加成反应
有机物分子中不饱和碳原子与 其他原子或基团结合生成新分
子的反应。
消除反应
有机物分子中失去小分子的反 应,如水、醇等。
氧化还原反应
有机物分子中电子转移的反应 ,可以导致有机物的氧化或还
原。
有机合成
能量守恒定律在热现象中的应用,即系统能量的增加等于传入 系统的热量与系统对外界所做的功的和。
揭示了热现象的自发性,即自发过程总是向着熵增加的方向进 行,而不可逆。
绝对零度不能达到原理,即绝对零度只能无限接近,而无法达 到。
动力学
反应速率
反应速率描述了化学反应的快慢程度,通常 用反应速率常数来描述。
化学键
总结词
化学键是分子或晶体中原子或离子间 的相互作用力,是决定物质性质的重 要因素。
详细描述
化学键分为共价键、离子键和金属键 等类型,它们决定了物质的物理和化 学性质,如稳定性、熔点和溶解度等 。
化学反应
总结词
化学反应是分子间的转化过程,涉及到旧化学键的断裂和新化学键的形成。
详细描述
化学反应可以按照不同的标准进行分类,如有机反应、无机反应、氧化还原反 应等。了解反应机理和条件对于理解反应过程和预测产物至关重要。
化学平衡
总结词
化学平衡是指在一定条件下,可逆反应中正逆反应速率相等时,反应物和生成物 浓度不再发生变化的状态。
详细描述
化学平衡是化学反应中重要的概念,可以通过平衡常数来描述。影响平衡的因素 包括温度、压力和反应物浓度等,了解这些因素对于优化化学反应过程具有重要 意义。
高中化学竞赛全套课件(无机化学)

化学——实用的、创造性的中心科学。
无机化学——一个古老的学科。近60多年来飞跃 发展,与其他学科交叉产生许多边缘学科。
无机化学的前沿领域: 配位化学、金属有机化学、 无机材料化学、生物无机化学、超分子化学等。
无机化学课程——高等学校化学化工类专业以及 近化学类专业的第一门重要化学基础课。
无机化学内容: 1. 化学反应基本原理(第1~7章); 2. 物质结构基础理论(第8~11章); 3. 元素化学基本知识(第12~18章)。
9.分子间作用力 范德华力、氢键以及其他分子间作用力的能 量及与物质性质的关系。
10.晶体结构 分子晶体、原子晶体、离子晶体和金属晶体。晶 胞(定义、晶胞参数和原子坐标)及以晶胞为基础的计算。点阵 (晶格)能。配位数。晶体的堆积与填隙模型。常见的晶体结构类 型:NaCl、CsCl、闪锌矿(ZnS)、萤石(CaF2)、金刚石、石墨、 硒、冰、干冰、金红石、二氧化硅、钙钛矿、钾、镁、铜等。
3.溶液 溶液浓度。溶解度。浓度和溶解度的单位与换算。溶 液配制(仪器的选择)。重结晶方法以及溶质/溶剂相对量的估算。 过滤与洗涤(洗涤液选择、洗涤方式选择)。重结晶和洗涤溶剂(包 括混合溶剂)的选择。胶体。分散相和连续相。胶体的形成和破坏。 胶体的分类。胶粒的基本结构。
高中化学竞赛辅导专题 原子中电子的分布41PPT

这这一一规规则则称称为为nn++0.07.7l 规l 规则则。。
从图中可以看出: (1)各电子层能级相对高低为:
K<L<M<N<O<P
(2)同一电子层各亚层能级的相对高低 为: Ens< Enp< End< Enf ……
2s2 3s23p3 3d54s1 5s25p5 5d106s2 5f36d17s2
由于价层上的电子参与化学反应,因此,
价层电子构型与元素性质的关系十分密
切。讨论电子层结构时,主要研究价层
电子构型。 轨道排布式:
15P [Ne] 3s2 3p3
24Cr [Ar] 26Fe [Ar]
3d5 4s1 3d6 4s2
则大能,量则越能高量。越而高且。该而能且级所该在能能级级所组在的能组级数组,的就组是数(,n 就+
0.是7 l()n的+整0.数7 l部)分的。整以数第部七分能。级以组第为七例能进级行组讨为论例进行讨
论 7 7pp ((nn++0.07.7l )l )==7 7++0.07.71 1==7.77.7 6 6dd ((nn++0.07.7l )l )==6 6++0.07.72 2==7.74.4 5 5f f ((nn++0.07.7l )l )==5 5++0.07.73 3==7.71.1 7 7s s ((nn++0.07.7l )l )==7 7++0.07.70 0==7.70.0
初中化学竞赛辅导培训PPT课件(初中科学)

1、物质结构的生长点
(1)原子组成和各微粒间量的关系
(2)1~18号元素原子核外电子排布
(3)元素的化合价应用
例题:若原子核外电子排布的基本规律为最外
层电子数不超过5个,次外层电子数不超过10个,
倒数第三层电子数不超过15个,而各电子层电子
的最大容量仍为2n2,写出并判断第三、四、五
周期的元素分别有
②对于原子: a、质子数=核电核数=核外电子数=原子序数 b、质量数=质子数+中子数;即A=Z+N
赛题举例:(9—6复).我国近年研制成功
一种气体,这种气体的每个分子由质子数为
8、相对原子质量为18的两个原子构成。下
列说法错误的是
()
A.这种气体的相对分子质量为36
B.这种原子的核外不一定有8个电子
均不同;③N2H4是一种化合物;④该反应中 N2O4是还原剂。 则下列选项正确的是 A.①② B.②③ C.①③ D.③④
3、化学反应分类及原理的生长点
(1)氧化还原反应
①判断是否是氧化还原反应 ②判断氧化剂、还原剂等 ③电子转移情况的表示 ④配平问题和得失守恒计算 ⑤氧化性、还原性强弱比较
氧化剂:得到电子(即化合价降低)的反应物 还原剂:失去电子(即化合价升高)的反应物
分
放热反应
热化学方程式
3、化学反应分类及原理的生长点
赛题举例(11—3复)在化学反应aZn+
bHNO3(稀) = cZn(NO3)2+d NO↑+eH2O中, 若e的值为4,则d的值为 ( )
A.1 B. 2 C. 3
D. 4
(11—6初)关于化学反应2N2H4+N2O4= 3N2+4H2O的有关说法: ①该反应属于置换反 应;②该反应中三种含氮物质的氮元素化合价
化学竞赛知识点总结ppt

化学竞赛知识点总结ppt一、元素周期表1. 元素周期表的组成元素周期表由周期和族组成,周期表示元素的电子层次,族表示元素的化学性质。
2. 元素周期表的特点元素周期表中元素的周期数代表电子层次,族数代表元素的化学性质。
元素的周期数越大,原子半径越大,电负性越小。
元素的主族号越大,原子半径越大,电负性越小。
二、化学键1. 化学键的类型化学键包括离子键、共价键、金属键和氢键。
2. 化学键的性质离子键是由阳离子和阴离子相互吸引而形成的,共价键是由原子间的电子共享而形成的,金属键是由金属原子内的自由电子形成的,氢键是由氢原子和电负性较大的原子间的相互作用力形成的。
三、化学反应1. 化学反应的类型化学反应包括合成反应、分解反应、置换反应、双替反应、还原反应、氧化反应等。
2. 化学反应的平衡方程式化学反应的平衡方程式是表示反应物和生成物之间物质的量之间的关系的化学式。
四、化学物质1. 化学物质的分类化学物质可分为元素和化合物两类,元素是由同一类原子组成的物质,化合物是由不同种原子组成的物质。
2. 化学物质的性质化学物质的性质包括物理性质和化学性质,物理性质是指物质自身所固有的性质,如颜色、形状、密度等,化学性质是指物质在化学反应中所表现的性质,如与其他物质发生反应等。
五、酸碱中和反应1. 酸碱中和反应的原理酸碱中和反应是指酸和碱在一定条件下反应生成盐和水的化学反应。
2. 酸碱中和反应的应用酸碱中和反应在生活和工业中有广泛的应用,如制备食盐、制造肥料、调节土壤酸碱度等。
六、化学平衡1. 化学平衡的定义化学平衡是指在一定条件下,反应物和生成物浓度达到一定比例的状态。
2. 化学平衡的影响因素温度、压力、浓度和催化剂是影响化学平衡的因素。
七、化学实验1. 化学实验的安全性化学实验是一项需要谨慎对待的活动,实验者需要注意实验设备的安全性、实验操作的谨慎以及实验环境的卫生等。
2. 化学实验的操作技巧化学实验操作需要掌握一定的实验技巧,如搅拌、加热、滴加等操作。
