有机3(8页)
有机化学第三版答案南开大学出版社第8章

4、按与AgNO3-酒精(SN 1)反应活性顺序排列:
(1) C6H5Br (3) CH3CH2CH2CH2Br CH3 (4) CH3CH2CHCH3 Br (5) Br (6) Br CH2Br
(2)>(1)>(4)>(3)> (6) >(5)
5.比较下列每对反应的速度:
(1) a. CH3CH2CHCH2Br CH3 b. CH3CH2CH2CH2Br + CN+ CN-
CH=CHBr CH2CN
(2)
Br
Cl
BrMg
Cl
Cl (3) CH CH3 CH3
Cl2 hv
C CH3
CH3
(4)
O2N Br
Cl
+
NH3
O2N Br
H Br
NH2
CH3 H CH3 Br H C2H5
≡
Br
H3C
H
CH3
C2H5
H
-
≡
C2H5
H
CH3 CH3
-Br -H2O
CH3 C2H5 CH3
19、有一化合物分子式为C8H10,在铁的存在下与1mol 溴作用,只生成一种化合物A,A在光照下与1mol 氯作用,生成两种产物B和C,试推断A、B、C的结 构: CH
3
CH3
Br2 Fe
Br
Cl2 光照
CH3
CH2Cl B Br
CH3 A
CH3 C Br
CH3
CH2Cl
20、化合物M的分子式为C6H11Cl,M和硝酸银醇精溶液 反应很快出现白色沉淀。M在NaOH水溶液作用下 只得到一种水解产物N,M与KI(丙酮)反应比氯 代环己烷快。试写出M,N的可能结构。
有机化学(第二版)3环烃-文档资料

第三章
第一节
环烃
脂环烃
环丁烷 环戊烷 环己烷
三、环烷烃的结构和稳定性
(二)环烷烃的结构
【例如】 环丙烷
60º 90º 108º 120º 以上环烷烃分子结构中形成的都是弯曲键,其成键电子云 重叠程度小,键的稳定性差,容易开环。 所以当C-C-C 键角约等于109.5º 时,C—Cσ 键是正常的σ 键,此时环系稳定。如环戊烷和环己烷。
H2 C H2C CH2
第三章
第一节
环烃
脂环烃
一、脂环烃的分类和命名
(二)脂环烃的命名
1.单环脂环烃的命名 (1)按照开链烃命名,前面冠以 “环”字,称“环某烷” (2)从特征官能团处编号,并使取代基位次最小 (3)环上含有复杂取代基时,可将脂环作为取代基 【例如】
环丙烷
环戊烷
Hale Waihona Puke 环己烷环辛烷第三章
第三章
第一节
环烃
脂环烃
三、环烷烃的结构和稳定性
(二)环烷烃的结构 为什么脂环烃会表现出上述化学性质?1885年拜尔(J.Baeyer) 提出了张力学说。 张力学说假定:1.烷烃是正四面体结构
2.环的结构是平面的
3. 碳原子是sp3杂化的,键角都109.5º 结论: 与正常键角109.5º 偏差越大,环越不稳定。环有恢复正常键角 的力,这种力称为角张力(又称为拜尔张力)。
第三章
第一节
环烃
脂环烃
一、脂环烃的分类和命名
(二)脂环烃的命名
2.螺环烃的命名
书写顺序: 取代基—几螺—[小.大环碳数]—母体,例如:
H3C
2 3 1 5 4 10 9 6 7
7 1 5 6 3 9 11 10 4 2
《有机化学》第三版 第8章

allyl bromide
有些多卤代烷有其特别的名称,常用俗名或商品名或根据来源命名,例如 CHCl3 称为 氯仿(chloroform) ,CHBr3 称为溴仿(bromoform) ,CHI3 称为碘仿(iodoform) ,CCl4 称为
2
四氯化碳(carbon tetrachloride) 。 2.系统命名法 卤代烃可以看作是烃的衍生物,把卤原子作为取代基,烃作为母体。命名的基本原则与 烃的命名规则相同。对于不饱和卤代烃,编号时,应尽可能使不饱和键的位次最小。双键有 立体构型则还要标出其构型。英文命名时,卤原子用词头 fluoro-、chloro-、bromo-、iodo-表示。 例如:
图 8-3 溴乙烷的 1H-NMR 谱
6
图 8-4 异丙基溴的 1H-NMR 谱 8.3 卤代烃的制备
目前从自然界中发现的天然卤代烃数目很少, 绝大多数卤代烃是通过合成方法得到的。 由于 卤代烃化学性质活泼, 通过化学反应可把卤代烃转化为多种含重要官能团的化合物, 卤代烃 的制备显得非常重要。 8.3.1 饱和碳原子上氢原子的卤代 在光照或高温条件下,烷烃与卤素发生自由基取代反应生成卤代烷(见 4.1 节) ,但烷烃 中几种不同的氢的反应活性相差不大,卤素的反应活性又高(如氯气)的情况下,常常得到 混合物,而且得到的混合产物很难通过化学方法分离,所以一般情况下,通过烷烃的自由基 卤代反应制备卤代烃的意义不大。 但这种自由基取代反应通常用来制备烯丙型和苄基型卤代 烃。工业上,可以通过调节烷烃与卤素的摩尔比和反应条件,来制备一氯甲烷和四氯化碳。 下面这些烃的自由基卤代反应具有较高的选择性,可用于制备卤代烃。
通常把卤素连在双键 α 碳原子上的卤代烃称为烯丙型卤代烃, 卤素直接连在双键碳原子 上的称为乙烯型卤代烃,卤素连在苯环 α-碳原子上的称为苄基型卤代烃,卤素直接连在苯 环上的称为苯基型卤代烃。
金属有机化学3

Et2O
NiCl2 + 2CH2 CHCH2MgBr
-10 C
o
Ni
Hale Waihona Puke + 2MgBrCl
-CO CoH(CO)4N + CH2 CHCH CH2 OC
Co CO CO
+ OC
Co CO CO
Fe OC CO CO
+ HCl
Fe OC CO
Cl CO
4. 具有过渡金属-碳 σ 键的络合物的合成
含有M-C σ 键的过渡金属化合物通常是不稳定的,但是 若有了环戊二烯基、CO、叔膦、联吡啶等有机碱配体后, 可以合成相当稳定的烷基或芳基化合物。 这类配体被称为稳定化配体(stabilizing ligand)或支持 配体(supporting ligand)。
CH3CMn(CO)5 O CH3Mn(CO)5 + CO
p- CH3C6H4SO2IrCl2(CO)(PPh3)2
p- CH3C6H4IrCl2(CO)(PPh3)2
-SO2
C6H5N2PtCl(PEt3)2
Al2O3 -N2
C6H5PtCl(PEt3)2
当加热不能发生消除反应时,光反应有时是有效的。 另外,芳基过渡金属络合物的合成方法与烷基化合物相似。
Ni Ni(cod)2
在此,AlEt2(OEt)为还原剂, 把Ni2+还原为Ni0.
Fe + 1,5-COD
Fe(cod)2
2. n-芳烃络合物 苯等芳烃配位所形成的络合物, 可由低原子价过渡金属络 合物和芳烃的置换反应, 或由过渡金属卤化物在芳烃存在下 还原而合成:
C6H5CH3 + Mo(CO)6
有机电致发光材料三(8-羟基喹啉)铝的合成工艺

有机电致发光材料三(8-羟基喹啉)铝(tris(8-hydroxyquinolinato)aluminum, Alq3)是一种常用的有机半导体材料,广泛应用于有机发光二极管(OLED)、有机场效应晶体管(OEFT)和太阳能电池等领域。
其合成方法较为简单,一般采用反相溶剂法,主要步骤如下:1.雄性醇类亲核试剂(如异丙醇)在氧化剂存在下氧化制备出8-羟基喹啉酸(8-hydroxyquinolinol, HQ)。
将醇类亲核试剂(如异丙醇)放入反应釜内,加入氧化剂(如氧气或过氧化氢) 进行氧化反应。
反应的最终产物是8-羟基喹啉酸。
2.在惰性溶剂(如氢氧化钾/钾碳酸钠溶液)中,将8-羟基喹啉酸与氯化铝反应制备出配合物Alq3。
在一个量热容器中加入8-羟基喹啉酸和氯化铝。
在惰性溶剂(如丙酮或四氢呋喃)中在-78°C 的温度下进行反应,控制加入氢氧化钾/钾碳酸钠两者的浓度,使反应物迅速反应形成Alq3中间体。
在反应后,Alq3物质会沉淀在反应溶液中。
为获取纯度高的Alq3,少量的取沉淀物用冷水洗涤,用真空泵吸干。
这些步骤需要多次重复,以确保纯度充分高的Alq3沉淀晶体获得。
3.沉淀的Alq3物质在凉水中反复洗涤、过滤干燥、再经真空干燥得到纯净的Alq3粉末。
取得的Alq3晶体沉淀通过凉水反复洗涤和过滤处理。
这些沉淀晶体然后在高温烘干箱中干燥,也可在真空下在低温下干燥以去除水分。
这样合成得到的Alq3配合物大多数晶体为亮绿黄色,对有机发光二极管的制备有广泛应用。
上述工艺过程比较简单,但需要注意入料顺序、溶剂的选择和反应条件等因素,以保证合成出的Alq3样品物理化学性质良好,达到研究和工程应用的需求。
有机化学第8章第三节醚2013
二巯基丙醇(BAL)
CH2 CH CH2 SH SH SO3Na
二巯基丙磺酸钠
HS HC CO2Na HS HC CO2Na
二巯基丁二酸钠
上述解毒剂与金属离子的亲和力较强,它们不仅能 与进入体内的重金属离子结合成不易解离的无毒配合物 由尿排出体外,以保护酶系统,而且还能夺取已经与酶 结合的重金属离子,使酶的活性恢复,从而达到解毒的 目的。但若酶的巯基与重金属离子结合过久,酶的活性 则难以恢复,故重金属中毒需尽早用药抢救。
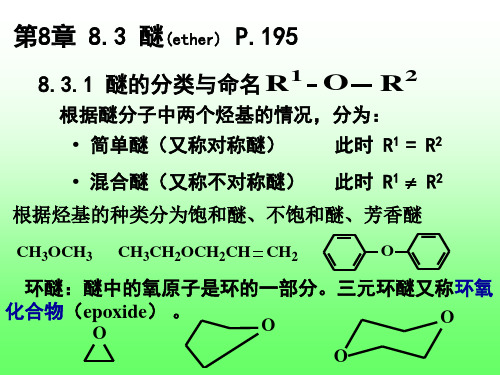
第8章 8.3 醚(ether) P.195
1 O R 8.3.1 醚的分类与命名
R2
根据醚分子中两个烃基的情况,分为:
• 简单醚(又称对称醚) 此时 R1 = R2
• 混合醚(又称不对称醚)
此时 R1 R2
根据烃基的种类分为饱和醚、不饱和醚、芳香醚
CH3OCH3 CH3CH2OCH2CH CH2 O
CH3CH2OCH2CH3 + O2
CH3CHOCH2CH3 O OH
形成的过氧化物遇热容易爆炸,所以储存时间长的醚在 使用前必须进行检查,若会使湿的KI-淀粉试纸变蓝或使 FeSO4-KCNS 混合液变红,则表明醚中含有过氧化物。 加铁粉或用FeSO4水溶液洗涤,可破坏其中的过氧化物。
8.3.3 醚的制备
1)酸性
RSH + NaOH
RSNa + H2O
C2H5SH > H2O >C2H5OH pKa 10.5 15.7 15.9
2).与重金属作用
与无机硫化物类似,硫醇可与 Pb、 Hg 、Cd、 Ag 、Cu 等重金属盐或氧化物作用生成不溶于水 的硫醇盐。
有机3-环烷烃(2)-(1)_图文
cis-1, 4-二叔丁基环己烷的构象
有较大的1, 3-竖键作用
扭船型构象
多取代环己烷: (1)环己烷多元取代物的最稳定的构象是e-取代最
多的构象; (2)环上有不同取代基是,大的取代基在e-键的构
象最稳定。
课堂练习:
1、画出1,1-二甲基环己烷的椅式构象,指出直立位甲基和平 伏位甲基。
1. 【解析】
椅式构像:① 所有两个相邻的碳原子的碳氢键都处于 交叉式位置;
② 所有环上氢原子间距离都相距较远,无 非键张力。
船式构像:① C2-C3及C5-C6间的碳氢键处于重叠式位 置;
② 船头和船尾上的两个碳氢键向内伸展,相 距较近,比较拥挤,存在非键张力。
环己烷碳架是折叠的
椅式构象
C2, C3, C5, C6 共平面
a, e-
能量相等
e, a-
cis-1, 4-二甲基环己烷
1, 4-cis
a, e-
e, a-
能量相等
trans-1, 4-二甲基环己烷
1, 4-trans
a, a有1. 3-竖键作用
e, e优势构象
不同基团二取代环己烷
1, 2-cis
大基团总是 占据 e键
1, 3-竖键作用较大
优势构象
扭曲式构象
各种环己烷构象的势能图
2. 单取代环己烷的构象分析
甲基环己烷的构象
1,3-竖键作用
CH3与C3为对位交叉 优势构象,室温时占95%
CH3与C3为邻位交叉
取代环己烷的构象1
叔丁基环己烷的构象
优势构象 室温:100%
1. 3-竖键作用非常大
3. 二取代环己烷的构象分析
cis-1, 2-二甲基环己烷
3有机化合物的构造、构型和构象构造构型
C2
C2
C3
(无)
H
H (无)
C2
只含旋转轴对称因素的分子是非对称分子。手性分子。
旋光异构体的性质 在相同的非手性条件下,旋光异构体的物理性质与化学性 质相同。 名称 (+)-酒石酸 熔点/oC 170 []25(20%水) 溶解度 +12o 139 pka1 pka2 2.93 4.23
(-)-酒石酸
此一类异构与骨架 异构比较类似,异 构体数目较多,异 构体化学性质和物 理性质相近,分离 较为困难,但比骨 架异构分离要稍容 易些。
CH3 CH3 CH3 CH3 Br Br COOH COOH O O
官能团异构可以将其排列为第三。如相同 碳数醇与醚、醛和酮、酸和酯等:
此一类异构由于是官 能团的差别,所以就 CH3OCH3 CH3CH2OH 导致异构体之间化学 和物理性质差别较大, CH3CH2CHO CH3COCH3 分离十分容易。 实 际上你可以将这种异 构看作是一种官能团 CH3CH2COOH CH3COOCH3 位置移动到一个极点 时发生特殊现象,比 CH3COCl ClCH2CHO 如醇可以看作是氧原 子移动到一端的结果, 醛是羰基移动到一端 等。
170
- 12o
热H2SO4
139
2.93 4.23
烯 溴烷 酯
(+)-2-甲基-1-丁醇 (- )-2-甲基-1-丁醇
HBr CH3COOH
例如:抗妊娠反应的镇静药—(R)-酞胺哌啶酮 (―反应停”)
O N
H
O
N
O
1)旋光异构体具有不同的生物活性强度
H3C H COOH
(S)-萘普森
判断下列化合物是否具有光学活性
高中化学实验全解-有机实验3-醇、酚性质与检验(教师版)
⾼中化学实验全解-有机实验3-醇、酚性质与检验(教师版)有机实验:醇、苯酚的性质与检验考情分析五年⾼考考情分析年份 2009年 2010年 2011年 2012年 2013年题号 9 6,10,1226 12 —— 分值 3 9 12 3 考点苯酚和⼄醇的性质苯酚和⼄醇的性质⼄醇的性质苯酚和⼄醇的性质⼩结近⼏年来,醇类和酚类的性质考查频繁,⼏乎每年必考,经常出现在选择题中,有时也会出现在实验题中,学⽣由于对有关基础知识把握不到位,容易造成失分。
⾼考链接1.【2012上海12】下列有机化合物中均含有酸性杂质,除去这些杂质的⽅法中正确的是() A .苯中含苯酚杂质:加⼊溴⽔,过滤B .⼄醇中含⼄酸杂质:加⼊碳酸钠溶液洗涤,分液C .⼄醛中含⼄酸杂质:加⼊氢氧化钠溶液洗涤,分液D .⼄酸丁酯中含⼄酸杂质:加⼊碳酸钠溶液洗涤,分液2.【2011上海26】实验室制取少量溴⼄烷的装置如右图所⽰。
根据题意完成下列填空:(1)圆底烧瓶中加⼊的反应物是溴化钠、和1:1的硫酸。
配制体积⽐1:1的硫酸所⽤的定量仪器为(选填编号)。
a .天平b .量筒c .容量瓶d .滴定管(2)写出加热时烧瓶中发⽣的主要反应的化学⽅程式。
(3)将⽣成物导⼊盛有冰⽔混合物的试管A 中,冰⽔混合物的作⽤是。
试管A中的物质分为三层(如图所⽰),产物在第层。
(4)试管A中除了产物和⽔之外,还可能存在、(写出化学式)。
(5)⽤浓的硫酸进⾏实验,若试管A 中获得的有机物呈棕黄⾊,除去其中杂质的正确⽅法是(选填编号)。
a.蒸馏b.氢氧化钠溶液洗涤c.⽤四氯化碳萃取d.⽤亚硫酸钠溶液洗涤若试管B中的酸性⾼锰酸钾溶液褪⾊,使之褪⾊的物质的名称是。
(6)实验员⽼师建议把上述装置中的仪器连接部分都改成标准玻璃接⼝,其原因是:。
3.【2010上海6】正确的实验操作是实验成功的重要因素,下列实验操作错误的是()4.【2010上海10】下列各组有机物只⽤⼀种试剂⽆法鉴别的是()A .⼄醇、甲苯、硝基苯B.苯、苯酚、⼰烯C.苯、甲苯、环⼰烷D.甲酸、⼄醛、⼄酸5.【2010上海12】下列实验操作或实验事故处理正确的是()A.实验室制溴苯时,将苯与液溴混合后加到有铁丝的反应容器中B.实验室制硝基苯时,将硝酸与苯混合后再滴加浓硫酸C.实验时⼿指不⼩⼼沾上苯酚,⽴即⽤70以上的热⽔清洗D.实验室制⼄酸丁酯时,⽤⽔浴加热6.【2009上海9】迷迭⾹酸是从蜂花属植物中提取得到的酸性物质,其结构如右图。
中级有机化学 (3)
E YC C+
EY CC
2
碳碳不饱和键经环丙正离子的亲电加成
环丙正离子中间体: 反式加成, 得到一对对映体产物.
C C + E+Y-
E
E
E
+
Y-
CC + CC YY
对映体
溴与烯烃的加成
溴与烯烃的加成
主要包括:
1. 与卤素溴和氯,ICl,IBr,NOCl等的加成
2. 与卤素的水、醇溶液等的加成
3. 与含有带正电的卤素试剂的反应,如NBS
C H + : CH2 singlet
C H + : CH2 triplet
CH C H2
C CH3
C . + . CH3 rotate combine or collide
C CH3
CH2N2
+
+
+
hv
56
37%
11%
26%
26%
卡宾与烯烃的反应
卡宾与烯烃的反应
类卡宾(carbenoid)与C=C双键的加成反应
O O
R
B与手性碳相连时, 重排时构型保持不变.
B(O2CR)3 + CH3CH2CH3 32
烯烃的硼氢化反应
烯烃的硼氢化反应的应用 (1)由烯烃制备醇, 特别是由端基烯烃制备一级醇. (与烯烃直接水合的区域选 择性相反). (2)还原烯烃.
炔烃的硼氢化反应
炔烃的硼氢化-氧化:使用位阻大的含有单氢的硼烷试剂
积大, 其p轨道容易与碳正离子的p轨道重叠形成环正离子, 进而进行反式
加成.
9
卤化碘等与烯烃加成
卤化碘ICl, IBr, NOCl(亚硝酰氯)等与烯烃加成
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
*几组概念的区别
1、,根、基、原子团
根:带电的原子或原子团,都是离子,存在于离子化合物中。
基:中性的原子或原子团,不能电离,烃分子中去掉一个或几个氢原子后剰余的含有末成对电子的原子团。
原子团:几个原子团结合而成的在许多反应中作为一个整体参加的集团。
烃基有:
甲基、--CH3
乙基、--CH2CH3
正丙基—CH2—CH2—CH3
异丙基--CH(CH3)2
乙烯基—CH=CH2
苯基--C6H5
官能团有:
碳碳双键C=C 碳碳叁键—C≡C—,
卤原子—X,羟基—OH,
醛基—CHO,羰基C=O ,
羧基—COOH,氨基—NH2,
硝基—NO2,磺酸基—SO3H等。
酰基—RCO—肽键—CONH—
2、同系物
(1)同系物必须结构相似,即组成元素相同,官能团种类、个数与连接方式相同,分子组成通式相同。
(2)同系物相对分子质量相差14或14的整数倍。
(3)同系物有相似的化学性质,物理性质有一定的递变规律。
练习1:苯甲醇和苯酚是否属于同系物?
练习2:HCOOH与HCOOCH3是否属于同系物?
3、同分异构体
凡分子式相同,但分子结构不同,因而性质也不同的几种化合物互称同分异构体。
同分异构体可以属于同一类物质,也可以属于不同类物质。
中学阶段涉及的同分异构体常见有三类:
(1)碳链异构
练习1 C8H18一个分子中含有4个—CH3的同分异构体有多少种?
练习2 用—X、---Y、---Z三种基团同时分别取代苯环上的3个氢原子可得多少种分子?练习3 分子式为C8H8O2 的酯的同分异构体有多少种?
(2)位置(官能团位置)异构
练习4 C7H8O有多少种同分异构体?
(3)异类异构(又称官能团异构)
常见的异类异构主要有以下几种:
1)烯烃与环烷烃,通式为C n H2n,n≥3。
2)二烯烃与炔烃,通式为C n H2n-2,n≥4。
3)饱和一元醇与醚,通式为C n H2n+2O,n≥2。
4)饱和一元醛、酮、烯醇,通式为C n H2n O,≥3。
5)饱和一元羧酸、酯、羟基醛,通式为C n H2n O2,n≥2。
6)芳香醇、芳香醚、酚,通式为C n H2n-6O,n≥7。
7)硝基化合物与氨基酸,通式为C n H2n+1NO2,n≥2。
4、硝基化合物与硝酸酯
硝基化合物:烃分子中氢原子被-NO2取代的
硝化产物,R-NO2。
硝酸酯:酯与硝酸发生酯化反应的产物RONO2。
5、酯与脂
酯:酸与醇发生分子间脱水后的生成物。
脂:高级脂肪酸和丙三醇形成的酯,属于酯,仅指高级脂肪酸的甘油酯
* 有机化学反应基本类型
取代反应、加成反应、消去反应、
加聚反应、氧化反应、还原反应。
缩聚反应 酯化反应 水解反应
显色反应 中和反应 脱水反应
1、取代反应:
有机分子里的某些原子或原子团被其它原子或原子团所代替的反应。
烷烃的卤化;
苯及其同系物的卤化、硝化、磺化;
苯酚的卤化、硝化;
醇跟卤化氢反应;
醇与酸的反应,
醇脱水成醚的反应,
卤代烃的水解,
酯的水解等
练习 写出下列化学方程式
CH4与Cl2反应
苯与液溴反应
苯与浓硝酸反应
苯酚与浓溴水反应
丙三醇与金属钠反应
2、加成反应
有机分子里的不饱和碳原子跟其它原子或原子团直接结合成一种新有机物的反应叫加成反应。
目前学习到的不饱和碳原子主要存在于
C =C 、-C ≡C -、 C =O 等。
(1)能发生加成反应的物质有烯烃、炔烃、二烯烃、苯、油酸(不饱和脂肪酸)、油脂、醛、葡萄糖及含有上述官能团的物质。
(2)可加的物质有H 2、X 2、HX 、H 2O 、HCN 等。
练习 写出下列化学方程式
苯与氢气反应
丙烯与水加成
丙炔与溴水反应
3、加聚反应
含有碳碳双链的不饱和有机物,以加成的方式相互结合,生成高分子化合物的反应叫加聚反应。
发生加聚反应的有:
(1)不同分子间的加聚。
(2)同种分子间的加聚。
例:nCH 2=CH -CH =CH 2+nCH 2=CN −−
→−催化剂 [ CH 2-CH =CH -CH 2-CH ] n
︱ ︱
- -
丁苯橡胶
练习写出下列化学方程式
2—丁烯聚合反应
2—甲基—2丁烯聚合反应
全氟丙烯聚合反应
4、缩聚反应
有机物单体间通过失去水分子等小分子形成高分子化合物的反应叫缩聚反应。
如:
对于加聚反应,缩聚反应要熟练掌握单体聚合体,以及高聚物中的链节。
5、消去反应
有机化合物在适当条件下,从一分子中脱去一个小分子(如水、卤化氢),而生成不饱和(含双链或叁键)化合物的反应称为消去反应。
(1)醇的分子内脱水
(2)卤代烃脱卤化氢。
从结构上看,发生消去反应的有机物分子中与官能团(—OH,—X)相连碳原子的相邻碳原子必须要有氢原子,否则不能发生消去反应。
CH3
如CH3—C—CH2OH就不能发生消去反应。
CH3
练习写出下列化学方程式
1、4—二溴丁烷与氢氧化钠醇溶液反应
1、4—丁二醇与浓硫酸共热(1700C)
6、氧化反应
氧化反应就是有机物分子里“加氧”或“去氢”的反应。
大部分有机物在空气中都可燃烧,这是属于剧烈的完全的氧化反应,这样的氧化反应,最终产物为CO2和H2O。
此外烯烃、炔烃、苯的同系物的侧链、醇、醛等可被某些氧化剂所氧化。
它包括两类氧化反应。
1)在有催化剂存在时被氧气氧化。
从结构上看,能够发生氧化反应的醇一定是连有—OH 的碳原子上必须有氢原子,否则不能发生氧化反应。
如 就不能发生氧化反应。
2)有机物被除O 2外的某些氧化剂(如KMnO 4、Cu(OH)2、[Ag(NH 3)2OH]等氧化)。
如:CH 3CHO+2Cu(OH)2−→−
∆
CH 3COOH+Cu 2O ↓+2H 2O
醛氧化为羧酸
3)燃烧反应:完全燃烧最终产物为CO 2和H 2O 。
4)苯酚在空气中被氧化——变红。
能发生银镜反应的物质有:醛类、甲酸、甲酸某酯、葡萄糖、麦芽糖
练习:写出下列化学方程式
乙二醛发生银镜反应
乙二醛与新制氢氧化铜反应
7、还原反应
还原反应是有机物分子里“加氢”或“去氧”的反应,其中加氢反应又属加成反应。
不饱和烃、芳香族化合物,醛、酮等都可进行加氢还原反应。
(1)不饱和烃、苯及其同系物的加氢还原。
(2)醛或酮的羰基部位加氢还原成对应的醇。
(3)油进行氢化变脂肪(油脂的硬化)。
(4)葡萄糖加氢变为己六醇。
练习:写出下列化学方程式
硝基苯还原
乙二醛与氢气反应
CH 3
CH 3—C —OH CH 3 如:
8、酯化反应
酸与醇起作用生成酯和水的反应称酯化反应。
发生反应的酸可以是羧酸也可以是含氧无机酸,醇包括一元醇、多元醇或葡萄糖、纤维等多羟基化合物。
酯化反应实质上是取代反应。
酯类化合物包括:
练习:写出下列化学方程式
丙二酸与甲醇反应
乙醇与硝酸反应
油酸与甘油反应
9、水解反应
有机物跟水在一定条件下发生的反应叫水解反应。
其实质是在有机分子中引入羟基的反应,主要有卤代烃、酯、油脂、二糖、多糖、蛋白质的水解,在不同酸碱条件下,水解的程度不同,产物也有所不同。
从本质上看,水解反应属于取代反应。
要注意有机物的断键部位,如乙酸乙酯水解时是与羰基相连的C—O键断裂(即成键位置):
如蛋白质水解,则是肽键断裂:
10、脱水反应
(1)分子内脱水HCOOH H2O+CO↑
CH3-CH2-OH CH2=CH2↑+H2O
(2)分子间脱水2C2H5OH C2H5-O-C2H5+H2O
练习:写出下列化学方程式
皂化反应
11、显色反应
某些有机化合物与特定试剂反应,显示出特殊颜色的反应叫显色反应。
(1)苯酚与FeCl3溶液反应显紫色;
(2)淀粉遇I2显蓝色;
(3)蛋白质与浓HNO3反应呈黄色。
12、中和反应
有机酸或是有酸性的有机物跟碱作用生成盐和水的反应,叫做中和反应。
特别需要指出的是苯酸是有弱酸性,可以跟NaOH溶液反应生成苯酸钠和水:
此外,还有裂化反应、裂解反应等反应类型。
练习:写出下列化学方程式
苯酚与碳酸钠溶液反应
*各类链烃及其衍生物的通式:
*重要有机物的鉴别
对有机物的鉴别最好应选择该物质的特征反应,并且要求操作简便,现象明显。
常见物质的特征反应列表如下:。
