质量守恒定律专题
初中化学质量守恒定律简答题专题训练含答案

初中化学质量守恒定律简答题专题训练含答案姓名:__________ 班级:__________考号:__________一、简答题(共15题)1、为验证质量守恒定律,某同学设计了如图实验。
该实验能否达到实验目的?请说明理由。
2、为验证质量守恒定律,某同学设计了下图实验。
该实验能否达到实验目的?请简要说明理由。
3、请用质量守恒定律的知识解释问题:碳燃烧的过程中,剩余固体质量越来越小:镁条在燃烧的过程中,剩余固体质量却越来越大?4、根据质量守恒定律解释下列现象:(1)细铁丝在氧气中燃烧后,生成物的质量比细铁丝的质量大。
(2)蜡烛在空气中充分燃烧后,质量变小。
5、为验证质量守恒定律,某同学设计了下图实验。
请回答:(1)利用右图装置不能验证质量守恒定律,请说明理由。
(2)如何改进右图装置使其能够验证质量守恒定律?6、为验证质量守恒定律,某同学设计了右图实验。
该实验能否达到实验目的?请说明理由。
7、为验证质量守恒定律,某同学设计了如图实验.该实验能否达到实验目的?请说明理由.8、根据化学方程式计算结果是:镁在空气中燃烧后,生成氧化镁的质量应该是增加的.但在实际实验过程中,得到的氧化镁质量比镁的质量小,据此结果,有人认为质量守恒定律有例外,你认为正确吗?请说明理由.9、某同学用稀盐酸和碳酸钠反应对质量守恒定律进行实验,结果观察到反应前后天平不平衡,由此得出这个化学反应不遵守质量守恒定律的结论.这个结论是否正确?为什么?10、为什么化学反应前后总质量总是相等的?11、一定质量的镁和碳酸镁混合物,经高温煅烧,直到质量不再变化为止。
发现反应前后总质量不变,求原混合物中镁粉的质量分数。
12、某同学按右图装置对质量守恒定律进行实验探究,结果观察到随蜡烛燃烧的进行,天平不平衡,由此得出蜡烛燃烧这个化学反应不遵守质量守恒定律的结论。
这个结论是否正确? 为什么?13、有两个同学在实验室做了两个实验及所得结论如下:A同学:实验操作及实验现象:带火星的木条伸入到一集气瓶中,木条不复燃。
专题05质量守恒定律化学方程式-2023年中考化学考点总复习

专题05 质量守恒定律化学方程式一、单选题1.下列化学方程式书写正确的是()A.Ba(OH)2+MgSO4=BaSO4↓+Mg(OH)2↓B.Fe2O3+H2SO4=FeSO4+H2OC.CaCl2+2KNO3=Ca(NO3)2+2KClD.NH4Cl+NaOH NaCl+NH3·H2O【答案】A【解析】B选项,铁元素反应前后化合价不变,应该生成硫酸铁Fe2(SO4)3。
C选项,氯化钙和硝酸钾不反应,生成物中没有水、气体、沉淀其中一种。
D选项,反应条件加热,应该生成氨气和水(NH3↑+H2O),不是一水合氨(NH3·H2O)。
2.关于下列实验,通过倾斜烧杯或锥形瓶的方法让装置内的两种物质接触,不符合质量守恒定律的是()A、B、C、D、【答案】D【解析】质量守恒定律的前提是物质之间发生化学反应,发生化学反应就一定符合质量守恒定律。
A选项,锌与稀硫酸能发生化学反应,符合质量守恒定律。
B选项,氯化钡与硫酸钠能发生化学反应,符合质量守恒定律。
C选项,石灰石和稀盐酸能发生化学反应,符合质量守恒定律。
D选项,沙子与白磷不发生化学反应,不符合质量守恒定律,故选D。
3.(2022年四川省自贡市中考)下列化学方程式正确的是()A.点燃天然气:CH4+2O2点燃2H2O+CO2↑ B.铁粉溶于稀盐酸:2Fe+6HCl═2FeCl3+3H2↑C.硫在空气中燃烧:S+O2点燃SO2 D.高炉炼铁:Fe2O3+CO高温2Fe+CO2【答案】C【解析】A、天然气的主要成分是甲烷,甲烷完全燃烧生成水和二氧化碳,反应的化学方程式为:42222O 2H O CH CO ++点燃,反应物中有气体,生成物中的气体后不加气体符号,故A 错误;B 、铁粉溶于稀盐酸生成氯化亚铁和氢气,反应的化学方程式为:222H Fe HCl FeCl ++↑=,故 B 错误;C 、硫在空气中燃烧生成二氧化硫,反应的化学方程式正确,故C 正确;D 、高炉炼铁的反应原理是氧化铁和一氧化碳反应生成二氧化碳和铁,化学方程式未配平,正确反应的化学方程式为:232O 323Fe CO Fe CO ++高温,故D 错误。
1.1质量守恒定律(原卷版+解析)
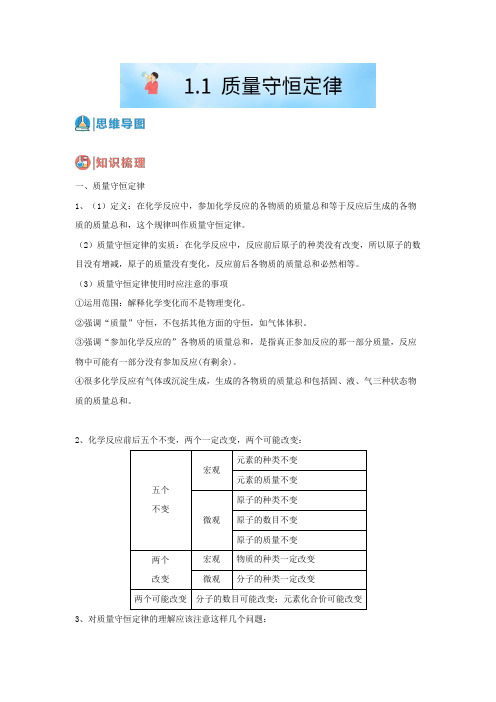
一、质量守恒定律1、(1)定义:在化学反应中,参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和,这个规律叫作质量守恒定律。
(2)质量守恒定律的实质:在化学反应中,反应前后原子的种类没有改变,所以原子的数目没有增减,原子的质量没有变化,反应前后各物质的质量总和必然相等。
(3)质量守恒定律使用时应注意的事项①运用范围:解释化学变化而不是物理变化。
②强调“质量”守恒,不包括其他方面的守恒,如气体体积。
③强调“参加化学反应的”各物质的质量总和,是指真正参加反应的那一部分质量,反应物中可能有一部分没有参加反应(有剩余)。
④很多化学反应有气体或沉淀生成,生成的各物质的质量总和包括固、液、气三种状态物质的质量总和。
2、化学反应前后五个不变,两个一定改变,两个可能改变:3、对质量守恒定律的理解应该注意这样几个问题:(1)质量守恒定律对化学变化有意义,对物理变化无意义。
(2)质量守恒定律指的是“质量”守恒,并不包括其他方面,如反应前后的体积不一定守恒。
(3)不能把“参加反应的各物质”简单理解成“反应物”,因为有些反应物不一定全部参与反应,有“过量”问题。
(4)对于利用质量守恒定律确定化学式,可以先确定已知一方各个原子的种类和数量,再对应查找另一方,左右相减就可确定物质的化学式。
【知识点详解】质量守恒定律的理解4、质量守恒定律的应用(1)推断物质的组成(依据:化学反应前后元素种类不变)。
(2)确定物质的化学式(依据:化学反应前后原子的种类、数目不变)。
(3)推断反应中的化学计量数及比值(依据:化学反应前后原子的数目不变)。
(4)判断化学方程式书写是否正确(依据:化学反应前后原子的种类和数目不变)。
(5)求算化学反应中某种物质或元素的质量。
解释反应前后物质的质量变化及用质量差确定某一种物质的质量,确定反应物、生成物及推断反应类型等(依据:化学反应前后,反应物和生成物的总质量不变)。
(6)对微观反应示意图进行解读。
质量守恒定律专题复习+课件

汇报人: 202X-12-29
目 录
• 质量守恒定律的概述 • 质量守恒定律的表述 • 质量守恒定律的实质 • 质量守恒定律的应用 • 质量守恒定律的拓展
CHAPTER 01
质量守恒定律的概述
质量守恒定律的定义
质量守恒定律
在化学反应中,参加反应的各物 质的质量总和等于反应后生成的 各物质的质量总和。
该定律是自然界的普遍规律, 适用于宏观和微观领域,是化 学反应和物理过程的基础。
它表明物质不灭,物质的量是 守恒的,是化学反应中的重要 原理之一。
质量守恒定律的微观解释
从原子层面解释,化学反应中,反应前后原子的种类和数目保持不变。 原子是化学变化中的最小粒子,反应前后原子的质量、数目和种类都不发生变化。
这意味着在化学反应中,反应物的质量和生成物的质量相等,总质量保持不变。
质量守恒定律与能量守恒定律的关系
质量守恒定律和能量守恒定律是自然 界的两个基本定律,它们之间存在密 切的联系。
在化学反应中,虽然能量的形式发生 了变化,但反应前后系统的总能量保 持不变。
能量守恒定律表明在一个封闭系统中 ,能量不能被创造或消灭,只能从一 种形式转化为另一种形式。
质量守恒定律的数学表述
总结词:直观明了
详细描述:质量守恒定律的数学表述为“反应物的总质量等于生成物的总质量”。
质量守恒定律的符号表述
总结词:专业规范
详细描述:质量守恒定律的符号表述为“∑m(反应前)= ∑m(反应后)”。
CHAPTER 03
质量守恒定律的实质
质量守恒定律的实质含义
质量守恒定律是指在一个封闭 系统中,无论发生何种物理或 化学变化,系统的总质量保持 不变。
5.1质量守恒定律(专题训练)

5.1 质量守恒定律(专题训练)【四大题型】【题型1 质量守恒定律及其应用】 ....................................................................................... 错误!未定义书签。
【题型2 有关化学式的计算和推断】 . (7)【题型3 某元素质量分数的计算】 (11)【题型4 化学方程式的概念、读法和含义】 (14)可能用到的相对原子质量:H1C12N14O16F19Na23S32 C135.5K39Ca40Fe56 Cu64 Zn65 I127【题型1 质量守恒定律及其应用】1.(2023•天宁区校级模拟)银器在使用过程中逐渐失去光泽是因为发生了化学反应:4Ag+O2+2H2S=2X+2H2O。
根据质量守恒定律可推测X是()A.Ag2S B.Ag2SO4C.SO2D.SO3【答案】A【分析】根据质量守恒定律,化学反应前后原子的种类和数目不变来分析。
【解答】解:根据质量守恒定律,化学反应前后原子的种类和数目不变,由反应的化学方程式4Ag+O2+2H2S=2X+2H2O可知,反应前有4个Ag,2个O,4个H,2个S,反应后有4个H,2个O,则2X中含有4个Ag,2个S,所以X的化学式为:Ag2S。
故选:A。
2.(2023•南岗区校级开学)现有氧化钙和碳酸钙的固体混合物78g,高温煅烧至完全反应,得到固体质量为56g,则原固体混合物中钙元素的质量分数为()A.50%B.40.2%C.32.5%D.51.3%【答案】D【分析】根据反应前后钙元素的质量不变,进行分析判断。
【解答】解:碳酸钙高温分解生成氧化钙和二氧化碳,高温煅烧至完全反应,得到固体质量为56g,56g是氧化钙的质量,由反应前后钙元素的质量不变,则原固体混合物中钙元素的质量为:56g××100%=40g,所以原固体混合物中钙元素的质量分数为:×100%≈51.3%。
专题 质量守恒定律的应用 中考化学答题技巧与模板构建

专题01 质量守恒定律的应用质量守恒定律是化学中的一条重要定律,中考中主要从以下三个方面进行考查,一是从定律本身出发;二是用原子、分子观点解释定律出发;三是定律的外延反映出元素在反应前后种类,质量都不改变出发。
常见的题型有:密闭容器中化学反应的数据分析、微观反应示意图分析以及根据残缺型化学方程式的分析、利用实验验证质量守恒定律等。
设问形式主要有:判断反应中某物质的元素组成或化学式;判断反应的反应类型;判断某物质是否可能为反应的催化剂;判断反应中物质的质量比等。
模|板|构|建一、关于密闭容器中化学反应的数据分析步骤 具体方法①确定待测质量“x”的值:根据反应前物质的质量总和=反应后物质的质量总和(或反应前各种物质的质量减少=反应后各种物质的质量增加)②判断反应物和生成物:计算表格中反应前后各物质质量变化(反应后-反应前),(结果负值为反应物;结果正值为生成物;结果为0可能是催化剂,也可能是与反应无关的物质或杂质)③ 写出反应的符号表达式,确定反应类型④ 标注反应前后各物质的质量变化关系⑤根据质量守恒定律及化学方程式的计算原理,结合所学知识,逐项进行分析判断正误二、有关质量守恒定律的微观反应示意图步骤 具体方法① 观察反应前后是否有相同的分子,若有则消除相同数目的同种分子;若无则省去此步 ② 根据图注分别写出反应前后各物质的化学式,并配平方程式 (如图注没给出原子的图示符号,可直接用物质的图示符号配平) ③根据书写的化学方程式进行逐项判断正误三、运用质量守恒定律推断化学式或元素组成步骤具体方法①观察反应方程式,锁定“未知”物质X②推断化学式根据质量守恒定律,反应前后元素的种类、原子的数目均不改变,由此确定出未知物质的组成(或化学式)。
确定元素组成根据已知的反应物和生成物的质量进行计算③根据推断或计算进行逐项正误判断疑|难|总|结1.质量守恒定律只适用于化学变化,而不适用于物理变化。
2.质量守恒是物质的“质量”守恒,而非“体积”守恒。
专题09质量守恒定律

专题09质量守恒定律1.质量守恒定律2.质量守恒定律的原因3.化学方程式的意义4.化学方程式的书写知识点一质量守恒定律1.质量守恒定律的内容(1)概念:是指参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
(2)研究对象:化学变化。
(3)注意事项:①质量守恒定律的“守恒”指的是质量守恒,其它方面如体积等不一定守恒。
②“参加反应的各物质”,没有参加反应的物质不包括在内(如催化剂、过量的物质)。
③“生成的各物质的质量总和”,应当包括生成的各种物质,如沉淀、气体等。
【典例1】★★☆☆☆1.反应A+B=C+D中,5gA和5gB恰好完全反应,生成8gC,则2.5gA完全反应,生成D的质量( )A.2g B.4g C.1g D.2.5g [答案]: C[解析]: 根据质量守恒定律可以知道,5gA和5gB恰好完全反应生成D的质量为:5g+5g-8g=2g因此,按照比例进行转化2.5gA完全反应,生成D的质量1g。
2.化学兴趣小组对某化学反应进行了探究,并将实验测的得结果填写在下表中,请你分析并填空:(1(2)C物质可能是该反应的________________ (填“反应物”、“生成物”或“催化剂”)。
(3)反应后D物质的质量是___________g。
[答案]:(1)化合反应(2)催化剂(3)32[解析]: 根据质量守恒定律可知:反应后质量减少的物质是反应物,质量增加的物质是生成物。
由于A的质量减少,A是反应物,B的质量减少,所以B也是反应物,C在反应前后质量没有改变,所以C既不是反应物也不是生成物,有可能是该反应的催化剂,也可能没有参加反应。
由此可见,D的质量一定会增加,D是生成物,两种物质生成一种物质,该反应属于化合反应,参加反应A的质量是20 g,B参加反应的质量是10 g,反应物的总质量是30 g,也就是生成了30 g D,则反应后D物质的质量是2 g+30 g=32。
【训练1】★★☆☆☆1.在化学反应中A+B=C+D中,80gA和2gB和恰好完全反应,生成40gB,则生成C的质量是_____g。
专题11 质量守恒定律 化学方程式(解析版)-备战2024年中考化学真题题源解密(全国通用)
主题三物质的化学变化专题11 质量守恒定律化学方程式考情概览:理解课标要求,把握命题方向,总结出题角度。
真题透视:精选真题,归类设置,完整展现中考试题的考查形式。
中考新考法:从新情境、新设问、跨学科等方向设置新考法真题。
新题特训:选用最新优质题、创新题,巩固考点复习效果。
课标要求考点考向考法常现关键词考向一质量守恒定律考法1 质量守恒定律及其应用考法2 化学方程式的概念、读法和含义质量比、充分反应、参加反应、生成、质量分数、可能是考向二如何正确书写化学方程式考法1 常见化学反应中的质量关系考法2 书写化学方程式、文字表达式、电离方程式遵循、不相符、剧烈燃烧、符合题意1.认识质量守恒定律,知道化学反应前后质量守恒的原因。
2.能对质量守恒定律进行应用。
3.知道化学系方程式的读法和意义。
4.能说明化学反应中的质量关系。
5.能正确书写简单的化学反应方程式。
6.能利用化学方程式进行简单的计算。
化学方程式考向三利用化学方程式的简单计算考法1 根据化学反应方程式的计算充分反应、一定条件、质量变化、参加反应、生成、质量比、元素种类不变、原子的种类不变、总个数不变►考向一质量守恒定律考法1 质量守恒定律及其应用1.(2023•淄博)现有8gA和足量B在一定条件下充分反应,生成22gC和18gD,则参加反应的A和B的质量比是( )A.4:11B.1:2C.1:4D.11:9【答案】C【解析】现有8gA和足量B在一定条件下充分反应,生成22gC和18gD,由质量守恒定律,参加反应的A和B的质量之和等于生成C和D的质量之和,则参加反应的B的质量为22g+18g﹣8g=32g,参加反应的A和B的质量比是8g:32g=1:4。
故选:C。
2.(2023•日照)t1时刻,在密闭容器内投入SO2、O2、SO3、V2O5(五氧化二钒)四种物质,在一定条件下SO2和O2发生反应生成SO3,在t2时刻测得容器内各物质的质量如表所示,下列说法错误的是( )甲乙丙丁t114.8g10g 6.2g1gt2a26g3g1gA.丁可能是催化剂V2O5B.乙是SO3C.a=2g D.丙是SO2【答案】D【解析】丁反应前后质量不变,是五氧化二钒,乙反应后质量增大,是生成物,即是三氧化硫,丙反应后质量减小,是反应物,a=14.8g+10g+6.2g+1g﹣26g﹣3g﹣1g=2g,甲物质质量减少,属于反应物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
质量守恒定律专题练习
一、判断下列说法是否正确(正确的打“√”,错误的打“×”)
(1)根据质量守恒定律,1L氢气和1L氧气反应生成2L水。
( )
(2)10 g水蒸发变成10 g水蒸气符合质量守恒定律。
( )
(3)只有固体、液体间反应遵守质量守恒定律,如果有气体参加反应,就不遵守质量守恒定律。
( )
(4)水在催化剂的作用下可变成燃油(主要含C、H)。
( )
(5)氢气和氧气形成混合物的质量一定等于其反应后生成水的质量()
二.选择题:
1.镁带在耐高温的密闭容器中(内含空气)燃烧,能正确表示容器里所盛物质总质量变化的图象是( )
2.潜艇中船员呼吸产生的二氧化碳能通过化学反应2Na2O2+2CO2═2X+O2吸收,则X的化学式为()
A.NaOH B.Na2C C.Na2O D.Na2CO3
3.a克过氧化氢溶液和b克二氧化锰混合, 待完全反应后得c克残余物, 则生成氧气的质量为()
A. (a-c)克
B. (a + b-c)克
C. (a-b + c)克
D.(a-b-c)克
4.一定条件下,在一个密闭容器内发生某反应,测得反应前后各物质的质量见下表,下列说法中正确的是()
物质 a b c d
18 1 2 32
反应前物质质量
/g
待测26 2 12
反应后物质质量
/g
A.该反应的基本类型为化合反应 B.待测数据是23
C.参加反应a、d的质量比为4:1 D.c物质一定是该反应的催化剂
5.已知化学反应:2A + B = 2C + D,当10g A和8g B恰好完全反应后,生成6g C。
如果要得到3g D,则参加反应的B物质的质量是()
A.1g
B.2g
C.3g
D.4g
6.下列示意图形象地表示了A()与B()反应生成C()其反应前后分子及数目的变化,则该反应的化学方程式中,A、B、C的化学计量数之比为()
A.2:1:2 B.1:2:2 C.1:1:1 D.2:2:3
7.下列实验能够直接用于验证质量守恒定律的是()
A B C D
8.将a克一氧化碳和b克氧气通入密闭容器中点燃,充分反应后,生成二氧化碳的质量为()
A.一定为(a+b)克
B.大于(a+b)克
C.小于(a+b)克
D.不大于(a+b)克
9.某可燃物在空气中燃烧可以生成二氧化碳和水,则可燃物中的元素组成()
A.一定含有C、H元素,可能含有O元素
B.只含有C、H元素
C.含有C、H、O三种元素
D.无法确定
10.碳在氧气中燃烧,下列说法符合质量守恒定律的是( )
A.3gC和8gO2生成11gCO2 B.2gC和4gO2生成6gCO2
C.4gC和5gO2生成9gCO2 D.5gC和9gO2生成14gCO2
二.填空题
11.化学反应前后一定不改变的是()
①原子数目②分子数目③物质种类④物质质量总和⑤原子质量⑥元素种类⑦相对原子质量.
12在化学反应3A+2B=2C+3D中,A、B、C的相对分子质量分别是27、16、19,则D的相对分子质量为
13.已知A+2B=2C+3D中,已知2.3gA跟4.8gB恰好完全反应生成4.4gC。
又知D的相对分子质量为18,则A的相对分子质量为
14.现有32g某可燃物在密闭容器中完全燃烧后,测定生成88g二氧化碳和72g水,则该可燃物中一定含有元素。
反应的化学方程式:(写出计算过程)。
