第十二章含氮化合物新-课件
合集下载
《含氮化合物》课件

硝基化合物具有特征的紫外-可见光谱 和红外光谱,可用于鉴别和检测。
硝基化合物的溶解性
硝基化合物一般难溶于水,但可溶于 有机溶剂。溶解度受温度、压力、溶 剂类型等因素影响。
硝酸盐的物理和化学性质
01
02
03
硝酸盐的稳定性
硝酸盐在常温下稳定,但 在高温或酸性条件下可能 发生分解。
硝酸盐的溶解性
硝酸盐易溶于水,也是植 物生长所需的氮肥来源之 一。
硝基有机化合物
定义
结构特点
分类
性质
硝基有机化合物是一类含硝基 官能团的有机化合物,通常以 C-NO2形式存在。
硝基有机化合物的结构特点是 含有硝基官能团,硝基中的氮 原子与两个氧原子相连,形成 一个稳定的电子结构。
硝基有机化合物可以分为脂肪 族硝基化合物和芳香族硝基化 合物两类,根据硝基连接的碳 原子数,又可以分为一元硝基 化合物、二元硝基化合物和多 元硝基化合物。
氮气的物理和化学性质
物理性质
无色、无味、无毒的气体,标准 状况下密度为1.25g/L,沸点为195.8°C,熔点为-209.8°C。
化学性质
氮气是一种惰性气体,不易与其 他物质发生反应,但在高温、放 电等条件下可以与氧气、氢气等 发生反应。
氮气的制备和用途
制备方法
工业上主要采用分离液态空气法来制备氮气,实验室中可以用金属镁和氮化物 反应制备氮气。
用途
氮气是合成氨、尿素等含氮化合物的重要原料,也是工业上常用的保护气体, 可用于填充灯泡、食品保鲜、医疗麻醉等领域。此外,氮气也是一种无色无味 的惰性气体,可用于制作氮肥、硝酸、炸药等。
02 氨和铵盐
氨的物理和化学性质
物理性质
氨是一种无色、易挥发、有刺激性气 味的气体,沸点为-33.5℃,极易溶 于水,形成氨水。
氮及其化合物ppt课件

无论是单一气体 ( NO2 ),还是 NO、NO2、O2 中的两者或三者的混合气 体溶于水,若有气体剩余只能是 NO 或 O2 ,不可能是NO2。
二、一氧化氮和二氧化氮
4. 氮氧化物对环境的污染 (1)NOx在紫外线作用下与碳氢化合物发生 一系列光化学反应,产生光化学烟雾。 (2)NOx排入大气中后,与水反应生成HNO3 和HNO2,随雨雪降到地面形成酸雨。 (3)破坏臭氧层:NO2可使平流层中的臭氧减 少,导致地面紫外线辐射量增加。 (4)NO与血红蛋白结合使人中毒。
硝酸的酸性比磷酸强
化合价: -3、 0、 +2、 +3、 +4、 +5
一、氮气及氮的固定
1.氮气的物理性质
颜色 无色
气味 无味
状态 气体
液氮
密度 密度比空气稍小
水溶解 难溶
一、氮气及氮的固定
2.氮气的化学性质
化学式
N2
电子式
N
N
结构式
NN
共价三键、键能大,性质稳定,难与其他物质反应
N2 表现氧化性
课堂导入
“死亡谷”之谜 青藏高原上的那棱格勒峡谷,每当牧民和牲畜进入后,风和
日丽的晴天顷刻电闪雷鸣,狂风大作,人畜常遭雷击而倒毙。奇 怪的是这里牧草茂盛,水草肥美,被当地牧民称为“死亡谷”。
考察队测定后发现,这里的磁场强度非常高。这里的地层, 除了分布着大面积的三叠纪火山喷发的强磁性玄武岩外,还有大 大小小30多个磁铁矿脉及石英闪长岩体。正是这些岩体和磁铁矿 产生了强大的地磁异常带。夏季,它使因昆仑山的阻挡而沿山谷 东西分布的雷、雨、云中的电荷常常在此汇集,形成超强磁场。 一旦遇到异物,便会发生尖端放电即产生雷击现象,使人和畜瞬 间死亡。巨大的磁力还导致了指南针失灵,仪器不准。
二、一氧化氮和二氧化氮
4. 氮氧化物对环境的污染 (1)NOx在紫外线作用下与碳氢化合物发生 一系列光化学反应,产生光化学烟雾。 (2)NOx排入大气中后,与水反应生成HNO3 和HNO2,随雨雪降到地面形成酸雨。 (3)破坏臭氧层:NO2可使平流层中的臭氧减 少,导致地面紫外线辐射量增加。 (4)NO与血红蛋白结合使人中毒。
硝酸的酸性比磷酸强
化合价: -3、 0、 +2、 +3、 +4、 +5
一、氮气及氮的固定
1.氮气的物理性质
颜色 无色
气味 无味
状态 气体
液氮
密度 密度比空气稍小
水溶解 难溶
一、氮气及氮的固定
2.氮气的化学性质
化学式
N2
电子式
N
N
结构式
NN
共价三键、键能大,性质稳定,难与其他物质反应
N2 表现氧化性
课堂导入
“死亡谷”之谜 青藏高原上的那棱格勒峡谷,每当牧民和牲畜进入后,风和
日丽的晴天顷刻电闪雷鸣,狂风大作,人畜常遭雷击而倒毙。奇 怪的是这里牧草茂盛,水草肥美,被当地牧民称为“死亡谷”。
考察队测定后发现,这里的磁场强度非常高。这里的地层, 除了分布着大面积的三叠纪火山喷发的强磁性玄武岩外,还有大 大小小30多个磁铁矿脉及石英闪长岩体。正是这些岩体和磁铁矿 产生了强大的地磁异常带。夏季,它使因昆仑山的阻挡而沿山谷 东西分布的雷、雨、云中的电荷常常在此汇集,形成超强磁场。 一旦遇到异物,便会发生尖端放电即产生雷击现象,使人和畜瞬 间死亡。巨大的磁力还导致了指南针失灵,仪器不准。
氮及其化合物(最新课件ppt)

不用KI淀粉试纸鉴别NO2与溴蒸气。
(3)因在常温常压下发生反应2NO2 N2O4,所以通 常“纯净”的NO2或N2O4并不纯.由于此可逆反应的发 生,通常实验测得NO2的相对分子质量大于它的实际 值。
2.氮的氧化物溶于水的计算 (1)方程式法 有关化学反应方程式 3NO2+H2O===2HNO3+NO① 4NO2+O2+2H2O=4HNO3② 4NO+3O2+2H2O===4HNO3③ 2NO+O2===2NO2④
3.氮的氧化物对大气的污染与防治 (1)
(2)
(3)
①无色
②无味
③不
④小
⑤N2+O2
放电 =====
2NO
⑥N2+3H2
高温高压 催化剂
2NH3
⑦N2+3Mg
点燃 =====
Mg3N2
⑧
合成氨 ⑨自然固氮 ⑩无 ⑪红棕色 ⑫无 ⑬刺激性
⑭ 有 ⑮ 有 ⑯ 大 ⑰ 大 ⑱ 不 溶 ⑲ 2NO+ O2===
一、氮气及氧化物
1.氮气
(1)物理性质
颜色 气味
溶解性
密度
①____ ②____ ③____溶于水 比空气④____
(2)化学性质
注意 (1)不能用向下排空气法收集N2, (2)N2化学性质不活泼,但N元素为活泼非金属元 素。
(3)氮的固定
2.氮的常见氧化物
思考1 如何鉴别NO2与溴蒸气? 【提示】 由于NO2和Br2在性质上有不少相似性: ①均具有氧化性;②溶于水均有酸生成;③均可与碱反 应;④均为红棕色等。所以不能用淀粉-KI试纸、pH 试纸、NaOH溶液来鉴别,但二者性质又有差别,可以 用下列方法鉴别:①AgNO3溶液;②CCl4;③用水洗 法。
A.NO2:17mL;O2:13mL B.NO2:27mL;O2:3mL C.NO2:15mL;O2:15mL D.NO2:25mL;O2:5mL
第十二章含氮化合物ppt课件
N H
CH 3
+
HNO2
CH 3
叔胺
N CH 3
+
HNO2
NO
N
CH
3
N-亚硝基甲苯胺 (棕色油状)
NMe 2
对亚硝基-N,N-二甲基苯胺 (绿色叶片状)
NO
小结: ① ② ③ ④ ⑤
0℃时,有N2↑为脂肪伯胺。 有黄色油状物或固体,则为脂肪和芳香仲胺。 无可见的反应现象为脂肪叔胺。 0℃时无N2↑,而室温有N2↑,则为芳香伯胺。 有绿色叶片状固体为芳香叔胺。 #
NH 2
Br2 Br Br + HBr
Br 白色↓
Br
Br
HNO3 Fe+HCl
H2SO4△
Br2 NaNO2H2SO4
0~5℃
H3PO2+H2O
TM
17
偶氮化合物中都含有—N=N—官能团。 偶氮化合物通式:R—N=N—R 、
Ar—N=N—R 或 Ar—N=N—
一A、r 芳香族重N盐的制备
NH2 + NaNO2+ 2HCl 0~5℃
NO 2
2-硝基丙烷
NO 2
NO 2
间二硝基苯
H3C
NO 2
对硝基甲苯
2
二、 性质
⒈ 物性
⑴ 硝基是一个强极性基,硝基化合物的偶极矩较大。 ⑵ 沸点比相应的卤代烃高。 ⑶ 多硝基化合物具有爆炸性。 ⑷ 液体硝基化合物是良好的有机溶剂。 ⑸ 有毒。 ⑹ 比重大于1。
⒉化性
⑴ 脂肪族硝基化合物
a. 互变异构和酸性
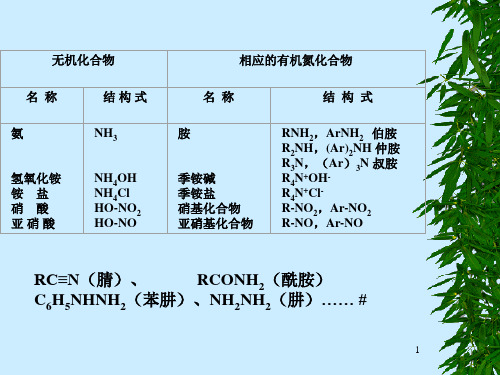
RC≡N(腈)、
RCONH2(酰胺)
C6H5NHNH2(苯肼)、NH2NH2(肼)…… #
大学有机化学课件含氮化合物详解演示文稿

R3N
蒸出物 R3N
蒸馏
残留物
Na C6H5SO2N -R
滤液 抽滤
Na 1. H3 O
C6H5SO2N -R
R-NH2
2. OH
C6H5SO2N -R2
滤饼 C6H5SO2N -R2
1. H3 O R2NH 2. OH
34
第34页,共89页。
三)、与亚硝酸的反应(P91)
1、脂肪胺与亚硝酸的反应
4
第4页,共89页。
三、硝基化合物的化学性质
1、脂肪族硝基化合物 ⑴、酸性
CH3-NO2
pKa: 10.2
H
O
R-CHN
O
假酸式 (硝基式)
CH3CH2-NO2 8.5
CH3-CH-CH3
NO2 7.8
OH
R-CHN
NaOH
O
酸式 (假酸式)
O-
R-CHN
Na+
O
5
第5页,共89页。
⑵、与羰基化合物的缩合反应
溶解
SO2-Cl + H-N-R2
仲胺
NaOH
SO2NR2
沉淀
SO2Cl + N-R3
叔胺
NaOH
R3N +
SO2O-Na+ + NaCl
不反应 (黄色油状物)
33
第33页,共89页。
用兴斯堡反应分离伯、仲、叔胺的混合物:
RNH2 R2NH R3N
C6H5SO2Cl NaOH
Na C6H5SO2N -R C6H5SO2N -R2
第二节 胺
胺类广泛地存在于生物界,具有极其 重要的生理作用。
绝大多数的药物含有胺的官能团——氨基。 蛋白质、核酸、许多激素、抗生素和生物
蒸出物 R3N
蒸馏
残留物
Na C6H5SO2N -R
滤液 抽滤
Na 1. H3 O
C6H5SO2N -R
R-NH2
2. OH
C6H5SO2N -R2
滤饼 C6H5SO2N -R2
1. H3 O R2NH 2. OH
34
第34页,共89页。
三)、与亚硝酸的反应(P91)
1、脂肪胺与亚硝酸的反应
4
第4页,共89页。
三、硝基化合物的化学性质
1、脂肪族硝基化合物 ⑴、酸性
CH3-NO2
pKa: 10.2
H
O
R-CHN
O
假酸式 (硝基式)
CH3CH2-NO2 8.5
CH3-CH-CH3
NO2 7.8
OH
R-CHN
NaOH
O
酸式 (假酸式)
O-
R-CHN
Na+
O
5
第5页,共89页。
⑵、与羰基化合物的缩合反应
溶解
SO2-Cl + H-N-R2
仲胺
NaOH
SO2NR2
沉淀
SO2Cl + N-R3
叔胺
NaOH
R3N +
SO2O-Na+ + NaCl
不反应 (黄色油状物)
33
第33页,共89页。
用兴斯堡反应分离伯、仲、叔胺的混合物:
RNH2 R2NH R3N
C6H5SO2Cl NaOH
Na C6H5SO2N -R C6H5SO2N -R2
第二节 胺
胺类广泛地存在于生物界,具有极其 重要的生理作用。
绝大多数的药物含有胺的官能团——氨基。 蛋白质、核酸、许多激素、抗生素和生物
氮及其氮的化合物课件

03
硝酸盐的种类
硝酸盐是一类无机化合物 的总称,包括硝酸钠、硝 酸钾、硝酸钙等。
硝酸盐的性质
硝酸盐易溶于水,具有较 高的稳定性,在自然界中 广泛存在。
硝酸盐的应用
硝酸盐是重要的工业原料 ,可用于制造化肥、炸药 、烟火等。
铵盐
铵盐的种类
铵盐是一类含氮的离子化 合物,常见的有氯化铵、 硫酸铵、硝酸铵等。
铵盐的性质
铵盐易溶于水,具有刺激 性气味,在加热时易分解 。
铵盐的应用
铵盐是重要的氮肥,也可 用于制造其他含氮化合物 和药物。
氰化物
氰化物的种类
氰化物是一类含碳和氮的化合物,常见的有氰化钠、氰化钾、氢 氰酸等。
氰化物的性质
氰化物具有剧毒,易溶于水,可在生物体内分解。
氰化物的作用与危害
氰化物在工业上用于电镀、金属热处理等,但如果不慎摄入或接触 ,会对人体造成严重危害,甚至致命。
氮气是一种非极性分子,不溶于水, 但可以溶于乙醇和乙醚等有机溶剂。
氮气的化学性质
氮气是一种惰性气体,化学性质不活 泼,常温下很难与其他物质发生反应 。
氮气是一种重要的工业气体,广泛应 用于化工、电子、航空航天等领域。
在高温或放电条件下,氮气可以与氧 气、氢气等物质发生反应,生成一氧 化氮、二氧化氮、氨气等化合物。
氮及其氮的化合物课件
目录
• 氮气 • 氮的氧化物 • 含氮无机化合物 • 氮的有机化合物 • 氮肥 • 总结与展望
01
氮气
氮气的物理性质
氮气的分子式为N2,是一种无色、 无味、无毒的气体。
氮气是一种双原子气体,其化学键是 共价键,分子之间是单键结合。
氮气的相对分子质量为28.0134,是 空气的主要成分之一,约占空气的 78%。
有机化学 含氮化合物PPT课件

RX R2NH
RX R3N
R4N+X--
四、与亚硝酸反应
亚硝酸(HNO2 )不稳定, 反应时由 亚硝酸钠与盐酸或硫酸作用而得。
1、脂肪胺与HNO2的反应:
第32页/共96页
RCH2CH2NH2 NaNO2 + HCl 低温
RCH2CH2N2Cl 重氮盐
分解 RCH2CH2 + N2 + Cl
生成的碳正离子可以发生各种不同 的反应生成烯烃、醇和卤代烃。
R4NX 季铵盐
ArNR2
R4NOH 季铵碱
必须注意区分“胺”、“铵”、“氨”的用法。
二、命名
1、简单的胺: 烃基数目 + 烃基名称 + 胺。
CH3NH2 (CH3)2NH CH3NHC2H5 CH3
NH2
甲胺
二甲胺 甲乙胺
第16页/共96页
对甲苯胺
2、多元胺: 烃基名称 + 氨基数目 + 胺。
NH2CH2CH2NH2
对于取代芳胺,当苯环上是供电子基 团,碱性增加,反之,当苯环上是吸电子 基团,碱性减小。
第23页/共96页
NH2
NH2
NH2
NO2
CH3
H
a
b
c
CH3CH2NH2 d
由于胺是弱碱,其盐与强碱作用可以 析出胺,通过该性质可以分离、提纯胺类 化合物:
RN+H3X--
+ NaOH
RNH2
第24页/共96页
RN
H OH2 H OH2 H OH2
H OH2 R2 N H OH2
2、芳香族胺ArNH2的碱性
第22页/共96页
H
R3
含氮有机化合物—精品课件

NO N
亚硝胺的致癌机理
在酶的作用下, 先形成羟基亚硝胺, 再经脱醛作用,生成单烷 基亚硝胺, 再经脱氮作用, 形成亲电子的烷基自由基, 后者在 肝脏或细胞内使核酸烷基化,生成烷基鸟嘌呤,引起细胞遗传突 变, 因而显示致癌性。以二甲基亚硝胺为例进行描述:
CH3 N NO
CH3
羟基酶 α-羟基化
CH3 N NO
O NH CCH3
NH2 O O +
O NHCCH3
H3C
O
H3C
(二)酰化和磺化反应
1、酰基反应
CH3CH2NHCH3 +
O C Cl
O C N CH2CH3
CH3
NHCH3
O
+ CH3C Cl
CH3 N CCH3
O
(二)酰化和磺化反应
2、磺化反应 伯胺和仲胺与磺酰化试剂作用,氨基上的氢 原子被磺酰基取代,生成相应芳磺酰胺。
N2Cl H3PO2 , H2O
+ N2
二、重氮盐的反应
(一)取代反应:
被氰基取代 芳香重氮盐与氰化钾、氰化亚 铜作用,重氮基被氰基取代,并放出氮气。
二、重氮盐的反应
(二)偶联反应: 重氮正离子是一个弱的亲电试剂(比NO2+、SO3等 亲电试剂弱得多),在一定PH下,能与酚或芳胺发 生亲电取代反应,生成有鲜艳颜色的偶氮化合物。 如果对位已被占据,则在邻位上发生偶联。
对于非芳香叔胺,若烃基不同时,按“次序规则” 较小基团做取代基,并在前面冠以“N-” 的标
示。
CH3CH2NHCH3 甲乙胺
CH3NCH2CH3 CH2CH2CH3
N-甲基-N-乙基丙胺
二、胺的命名
3.芳香族仲胺和叔胺,以芳香伯胺为母体,脂 肪烃基作为取代基,并将其名称写在母体的前 面,并冠以“N-” 的标示,以表明脂肪烃基 是连在N原子上,而不是连在苯环上。
亚硝胺的致癌机理
在酶的作用下, 先形成羟基亚硝胺, 再经脱醛作用,生成单烷 基亚硝胺, 再经脱氮作用, 形成亲电子的烷基自由基, 后者在 肝脏或细胞内使核酸烷基化,生成烷基鸟嘌呤,引起细胞遗传突 变, 因而显示致癌性。以二甲基亚硝胺为例进行描述:
CH3 N NO
CH3
羟基酶 α-羟基化
CH3 N NO
O NH CCH3
NH2 O O +
O NHCCH3
H3C
O
H3C
(二)酰化和磺化反应
1、酰基反应
CH3CH2NHCH3 +
O C Cl
O C N CH2CH3
CH3
NHCH3
O
+ CH3C Cl
CH3 N CCH3
O
(二)酰化和磺化反应
2、磺化反应 伯胺和仲胺与磺酰化试剂作用,氨基上的氢 原子被磺酰基取代,生成相应芳磺酰胺。
N2Cl H3PO2 , H2O
+ N2
二、重氮盐的反应
(一)取代反应:
被氰基取代 芳香重氮盐与氰化钾、氰化亚 铜作用,重氮基被氰基取代,并放出氮气。
二、重氮盐的反应
(二)偶联反应: 重氮正离子是一个弱的亲电试剂(比NO2+、SO3等 亲电试剂弱得多),在一定PH下,能与酚或芳胺发 生亲电取代反应,生成有鲜艳颜色的偶氮化合物。 如果对位已被占据,则在邻位上发生偶联。
对于非芳香叔胺,若烃基不同时,按“次序规则” 较小基团做取代基,并在前面冠以“N-” 的标
示。
CH3CH2NHCH3 甲乙胺
CH3NCH2CH3 CH2CH2CH3
N-甲基-N-乙基丙胺
二、胺的命名
3.芳香族仲胺和叔胺,以芳香伯胺为母体,脂 肪烃基作为取代基,并将其名称写在母体的前 面,并冠以“N-” 的标示,以表明脂肪烃基 是连在N原子上,而不是连在苯环上。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十二章含氮化合物新
12I 硝基化合物
12I-1 硝基化合物的种类及命名:
➢酯类:
H O NO2
硝酸
R O NO2
硝酸酯
H3C O NO2
硝酸甲酯
H O NO R O NO
亚硝酸 亚硝酸酯
H3CH2C O NO
亚硝酸乙酯
➢硝基化合物类:
R NO2
硝基化合物
R NO
亚硝基化合物
H3CH2C NO2
N O 2 H 3+O
O 2N
OH NO2
NO2
NO2
•而通常苯环难以被亲核取代;
Cl
OH
NaOH
H+
高温,高压
难以反应
•硝基芳香卤代烃的亲核取代举例
OCH3 NO2
NO2
NaOCH3
Cl NO2
NaSH
SH NO2
NO2
NHNH2 NO2
NO2
NO2 NH2NH2
NH2CH3
NHCH3 NO2
对映关系 但无手性
脂肪胺 N 原子一 般为 sp3 杂化
•手性胺或手性季铵盐
手性 中心
N
N
手性 中心
手性
R1
中心 N
R4
R2
R3
CH3
C2H5
N+ IPh
CH2 CH CH2
CH3
I-N+ Ph
C2H5
H2C CH CH2
➢胺的命名: •简单的胺命名为: 烃基 + 胺;
C2H5 NH2
乙胺
C2H5 C2H5 N C2H5
Z n / N a O H
N O 2
N H N H
12I-3.2 脂肪族硝基化合物的酸性;
O RC H 2 N
O
O H RC HN
O
O RC HN
O H
R C H 2N O 2+ N a O H N aR C H N O 2+ H 2 O
➢脂肪族硝基化合物负离子的稳定性:
O RCHN
O
O RCHN
硝基乙烷
CH3
NO
间亚硝基甲苯
H2C O NO2 HC O NO2 H2C O NO2
三硝酸甘油酯
CH3
O2N
NO2
NO2
2,4,6-三硝基甲苯
12I-2 硝基化合物的物理性质
➢由于硝基的强吸电子性,硝基化合物 的极性很大,是有机良溶剂;
O
RN
O
两个N—O键 等长
O
RN O
不能反映 实际结构
➢硝基化合物的密度比水大; ➢硝基化合物的熔、沸点一般较高; ➢硝基化合物一般有毒;
三乙胺
C2H5 NH C2H5
二乙胺
Me
N Et
甲基乙基环丙胺
•芳香族仲胺或叔胺, 用N指示位置;
NH2
苯胺
CH3 N
CH3
N,N-二甲基苯胺
CH2CH3 N
CH3
N-甲基-N-乙基苯胺
H3C
NH CH3
N,4-二甲基苯胺
•复杂的胺按IUPAC命名法, 把胺基当作 取代基;
NH2CH2CH2NH2
➢芳香胺极具毒性, 某些有致癌作用;
12II-3 胺的化学性质 12II-3.1 胺结构分析;
有未共用电子对
• 有碱性 • 有亲核性 • 可被氧化剂氧化
RN H H
RN R H
RNR R
有活泼氢
• 可被强碱夺取 • 可被氧化剂氧化
12II-3.2 胺的碱性 ➢碱性强弱:脂肪胺﹥ 氨﹥芳香胺;
伯胺﹤ 仲胺﹥叔胺;
NO2
➢硝基使邻、对位苯酚的酸性增强;
OH
OH
OH
OH
NO2
P K a 9.89
7 .1 7
O
O
N
NO2
7 .1 6
NO2
8 .2 8
OH NO2
NO2
P K a 3.96
12II 胺
12II-1 胺的分类和命名
➢胺可看作氨的氢被烃基取代后的产物,
其中-NH2称氨基,-NH-称亚氨基,是胺 的官能团;
4.30D
1.40D
12II-3.3 胺的氧化;
➢胺容易被氧化,脂肪伯、仲胺及芳香 胺的氧化产物很复杂,叔胺与过氧化氢 在室温放置得氧化胺;
[O ] R NH2
R NHOH + R NO + R NO2
产物复杂
R3N H2O2 R3N O 氧 化 胺
R" RN
R'
H 2O 2
O
O
N
+
N
"R
R' R'
C2H5
氢氧化三甲乙胺
N
NH2
4-氨基吡啶
12II-2 胺的物理性质
➢胺能与水形成氢键, 在水等质子溶剂 中溶解性较大;
➢N-H氢键不如O-H的氢键强, 所以胺的 沸点较相应的醇低, 而叔鞍由于没有氢 作用, 其沸点甚至于接近烷烃;
➢胺一般有特殊的气味, 1,4-丁二胺又名 腐胺, 1,5-戊二胺又名尸胺;
12I-3 硝基化合物的化学性质 12I-3.1 硝基的还原: ➢催化氢化:
R NO2
H2
R NH2 +2H2O
Catalyst
Cat: Ni, Pd, Pt等
➢活泼金属与酸对硝基还原: 酸性还原
NO2 M/ HCl
NH2
M=Fe, Zn, SnorSnCl2
➢活泼金属与碱对硝基还原: 碱性还原
O
O RCHN
O
12I-3.3 硝基对芳环上取代基的影响; ➢硝基使苯环难以被亲电取代;
O O N
OO N
OO N
OO N
OO N
➢硝基使苯环的邻、对位被亲核取代;
N aO H
H+
O 2N
X 135~160℃
O 2N
OH
X
N O 2 N a2C O 3
H+
100℃
NO2
OH NO2
NO2
X O 2N
H
H
HNH
HNR
➢胺按烃基数目分伯、仲、叔、季胺; ➢按烃基类型分脂肪胺和芳香胺;
R
R
R
R
H N R N R N R N RX
H
H
R
一级胺 二级胺 三级胺
伯胺
仲胺 叔胺
四 R级胺 季铵盐
➢胺类化合物的结构与立体异构;
R'
快速翻转 R
N
N
R R'
R" 25kJ/mol
R" 转180o "R
N R
R'
R"
R
R
有手性的胺氧化物
12II-3.4 胺的烷基化(alkylation);
➢胺上的氢被烷基取代的反应称为胺 的烷基化;
NH3 + R' X RNH2 + R' X
NH2 R' + HX RNH R' + HX
NH4X
R2NH + R' X R3N + R' X
R2N R' + HX
R3N R' X 季铵盐
R NH2 + H2O R NH2 + HCl
+
_
RNH3 + OH
+
_
RNH3 + Cl
➢芳胺的p-共轭造成:
• C—N键缩短(1.40Å比正常1.47Å短);
•氮的碱性及亲核性降低, 芳环的亲电取 代活性增强;
H
H
R
H
N
R
H
H
•芳胺的p-共轭的实验数据证明:
NH2
NH2
CF3
u
2.90D
CF3
➢胺或氨的烷基化是连串反应
1,2-乙二胺
CH3CH CH2CH(CH3)2
NH2
2-甲基-4-氨基戊烷
CH3NH CH(CH2)4CH3
CH3
2-甲氨基庚烷
NH2CH2CH2CH2COOH
氨基丁酸 氨基丁酸
CH3 N(C2H5)2 CH3CH2 CH CHCH3
2-(N,N-二乙胺基)-3-甲基戊烷
CH3 CH3 N+ CH3 OH-
12I 硝基化合物
12I-1 硝基化合物的种类及命名:
➢酯类:
H O NO2
硝酸
R O NO2
硝酸酯
H3C O NO2
硝酸甲酯
H O NO R O NO
亚硝酸 亚硝酸酯
H3CH2C O NO
亚硝酸乙酯
➢硝基化合物类:
R NO2
硝基化合物
R NO
亚硝基化合物
H3CH2C NO2
N O 2 H 3+O
O 2N
OH NO2
NO2
NO2
•而通常苯环难以被亲核取代;
Cl
OH
NaOH
H+
高温,高压
难以反应
•硝基芳香卤代烃的亲核取代举例
OCH3 NO2
NO2
NaOCH3
Cl NO2
NaSH
SH NO2
NO2
NHNH2 NO2
NO2
NO2 NH2NH2
NH2CH3
NHCH3 NO2
对映关系 但无手性
脂肪胺 N 原子一 般为 sp3 杂化
•手性胺或手性季铵盐
手性 中心
N
N
手性 中心
手性
R1
中心 N
R4
R2
R3
CH3
C2H5
N+ IPh
CH2 CH CH2
CH3
I-N+ Ph
C2H5
H2C CH CH2
➢胺的命名: •简单的胺命名为: 烃基 + 胺;
C2H5 NH2
乙胺
C2H5 C2H5 N C2H5
Z n / N a O H
N O 2
N H N H
12I-3.2 脂肪族硝基化合物的酸性;
O RC H 2 N
O
O H RC HN
O
O RC HN
O H
R C H 2N O 2+ N a O H N aR C H N O 2+ H 2 O
➢脂肪族硝基化合物负离子的稳定性:
O RCHN
O
O RCHN
硝基乙烷
CH3
NO
间亚硝基甲苯
H2C O NO2 HC O NO2 H2C O NO2
三硝酸甘油酯
CH3
O2N
NO2
NO2
2,4,6-三硝基甲苯
12I-2 硝基化合物的物理性质
➢由于硝基的强吸电子性,硝基化合物 的极性很大,是有机良溶剂;
O
RN
O
两个N—O键 等长
O
RN O
不能反映 实际结构
➢硝基化合物的密度比水大; ➢硝基化合物的熔、沸点一般较高; ➢硝基化合物一般有毒;
三乙胺
C2H5 NH C2H5
二乙胺
Me
N Et
甲基乙基环丙胺
•芳香族仲胺或叔胺, 用N指示位置;
NH2
苯胺
CH3 N
CH3
N,N-二甲基苯胺
CH2CH3 N
CH3
N-甲基-N-乙基苯胺
H3C
NH CH3
N,4-二甲基苯胺
•复杂的胺按IUPAC命名法, 把胺基当作 取代基;
NH2CH2CH2NH2
➢芳香胺极具毒性, 某些有致癌作用;
12II-3 胺的化学性质 12II-3.1 胺结构分析;
有未共用电子对
• 有碱性 • 有亲核性 • 可被氧化剂氧化
RN H H
RN R H
RNR R
有活泼氢
• 可被强碱夺取 • 可被氧化剂氧化
12II-3.2 胺的碱性 ➢碱性强弱:脂肪胺﹥ 氨﹥芳香胺;
伯胺﹤ 仲胺﹥叔胺;
NO2
➢硝基使邻、对位苯酚的酸性增强;
OH
OH
OH
OH
NO2
P K a 9.89
7 .1 7
O
O
N
NO2
7 .1 6
NO2
8 .2 8
OH NO2
NO2
P K a 3.96
12II 胺
12II-1 胺的分类和命名
➢胺可看作氨的氢被烃基取代后的产物,
其中-NH2称氨基,-NH-称亚氨基,是胺 的官能团;
4.30D
1.40D
12II-3.3 胺的氧化;
➢胺容易被氧化,脂肪伯、仲胺及芳香 胺的氧化产物很复杂,叔胺与过氧化氢 在室温放置得氧化胺;
[O ] R NH2
R NHOH + R NO + R NO2
产物复杂
R3N H2O2 R3N O 氧 化 胺
R" RN
R'
H 2O 2
O
O
N
+
N
"R
R' R'
C2H5
氢氧化三甲乙胺
N
NH2
4-氨基吡啶
12II-2 胺的物理性质
➢胺能与水形成氢键, 在水等质子溶剂 中溶解性较大;
➢N-H氢键不如O-H的氢键强, 所以胺的 沸点较相应的醇低, 而叔鞍由于没有氢 作用, 其沸点甚至于接近烷烃;
➢胺一般有特殊的气味, 1,4-丁二胺又名 腐胺, 1,5-戊二胺又名尸胺;
12I-3 硝基化合物的化学性质 12I-3.1 硝基的还原: ➢催化氢化:
R NO2
H2
R NH2 +2H2O
Catalyst
Cat: Ni, Pd, Pt等
➢活泼金属与酸对硝基还原: 酸性还原
NO2 M/ HCl
NH2
M=Fe, Zn, SnorSnCl2
➢活泼金属与碱对硝基还原: 碱性还原
O
O RCHN
O
12I-3.3 硝基对芳环上取代基的影响; ➢硝基使苯环难以被亲电取代;
O O N
OO N
OO N
OO N
OO N
➢硝基使苯环的邻、对位被亲核取代;
N aO H
H+
O 2N
X 135~160℃
O 2N
OH
X
N O 2 N a2C O 3
H+
100℃
NO2
OH NO2
NO2
X O 2N
H
H
HNH
HNR
➢胺按烃基数目分伯、仲、叔、季胺; ➢按烃基类型分脂肪胺和芳香胺;
R
R
R
R
H N R N R N R N RX
H
H
R
一级胺 二级胺 三级胺
伯胺
仲胺 叔胺
四 R级胺 季铵盐
➢胺类化合物的结构与立体异构;
R'
快速翻转 R
N
N
R R'
R" 25kJ/mol
R" 转180o "R
N R
R'
R"
R
R
有手性的胺氧化物
12II-3.4 胺的烷基化(alkylation);
➢胺上的氢被烷基取代的反应称为胺 的烷基化;
NH3 + R' X RNH2 + R' X
NH2 R' + HX RNH R' + HX
NH4X
R2NH + R' X R3N + R' X
R2N R' + HX
R3N R' X 季铵盐
R NH2 + H2O R NH2 + HCl
+
_
RNH3 + OH
+
_
RNH3 + Cl
➢芳胺的p-共轭造成:
• C—N键缩短(1.40Å比正常1.47Å短);
•氮的碱性及亲核性降低, 芳环的亲电取 代活性增强;
H
H
R
H
N
R
H
H
•芳胺的p-共轭的实验数据证明:
NH2
NH2
CF3
u
2.90D
CF3
➢胺或氨的烷基化是连串反应
1,2-乙二胺
CH3CH CH2CH(CH3)2
NH2
2-甲基-4-氨基戊烷
CH3NH CH(CH2)4CH3
CH3
2-甲氨基庚烷
NH2CH2CH2CH2COOH
氨基丁酸 氨基丁酸
CH3 N(C2H5)2 CH3CH2 CH CHCH3
2-(N,N-二乙胺基)-3-甲基戊烷
CH3 CH3 N+ CH3 OH-
