第十一章羧酸及其衍生物
11._羧酸及其衍生物
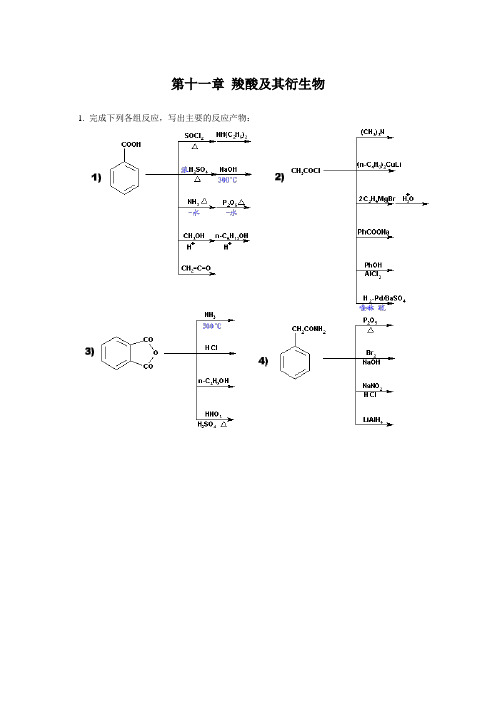
第十一章羧酸及其衍生物1. 完成下列各组反应,写出主要的反应产物:2. 写出下列反应的主产物:3. 两个什么样的化合物缩合后再酸化会得到下列各产物?4. 给下列反应式填入适当的试剂:5. 回答下列问题:1)比较下列各酯水解的反应相对活性:2)比较下列各个酯氨解反应的相对活性:3)比较化合物的酸性强弱顺序:3. 两个什么样的化合物缩合后再酸化会得到下列各产物?4. 给下列反应式填入适当的试剂:5. 回答下列问题:1)比较下列各酯水解的反应相对活性:2)比较下列各个酯氨解反应的相对活性:3)比较化合物的酸性强弱顺序:8. 某化合物(E) 的分子式为C5H6O3,(E)和乙醇作用得到两个互为异构体(F)和(G),将(F)和(G)分别与亚硫酰氯作用后,再与乙醇作用得到相同的化合物(H),试推测(E)(F)(G)(H)的构造式,并写出各步反应式。
9. 一个中性化合物C7H13O2Br,与羟氨和苯肼均没有反应。
IR 谱在2850-2950cm-1区域有吸收峰,而在3000cm-1以上区域没有吸收峰,另外一个较强的吸收峰在1740cm-1。
NMR 谱在δ=1.0(3H)三重峰;δ=1.3(6H)二重峰;δ=2.1(2H)多重峰;δ=4.2(1H) 三重峰;δ=4.6(1H) 多重峰。
请推测此化合物的结构。
10. 化合物A, 分子式为C9H10O3。
它不溶于水、稀HCl 及稀NaHCO3溶液,但能溶于NaOH 液。
A 与稀NaOH 共热后,冷却酸化得一沉淀B,分子式为C7H6O3,B 能溶于NaHCO3溶液并放出气体,B 与FeCl3 溶液作用给出紫色,B 在酸性介质中可以进行水蒸气蒸馏,写出A,B 的构造式及各步反应式。
11. 写出化合物的A-F 正确构造式。
12. 推测化合物A-F 的结构。
13. 化合物A的分子式为C10H22O2,与碱不起作用,但可被稀酸水解成B 和C。
C 的分子式为C3H8O,与金属钠作用有气体放出,能与NaIO 反应。
11取代羧酸

H—C—COOH O 乙醛酸
CH3 C COOH O
α-丙酮酸
β-丁酮酸
CH3 C CH2COOH O
一、 酮酸的命名
以羧酸为母体, 酮基作取代基, 酮基的位次用阿 拉伯数字或希腊字母标明。酮基也可称为氧代。
O
O
O
C CH2COOH CH3CCOOH H CH C 3CH 2COOH a b
丙酮酸或2-氧代丙酸 b -丁酮酸(乙酰乙酸)
2.β-酮酸的分解反应
(1) 脱羧反应
β-酮酸比α-酮酸更易脱羧, 通常β-酮酸只能在低温下保存。
O CH3 C CH2COOH
温热
O CH3 C CH3
CO2
β-酮酸由于羧基受β-羰基的影响, 同时也由于 形成6员环的分子内氢键而使脱羧更加容易。其反 应机制为:
O H CH3 C O C O β-丁酮酸
O H CH3 C O C O
CO2
微热
CH3 C CH2 烯醇式
OH
O CH3 C CH3
由于β-酮酸脱羧产物是酮,故称为酮式分解。
(2) 酸式分解
β-酮酸与浓碱共热,分解为两分子羧酸盐,称为酸式分解。
O CH3CH2CCH2CO2H β-戊酮酸 NaOH
△
CH3CH2CO2Na 丙酸钠
CH3CO2Na 乙酸钠
CO2H
> HO
4.54
CO2H
邻位-OH: +C效应 间位-OH主要 及 分 子 内 氢 键 . 后 表现为 -I 效应 者使酸性明显增强
对位-OH主要 表现 +C 效应
OH C O O H
O C O O H
H
2.酚酸的脱羧反应
第十一章羧酸及其衍生物

第十章羧酸及其衍生物【教学重点】羧酸及其衍生物的化学性质、丙二酸二乙酯和乙酰乙酸乙酯在合成上的应用。
【教学难点】诱导效应、酰基上的亲核取代反应机理。
【教学基本内容】羧酸的结构;羧酸的制备方法;羧酸及其衍生物的物理性质;羧酸的化学性质——羧酸的酸性及影响酸性强度的因素(诱导效应、共轭效应和场效应);羧酸衍生物的生成;羧基的还原反应;脱羧反应;α-氢原子的卤代反应。
羟基酸的制备方法(卤代酸水解、羟基腈水解、Refomatsky反应)、羟基酸的化学性质——酸性、脱水反应、α-羟基酸的分解。
羧酸衍生物的化学性质——酰基上的亲核取代反应(水解、醇解、氨解)及其反应机理;还原反应;与Grignard反应;酰胺氮原子上的反应(酰胺的酸碱性、脱水反应、Hofmann降解反应)。
乙酰乙酸乙酯的制备方法(Claisen酯缩合);乙酰乙酸乙酯的化学性质——酮式-烯醇式互变异构、酸式分解和酮式分解;乙酰乙酸乙酯在合成上的应用。
丙二酸二乙酯的制备及在合成上的应用。
Ⅰ目的要求羧酸是含有羧基(—COOH)的含氧有机化合物,我们平常所说的有机酸就是指的这类化合物。
所谓羧酸衍生物,包括的化合物种类很多,诸如羧酸盐类、酰卤类、酯类(包括内酯、交酯、聚酯等)、酸酐类、酰胺类(包括酰亚胺、内酰胺)等都是羧酸衍生物,有人甚至把腈类也包括在羧酸衍生物的范围之内。
其实,比较常见的而又比较重要的是酰卤、酸酐、酯和酰胺这四类化合物。
羧酸盐与一般无机酸盐在键价类型上没大区别,不作专门介绍。
至于腈类,将放在含氮化合物中加以介绍。
这四类化合物都是羧酸分子中,因酰基转移而产生的衍生物,所以又叫羧酸的酰基衍生物。
羧酸及其衍生物RCOL(L:-OH、-X、-OOCR′、-OR′、-NH2)在许多重要天然产物的构成以及在生物代谢过程中均占有重要地位。
本章将以饱和一元脂肪酸为重点,讨论羧酸及其衍生物的结构和性质。
鉴于乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的重要地位,本章作概括介绍。
有机化学-羧酸及其衍生物

O CH3OC
O
H+
COCH3 + 2HOCH2CH2OH -2CH3OH
酯交换
O
O
O HOCH2CH2 OC
O
CH3OC
COCH3
COCH2CH2OH
HOCH2CH2OH
酯交换
O
O
C
C OCH2CH2O n n=80100
( 涤纶 )
16
4、酰胺的反应
酰胺的反应活性更小,需在酸或碱催化下长时间
加热回流才能水解
O
或 其它试剂
R CH
醛
水解反应 醇解反应 胺解反应
还原反应
11
1、酰氯的取代反应
H—OH O
R—C—Cl + H—OR'
H—NH2
O
R—C—OH O
HCl 水解
R—C—OR' + HCl 醇解
O
R—C—NH2 NH4Cl 氨解
(酰氯活性大是个优良的酰基化试剂)
O CH3CCl + CH3CH2CH2OH
RCH2
O CX
O
O
RCH2 C O C R
O RCH2 C OR'CH C
H
有弱酸性
可加成至 饱和
L
可被亲核 试剂取代
L: 离去基团 (Leaving group)
9
一、羧酸衍生物的取代反应
这类反应是羧酸衍生物与羧酸、以及羧酸衍生物 之间的相互转化。
O RCL
HOH
R C OH
RCOOH
OO
O
RC O C R HOR'
R C OR' RCOOH
羧酸及衍生物

H HOOC
H
chrysanthemic acid (pyrethrin)
二、物理性质(physical properities)
沸 点:
CH3CH2CH2OH CH 3CO OH
2OH
HCOO H
+ H2O
COOH 230℃ COOH
丁二 酸 酐 二 丁 CO 酸 酐 O
KMnO4 H2SO4
O
COOH COOH
P2O5
O
O + H2OFra bibliotek⑷ 酰卤 (acyl halide)的生成:
O R C O OH + Cl S Cl 亚硫酰氯 氯化亚砜 O
R
C
Cl + HCl + SO2
卤化试剂:PCl3, PCl5, SOCl2, PBr3
COOH
A-CH2-COOH
加热 ,碱
CH
ACH3 + CO2
在结构上,两个吸电子基连在同一个碳上的 化合物,热力学上是不稳定的,受热易脱羧。
HOOCCH2COOH
CH3COOH + CO2
当-碳上连有吸电子基团时,羧酸受热易发生脱 羧反应。
O O CH3 C C O H
-CO2
O CH3 C H
合成题:
COOH CH2Br
解:
COOH 1).LiAlH4 2).H3O+
HBr CH2Br
CH2OH
4. 脱羧反应(decarboxylation)
—羧酸失去羧基的反应,即脱去一分子CO2。
《有机化学》第十一章 羧酸及其衍生物的结构与性质

第十一章羧酸及其衍生物的结构与性质引言羧基()是羧酸的官能团,是由羰基和羟基组成的。
由于羰基的碳氧双键与羟基氧原子的共轭效应的作用,使羟基中氧原子电子向羰基转移,羟基的氢易离解而显酸性。
羧基中羟基也能被其它基团取代生成羧酸衍生物。
羧基是吸电子基,α-H具有活性,可以被卤代。
此外羧酸还能被还原和发生脱羧反应。
这里所讨论的羧酸衍生物主要是指羧基中羟基被取代后生成的酰卤(),酸酐(),酯(),酰胺()以及由酰胺脱水后生成的产物腈()。
在羧酸衍生物中羰基与卤素,酰胺基,烷氧基和氨基相连,由于卤素,氧原子和氮原子的负电性以及孤对电子的作用,使羰基碳上正电性不同,因此它们发生亲核反应性质也有差别。
羧酸衍生物还能发生还原反应。
11.1 羧酸的酸性羧酸是弱酸,能与强碱反应生成盐:羧酸酸性的强弱与所连的基团有关,连吸电子基团的羧酸酸性较强,而连供电子基团的酸性相对较弱。
如下列化合物酸性强弱顺序为:11.2 羧酸衍生物的生成羧基中的羟基被卤素、酰胺基、烷氧基和氨基取代形成酰卤、酸酐、酯和酰胺等羧酸衍生物。
1、酰卤的形成羧酸与SO2Cl,PCl5,PCl3等氯化剂直接反应生成酰卤:因为POCl3沸点低易除去,此法可制备高沸点的酰氯。
H3PO3沸点高,可制备低沸点的酰氯。
该法产生的SO2,HCl易除去,因此生成的酰氯纯度高,后处理容易。
2、酸酐的形成羧酸在脱水剂(如乙酰氯、乙酸酐)存在下加热,失去一分子水而生成酸酐。
二元酸可以分子内脱水生成二酸酐:3、酯化反应羧酸和醇在催化剂(H2SO4、HCl或苯磺酸等)作用下回流生成酯:酯化反应由多种机理,在大多数情况下,是羧酸中羟基与醇中羟基氢结合生成水,表观上看是一种亲核取代反应,实际上是一个亲核加成-消除反应的机理:决定反应速度的一步是亲核加成,因此羧基中碳的正电性以及羧基所连的基团大小核亲核试剂R'OH中R'体积大小都影响反应的速度,下列羧酸与甲醇酯化反应的相对速度的快慢顺序为:4、形成酰胺的反应羧酸与氨立即反应生成盐,在加热条件下,脱水生成酰胺,生成酰胺的反应是可逆的,如果把生成的水从反应体系中除去,反应可趋于完全。
羧酸及其衍生物ppt课件

RCOOR"+ R'MgCl
RCOR' (fast)
RCOR'
(1) R'MgCl (2) H2O
R' R C OH R'
酸酐与Grignard 试剂的反应在低温下也可得到酮。
2.2.3 还原
催化氢化或用LiAlH4作还原剂,酰卤、酸酐、酯可被还原成醇,酰胺 则被还原成胺。 2.2.4 酯的缩合反应 • Claisen缩合:
2.2 化学性质 2.2.1 亲核取代反应 (水解、醇解、氨解等)
O R C
L
O O
+
Nu
R
C Nu
L
RCNu
+
L
反应活性: RCOCl > (RCO)2O > RCOOR’ > RCONH2 > RCONR’2
水解: RCOCl (RCO)2O RCOOR’ RCONH2 醇解: RCOCl (RCO)2O + R’OH RCOOR’ + HCl RCOOR’ + RCOOH + H2O RCOOH + HCl 2 RCOOH (加热) (催化) (催化、回流) RCOOH + R’OH RCOOH + NH3
一元羧酸:
HCOOH 甲酸
CH3COOH 乙酸
CH3CHCH2COOH
COOH
CH3C CH3
CHCOOH
Cl
3-甲基-2-丁烯酸
3-(对-氯苯基)丁酸
苯甲酸
二元羧酸:
COOH
CHCOOH
HOOCCOOH
第十一、十二章 羧酸及其衍生物

2. 溶解性(solubility) 低级羧酸与水混溶;高级羧酸不溶;一般二元和 多元酸易溶。
第18页,共109页。
羧酸的物理性质
3.熔点(melting point)
有一定规律,随着分子中碳原子数目的增加呈锯齿状的 变化。
乙酸熔点16.6℃,当室温低于此温度时,立即凝成冰状 结晶,故纯乙酸又称为冰醋酸。
COOH
CHCO2H OH
羧基 连在Ar或R
上都可
羟基酸
C CO2H O
羰基酸
CH COOH NH2
氨基酸
取代羧酸
第1页,共109页。
羧酸分子中烃基上的氢被取代后的产物称取代羧酸。
R CH COOH X
R CH COOH OH
R C COOH O
R CH COOH NH2
取代羧酸
R
O
R
R C OH
R
R
O CX O C OCOR O C OR O C NH2
羧酸衍生物
第2页,共109页。
DHA怎么补?
DHA
DHA,二十二碳六烯酸(docosahexenoic acid ),俗称脑 黄金,是一种对人体非常重要的多不饱和脂肪酸,属于 Omega-3不饱和脂肪酸家族中的重要成员。DHA是神经系统
细胞生长及维持的一种主要元素,是大脑和视网膜的重要
136pm
O···· H
羰基和羟基通过 p-π共轭 构成一个整 体, 故羧基不是羰基和羟基的简单加合。
第15页,共109页。
123pm
127pm
R
136pm 游离羧酸分子中的 p-π 共轭
R
H
127pm 羧酸根负离子的 p-π 共轭
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
RC OCH3
CH3 NH2 147.4pm O
RC NH N
CH3 OH 143.0pm O RC OCH3
p-π共轭,部分双键。
O H3C C Cl
133.4pm
O ..
RC Cl
CH3 Cl 143.0pm
O RC Cl
p-π +C: RCONH2 > RCOOR’ > RCOCl C=O 的反应性:RCONH2 < RCOOR’ < RCOCl
PBr3
O RCH2CBr
α-H活性增大
OH RCH=CBr
Br2 -HBr
O RCHCBr RCH2CO2H
O
O
RCHCOH + RCH2CBr
Br
Br
P Br2
PBr3
例:
CO2H P/Br2
CO2H Br
PhCH2CO2H PBr3/Br2 PhCHCO2H Br
11.2. 羧酸衍生物 羧酸的羟基被其它含杂原子基团取代的有机物称羧酸衍生物 (carboxylic acid derivative)。
RCN
H2O H+ or OH
RCONH2
H2O H+ or OH
H2O
NH ..
R C OH
酯水解: O
RC O R' a.酰氧断裂
ab
b.烷氧断裂
RCOOH
(1) 碱性酯水解
O
CH3COC5H11 + 18OH
O CH3C 18OH + C5H11O
O CH3C 18O + C5H11OH
8
酰氧断裂 加成-消除历程:
CH3(CH2)14COOH 棕榈酸
1
HOOC-COOH 草酸
HOOCCH(OH)CH(OH)COOH 酒石酸
(2)IUPAC 法 含-COOH 最长碳链, 从-COOH 编号
(CH3)2CHCHCH2COOH Cl
4-甲基-3-氯戊酸 3-chloro-4-methylpentanoic
acid
PhCH2OH
O
1. LiAlH4
OH 2. H2O
OH
5.α-卤代
O RCH2COH
PBr3/Br2
O RCHCOH
Br
O ..
RCH C OH H δ+减小,α-H活性减小。
5
在磷或卤化磷催化下,羧酸与卤素作用生成α-卤代酸的反应称
Hell-Volhard-Zelinsky 反应。
历程:
O RCH2COH
7
2.性质比较
亲核取代反应:
O R C L + Nu
加成
O R C Nu
消除
O R C Nu + L
加成-消除历程
L
加成: L 吸电子有利;反应性,-X > -OCOR > -OR > -NH2 消除: Lˉ碱性弱易离去;反应性同上。
亲核取代的反应性:R’CO-X > R’CO -OCOR > R’CO -OR > R’CO -NH2 Nu: H2O RCOOH ROH RNH2
亲核取代反应: 水解 酸解 醇解 胺解
············产物: 酸
酐
酯
酰胺
三. 化学性质 1.水解(Hydrolysis)
RCOCl
RCOOH + HCl
(RCO)2O H2O
2RCOOH
RCOOR' RCONR'2
r.t. or H+ or OH
RCOOH + R'OH RCOO + NH2R'2
[O ]
ArCHRR'
ArCOOH
CH(CH3)2 K2Cr2O7 H+
(CH2)6CH3
COOH COOH
2
2.水解法
腈:
RX CN
RCN
H3O
RCOOH
Br
Br 2NaCN NC
CN H3O HOOC
COOH
三卤代烃:
CH3 Cl2 hv
CCl3 H3O
COOH
酯:
RCOOR' H+ or OH
HO
COOH
3-羟基环戊烷酸 3-hydroxy cyclopentane
carboxylic acid
=CCH2CH2COOH CH2CH3
4-乙基-6-羟基-4-己烯酸 4-ethyl-6-hydroxy-4-hexenoic
acid
COOH
OCH3 间甲氧基苯甲酸 m-methoxy benzoic
4
1
C CO H
R'5
2
H
1.酸性
RCOOH + H2O
羧基: 1.酸性 2.酰化 3.脱羧 4.还原 α-氢: 5.卤代
RCOO + H3O
pKa = 4-5 ( H2CO3 pKa = 6.3 )
RCOOH + NaHCO3
RCOONa + CO2 + H2O
PhCO2H PhOH NaOH PhCH3
相对速度 1
0.93
(CH3)2CH (CH3)3C
0.57
1.15 ↑
1°,2°酰氧断裂;3°烷氧断裂。
O
CH3C O18 C(CH3)3 + H2O
H
O CH3C O18 H
历程:
O R C O C(CH3)3 H
OH R C O C(CH3)3
OH R C O + C(CH3)3
H2O (CH3)3COH2
第十一章 羧酸及其衍生物
11.1. 羧酸
含羧基的有机物称羧酸(carboxylic acid)。
O C OH 羧基 carboxyl
O RC
酰基 acyl
烃基种类,脂肪、芳香、取代酸等; 羧基数,一元、二元、多元酸。
一.结构和命名 1.结构
O 123pm
C 122.5o
sp2
136pm
OH
Oδ
C
负电荷分散在
电负性大的两个氧上。
Oδ
O R C OH
O
R C O..H
O R C OH
贡献小(正负电荷分离)。
O
O
RC O
RC O
稳定(极限式相同)
Oδ
R CH
3 4
Oδ
O
2 R C OH
稀溶液 低压气态
O HO
RC O
H
O C R 通过氢键形成二缔合体
固、液、高压气态
2.命名 (1)俗名
HCOOH 蚁酸
CH3COOH 醋酸
O R C OR' + OH
R-CO2Et R CH3
相对速度 1 R CH3
相对速度 1
O
R C OR'
OH 四面体中间体
O R C OH + OR'
CH2Cl 290
CH3CH2 0.470
CHCl2 CH3CO CCl3
6130
7200 23150
(CH3)2CH (CH3)3C
0.100
0.010
R22NH
H+ or OH
较困难
RCONR22 + R2NH2 Cl RCONR22 + RCOONHR22 RCONR22 + R1OH RCONR22 + R12NH
3.与格氏试剂的反应
(1)酯
酮 C=O 活性比酯高,难停在酮。
RCO2R1
1. R2MgX 2. H2O
OH RCR22
O
O 1. CH3CH2MgBr 2. H3O
O
CH3
R C O C* H
+ H2O
构型保持 (CH2)5CH3
叔醇,羧酸失 H:
RCOOH + (CH3)3CO18H
H+
RCOOC(CH3)3 + H2O18
历程:
(CH3)3CO18H
H+
(CH3)3CO18H2
(CH3)3C
O (CH3)3C + RCO-H
O
H+
RCHO-C(CH3)3
+ H2O18 RCOOC(CH3)3
RCH2OH
1o
10
Rosenmund还原:
RCOCl H2 / Pd-BaSO4 硫-喹啉
RCHO
CH3O2CCH2CH2COCl
H2 / Pd-BaSO4 硫-喹啉
(2)酯
RCOOR'
LiAiH4
RCH2OH 1o
CH3O2CCH2CH2CHO
(3)酰胺
O
RCNR1R2 LiAlH4
RCH2NR1R2
(CH3CO)2 乙酸酐
CH3COOCOCH2CH3 乙酸丙酸酐
OO O 丁二酸酐
腈(nitrile): CH3CN 乙腈
CH3CH2CH(CH3)CH2CN 3-甲基戊腈
NC(CH2)4CN 己二腈
二. 结构和性质比较
1.结构比较
O H C NH2 137.6pm
O ..
RC NH2
O H C OCH3 133.4pm
Cl
(4)生成酐
简单酸酐常用:
O 2 RC-OH
P2O5 H2O
OO RC-O-CR
混合酸酐常用:
RCOONa + R'COCl
