实验室用双氧水制取氧气教学流程
3.21用双氧水制取氧气

1
实验3-4:用过氧化氢(H2O2)溶液制取氧 气
步骤一:在常温下,把带火星的木条 伸入过氧化氢溶液的试管,观察木条 是否复燃? 现 象:木条不能复燃, 结 论:说明常温下无氧气放出。
2
步骤二:向上述试管中,加入少量二氧化锰, 把带火星的木条伸入试管。观察发生的现象。 现 象:木条复燃了 结 论:说明在常温下过氧化氢溶液遇到二 氧化锰(MnO2)时迅速产生大量的氧气。
速率变。 二不变:本身的质量不变、化学
性质不变。
4
文字表达式:过氧化氢 二氧化锰 水 + 氧气 符号表达式:H2O2 MnO2 H2O + O2
5
ቤተ መጻሕፍቲ ባይዱ 6
3
步骤三:反应停止后,重新加入过氧化氢溶液, 把带火星的木条伸入试管。观察发生的现象。
现 象:木条复燃了
结 论:说明产生大量的氧气,也就是说二氧 化锰(MnO2)仍然起作用。 催化剂:在化学反应里能改变其他物质的化学 反应速率,而本身质量和化学性质在化学反应 前后都没有发生变化的物质。
催化剂的特点:一变:其他物质的化学反应
双氧水制氧气的实验步骤

双氧水制氧气的实验步骤
制备双氧水制氧气的实验步骤如下:
1. 准备材料和设备:双氧水溶液、玻璃试管、橡皮塞、酒精灯、酒精灯架、钳子、气球。
2. 将一小瓶双氧水溶液倒入试管中,注意不要装满,留有一定空间。
3. 用酒精灯加热试管底部,使双氧水溶液加热至沸腾。
加热时应小心,以免溶液溢出。
4. 当试管中溶液沸腾时,立即将试管口用橡皮塞密封,同时将试管倒置。
5. 将试管的一端插入盛有水的容器中,使试管的另一端离开水面。
这样就可以观察到试管内的氧气在水中上升。
6. 将一个气球套在试管的另一端,注意保持气球的口与试管口紧密贴合。
7. 随着试管内的气体的上升,气体会逐渐被气球充满。
直到气球充满氧气为止。
8. 当气球充满氧气后,使用钳子夹住试管,使试管从水中取出。
9. 将气球的口用手指封住,可以将气球中的氧气取出使用。
需要注意的是,在进行这个实验的过程中,要注意安全。
加热试管时要小心,以免溶液溢出或试管破裂。
同时,处理试管时要戴上防护手套,避免直接接触试管和双氧水溶液。
实验室中用过氧化氢溶液制取氧气的化学方程式

实验室中用过氧化氢溶液制取氧气的化学方程式
过氧化氢是一种强氧化剂,水溶液俗称双氧水,为无色透明液体。
过氧化氢制取氧气的化学方程式为2H2O2=2H2O+O2↑。
实验药品:3%过氧化氢溶液、小木条、二氧化锰固体。
实验步骤
(1)在试管中加入少量过氧化氢溶液,把带火星的小木条放在试管口,观察现象(无明显现象)。
(2)在试管中加入少量二氧化锰,观察现象(出现大量气泡,木条复燃)。
(3)当停止生成气泡时,继续加入过氧化氢溶液,观察现象(出现大量气泡,木条复燃)。
(4)化学方程式:2H2O2=2H2O+O2↑。
实验室制取氧气的实验步骤

实验室制取氧气的实验步骤
制取氧气是一项常见的实验,通常使用过氧化铁(II)和过氧化
氢的反应来制备氧气。
以下是一种常见的实验步骤:
1. 准备实验器材,玻璃烧瓶、橡胶塞、吸管、水槽、过滤纸、
过氧化铁(II)粉末、过氧化氢溶液。
2. 在玻璃烧瓶中放入适量过氧化铁(II)粉末,然后加入适量的
过氧化氢溶液。
3. 立即用橡胶塞封闭烧瓶口,并用吸管将烧瓶口放入水槽中。
4. 随着反应进行,氧气会从烧瓶中析出,通过吸管进入水槽。
5. 当烧瓶内的反应停止产生气体时,可以停止实验,并用过滤
纸验证气体为氧气。
需要注意的是,制取氧气的实验涉及到氧气的收集和安全使用,实验者应当严格遵守实验室安全规定,确保操作过程安全可靠。
同时,实验中要注意控制反应的速率,避免产生过多的氧气,以免发
生意外。
另外,实验后要妥善处理残余物品和化学废液,做好实验
室的清洁工作。
希望这些信息能够帮助你理解制取氧气的实验步骤。
实验室制取氧气的步骤和注意事项

实验室制取氧气的步骤和注意事项实验室中制取氧气的主要方法有化学法和物理法。
化学法制取氧气的步骤如下:1.准备原料:准备氢氧化钠(NaOH)和高纯度的双氧水(H2O2)。
2.混合反应物:将一定质量的氢氧化钠溶解于适量的双氧水中,并搅拌均匀。
3.收集氧气:将混合液倒入一个装满水的容器中,并用一根漏斗将混合液缓慢滴入容器的底部,使氧气逐渐释放出来。
氧气会在容器的顶部形成气泡,可以用一个空气袋或气体收集瓶收集氧气。
4.除杂:氧气在制取的过程中可能伴随有一些杂质,可以使用吸附剂或过滤器进行净化,以去除杂质。
5.存储氧气:将净化后的氧气存放在密闭的容器中,以免被其他气体或杂质污染。
在进行化学法制取氧气时,需要注意以下事项:1.安全操作:实验中使用的氢氧化钠和双氧水都是腐蚀性的物质,操作时需要戴上防护手套和护目镜,避免与皮肤和眼睛接触。
实验室操作时应注意其他安全操作规程。
2.操作环境:制取氧气的实验应在通风良好的环境下进行,以避免氧气积聚导致的安全隐患。
3.反应速度:在滴加混合液时要注意速度,过快或过慢都会影响氧气的生成。
应该控制滴入速度,保持适量的混合液进入容器。
4.收集器具:收集氧气的装置应该选择具有较高密封性的器具,以免氧气泄漏或被其他气体污染。
5.净化氧气:制取的氧气可能伴随有一些杂质,需要进行净化处理,以保证气体的纯度。
另外,物理法制取氧气的步骤如下:1.准备原料:准备一定质量的高纯度双氧水。
2.加热分解:将双氧水加热至其沸点以上的温度(约150℃),双氧水分解生成氧气和水,反应方程式如下:2H2O2->2H2O+O2↑3.收集氧气:将产生的氧气收集在一个收集瓶或气囊中。
4.除杂:同样,由于制取氧气时可能伴随有一些杂质,需要使用吸附剂或过滤器进行净化。
物理法制取氧气时的注意事项如下:1.安全操作:实验中使用的高纯度双氧水是一种强氧化剂,所以在操作时应注意安全,防止烧伤和有毒物质产生等安全问题。
实验室用双氧水制取氧气教学流程

实验室用双氧水制取氧气教学流程材料和设备:1.双氧水溶液(H2O2)2.还原剂(例如碘化钾)3.水槽4.水银汞柱或气体收集瓶5.实验室玻璃器皿(例如烧杯、漏斗、试管)6.水7.镊子或夹子8.导管实验步骤:步骤1:制备双氧水溶液1.在烧杯中,加入适量的水。
2.将适量的双氧水(H2O2)加入烧杯中,搅拌均匀。
步骤2:制备还原剂1.在另一个烧杯中,加入适量的水。
2.将适量的还原剂(例如碘化钾)加入烧杯中,搅拌均匀。
步骤3:将双氧水溶液转移到水槽中1.将双氧水溶液缓慢地倒入水槽中。
2.确保水槽中的双氧水溶液深度足够容纳后续实验所需的氧气量。
步骤4:开始反应1.将还原剂的溶液缓慢地倒入水槽中的双氧水溶液中。
此时会产生氧气的释放。
2.注意观察反应过程中产生的气泡。
步骤5:收集氧气1.将一个试管或气体收集瓶倒置并浸入水池中,以保持试管或瓶口气体收集区域始终处于水中。
2.使用镊子或夹子将试管或气体收集瓶固定在水池中。
步骤6:将氧气收集到试管或气体收集瓶中1.将试管或气体收集瓶的开口对准气泡,并允许气体从水中逸出并进入试管或气体收集瓶中。
2.可以进一步使用水银汞柱来测量气体的收集量。
步骤7:注意安全1.实验过程中要注意安全,避免接触氧气和还原剂。
2.当氧气收集到足够的量后,关闭反应并转移到下一步。
步骤8:处理废液1.实验完成后,废液中可能含有未反应的双氧水溶液和还原剂。
因此,需要将废液处理掉。
需要注意的事项:1.实验过程中要小心操作。
双氧水是一种强氧化剂,还原剂也具有一定的危险性。
避免直接接触该物质。
2.实验室用双氧水制取氧气需要一个安全通风环境,以防止气体浓度达到可燃或有害水平。
3.在实验过程中尽量避免产生大量的气泡,以防止气体泄漏或封闭的容器破裂。
实验室用过氧化氢制取氧气
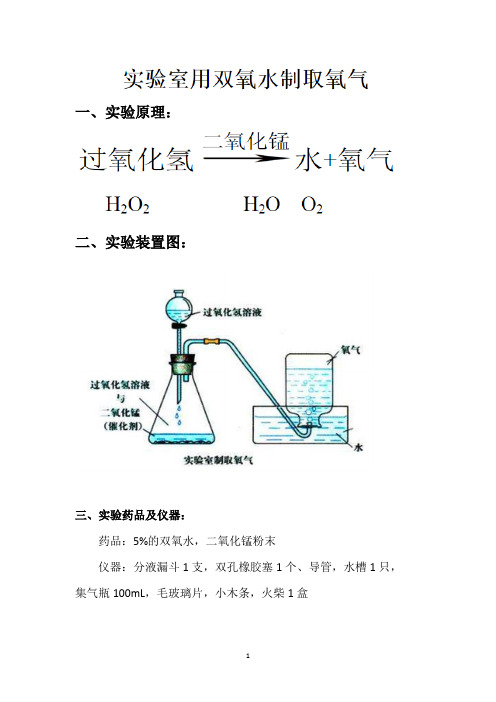
一、实验原理:
二、实验装置图:
三、实验药品及仪器:
药品:5%的双氧水,二氧化锰粉末
仪器:分液漏斗1支,双孔橡胶塞1个、导管,水槽1只,集气瓶100mL,毛玻璃片,小木条,火柴1盒
四、实验步骤:
1.连接好实验装置,检查试验装置气密性
2.在锥形瓶中加入少量的二氧化锰粉末,塞紧橡胶塞,再分液漏斗中加入适量的过氧化氢溶液。
3、打开活塞,等气泡连续均匀冒出时,把导管口伸入盛满水的集气瓶,开始收集气体。
4、等集气瓶中液面下降至瓶口,瓶外有气泡产生时,在水面下用玻璃片盖住瓶口。
小心地把集气瓶移出水槽,正方在桌子上。
5、将带火星的木条伸入集气瓶中,观察现象
6、实验完毕,整理器材。
过氧化氢制取氧气教学设计

《过氧化氢制取氧气》教学设计彩虹学校高峰2016-041、教学目标1.理解实验室用过氧化氢制氧气的方法(反应原理、实验装置、收集方法);2.认识催化剂的特征和催化作用。
3.通过探究实验室制取氧气的原理,让学生初步学习实验探究方法和运用比较学习法。
2、教学重点及难点重点:实验室制取氧气的反应原理、实验装置和操作方法。
难点:催化剂概念的理解,实验装置的改进思路。
3、教学方法自主学习、分组实验探究法4、教学过程化的物质叫做催化剂(又叫触媒)。
2催化剂在反应中的表示方法:过氧化氢制氧气的文字表达式过氧化氢水+氧气念的关键词加以解领悟。
环节四:合作探究选取实验装置刚才我们了解了用过氧化氢制取氧气的原理,那我们该选用什么装置来制取氧气呢我们一起来探究一下【投影展示】下面装置均是我们常见的反应仪器,哪些可以用来制取氧气为什么提示:我们如何才能让气流按我们的想法排出方便收集呢【教师评价】大部分同学都组装出了以下装置:这套装置,很显然组装起来很方便,它使用起来会不会有什么不足呢【探究实验3】用以下装置制取氧气,体会此装置的优缺点【教师小结】:若用这套装置制取氧气时,操作很方便,装置也很简单,但是若还未收集满,药品已用完,此时还需拔掉胶塞,再加液体,会混入空气,很麻烦,所以不便于随时添加药品。
【思考】有没有制得气体多些,又可随探寻实验装置学生交流讨论探究一,利用桌面上的仪器进行筛选、并展示成果。
学生观察实验现象,交流讨论此装置的优缺点学生讨论思考:指导学生学会选择实验仪器二氧化锰时方便添加液体药品的方法呢提示:可以试着选用以下仪器【讲解】研究者们经过不断探索改进得到以下装置,克服了第一套装置的不足.【探究实验4】用改进后的装置进行实验【思考】那这套装置还有没有缺点呢如何改进【教师总结评价】这套置制氧气,气流会不够平稳,而且对过氧化氢需要的比较多,那么怎样改进可以控制氧气产生的快慢呢并能节约药品呢通过讨论得出第三套装置:【探究实验5】利用以上装置制取氧气如何组装仪器使反应可以随时添加药品呢实验体会并思考以下问题:1这套装置使用时需要注意什么呢2该装置有没有缺点呢学生讨论思考:怎样改进可以控制氧气产生的快慢呢并节约药品呢体会改进后装置的优点实验前不提醒,让学生从自己的错误中吸取教训从而了解使用的注意事项,有利于学生发现问题解决问题。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验室用过氧化氢制取氧气
怀安县左卫中学:李媛媛
教学目标:
知识与技能:1.让学生掌握实验室用双氧水制备氧气的原理、装置和操作;
2.学生能认识催化剂在化学反应中的作用及反应前后质量和化学性质的变化。
过程与方法:通过各组对比实验,使学生在不断对比中获得新知识,感受对比实验在化学学习中的重要价值;
情感态度与价值观:1.通过对催化剂更优化的选择,培养学生低碳环保的高贵品质;
2.通过对比实验,培养学生合理、科学地分析客观事物的能力。
教学重点:过氧化氢制备氧气的原理、装置和装置优缺点的比较。
教学难点:对比实验装置的优缺点。
教学器材:仪器:试管、药匙、火柴等。
药品:5%的过氧化氢、二氧化锰。
教学过程:
除了试管,还可用
活动探究
通过学生提出的观点,教师归纳总结
思考:使用这套装置需注意什么问题?学生思考并回答:
斗的末端必须插入液体中,止生成的气体从长颈漏斗口逸出,所以必须液封
那么在实验室氧气的收集装置该怎样确定教师拿出下列装置,引导学生观察其特
3.下列变化属于分解反应的是()
A、从空气中分离出氧气和氮气
B、加热高锰酸钾制取氧气
C、红磷在氧气中燃烧生成五氧化二磷
D、蜡烛在氧气中燃烧生成二氧化碳和水
4.下列有关催化剂的说法正确的是( )
A.催化剂就是用来加快化学反应速率的
B. 二氧化锰是催化剂
C.没有二氧化锰的催化,过氧化氢也能分解放出氧气
D.催化剂在化学反应前后的性质不变
5.(1)仪器⑤的名称是;取用粉末状固体必须用到的仪器是(填序号)。
(2)如果用加热KMnO4的方法制取氧气,制气装置应选仪器(填序号)。
(3)如果用H2O2分解来制取氧气,制气装置最好选用仪器(填序号);
(4)比较(2)和(3)两种制取氧气的方法,最好选用方法(3)的原因是。
6.过氧化氢溶液在二氧化锰作催化剂的条件下能迅速分解成氧气和水,试回答下列问题:
(1)要收集一瓶比较纯净的氧气应选择上图中的装置是____;
收集一瓶比较干燥的氧气应选择上图中的装置是。
(2)实验室常用高锰酸钾或者过氧化氢与二氧化锰来制取氧气,你觉得其中相对比较好的方法是:_____ _____ __ __ ,其理由是________ _ ;
(3)装置A中反应十分剧烈,据此提出该实验安全注意事项是
A.控制液体的滴加速度 B.用体积小的锥形瓶 C.加热反应物。
