4.第四章氧化还原反应概要
(完整版)氧化还原反应知识点总结
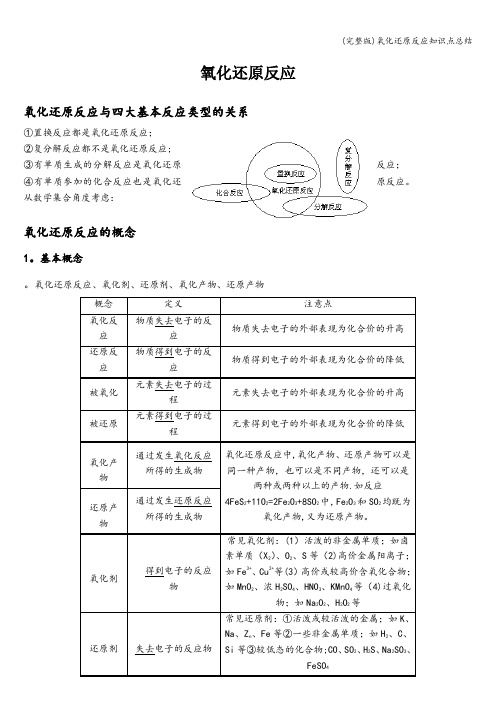
氧化还原反应氧化还原反应与四大基本反应类型的关系①置换反应都是氧化还原反应;②复分解反应都不是氧化还原反应;③有单质生成的分解反应是氧化还原反应;④有单质参加的化合反应也是氧化还原反应。
从数学集合角度考虑:氧化还原反应的概念1。
基本概念。
氧化还原反应、氧化剂、还原剂、氧化产物、还原产物概念定义注意点氧化反应物质失去电子的反应物质失去电子的外部表现为化合价的升高还原反应物质得到电子的反应物质得到电子的外部表现为化合价的降低被氧化元素失去电子的过程元素失去电子的外部表现为化合价的升高被还原元素得到电子的过程元素得到电子的外部表现为化合价的降低氧化产物通过发生氧化反应所得的生成物氧化还原反应中,氧化产物、还原产物可以是同一种产物,也可以是不同产物,还可以是两种或两种以上的产物.如反应4FeS2+11O2=2Fe2O3+8SO2中,Fe2O3和SO2均既为氧化产物,又为还原产物。
还原产物通过发生还原反应所得的生成物氧化剂得到电子的反应物常见氧化剂:(1)活泼的非金属单质;如卤素单质(X2)、O2、S等(2)高价金属阳离子;如Fe3+、Cu2+等(3)高价或较高价含氧化合物;如MnO2、浓H2SO4、HNO3、KMnO4等(4)过氧化物;如Na2O2、H2O2等还原剂失去电子的反应物常见还原剂:①活泼或较活泼的金属;如K、Na、Z n、Fe等②一些非金属单质;如H2、C、Si等③较低态的化合物;CO、SO2、H2S、Na2SO3、FeSO4氧化性 得到电子的能力 物质的氧化性、还原性的强弱与其得失电子能力有关,与得失电子的数目无关。
还原性失去电子的能力2.基本概念之间的关系:氧化剂有氧化性化合价降低得电子被还原发生还原反应生成还原产物 还原剂有还原性化合价升高失电子被氧化发生氧化反应生成氧化产物[例1]金属钛(Ti )性能优越,被称为继铁、铝制后的“第三金属"。
工业上以金红石为原料制取Ti 的反应为:aTiO 2+bCl 2+cC aTiCl 4+c CO ……反应① TiCl 4+2Mg Ti +2MgCl 2 ……反应②关于反应①、②的分析不正确的是( )①TiCl 4在反应①中是还原产物,在反应②中是氧化剂; ②C、Mg 在反应中均为还原剂,被还原;③在反应①、②中Mg 的还原性大于C ,C 的还原性大于TiCl 4; ④a =1,b =c =2;⑤每生成19.2gTi ,反应①、②中共转移4。
初中化学氧化还原反应解析

初中化学氧化还原反应解析氧化还原反应是化学反应中最常见的反应类型之一,也是化学学科中重要的基础知识之一。
本文将对初中化学中的氧化还原反应进行解析,详细介绍其基本概念、特征和应用。
1. 氧化还原反应的基本概念氧化还原反应是指物质中的电子在化学反应过程中的转移,包括氧化剂和还原剂的参与。
在氧化还原反应中,氧化剂接受电子,而还原剂释放电子。
其中,氧化剂的含氧量增加,被还原剂氧化,而还原剂的氧含量减少,同时被氧化剂还原。
2. 氧化还原反应的特征氧化还原反应具有以下几个基本特征:(1)电子转移:氧化还原反应中,发生电子的转移,从还原剂到氧化剂。
(2)氧化与还原同时进行:氧化还原反应中,氧化与还原是同时进行的,并且两个过程是相互依赖、相互促进的。
(3)以化合价的变化为基础:氧化还原反应中,通过元素化合价的变化来表述电荷转移或共用电子数的减少。
(4)伴随能量变化:氧化还原反应通常伴随能量的变化,可以是放热反应(释放能量)或吸热反应(吸收能量)。
3. 氧化还原反应的应用氧化还原反应在日常生活和工业生产中有着广泛的应用,以下是其中几个常见的应用:(1)电池:电池就是利用氧化还原反应产生电能的装置,如干电池、锂离子电池等。
在电池中,还原剂和氧化剂相互作用,通过电子转移产生电能。
(2)腐蚀:金属的腐蚀现象是氧化还原反应的一种表现。
当金属与氧气或其他氧化剂接触时,金属发生氧化反应,形成金属氧化物,同时释放电子,这个过程即为腐蚀。
(3)燃烧:燃烧是氧化还原反应的一种重要形式。
燃烧过程中,燃料与氧气发生氧化还原反应,释放大量的热能和光能。
(4)防锈处理:在工业生产中,为了防止金属材料受到氧化的影响,常常会采取防锈处理。
防锈处理的原理就是利用还原剂与金属表面的氧化物发生氧化还原反应,还原金属氧化物,达到防止金属锈蚀的目的。
通过对初中化学中氧化还原反应的解析,我们了解了氧化还原反应的基本概念、特征和应用。
氧化还原反应不仅在化学学科中具有重要的地位,也在日常生活和工业生产中扮演着重要的角色。
超级详细氧化还原反应

在氧化还原反应中,氧化剂和还原剂之间会发生电子转 移,氧化剂从还原剂中夺取电子,使其被氧化;而还原 剂则向氧化剂提供电子,使其被还原。
氧化数与氧化还原电位
氧化数是衡量原子或分子氧化程度的数值,它反映了原子或分 子失去或获得电子的可能性。在氧化还原反应中,氧化数发生 变化。
光合作用
植物通过光合作用将二氧化碳 和水转化为有机物质,同时释
放氧气。
电子转移
在光合作用中,植物通过光能驱 动电子从叶绿素向辅酶Q转移, 进而将电子传递给氧气,生成水 。
能量转化
电子转移过程中,光能被转化为化 学能,储存在有机物质中。
案例三:燃料电池的原理与应用
燃料电池概述
燃料电池是一种将化学能转化 为电能的装置,其燃料和氧化
光电化学转换
光电化学转换是一种利用光能驱动氧化还原反应的能源转换方式。 在光电化学转换中,光照射到半导体材料上,激发电子,产生光电流,进而驱动氧化还原反应。 光电化学转换被广泛应用于太阳能电池、光催化等领域,如染料敏化太阳能电池、光催化制氢等。
生物体内的氧化还原调节
生物体内的氧化还原调节是一种维持细胞内氧 化还原平衡的生理机制。
案例一:钢铁的腐蚀与防护
钢铁腐蚀现象
钢铁在自然环境中受到氧气、水分、盐分等影响 ,会发生腐蚀现象,表现为表面形成锈蚀。
腐蚀原理
钢铁在腐蚀过程中,会发生氧化还原反应,铁元 素被氧化成铁离子,氧元素被还原成氢气。
防护措施
为防止钢铁腐蚀,可以采用涂层保护、电化学保 护等方法。
案例二:植物光合作用的电子转移过程
02
氧化还原反应 课件

②2Fe2++Br2===2Fe3++2Br- ③2Fe3++SO2+2H2O===2Fe2++SO24-+4H+
下列有关性质的比较正确的是
√A.氧化性:Cr2O27->Cl2>Fe3+
B.氧化性:Cl2>Br2>Cr2O27-
C.还原性:SO2<Fe2+<Br-
D.还原性:Cl->Cr3+>Fe2+
一、氧化还原反应的基本概念
1.氧化剂和还原剂 (1)氧化剂 ①氧化剂是 得到 电子(或电子对 偏向 )的物质,具有氧化性。 ②氧化剂在反应时所含元素的化合价 降低 ,本身被还原。 (2)还原剂 ①还原剂是 失去 电子(或电子对 偏离 )的物质,具有还原性。 ②还原剂在反应时所含元素的化合价 升高 ,本身被氧化。
4.常见的氧化剂和还原剂
(1)常见的氧化剂 ①活泼性较强的非金属单质:如Cl2、 O2 。 ②变价元素的 高 价态化合物:如KMnO4、FeCl3、HNO3。 ③过氧化物:如Na2O2、 H2O2 。 ④其他:如HClO、漂白粉、MnO2。 (2)常见的还原剂
①活泼性较强的金属单质:如Al、Fe、Zn。 ②某些 非金属 单质:如H2、S、C等。 ③含有较低价态元素的化合物:如CO、SO2。 ④其他:如浓盐酸、NH3。
思维启迪
根据化学方程式比较物质氧化性或还原性的方法思路: 比什么性,找什么剂,产物之性小于剂。
例4 已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强
弱顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是 A.2Fe3++SO2+2H2O===2Fe2++ SO24-+4H+
例1 分析下列反应并按要求填空。 (1)2Fe+3Cl2=点==燃==2FeCl3
大学基础课程无机化学课件p氧化还原反应定稿

+1
+2
NaClO + 2FeSO4 + H2SO4
氧还
介
化原
质
剂剂
–1 +3
NaCl + Fe2(SO4)3 + H2O
还氧 原化 产产 物物
三、氧化还原半反应
任何一个氧化还原反应由两个半反应组成:
氧化数升高 氧化
H2O2 + Fe2+ + H+ → H2O + Fe3+
氧化数降低 还原
还原剂的氧化反应: Fe2+ - e- → Fe3+ 氧化剂的还原反应: H2O2 + 2e- + 2H+ →2H2O
Cu2+/Cu 氧化还原电对
半电池 半电池
原电池 氧化还原电对:
由同一种元素的氧化型物质和还原型物质构成
氧化还原电对表示方法 氧化型物质/还原型物(Ox/Red)
如 Cu2+/Cu、Zn2+/Zn、H+/H2、Sn4+/Sn2+
氧化型 + ne- 还原型
一个电对氧化型的氧化能力越强, 则共轭电对的还原型还原能力越弱;
氧化数可以是正数、负数,也可以是 整数、分数、零。
Question “氧化数”与“ 化合价” 和“ 共价数”有否区 别?
氧化数不等同化合价
氧化数 荷电数 有正负 可为分数
化合价 原子相互结合的个数比
无正负 无分数
如
CH4
氧化数 -4
化合价 4
CH3Cl -2
4
CCl4 +4
4
CH2Cl2 0
4
氧化数与共价键数不同。
《氧化还原反应》 讲义

《氧化还原反应》讲义一、什么是氧化还原反应在化学世界中,氧化还原反应是一类极其重要的化学反应。
简单来说,氧化还原反应是指在反应过程中,元素的氧化态(化合价)发生了变化的反应。
氧化态的变化是氧化还原反应的核心特征。
当一种物质中的元素氧化态升高,我们就说这个元素被氧化了;反之,当元素的氧化态降低,我们就说这个元素被还原了。
例如,氢气(H₂)和氧气(O₂)反应生成水(H₂O)的过程就是一个典型的氧化还原反应。
在这个反应中,氢元素的化合价从 0 价升高到+1 价,氢被氧化;氧元素的化合价从 0 价降低到-2 价,氧被还原。
二、氧化还原反应的特征氧化还原反应有几个显著的特征。
首先,氧化还原反应一定伴随着电子的转移。
电子从被氧化的物质转移到被还原的物质。
其次,氧化还原反应中,氧化剂和还原剂同时存在。
氧化剂在反应中得到电子,化合价降低;还原剂在反应中失去电子,化合价升高。
再者,氧化还原反应前后,元素的种类和原子的个数不变,遵循质量守恒定律。
三、氧化剂和还原剂氧化剂是在氧化还原反应中能够得到电子,使其他物质氧化,自身被还原的物质。
常见的氧化剂有氧气、氯气、高锰酸钾等。
以高锰酸钾(KMnO₄)受热分解制取氧气的反应为例,高锰酸钾中的锰元素化合价从+7 价降低到+4 价和+6 价,高锰酸钾是氧化剂。
还原剂则是在氧化还原反应中能够失去电子,使其他物质还原,自身被氧化的物质。
常见的还原剂有氢气、一氧化碳、金属单质等。
比如在氢气还原氧化铜(H₂+ CuO = Cu + H₂O)的反应中,氢气中的氢元素化合价从 0 价升高到+1 价,氢气是还原剂。
四、氧化还原反应的表示方法为了清晰地表示氧化还原反应中电子的转移情况,我们通常采用双线桥法和单线桥法。
双线桥法是从反应物中化合价发生变化的元素指向生成物中相应元素,在线桥上标明电子的得失和化合价的升降。
例如,对于铜与硝酸的反应:3Cu + 8HNO₃(稀) = 3Cu(NO₃)₂+2NO↑ + 4H₂O双线桥表示为:从 Cu 指向 Cu(NO₃)₂,线上标明“失去 6e⁻,化合价升高”;从 HNO₃指向 NO,线上标明“得到 6e⁻,化合价降低”。
氧化还原反应重要知识点梳理

氧化还原反应——重要知识点梳理氧化还原反应是高中化学教材的开篇内容,也是中学化学中的重要理论知识之一,所以同学们一定要理解和掌握它的内容,并学会应用。
一、回顾化学反应的分类1.反应类型归纳2.四种基本反应类型与氧化还原反应的关系置换反应一定是氧化还原反应;复分解反应一定是非氧化还原反应;化合反应、分解反应可能是氧化还原反应,也可能是非氧化还原反应。
二、理解氧化还原反应的五个基本概念下面以CO+CuO Cu+CO2的反应为例,说明氧化还原反应的五个基本概念。
1.氧化还原反应:有电子转移(得失或偏移)的反应叫氧化还原反应。
氧化还原反应的实质是电子的转移,表现为化合价的变化,所以有化合价变化的反应一定是氧化还原反应。
2.氧化剂:发生还原反应(得电子,化合价降低)的物质是氧化剂;氧化剂具有氧化性(即能够把还原剂氧化),上述反应中的氧化剂是CuO。
3.还原剂:发生氧化反应(失电子,化合价升高)的物质是还原剂;还原剂具有还原性(即能够把氧化剂还原),上述反应中的还原剂是CO。
4.氧化产物:氧化产物是发生氧化反应后的产物,即化合价升高后的生成物,或还原剂转变成的生成物。
上述反应中的氧化产物是CO2。
5.还原产物:还原产物是发生还原反应后的产物,即化合价降低后的生成物,或氧化剂转变成的生成物,上述反应中的还原产物是Cu。
对概念的理解重点落脚在会应用这些概念,所以要明确氧化还原反应的实质和表现形式,特别是通过化学反应中元素化合价这一表现形式可以很简单地判断氧化还原反应、氧化剂、还原剂、氧化产物和还原产物。
三、了解常见的氧化剂和还原剂常见的氧化剂有:(1)高价态的化合物:KMnO4、HNO3、浓H2SO4、KClO3、K2Cr2O7;(2)高价态金属离子:Cu2+、Fe3+;(3)活泼的非金属单质:X2、O2、S。
常见的还原剂有:(1)低价态的物质:H2S、CO、SO2、H2SO3、 Na2SO3、NH3;(2)低价态离子:Cl- 、Br- 、I- 、Fe2+、S2-;(3)活泼金属: K、Na、Mg、Al、Zn、Fe。
第四章氧化还原反应和电化学概要

MnO
4
SO32
Mn2
SO42
(酸性介质)
(1)氧化:
SO
2 3
SO42
还原:MnO4 Mn2 (2)配平原则:
酸性介质中:多氧的一边加H+,少氧的一边加H2O ; 碱性介质中:多氧的一边加H2O,少氧的一边加OH- ; 中性介质中:左边加H2O,右边根据需要加H+或OH-。
SO
3
H 2O
Cu2 | Cu
电对符号
电极符号
30 构成电极的物质,有时须注明状态。如气体分压
液体浓度等。
两个半电池中进行的反应称为半电池反应或者电极反应。
根据正负极的规定,我们可以知道:负极进行的是氧化 反应(失去电子);正极进行的是还原反应(得到电子)。
对于Cu-Zn原电池来说,它的电极反应为:
负极:Zn = Zn2+ + 2e- 正极:Cu2+ + 2e-=Cu
氧化: CrO2 CrO42 CrO2 4OH CrO42 2H2O 3e
还原: H2O2 2e 2OH 整理: 2CrO2 3H2O2 2OH 2CrO42 4H2O
§4.2 原电池与电极电势
(Primary cell and electrode potential)
3) 2I I2 2e
2) MnO4 2H2O 3e MnO2 4OH
——————————————————————————
2MnO4 6I 4H2O 2MnO2 3I2 8OH ★ 特例:H2O2
酸性介质中 氧化:H2O2 O2 2H 2e(作还原剂)
还原:H2O2 2H 2e 2H2O(作氧化剂)
Fe2 Fe3 e
Fe 3 Fe 2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四章 氧化还原反应板书: 第4章 氧化还原反应板书: 4.1 氧化还原方程式的配平板书: 4.1.1 氧化数法板书: 1. 氧化数:元素原子在其化合态中的形式电荷数副板书: 离子化合物:阴、阳离子所带的电荷数,例如:NaCl 共价化合物:共用电子对的偏向,例如:HCl板书: 2. 配平原则:(1)元素原子氧化数升高的总数等于元素原子氧化数降低的总数; (2)反应前后各元素的原子总数相等。
板书: 4.1.2 离子-电子法板书: 1. 配平原则:(1)氧化剂所得到的电子数等于还原剂失去的电子数 (2)反应前后各元素的原子总数相等。
板书: 例1:在酸性溶液中,高锰酸钾将亚硫酸氧化。
反应的离子方程式: 2224342MnO SO H Mn SO H O --++-++→++在此反应中:氧化剂为:74M nO +-→ 22M n ++ 还原反应 还原剂为: 423S O+- → 624S O +-氧化反应还原半反应: 2⨯ 242584MnO e H Mn H O -++++→+ 电子转移数5e 氧化半反应: 5⨯ 2232422SO H O SO e H --++→++ 电子转移数为2e 取电子转移最小公倍数,相加得:2224342256253MnO SO H Mn SO H O --++-++==++板书: 例2 氯气在热的氢氧化钠溶液中发生歧化反应的配平反应式为: 23270 o C Cl NaOH NaCl NaClO H O ∆>+−−−→++ (条件:加热,温度>70℃) 歧化反应: 02C l →1NaCl - 还原反应 02C l (5)3Na Cl O + 氧化反应还原半反应: 5⨯ 222Cl e Cl -+→ 电子转移数为2e 氧化半反应: 1⨯ 232122610Cl OH ClO H O e --+→++ 电子转移数为10e取电子转移最小公倍数,相加得总反应的离子反应方程式:2326121026Cl OH Cl ClO H O ---+→++整理后,得: 2323653Cl NaOH NaCl NaClO H O +==++板书: 注:(1)若是酸性介质,只出现H +,而不出现OH -; (2)若是碱性介质,只出现OH -,而不出现H +。
板书:表: 要求大家最好能够背会板书: 4.2. 电极电势板书: 4.2.1 原电池板书: 22Zn CuZn Cu +++→+(化学能转化成热能)板书: 在原电池中盐桥的作用:(1)构成回路;(2)中和过剩的电荷,使化学反应进一步进行。
板书: (负极)氧化反应: 22Zn e Zn +-→ (盐桥中的Cl -迁移过来以中和过剩的Zn 2+)板书: (正极)还原反应: 22Cu e Cu ++→ (盐桥中的K +移过来以中和过剩的SO 42-)板书: 总反应: 22Zn CuZn Cu +++→+ (化学能转化成为电能)板书: 1. 电对: 任何一个元素不同氧化态之间的关系称为电对。
注:每一个电对可代表一个半反应板书: 例如:MnO 4-/Mn 2+;Zn 2+/Zn ;Cu 2+/Cu ;H +/H 2;Fe 3+/Fe 2+等板书: 2. 原电池的表示方法(原电池的符号)板书:(-)Zn/Zn 2+(C 1)//Cu 2+(C 2)/Cu (+) 注:高氧化数物质写在靠近盐桥的位置。
板书: 例1. 322422FeSn Fe Sn +++++==+氧化半反应: 242Sne Sn ++-→ (原电池的负极) 还原半反应: 32Fee Fe +++→ (原电池的正极)原电池的符号:(-)Pt/Sn 2+(C 1),Sn 4+(C 2)//Fe 3+(C 3),Fe 2+(C 4)/Pt (+) 惰性电极:不参加电极反应,但是能够导电的物质。
例2 222Zn H Zn H +++==+氧化反应:22Zn e Zn +-→ (原电池的负极)还原反应:222H e H +→ (原电池的正极)原电池符号: (-)Zn/Zn 2+(C 1)//H +(C 2)/H 2(P ),Pt (+)注:气态物质水溶液中,水溶液要与气体用“/”隔开,对于气体与固体之间可以用“/”也可以用逗号隔开。
板书: 4.2.2 电解电势的产生板书: 平衡电极电势见图:n M M ne +-+双电层平衡电极电势金属溶解的倾向大于沉积的倾向时,金属表面带负电荷。
双电层 平衡电极电势金属沉积的倾向大于溶解的倾向时,金属表面带正电荷。
板书: 4.2.3 电极电势的测定板书:1. 标准氢电极电势板书: 标准氢电极的电极电势为零,即:20H H θϕ+= V板书: 电动势: 0E ϕϕϕϕϕϕ+-=-=-=-=待测电极标准氢电极待测电极待测电极板书: 2 标准电动势:E θθϕϕ+-=-板书: (-)Pt ,H 2(P 0)/H +(1.0mol/L )//Cu 2+(1.0mol/L )/Cu (+)标准电动势:20.34Cu CuE θθθθϕϕϕ++-=-==+板书: 结论:(1)金属活动顺序表中越靠前的金属,其电对的θϕ越小,表明金属失电子能力越大,金属活性越高;(2)电对θϕ不随半反应而变例如:Li e Li ++→ 或是 Li e Li +-→ /LiLiθϕ+(3)θϕ不随半反应系数而变化 例如: Zn 2++2e =Zn 2/0.763Zn Znθϕ+=- V 2Zn 2++4e =2Zn2/0.763ZnZnθϕ+=- V(4)非标态时,不能用θϕ计算(5)θϕ代数值越小,其还原型物质的还原性越强(6)θϕ代数值越大,其氧化型物质的氧化性越强板书: 4.2.4 影响电极电势的因素:板书: 1. 电极的能斯特方程:对于任一电极,其电极反应可以写成: ne -+==氧化型还原型能斯特方程:((/ln RT nF θϕϕ⎡⎤⎣⎦=+⎡⎤⎣⎦氧化型/还原型)氧化型还原型)氧化型还原型 式中:(ϕ氧化型/还原型)为某浓度下电极的电极电势;(/θϕ氧化型还原型)为标准电极电势;[氧化型]表示反应中在氧化型一侧各物种相对浓度幂的乘积; [还原型]表示反应中在还原型一侧各物种相对浓度幂的乘积; n 表示电极反应中,转移的电子数;R 为摩尔气体常数,118.314R J K mol --=⋅⋅ ;T 为热力学温度;F 为法拉第常数,1196485F J V mol --=⋅⋅ 。
板书:能斯特方程:((/0.0592lgn θϕϕ⎡⎤⎣⎦=+⎡⎤⎣⎦氧化型/还原型)氧化型还原型)氧化型还原型 (298.15T K = )板书: 例题4.9解:电极反应: 2327214627Cr O H eCr H O -+-++++氧化型 还原型 电极电势: 2273142()()()0.0592lg 6)Cr O HCr C C C θϕϕ-++⋅=+2-3+2-3+2727Cr O /Cr Cr O /Cr (板书:注:(1)在能斯特方程式中,不列入固态,纯液体,以及稀溶液溶剂例如: 2()22Br l eBr --+电极电势:2((0.05921lg 2)θϕϕ=+--22-Br /Br )Br /Br )Br (C 氧化型一侧还原型一侧 (2)电极反应书写形式以及反应系数,不会影响电极电势的大小。
板书: 例如:电极反应:22Zn eZn +-+ 22(/)/)0.0592lg 21Zn Zn Zn Zn C θϕϕ++=+2+(Zn 板书: 电极反应:2242Zne Zn +-+ ,其电极电势为:板书:(3)对于气体反应,应写入气体的分压和标准压力例:电极反应: 222Cl eCl --+222222(/)/)/)/)(/)()0.0592lg410.0592*2 lg 410.0592 lg 21Zn Zn Zn Zn Zn Zn Zn Zn Zn Zn C C C θθθϕϕϕϕϕ+++++=+=+=+=2+2+2+,(Zn (Zn (Zn (不变)电极电势:22((0.0592lg 2)Cl Cl Cl P P C θθϕϕ-=+--22Cl /Cl )/Cl )( (类似于化学平衡常数) 板书:(4)对于电极反应式中有H +或是OH -时,一定要列入电极电势的计算式中(酸度对ϕ的影响)例1:电极反应:242584MnO e HMn H O --+++++电极电势:4224428()()*()0.0592lg 5MnO H MnO Mn MnO Mn Mn C C C θϕϕ-+-+-++=+//注:正确书写并配平电极反应,正确找到反应中氧化型一侧的各种物质,以及还原型一侧的各种物质。
板书:例2:电极反应:2327261427Cr O e HCr H O --+++++电极电势:227232327273142()()*()0.0592lg 6()Cr O HCr O Cr Cr O Cr Cr C C C θϕϕ-+-+-++=+//板书: 例3:实验室制取氯气的反应:2222()42MnO HCl MnCl Cl H O +=+↑+浓电极反应式:222422MnO H eMn H O +-++++ (还原反应)原电池的正极222ClCl e --+ (氧化反应)原电池的负极已知:22()1.23 MnO Mn V θϕ+=/,2() 1.36 Cl V θϕ-=/Cl由标准电极电势的数值可见:222()()MnO Mn Cl θθϕϕ+-<//Cl ,所构成的原电池的电动势是小于零因此,该反应在标准条件下是无法正向进行的。
但是若是在浓盐酸中: 板书: 正极的电极电势:22222224()()()()0.0592lg 2H MnO Mn MnO Mn MnO Mn Mn C C θθϕϕϕ+++++=+>///负极的电极电势:22(((0.0592lg 2)Cl Cl Cl P P θθθϕϕϕ=+<---222-Cl /Cl )/Cl )/Cl )Cl (C 板书:所以有:222()()MnO Mn Cl ϕϕ+->//Cl电池的电动势:222()()0MnO Mn Cl E ϕϕ+-=->//Cl 反应能够进行板书: 4.2.5 电极电势的应用板书: 1. 判断原电池的正、负极(计算原电池的电动势)板书: 正极:电极电势较大的 负极:电极电势较小的电动势:E ϕϕ+-=- 标准电动势:E θθθϕϕ+-=-板书: 2. 判断氧化剂、还原剂的相对强弱 板书: ϕ氧化型还原型越大,氧化剂的氧化性越强; ϕ氧化型还原型越大,还原剂的还原性越强。
板书: 例1:已知:24/ 1.51 V MnO Mnθϕ-+=;2/ 1.36 V Cl Clθϕ-=;2/ 1.065 V Br Br θϕ-=;2/0.54 V I I θϕ-=;32/0.77 V Fe Fe θϕ++=,判断各种物质的氧化型强弱。
