2020届高考化学专题练习 元素周期表和周期律(包含答案)
2020-2021高考化学复习元素周期律专项综合练含详细答案
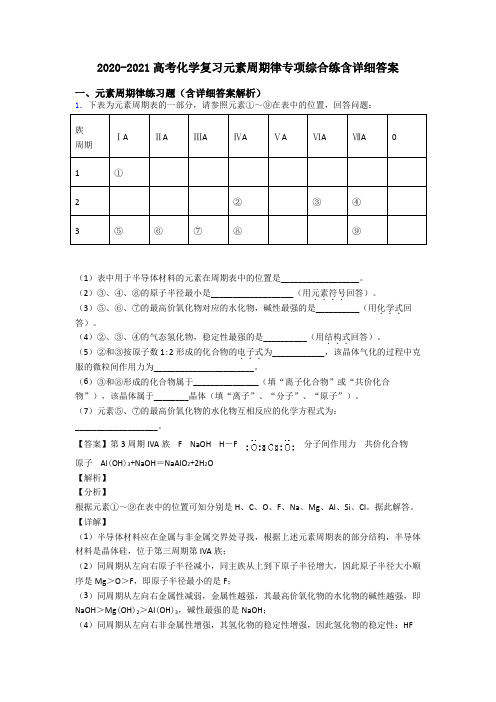
2020-2021高考化学复习元素周期律专项综合练含详细答案一、元素周期律练习题(含详细答案解析)1.下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答问题:族ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0周期1①2②③④3⑤⑥⑦⑧⑨(1)表中用于半导体材料的元素在周期表中的位置是__________________。
(2)③、④、⑧的原子半径最小是___________________(用元素符号....回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是__________(用化学式...回答)。
(4)②、③、④的气态氢化物,稳定性最强的是__________(用结构式...回答)。
(5)②和③按原子数1:2形成的化合物的电子式...为____________,该晶体气化的过程中克服的微粒间作用力为_______________________。
(6)③和⑧形成的化合物属于_______________(填“离子化合物”或“共价化合物”),该晶体属于________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的化学方程式为:___________________。
【答案】第3周期IVA族 F NaOH H-F 分子间作用力共价化合物原子 Al(OH)3+NaOH=NaAlO2+2H2O【解析】【分析】根据元素①~⑨在表中的位置可知分别是H、C、O、F、Na、Mg、Al、Si、Cl。
据此解答。
【详解】(1)半导体材料应在金属与非金属交界处寻找,根据上述元素周期表的部分结构,半导体材料是晶体硅,位于第三周期第IVA族;(2)同周期从左向右原子半径减小,同主族从上到下原子半径增大,因此原子半径大小顺序是Mg>O>F,即原子半径最小的是F;(3)同周期从左向右金属性减弱,金属性越强,其最高价氧化物的水化物的碱性越强,即NaOH>Mg(OH)2>Al(OH)3,碱性最强的是NaOH;(4)同周期从左向右非金属性增强,其氢化物的稳定性增强,因此氢化物的稳定性:HF>H 2O >CH 4,最稳定的氢化物是HF ,其结构式为H -F ; (5)②和③按原子数1:2形成的化合物是CO 2,其电子式为:,CO 2属于分子晶体,熔化时克服分子间作用力;(6)③和⑧构成的化合物是SiO 2,属于共价化合物,其晶体为原子晶体;(7)⑤是钠元素,其最高价氧化物的水化物是NaOH ,⑦是Al ,其最高价氧化物的水化物是Al (OH )3,Al (OH )3表现两性,与碱反应的化学方程式为Al (OH )3+NaOH =NaAlO 2+2H 2O 。
2020高考化学 元素周期表和元素周期律 考点专练(含答案解析)

2020高考化学元素周期表和元素周期律考点专练1.下列说法不正确的是( )A.4820Ca2+的中子数比核外电子数多10B.同种元素的原子均有相同的质子数和中子数C.微粒Na+、Mg2+、O2-具有相同的电子层结构D.第ⅣA与ⅦA族元素的原子间构成的分子均满足原子最外层8电子结构2.下列说法正确的是( )A.N和As属于第ⅤA族元素,氮原子得电子能力比砷原子强B.族序数等于其周期序数的元素一定是金属元素C.元素周期表中,位于金属和非金属交界线附近的元素属于过渡元素D.Si、S、Cl的最高价氧化物都能与水反应生成相应的酸,且酸性依次增强3.据报道,俄罗斯科学家再次合成117号元素,其中有5个293117X,1个294117X。
下列关于293117X和294117X的说法,不正确的是( )A.是两种核素B.互为同位素C.中子数分别为176和177D.核外电子数相差14.下列变化需克服相同类型作用力的是( )A.碘和干冰的升华B.Na2O2和C60的熔化C.氯化氢和氯化钾的溶解D.溴的汽化和NH4Cl加热分解5.a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。
下列叙述错误的是 ( )A.四种元素中,d元素的非金属性最强B.它们均存在两种或两种以上的氧化物C.只有a与其他三种元素生成的化合物都是离子化合物D.b、c、d分别与氢形成的化合物中化学键均为极性共价键6.有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。
下列说法中正确的是( )A.X、M两种元素只能形成X2M型化合物B.X、W、M三种元素形成的一种常见消毒剂,其结构中只有离子键C.元素Y与W可以形成离子化合物D.元素W和M的某些单质可作为水处理中的消毒剂7.W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。
2020-2021高考化学压轴题之元素周期律(高考题型整理,突破提升)及详细答案

2020-2021高考化学压轴题之元素周期律(高考题型整理,突破提升)及详细答案一、元素周期律练习题(含详细答案解析)1.下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答问题:族ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0周期1①2②③④3⑤⑥⑦⑧⑨(1)表中用于半导体材料的元素在周期表中的位置是__________________。
(2)③、④、⑧的原子半径最小是___________________(用元素符号....回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是__________(用化学式...回答)。
(4)②、③、④的气态氢化物,稳定性最强的是__________(用结构式...回答)。
(5)②和③按原子数1:2形成的化合物的电子式...为____________,该晶体气化的过程中克服的微粒间作用力为_______________________。
(6)③和⑧形成的化合物属于_______________(填“离子化合物”或“共价化合物”),该晶体属于________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的化学方程式为:___________________。
【答案】第3周期IVA族 F NaOH H-F 分子间作用力共价化合物原子 Al(OH)3+NaOH=NaAlO2+2H2O【解析】【分析】根据元素①~⑨在表中的位置可知分别是H、C、O、F、Na、Mg、Al、Si、Cl。
据此解答。
【详解】(1)半导体材料应在金属与非金属交界处寻找,根据上述元素周期表的部分结构,半导体材料是晶体硅,位于第三周期第IVA族;(2)同周期从左向右原子半径减小,同主族从上到下原子半径增大,因此原子半径大小顺序是Mg>O>F,即原子半径最小的是F;(3)同周期从左向右金属性减弱,金属性越强,其最高价氧化物的水化物的碱性越强,即NaOH>Mg(OH)2>Al(OH)3,碱性最强的是NaOH;(4)同周期从左向右非金属性增强,其氢化物的稳定性增强,因此氢化物的稳定性:HF >H2O>CH4,最稳定的氢化物是HF,其结构式为H-F;(5)②和③按原子数1:2形成的化合物是CO2,其电子式为:,CO2属于分子晶体,熔化时克服分子间作用力;(6)③和⑧构成的化合物是SiO2,属于共价化合物,其晶体为原子晶体;(7)⑤是钠元素,其最高价氧化物的水化物是NaOH,⑦是Al,其最高价氧化物的水化物是Al(OH)3,Al(OH)3表现两性,与碱反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O。
2020-2021版全国卷高考化学一轮专题训练:原子结构与化学键元素周期律与元素周期表(含解析)

专题突破原子结构与化学键元素周期律与元素周期表一、选择题(每小题只有一个选项正确)1.一世条件下,氨气与氟气发生反应:4NH3+3F2=NF3+3NH4E其中NFs分子构型与NHs相似。
下列有关说法错误的是()A.NF3中只含极性共价键B∙NF3既是氧化产物,又是还原产物C.NH4F中既含有离子键,又含有共价键D.上述反应中,反应物和生成物均属于共价化合物答案D2.已知X、Y是元素周期表中前20号元素,二者原子序数相差3.X、Y能形成化合物下列说法正确的是()A.若X和Y处于同一周期,则X的原子半径肯左小于V的原子半径B.若X和Y处于不同周期,则M溶于水所得溶液肯立呈碱性C.若M属于共价化合物,则该分子中原子个数比可能为1 : 2D.若M属于离子化合物,则该化合物中只存在离子键答案C3.下列过程中,共价键被破坏的是()①碘升华②浪蒸气被木炭吸附③洒精溶于水④HCI气体溶于水⑤冰融化⑥NH£ 1受热分解⑦氢氧化钠熔化⑧(NH4)2SO4溶于水A.④©B.©@® D •①④⑥⑦答案A4•短周期主族元素W. X、Y. Z的原子序数依次增大,W的最简单氢化物是天然气的主要成分,W 与Y的最外层电子数之和等于X的最外层电子数,且W、X、Y、Z的最外层电子数均为偶数;向X、Y、Z组成的一种化合物中加入盐酸,产生的气体能使品红溶液褪色。
下列说法不正确的是()•••A.Z与X同主族B.X、Y的简单离子的电子层结构相同c.wz2中只含有共价键D.W、X两种元素只能形成一种化合物5.主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。
W、X处于同周期.W、Y处于同主族.W、X、Z原子的最外层电子数之和为13:Y的一种同素异形体容易自燃。
下列说法错误的是()A.Y的最高价氧化物可用作干燥剂B.原子半径:Z>Y>W>XC.X、Z形成的化合物中只含离子键D.Z的最髙价氧化物对应的水化物属于强碱答案C6.X、Y、Z、R、W是原子序数依次增大的五种短周期元素,它们可组成离子化合物Z2Y和共价化介物RY3、XW∙1,已知Y、R同主族,Z、R、W同周期。
2020届高考化学热点猜押练一 热点练4 物质结构 元素周期律(含解析)

猜押练一致胜高考必须掌握的10个热点热点练4:物质结构元素周期律(一)元素周期表与元素周期律(必修)1.主族元素X、Y、Z、W的原子序数依次增大,且均不大于20。
其中X、Y处于同一周期,Y的单质与水反应可生成X的单质,X、Y、W的最外层电子数之和是Z的最外层电子数的3倍。
下列说法正确的是( )A.简单离子的半径:Z>Y>XB. WX2中含有非极性共价键C.简单氢化物的热稳定性:X>YD. 常温常压下Z的单质为气态2.短周期主族元素X、Y、Z、W、Q的原子序数依次增加。
已知,离子化合物甲是由X、Y、Z、W四种元素组成的,其中,阴阳离子个数比为1∶1,阳离子是一种5核10电子微粒;Q元素原子半径是短周期主族元素中最大的;乙为上述某种元素的最高价氧化物对应的水化物;甲与乙的浓溶液反应生成丙、丁、戊三种物质,其中丁在常温下为气体。
下列说法正确的是 ( )A.甲中既含离子键,又含共价键B.丙和戊的混合物一定显酸性C.丁一定能使湿润的红色石蕊试纸变蓝D.原子半径:X<Y<Z<W3.短周期主族元素X、Y、Z、W的原子序数依次递增,其中Y与Z同主族。
X与Y、Z与W均可形成如图所示的分子结构,且Z与W形成的分子中所有原子最外层均满足8电子稳定结构。
下列说法中正确的是 ( )A.原子半径:W>Z>Y>XB.气态氢化物热稳定性:Z>WC.元素Z和W均存在两种以上的含氧酸D.元素Z和W在自然界中均只能以化合态存在4.短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为20。
则下列说法不正确的是( )X YW ZA.B.原子半径大小:Y<WC.X元素和氢元素所形成的化合物的沸点一定比Y的氢化物的沸点低D.ZY2是一种高效广谱型消毒剂5.短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是短周期主族元素原子中最大的,W与Y同族且W原子的质子数是Y原子的一半。
2020-2021高考化学专题训练---元素周期律的综合题分类附详细答案

2020-2021高考化学专题训练---元素周期律的综合题分类附详细答案一、元素周期律练习题(含详细答案解析)1.下表列出了①~⑩十种元素在周期表中的位置。
族周期ⅠA01①ⅡAⅢAⅣAⅤAⅥAⅦA2②④⑩3⑤⑥⑦③⑧⑨回答下列问题:(1)①、④按原子个数比1:1 组成的分子的电子式为____________________ ;由②、④两种元素组成的一种无毒化合物的结构式为 _____________________。
(2)这10种元素中,化学性质最不活泼的元素是_____________(填元素符号,下同),得电子能力最强的原子是__________________,失电子能力最强的单质与水反应的化学方程式是_________________________。
(3)用化学方程式表示②和⑨两种元素的非金属性强弱:________________________ 。
(4)元素③的气态氢化物和元素⑧的气态氢化物中,易于制备的是____________________(填化学式)(5)元素⑤的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应,其离子方程式为 ______________________________。
(6)元素①、④、⑤两两之间可以形成两种类型的化合物,写出一种共价化合物的化学式:___________________ ;写出一种离子化合物的化学式:______________________。
【答案】 O=C=O Ne O 2Na+2H2O=2NaOH+H2↑ 2HClO4+Na2CO3=CO2↑+2NaClO4 +H2O H2S Al(OH) 3 +OH- = AlO2- +2 H2O H2O(或H2O2) Na2O(或Na2O2或NaH)【解析】【分析】从表中元素所在的位置,可推出①为氢(H),②为碳(C),③为磷(P),④为氧(O),⑤为钠(Na),⑥为镁(Mg),⑦为铝(Al),⑧为硫(S),⑨为氯(Cl),⑩为氖(Ne)。
2020-2021高考化学元素周期律综合经典题含详细答案

2020-2021高考化学元素周期律综合经典题含详细答案一、元素周期律练习题(含详细答案解析)1.有四种短周期元素,它们的结构、性质等信息如下表所述:元素结构、性质等信息A 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂B B与A同周期,其最高价氧化物的水化物呈两性C元素的气态氢化物极易溶于水,可用作制冷剂D 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂请根据表中信息填写:(1)A原子的核外电子排布式________________.(2)B元素在周期表中的位置____________________;离子半径:B________A(填“大于”或“小于”).(3)C原子的电子排布图是_______________________,其原子核外有___个未成对电子,能量最高的电子为___轨道上的电子,其轨道呈___________形.(4)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为_______________________________,与D的氢化物的水化物反应的化学方程式为_____________________________.【答案】1s22s22p63s1第三周期第ⅢA族小于 3 2p 哑铃 Al(OH)3+NaOH═NaAlO2+2H2O 3HCl+Al(OH)3═AlCl3+3H2O【解析】【分析】A是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂,所以A为Na元素;B与A同周期,其最高价氧化物的水化物呈两性,则B为Al元素;C元素的气态氢化物极易溶于水,可用作制冷剂,则C为N元素;D是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,则D为Cl元素,据此回答;【详解】(1)A为钠元素,A原子的核外电子排布式1s22s22p63s1;答案为:1s22s22p63s1;(2)B为铝元素,B元素在周期表中的位置第三周期第ⅢA族,电子层数相同的离子,核电荷数越大,离子半径越小,所以铝离子半径小于钠离子;答案为:第3周期第ⅢA族;小于;(3)C为氮元素,C原子的基态原子的电子排布图是,其原子核外有3个未成对电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃;答案为:;3;2p;哑铃;(4)B为铝元素,A为Na元素,B的最高价氧化物对应的水化物与A的最高价氧化物的水化物反应的化学方程式为:Al(OH)3+NaOH═NaAlO2+2H2O;D的氢化物HCl,氯化氢与氢氧化铝反应的离子方程式为:3HCl+Al(OH)3═AlCl3+3H2O;答案为:Al(OH)3+NaOH═NaAlO2+2H2O;3HCl+Al(OH)3═AlCl3+3H2O。
山东省东营市2020届高考化学第一轮复习过关检测《元素周期表和周期律及应用》含答案

绝密★启用前山东省东营市2020届高考化学第一轮复习过关检测《元素周期表和周期律及应用》本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分,考试时间90分钟。
第Ⅰ卷一、单选题(共10小题,每小题3.0分,共30分)1.下列粒子半径大小的比较正确的是()A. Na+<Mg2+<Al3+<O2-B. S2->Cl->Na+>Al3+C. Na<Mg<Al<SD. Cs<Rb<K<Na2.短周期元素W、X、Y、Z在元素周期表中的位置如图所示。
下列说法中,正确的是()A. W的最高价氧化物对应的水化物是强酸B. Y的原子半径在同周期主族元素中最大C. W的非金属性比Z的弱D. Z的气态氢化物的稳定性在同主族元素中最强3.下列几种氢键:①O-H…O、②N-H…N、③F-H…F、④O-H…N,按氢键从强到弱的顺序正确的是()A.③>①>④>②B.①>②>③>④C.③>②>①>④D.①>④>③>②4.在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是()A.范德华力、范德华力、范德华力B.范德华力、范德华力、共价键C.范德华力、共价键、共价键D.共价键、共价键、共价键5.若氧元素只有16O、18O两种核素,下列说法正确的是()A.16O和18O的物理性质和化学性质完全相同B.通过化学反应可以实现16O与18O的相互转化C.向的平衡体系中加入18O2,达到新的平衡后18O只出现在O2与SO3中D.用惰性电极电解含有H218O的普通水时,阳极可能产生三种相对分子质量不同的氧分子6.元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。
下列推测不正确的是()A.同周期元素中X的金属性最强B.原子半径X>Y,离子半径X+>Z2-C.同族元素中Z的氢化物稳定性最高D.同周期元素中Y的最高价含氧酸的酸性最强7.有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质是一种重要的半导体材料。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020届高考专题练习元素周期表和周期律(含答案)
1.根据中学化学教材所附元素周期表判断,下列叙述正确的是()
A.M电子层电子数为奇数的所有元素都是金属
B.第三、四、五、六周期元素的数目分别是8、18、32、32
C.由左至右第2到12列,共十一列元素中没有非金属元素
D.只有第ⅡA族元素的原子最外层有2个电子
【答案】C
2.元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比
中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是()
A.Ⅱ、Ⅱ、Ⅱ对应原子的半径依次减小
B.Ⅱ、Ⅱ的最高价氧化物对应的水化物能相互反应
C.元素Ⅱ为Fe元素,处于常见周期表第四周期第VIIIB族
D.Ⅱ可分别与Ⅱ、Ⅱ、Ⅱ均可形成既含极性键又含非极性键的化合
物
【答案】C
3.短周期元素A、B、C的原子序数依次增大,其原子的最外层电子数之和为10,A与C
在周期表中位置上下相邻,B原子最外层电子数等于A原子次外层电子数,下列有关叙述不正确的是()
A.A与C可形成共价化合物B.A的氢化物的稳定性大于C的氢化物的稳定性C.原子半径A<B<C D.B的氧化物的熔点比A的氧化物熔点高
【答案】C
4.元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子
层结构。
下列推测不正确的是()
A.同周期元素中X的金属性最强B.原子半径X>Y,离子半径X+>Z2-C.同族元素中Z的氢化物稳定性最高D.同周期元素中Y的最高价含氧酸的酸性最强
【答案】B
5.短周期元素X原子核外的电子处于n个电子层上,最外层电子数为(2n+1),核内质子
数为(2n2-1)。
有关X的说法中不正确的是()
A.X元素气态氢化物的水溶液呈酸性
B.X能形成化学式为NaXO3的含氧酸钠盐
C.X原子的最外层电子数和核电荷数不可能为偶数
D.X元素常见单质的化学式为X2
【答案】A
6.X、Y、Z是三种短周期金属元素,原子序数依次增大,单质的物质的量分别为n(X)、
n(Y)、n(Z),它们与足量盐酸反应产生的氢气体积(标准状况下)为V(H2)X、V(H2)Y、V(H2)Z,且n(X)=n(Y)=n(Z),2V(H2)X=V(H2)Y+V(H2)Z。
下列说法正确的是()
A.X、Y、Z一定处于同一周期
B.X可能是镁
C.Y和Z的最高价氧化物对应的水化物在一定条件下能反应
D.工业上冶炼X、Y、Z通常是用热还原法制得
【答案】C
7.有X、Y、Z三种短周期元素,原子半径由大到小的顺序为Y>X>Z,原子序数之和为
16。
三种元素的常见单质在适当条件下可发生如图所示的变化,其中B和C均为10电子分子。
有关判断不正确的是()
A.X元素位于ⅡA族
B.A不能溶解于B中
C.B的沸点高于C的沸点
D.A和C不可能发生氧化还原反应
【答案】D
8.下表为部分短周期元素的原子半径及主要化合价。
下列说法正确的是()
元素代号L M Q R T
原子半径/nm 0.186 0.143 0.104 0.075 0.066
主要化合价+1 +3 +6、-2 +5、-3 -2
A.气态氢化物的稳定性:R>T
B.工业上电解MCl3溶液制备单质M
C.化合物L2T与QT2所含化学键类型相同
D.L与Q的最高价氧化物对应水化物均能与M(OH)3反应
【答案】D
9.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。
X是周期表中原子半径最
小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。
下列说法正确的是()
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:X m Y>X m R
D.元素W、R的最高价氧化物的水化物都是强酸
【答案】C
10.(不定项)短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和
为13。
X的原子半径比Y的小,X与W同主族,Z是地壳中含量最高的元素。
下列判断合理的是()
A.元素W分别与X、Y、Z形成的化合物都是离子化合物
B.四种元素简单离子的半径:X < Y < Z < W
C.Z与其他三种元素形成的常见化合物中有离子晶体、原子晶体和分子晶体
D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物
【答案】AD
11.短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中Y原子的最外
层电子数是其电子层数的3倍。
下列说法正确的是()
A.元素Y和元素Z的最高正化合价相同
B.单核阴离子半径的大小顺序为:r(W)>r(Y)>r(Z)
C.气态氢化物的热稳定性顺序为:X<Y<Z
D.元素W的最高价氧化物对应水化物的酸性最强
【答案】D
12.短周期元素甲、乙、丙、丁、戊五种元素在元素周期表中的位置如下图所示,其中戊是
同周期中原子半径最小的元素。
下列有关判断正确的是()
A.最外层电子数:甲>乙>丙>丁>戊
B.简单离子的离子半径:戊>丁
C.含有丁元素的酸有多种
D.乙的氢化物多种多样,丙、丁、戊的氢化物各有一种
【答案】C
13.短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数
与主族序数相等,下列说法正确的是()
A.W在周期表中的位置是第三周期ⅡA族
B.原子半径Q>R>T
C.W原子得电子能力强于Q原子,且可形成共价化合物QW2
D.原子序数比R多1的元素只能形成一种氢化物
【答案】C
14.A元素原子得电子变成阴离子释放出的能量比B元素原子得电子变成阴离子释放出的
能量大,则()
A.氧化性A->B-B.还原性A->B-
C.氧化性A>B D.还原性A>B
【答案】C
15.X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀H2SO4中时,X溶解,
Z板上有H2放出,若电解Y2+离子和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子,则这四种金属的活动性由强到弱的顺序为()
A.X > Z > Y > M B.X > Y > Z > M
C.M > Z > X > Y D.X > Z > M > Y
【答案】A
16.已知W、X、Y、Z为短周期元素,原子序数依次增大。
W、Z同主族,X、Y、Z同周
期,其中只有X为金属元素。
下列说法一定正确的是()
A.原子半径:X>Y>Z>W
B.W的含氧酸的酸性比Z的含氧酸的酸性强
C.W的气态氢化物的稳定性小于Y的气态氢化物的稳定性
D.若W与X原子序数差为5,则形成化合物的化学式为X3W2
【答案】A
不能作为判断硫、氯两种元素非金属性强弱的依据是()
17.
A.单质氧化性的强弱B.单质沸点的高低
C.单质与氢气化合的难易D.最高价氧化物对应的水化物酸性的强弱
【答案】B
18.短周期元素甲、乙、丙、丁的原子序数依次增大,甲和丁的原子核外均有两个未
成对电子,乙、丙、丁最高价氧化物对应的水化物两两之间能相互反应。
下列说法错误的是()
A.元素丙的单质可用于冶炼金属B.甲与丁形成的分子中由非极性分子
C.简单离子半径:丁> 乙> 丙D.甲与乙形成的化合物均有氧化性
【答案】D
19.今年是门捷列夫诞辰180周年。
下列事实不能用元素周期律解释的只有()
A.碱性:KOH>NaOH B.相对原子质量:Ar>K
>H2SO4D.元素的金属性:Mg>Al C.酸性:HClO
4
【答案】B
20.BeCl2熔点较低,易升华,溶于醇和醚,其化学性质与AlCl3相似。
由此可推测
BeCl2()
A.熔融态不导电B.水溶液呈中性
C.熔点比BeBr2高D.不与NaOH溶液反应
【答案】A
21.X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上
通过分离液态空气获得其单质;Y元素原子最外电子层上s、p电子数相等;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子的M层有1个未成对的p电子。
下列有关这些元素性质的说法一定正确的是()
A.X元素的氢化物的水溶液显碱性
B.Z元素的离子半径大于W元素的离子半径
C.Z元素的单质在一定条件下能与X元素的单质反应
D.Y元素最高价氧化物的晶体具有很高的熔点和沸点
【答案】C
22.元素周期表中铋元素的数据见右图,下列说法正确的是()
A.Bi元素的质量数是209
B.Bi元素的相对原子质量是209.0
C.Bi原子6p亚层有一个未成对电子
D.Bi原子最外层有5个能量相同的电子
【答案】B。
