2018年高考化学考前知识专题复习氧化还原反应
氧化还原反应高考知识点

氧化还原反应高考知识点氧化还原反应是化学中一个重要的知识点,也是高考考查的内容之一。
它涉及到许多基本概念和具体应用,对于理解化学反应和解决实际问题都非常有帮助。
本文将从氧化还原反应的定义、基本原理、常见应用以及解题方法等方面进行探讨。
一、氧化还原反应的定义和基本原理氧化还原反应,简称氧化反应,是指物质中氧化剂和还原剂之间的电子转移过程。
氧化剂指能够接受电子的物质,还原剂则相反,它能够提供电子。
在氧化还原反应中,还原剂失去电子,被氧化剂氧化,同时氧化剂被还原剂还原,电子的转移导致了物质的氧化和还原。
氧化还原反应的基本原理是电子的转移和能级的变化。
在反应中,还原剂的电子从较低的能级跃迁到较高的能级,被氧化剂的电子所接受。
这个过程导致了能级的变化,同时释放出能量。
因此,氧化还原反应通常伴随着能量的释放,如燃烧等。
二、氧化还原反应的常见应用氧化还原反应在生活中和工业领域有着广泛的应用。
首先,燃烧反应是一种常见的氧化还原反应。
例如,我们日常使用的火柴和煤都是通过燃烧产生热能,这是燃料被氧化剂氧化的结果。
此外,电池也是基于氧化还原反应的原理工作的。
电池通过将还原剂和氧化剂隔开,使得氧化还原反应逐步进行。
电子在还原剂和氧化剂之间转移,从而产生电流。
常见的干电池和蓄电池都是通过氧化还原反应来实现能量的转换和储存。
此外,高聚物的合成也是通过氧化还原反应来实现的。
例如,常见的聚合反应中,单体被还原剂的电子氧化,从而形成多聚物。
利用氧化还原反应合成高聚物具有很高的经济效益和环境友好性。
三、氧化还原反应的解题方法在高考中,氧化还原反应经常出现在选择题和计算题中。
要掌握解题的方法,首先需要了解反应的类型和反应方程式。
常见的氧化还原反应类型包括金属与非金属的氧化反应、金属与酸的反应、金属与水的反应等。
对于选择题,解题的关键是要分析出氧化剂和还原剂以及氧化剂的变化程度。
常见的氧化剂有氧气、各种金属离子等,还原剂则是指能够提供电子的物质。
高考化学专题复习之氧化还原反应知识点总结
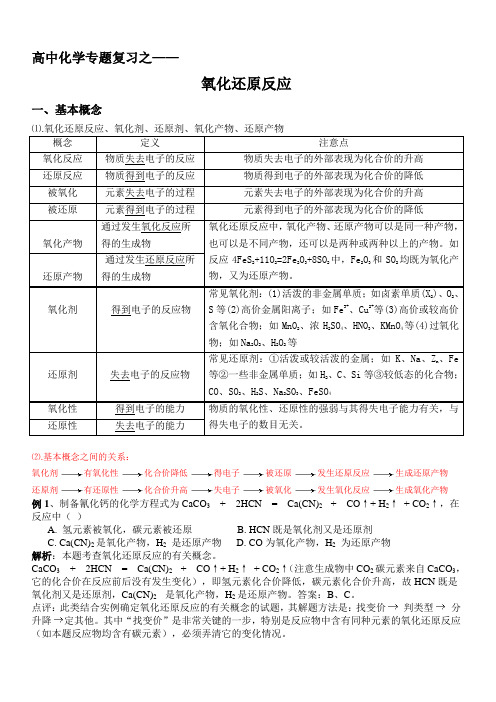
高中化学专题复习之——氧化还原反应一、基本概念⑴.氧化还原反应、氧化剂、还原剂、氧化产物、还原产物概念定义注意点氧化反应物质失去电子的反应物质失去电子的外部表现为化合价的升高还原反应物质得到电子的反应物质得到电子的外部表现为化合价的降低被氧化元素失去电子的过程元素失去电子的外部表现为化合价的升高被还原元素得到电子的过程元素得到电子的外部表现为化合价的降低氧化产物通过发生氧化反应所得的生成物氧化还原反应中,氧化产物、还原产物可以是同一种产物,也可以是不同产物,还可以是两种或两种以上的产物。
如反应4FeS2+11O2=2Fe2O3+8SO2中,Fe2O3和SO2均既为氧化产物,又为还原产物。
还原产物通过发生还原反应所得的生成物氧化剂得到电子的反应物常见氧化剂:(1)活泼的非金属单质;如卤素单质(X2)、O2、S等(2)高价金属阳离子;如Fe3+、Cu2+等(3)高价或较高价含氧化合物;如MnO2、浓H2SO4、HNO3、KMnO4等(4)过氧化物;如Na2O2、H2O2等还原剂失去电子的反应物常见还原剂:①活泼或较活泼的金属;如K、Na、Zn、Fe等②一些非金属单质;如H2、C、Si等③较低态的化合物;CO、SO2、H2S、Na2SO3、FeSO4氧化性得到电子的能力物质的氧化性、还原性的强弱与其得失电子能力有关,与得失电子的数目无关。
还原性失去电子的能力⑵.基本概念之间的关系:氧化剂有氧化性化合价降低得电子被还原发生还原反应生成还原产物还原剂有还原性化合价升高失电子被氧化发生氧化反应生成氧化产物例1、制备氰化钙的化学方程式为CaCO3+ 2HCN = Ca(CN)2 + CO↑+ H2↑+ CO2↑,在反应中()A. 氢元素被氧化,碳元素被还原B. HCN既是氧化剂又是还原剂C. Ca(CN)2是氧化产物,H2是还原产物D. CO为氧化产物,H2为还原产物解析:本题考查氧化还原反应的有关概念。
CaCO3+ 2HCN = Ca(CN)2 + CO↑+ H2↑+ CO2↑(注意生成物中CO2碳元素来自CaCO3,它的化合价在反应前后没有发生变化),即氢元素化合价降低,碳元素化合价升高,故HCN既是氧化剂又是还原剂,Ca(CN)2 是氧化产物,H2是还原产物。
高考化学专题复习讲义:氧化还原反应

第3讲氧化还原反应知考点明方向满怀信心正能量设问方式①氧化还原反应基本概念的辨析与应用[例](2018·北京卷,9),(2017·北京卷,8)②氧化还原反应规律应用[例](2018·北京卷,28),[例](2018·江苏卷,12),[例](2018·全国卷Ⅰ,28)③氧化还原反应方程式书写与配平[例](2018·江苏卷,20),(2017·海南卷,4)知识点网络线引领复习曙光现释疑难研热点建模思维站高端考点一基于“双线桥”辨析概念▼▼ 命题规律:1.题型:Ⅰ卷正误判断型选择题(主)、Ⅱ卷填空题(次)。
2.考向:有关氧化还原反应概念的辨析与判断可借助元素化合物、电化学等知识为载体,以选择题中的某一选项和非选择题中某一设问的形式进行考查,形式灵活,知识面广,但一般难度较低。
▼ 方法点拨:1.氧化还原反应基本概念图示理解与口诀记忆2.准确识记常考物质中某元素的化合价(1)CuFeS 2:Cu +2 Fe +2 S -2(2)K 2FeO 4:Fe +6 (3)Li 2NH 、LiNH 2、AlN :N -3 (4)Na 2S 2O 3:S +2(5)MO +2:M +5(6)C 2O 2-4:C +3 (7)HCN :C +2 N -3(8)CuH :Cu +1 H -1 (9)NaN 3:N 13 (10)O 2F 2:O +11.(1)下列说法中正确的是__ADE__。
A .ClO 2处理过的饮用水会含有一定量的亚氯酸盐。
可以用硫酸亚铁除去超标的亚氯酸盐。
(2015·全国卷Ⅱ)B .反应H 2S +4O 2F 2→SF 6+2HF +4O 2中O 2为氧化产物(2016·上海卷)C .反应H 2S +4O 2F 2→SF 6+2HF +4O 2中O 2F 2既是氧化剂又是还原剂(2016·上海卷)D .SO 2通入H 2S 溶液中产生黄色沉淀,说明SO 2有氧化性(2017·北京卷)E .SO 2通入含HCl 、BaCl 2的FeCl 3溶液中产生白色沉淀,说明SO 2有还原性(2017·北京卷)(2)①(2016·全国卷Ⅰ) NaClO 2中Cl 的化合价为__+3__。
高考化学复习高中总复习:专题2第1讲氧化还原反应的基本概念和规律

第1讲 氧化还原反应的基本概念和规律[考纲要求] 1.了解氧化还原反应的本质是电子转移。
2.了解常见的氧化还原反应。
考点一 用分类思想理解氧化还原反应1.根据反应中有无________转移或元素____________是否发生变化,可以把化学反应划分为____________反应和____________反应。
判断氧化还原反应的最佳判据是______________________。
2.四种基本反应类型和氧化还原反应的关系可用下图表示:1. 下列反应属于氧化还原反应的是____________,属于化合反应的是______________,属于分解反应的是____________________________________________________________, 属于置换反应的是____________,属于复分解反应的是______________。
A .Cu 2S +O 2===2Cu +SO 2 B .3O 2===2O 3C .Fe 2O 3+3CO=====△2Fe +3CO 2 D .2Na +2H 2O===2NaOH +H 2↑E .CaCO 3=====△CaO +CO 2↑ F .2H 2O 2===2H 2O +O 2↑ G .SO 3+H 2O===H 2SO 4H .2Fe +3Cl 2=====△2FeCl 3 I .H 2SO 4+2NaOH===Na 2SO 4+2H 2O考点二 结合实例理解氧化还原反应的相关概念实例:在Fe 2O 3+3CO=====高温2Fe +3CO 2的反应中________是氧化剂,________是还原剂;________元素被氧化,________元素被还原;Fe 2O 3具有氧化性,CO 具有还原性;________是氧化产物,________是还原产物。
1.相关概念还原剂在反应中表现为所含元素的化合价________,实质上____电子。
高中化学的复习知识点氧化还原反应.doc

三、氧化还原反应1、准确理解氧化还原反应的概念1.1 氧化还原反应各概念之间的关系(1)反应类型:氧化反应:物质所含元素化合价升高的反应。
还原反应:物质所含元素化合价降低的反应。
氧化还原反应:有元素化合价升高和降低的反应。
(2)反应物:氧化剂:在反应中得到电子的物质还原剂:在反应中失去电子的物质(3)产物:氧化产物:失电子被氧化后得到的产物还原产物:得电子被还原后得到的产物(4)物质性质:氧化性:氧化剂所表现出得电子的性质还原性:还原剂所表现出失电子的性质(5)各个概念之间的关系如下图例题1:下列变化过程属于还原反应的是( D )A.HCl→MgCl2B.Na→Na+C.CO→CO2D. Fe3+→Fe例题2:下列化学反应不属于氧化还原反应的是( C )A、3Cl2 + 6KOH =5KCl + KClO3 + 3H2OB、2NO2 + 2NaOH =NaNO3 +NaNO2 +H2OC、SnCl4 + 2H2O = SnO2 + 4HClD、3CCl4 + 2K2Cr2O7 = 2CrO2Cl2 + 3COCl2 +2KCl1.2 常见的氧化剂与还原剂(1)物质在反应中是作为氧化剂还是作为还原剂,主要取决于元素的化合价。
①元素处于最高价时,它的原子只能得到电子,因此该元素只能作氧化剂,如+7价的Mn和+6价的S②元素处于中间价态时,它的原子随反应条件不同,既能得电子,又能失电子,因此该元素既能作氧化剂,又能作还原剂,如0价的S和+4价的S③元素处于最低价时,它的原子则只能失去电子,因此该元素只能作还原剂,如-2价的S(2)重要的氧化剂①活泼非金属单质,如F2、Cl2、Br2、O2等。
②元素处于高价时的氧化物、高价含氧酸及高价含氧化酸盐等,如MnO2,NO2;浓H2SO4,HNO3;KMnO4,KClO3,FeCl3等。
③过氧化物,如Na2O2,H2O2等。
(3)重要的还原剂①金属单质,如Na,K,Zn,Fe等。
专题四 氧化还原反应 (2022高考化学专题复习课件)新高考版

D.[大纲卷高考]SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同
考法帮▪解题能力提升
解析 溶液变黄说明有溴单质生成,即还原剂(KBr)被氧化生成Br2,氧化
剂(Cl2)被还原,A项正确。氧化剂(HNO3)被还原,生成NO,还原剂(Fe)被
氧化,证明还原剂(Fe)的还原性强于还原产物(NO)的,B项错误。O3、Cl2、
高考关注的还原剂
对应的常见氧化产物
CO
CO2
SO2
SO3或SO24−
NH3
NO
H 2S
S
SO23−
SO24−
Fe2+
Fe3+
I-、Br-
I2、Br2
H2O2、Na2O2
Mg、Sn、HI、Na2S、S等
O2
考法帮▪解题能力提升
注意
1.题中没有特别说明时,判断氧化产物或还原产物时,一般优先考虑元素的常
电子数为0.2NA(
)
考点帮▪必备知识通关
4.[2015安徽,10D改编]NaClO和浓盐酸反应,每产生1 mol Cl2,转移电子约为
6.02×1023个(
)
5.[2015广东,10D]3 mol单质Fe完全转变为Fe3O4,失去8NA个电子(
答案 1.√
2.√
3.√
4.√
5.√
)
考法帮▪解题能力提升
2020全国卷Ⅰ,7B
NaClO通过氧化灭活病毒(√)
2020浙江7月选考,8C KMnO4具有氧化性,其稀溶液可用于消毒(√)
2017海南,1C
双氧水可作消毒剂(√)
2017江苏,3B
ClO2具有还原性,可用于自来水的杀菌消毒(✕)
高考化学考前专题3 氧化还原反应复习课件
MnO
-
4
>
Fe3+
>
Cu2+。
(3)①碱式滴定管(乙)下端有一段橡胶管,能被酸性高锰酸钾
溶液氧化,因此应该使用酸式滴定管(甲)装酸性高锰酸钾溶
液。终点时,溶液的颜色变为紫色或紫红色。②n(KMnO4) =0.100 mol·L-1×0.100 L=0.010 mol。根据关系式 Cu2O~ 2Fe3+~2Fe2+~2/5KMnO4,可得 n(Cu2O)=0.010 mol×5/2= 2.5×10-2 mol,而 m(Cu2O)=2.5×10-2 mol×144 g·mol-1= 3.6 g,w(Cu2O)=3.6 g/5 g×100%=72%。
命题猜想 2 向盛有 KI 溶液的试管中加入少许 CCl4 后滴加 氯水,振荡,静置,CCl4 层变成紫色。如果继续向试管中 滴加氯水,振荡,CCl4 层会逐渐变浅,最后变成无色,生 成物之一为 HIO3。则有关该过程的说法不正确的是( ) A.CCl4 层由紫色变成无色的化学反应方程式为 I2+5Cl2 +6H2O===2HIO3+10HCl B.整个过程中每生成 1 mol HIO3 共转移 6NA 个电子 C.整个过程中的还原剂有 KI、I2 D.若把 KI 换成 KBr,则 CCl4 层变为橙红色,继续滴加 氯水,CCl4 层的颜色没有变化,则 Cl2、HIO3、HBrO3 的氧化性由强到弱的顺序是 Cl2>HBrO3>HIO3
H2===LiNH2+LiH,下列有关说法正确的是
()
A.Li2NH 中 N 被氧化
B.该反应中 H2 既是氧化剂又是还原剂
C.在标准状况下,11.2 L H2 参加反应,转移的电子为 1 mol
D.在反应中被氧化的元素原子与被还原的元素原子个数
高考化学复习《氧化还原反应》知识点解析及练习题含答案
1.了解氧化还原反应的本质是电子转移。
2.了解氧化剂、还原剂、氧化产物和还原产物等概念。
3.能够利用得失电子守恒进行有关氧化还原反应的计算。
4.了解常见的氧化剂和还原剂及常见的氧化还原反应。
知识点一、氧化还原反应的基本概念及相互关系1.氧化还原反应的实质是电子的得失或电子对的偏移,特征是反应前后元素化合价的升降;判断某反应是否属于氧化还原反应可根据反应前后化合价是否发生了变化这一特征。
2.基本概念(1)氧化反应:失去电子(化合价升高)的反应。
(2)还原反应:得到电子(化合价降低)的反应。
(3)氧化剂(被还原):得到电子的物质(所含元素化合价降低的物质)。
(4)还原剂(被氧化):失去电子的物质(所含元素化合价升高的物质)。
(5)氧化产物:还原剂失电子后对应的产物(包含化合价升高的元素的产物)。
(6)还原产物:氧化剂得电子后对应的产物(包含化合价降低的元素的产物)。
3.氧化还原反应的表示方法高考化学复习《氧化还原反应》知识点解析及练习题含答案(1)双线桥法箭头必须由反应物指向生成物,且两端对准同种元素。
箭头方向不代表电子转移方向,仅表示电子转移前后的变化。
在“桥”上标明电子的“得”与“失”,且得失电子总数应相等。
(2)单线桥法箭头必须由还原剂中失电子的元素指向氧化剂中得电子的元素。
箭头方向表示电子转移的方向。
在“桥”上标明转移的电子总数。
1.氧化还原反应与四种基本反应类型的关系(1)有单质参加的化合反应一定是氧化还原反应;(2)有单质生成的分解反应一定是氧化还原反应;(3)置换反应一定是氧化还原反应;(4)复分解反应一定不是氧化还原反应。
2.常见的氧化剂和还原剂重要的氧化剂一般有以下几类:(1)活泼的非金属单质,如Cl2、Br2、O2等。
(2)元素(如Mn等)处于高化合价时的氧化物,如MnO2等。
(3)元素(如S、N等)处于高化合价时的含氧酸,如浓H2SO4、HNO3等。
(4)元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、KClO3、FeCl3等。
五年2018-2022高考化学真题按知识点分类汇编7-氧化还原反应基本概念(含解析)
五年2018-2022高考化学真题按知识点分类汇编7-氧化还原反应基本概念(含解析)一、单选题1.(2022·湖南·高考真题)科学家发现某些生物酶体系可以促进+H 和-e 的转移(如a 、b 和c),能将海洋中的2NO -转化为2N 进入大气层,反应过程如图所示。
下列说法正确的是A .过程Ⅰ中2NO -发生氧化反应B .a 和b 中转移的-e 数目相等C .过程Ⅱ中参与反应的()4+n(NO):n NH =1:4D .过程Ⅰ→Ⅲ的总反应为-+2422NO +NH =N +2H O ↑2.(2022·山东·高考真题)实验室制备4KMnO 过程为:①高温下在熔融强碱性介质中用3KClO 氧化2MnO 制备24K MnO ;②水溶后冷却,调溶液pH 至弱碱性,24K MnO 歧化生成4KMnO 和2MnO ;③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得4KMnO 。
下列说法正确的是A .①中用瓷坩埚作反应器B .①中用NaOH 作强碱性介质C .②中24K MnO 只体现氧化性D .2MnO 转化为4KMnO 的理论转化率约为66.7%3.(2022·山东·高考真题)古医典富载化学知识,下述之物见其氧化性者为 A .金(Au):“虽被火亦未熟"B .石灰(CaO):“以水沃之,即热蒸而解”C .石硫黄(S):“能化……银、铜、铁,奇物”D .石钟乳(3CaCO ):“色黄,以苦酒(醋)洗刷则白”4.(2022·浙江·统考高考真题)关于反应223242422Na S O H SO =Na SO S ++SO ++H O ↓↑,下列说法正确的是 A .24H SO 发生还原反应B .223Na S O 既是氧化剂又是还原剂C .氧化产物与还原产物的物质的量之比为2∶1D .2231mol Na S O 发生反应,转移4mol 电子5.(2022·浙江·统考高考真题)关于反应4CO 2+SiH 4 高温4CO+2H 2O+SiO 2,下列说法正确的是 A .CO 是氧化产物B .SiH 4发生还原反应C .氧化剂与还原剂的物质的量之比为1∶4D .生成1molSiO 2时,转移8mol 电子 6.(2021·江苏·高考真题)黑火药是中国古代四大发明之一,其爆炸反应为2KNO 3+S+3C=K 2S+N 2↑+3CO 2↑。
高三化学一轮复习知识点第8讲氧化还原反应的基本概念和规律
精品基础教育教学资料,仅供参考,需要可下载使用!第8讲 氧化还原反应的基本概念和规律【核心素养分析】证据推理与模型认知:建立氧化还原反应的观点,掌握氧化还原反应的规律,结合常见的氧化还原反应理解有关规律;通过分析、推理等方法认识氧化还原反应的特征和实质,建立氧化还原反应计算和配平的思维模型。
科学探究与创新意识:认识科学探究是进行科学解释和发现。
创造和应用的科学实践活动;能从氧化还原反应的角度,设计探究方案,进行实验探究,加深对物质氧化性、还原性的理解。
【重点知识梳理】知识点一 氧化还原反应的相关概念 一、氧化还原反应1.氧化还原反应的本质和特征2.氧化还原反应的相关概念及其关系例如,反应MnO 2+4HCl(浓)=====△MnCl 2+Cl 2↑+2H 2O 中,氧化剂是MnO 2,还原剂是HCl ,氧化产物是Cl 2。
生成1 mol Cl 2时转移电子数目为2N A ,被氧化的HCl 的物质的量是2_mol ,盐酸表现的性质是酸性和还原性。
【特别提醒】元素由化合态变为游离态时,该元素不一定被还原。
如:Cu 2+→Cu 时,铜元素被还原,Cl-→Cl2时,氯元素被氧化。
3.氧化还原反应中电子转移的表示方法(1)双线桥法①表示方法写出Cu与稀硝酸反应的化学方程式并用双线桥标出电子转移的方向和数目:。
②注意事项a.箭头指向反应前后有元素化合价变化的同种元素的原子,且需注明“得到”或“失去”。
b.箭头的方向不代表电子转移的方向,仅表示电子转移前后的变化。
c.失去电子的总数等于得到电子的总数。
(2)单线桥法①表示方法写出Cu与稀硝酸反应的化学方程式并用单线桥标出电子转移的方向和数目:。
②注意事项a.箭头从失电子元素的原子指向得电子元素的原子。
b.不标“得到”或“失去”,只标明电子转移的总数。
c.线桥只出现在反应物中。
4.一些特殊物质中元素的化合价5.氧化还原反应与四种基本反应类型间的关系(1)有单质参与的化合反应是氧化还原反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2018年高考化学考前知识专题复习氧化还原反应
[高考关键词] 1.概念:氧化反应和还原反应,氧化剂和还原剂,氧化产物和还原产物。
2.规律:反应的先后顺序,氧化性、还原性的强弱,电子得失守恒。
3.转移电子数。
4.氧化还原反应方程式的书写与配平。
对于Cu+HNO3(稀)===Cu(NO3)2+NO↑+H2O(未配平)
(1)Cu在反应中________电子,发生__________反应,是________剂。
(2)HNO3在反应中________电子,被__________,是________剂。
(3)该反应的氧化产物是________,还原产物是______(填化学式)。
(4)配平上述化学方程式。
(5)9.6 g铜溶于足量稀硝酸中,转移电子数________ N A,在标准状况下产生气体的体积为________ L。
答案(1)失氧化还原
(2)得还原氧化
(3)Cu(NO3)2NO
(4)3832 4
(5)0.3 2.24
高考题型1用“双线桥”理解氧化还原反应的概念
1.(2017·上海,13)O2F2可以发生反应:H2S+4O2F2―→SF6+2HF+4O2,下列说法正确的是()
A.氧气是氧化产物
B.O2F2既是氧化剂又是还原剂
C.若生成4.48 L HF,则转移0.8 mol电子
D.还原剂与氧化剂的物质的量之比为1∶4
答案 D
解析A项,O元素的化合价由反应前的+1价变为反应后的0价,化合价降低,获得电子,
所以氧气是还原产物,错误;B 项,在反应中O 2F 2中的O 元素的化合价降低,获得电子,所以该物质是氧化剂,而H 2S 中的S 元素的化合价是-2价,反应后变为SF 6中的+6价,所以H 2S 是还原剂,错误;C 项,外界条件不明确,不能确定HF 的物质的量,所以不能确定转移电子的数目,错误;D 项,根据反应化学方程式可知还原剂H 2S 与氧化剂O 2F 2的物质的量之比是1∶4,正确。
2.(2017·山东理综,7)下表中对应关系正确的是( )
答案 B 解析 A 项,乙烯与HCl 发生的是加成反应,而非取代反应,该选项错误;B 项,油脂属于酯类,能发生水解反应,且得到的醇都是丙三醇(甘油),淀粉水解得到葡萄糖,该选项正确;C 项,Zn →Zn 2+的过程中,化合价升高,Zn 被氧化,该选项错误;D 项,在两个反应中,H 2O 中两种元素的化合价都没有发生变化,H 2O 在两个反应中均既不作氧化剂,也不作还原剂,该选项错误。
解答氧化还原反应有关概念的试题并不难,只需坚持一种思想,用好一个关系,循着正确的思维程序,所有问题都可迎刃而解。
(1)核心思想——对立统一思想
在一个氧化还原反应中,化合价有升就有降、电子有得就有失;氧化剂与还原剂、氧化产物
与还原产物、氧化反应与还原反应共存于同一反应中。
(2)关系式
(3)解答氧化还原反应有关概念题的“三个步骤”
第一步:依据题意分析概念
“升失氧,降得还;剂性一致,其他相反。
”“剂性一致”即氧化剂具有氧化性,还原剂具有还原性。
“其他相反”即氧化剂被还原,发生还原反应,生成还原产物;还原剂被氧化,发生氧化反应,生成氧化产物。
第二步:依据规律判断反应的合理性
氧化还原反应遵循化合价互不交叉规律、强弱规律等。
同学们应掌握化合价与氧化性的关系,“高价氧,低价还,中间价态两面转”。
第三步:利用电子守恒进行定量判断
有关氧化还原反应的定量问题,利用得、失电子守恒法可以简化计算过程。
对于生疏的或多步氧化还原反应,可直接找出起始的氧化剂、还原剂和最终的还原产物、氧化产物,利用原子守恒和电子守恒,建立已知量与未知量的关系,快速列等式求解。
如:一定量的Cu与HNO3完全反应产生NO x,该NO x又被氧化为HNO3,则Cu和O2的关系为n(Cu)×2=n(O2)×4。
考向1氧化还原反应概念的辨析
1.下列化学应用中不涉及氧化还原反应的是()
A.过氧化钠用作缺氧场所的供氧剂
B.热的纯碱溶液常用作物品表面油污洗涤剂
C.漂白粉常被用于疫区的环境消毒
D.铝热反应常被用于野外焊接钢轨
答案 B
解析 A 项,发生的反应为2Na 2O 2+2CO 2===2Na 2CO 3+O 2;C 项,利用HClO 的强氧化性消毒;D 项,发生的反应为2Al +Fe 2O 3=====高温
Al 2O 3+2Fe ,A 、C 、D 项均涉及氧化还原反应;而B 项中利用纯碱的水解反应去除油污,不涉及氧化还原反应。
2.氧化还原反应概念正误判断,正确的打“√”,错误的打“×”。
(1)有化合价升降的化学反应一定是氧化还原反应( )
(2)置换反应全部属于氧化还原反应,因为有单质参加和生成,化合价发生了变化(
) (3)氧化还原反应一定属于四大基本反应类型( )
(4)有单质参加或生成的化学反应一定是氧化还原反应( )
(5)氧化还原反应中,反应物不是氧化剂就是还原剂( )
(6)在氧化还原反应中,氧化剂和还原剂既可以是不同物质也可以是同种物质( )
(7)在氧化还原反应中,非金属单质都作氧化剂( )
(8)生成物中来源于氧化剂的是还原产物( )
(9)还原剂具有还原性,反应时本身被还原,发生还原反应( )
(10)元素从化合态变为游离态,该元素不一定被还原( )
(11)失电子越多,还原性越强,得电子越多,氧化性越强( )
(12)在同一氧化还原反应中,氧化剂的氧化性一定大于氧化产物的氧化性( )
(13)金属元素被还原,不一定得到金属单质( )
(14)含氧酸的价态越高,氧化性一定越强( )
(15)不容易得到电子的物质,肯定容易失去电子( )
答案 (1)√ (2)√ (3)× (4)× (5)× (6)√ (7)× (8)× (9)× (10)√
(11)× (12)√
(13)√ (14)× (15)×
考向2 氧化还原反应基本概念的相互关系
3.关于反应4Al +3TiO 2+3C===2Al 2O 3+3TiC 的叙述正确的是( )
A .Al 是还原剂,TiC 是氧化产物
B .TiO 2是氧化剂,Ti
C 是还原产物
C .反应中氧化剂与还原剂的物质的量之比是1∶1
D .生成1 mol TiC 时转移4 mol 电子
答案 D。
