高中化学选修四第四章原电池电极反应式的书写汇总-练习与答案
高中化学第四章电化学基础重难点三电极反应和电池反应方程式含解析新人教版选修4

重难点三电极反应和电池反应方程式电极反应方程式的书写步骤:1.首先判断原电池的正负极如果电池的正负极判断失误,则电极反应必然写错.一般来说,较活泼的金属失去电子,为原电池的负极,但不是绝对的.如镁片和铝片插入氢氧化钠溶液中组成的原电池虽然镁比铝活泼,但由于铝和氢氧化钠溶液反应失去电子被氧化,因而铝是负极,此时的电极反应为:负极:2Al-6e-═2Al3+正极:6H2O+6e-═6OH-+3H2↑ 或 2Al3++2H2O+6e-+2OH-═2AlO2-+3H2↑再如,将铜片和铝片同时插入浓硝酸中组成原电池时,由于铝在浓硝酸中发生了钝化,铜却失去电子是原电池的负极被氧化,此时的电极反应为:负极:Cu-2e-═Cu2+正极:2NO3-+4H++2e-═2NO2↑+2H2O2.要注意电解质溶液的酸碱性在正负极上发生的电极反应不是孤立的,它往往与电解质溶液紧密联系.如氢-氧燃料电池就分酸式和碱式两种,在酸性溶液中的电极反应:负极:2H2-4e-═4H +正极:O2+4H++4e-═2H2O如果是在碱性溶液中,则不可能有H+出现,同样在酸性溶液中,也不能出现OH-.由于CH4、CH3OH 等燃料电池在碱性溶液中,碳元素是以CO32-离子形式存在的,故不是放出CO2.3.还要注意电子转移的数目在同一个原电池中,负极失去电子的总数一定等于正极得到电子的总数,所以在书写电极反应式时,要注意电荷守恒.这样可避免在有关计算时产生错误或误差,也可避免由电极反应式写总反应方程式或由总方程式改写电极反应式时所带来的失误4.抓住总的反应方程式从理论上讲,任何一个自发的氧化还原反应均可设计成原电池.而两个电极相加即得总的反应方程式.所以对于一个陌生的原电池,只要知道总的反应方程式和其中的一个电极反应式,就可写出另一个电极反应式【重难点点睛】原电池正、负极电极反应式的书写技巧:(1)先确定原电池的正负极上的反应物质,并标出相同电子数目的得失;(2)注意负极反应生成的阳离子与电解质溶液中的阴离子是否共存.若不共存,则该电解质溶液中的阴离子应写入负极反应式;若正极上的反应物质是O2,且电解质溶液为中性或碱性,则H2O必须写入正极反应式中,且O2生成OH-;若电解质溶液为酸性,则H+必须写入正极反应式中,且O2生成H2O;若在熔融盐电解质中反应,则O2可能得电子变成O2-;(3)正负电极反应式相加得到电池反应的总方程式,若能写出已知电池反应的总方程式,可以减去较易写出的电极反应式,从而得到比较难写的电极反应式。
2019-2020学年高二化学人教版选修4练习:第4章 第1节 原电池 Word版含解析

第一节原电池课后篇巩固提升基础巩固1.下列说法正确的是()A.原电池中,负极上发生的反应是还原反应B.原电池中,电流的方向是负极—导线—正极C.双液原电池中的盐桥是为了联通电路,所以也可以用金属导线代替,阳离子移向正极,阴离子移向负极项,原电池负极上发生氧化反应;B项,电流的方向应是正极—导线—负极;C项,盐桥不能用导答案DFe+2H+Fe2++H2↑,则下列说法中正确的是()A.用HNO3作电解质溶液B.用锌作原电池正极C.用铁作负极,铁的质量不变D.用铜作原电池正极解析根据原电池反应可以确定原电池负极为Fe,电解质溶液为稀盐酸或稀硫酸等,但不能为硝酸,若,则原电池反应为3Fe+8H++2N O3-2NO↑+3Fe2++4H2O。
答案D,以下叙述正确的是()A.两烧杯中铜片表面均无气泡产生B.甲中铜片是正极,乙中铜片是负极C.两烧杯中溶液的pH均增大解析图甲是一个原电池装置,负极(Zn):Zn-2e-Zn2+,正极(Cu):2H++2e-H2↑,形成原电池能加快;图乙中,Zn直接与稀硫酸反应生成H2:Zn+2H+Zn2++H2↑,甲、乙两烧杯中H2SO4 ,溶液的pH均增大。
答案C()A.甲中电池总反应的离子方程式为Cd(s)+Co2+(aq)Co(s)+Cd2+(aq)B.反应2Ag(s)+Cd2+(aq)Cd(s)+2Ag+(aq)能够发生C.盐桥的作用是形成闭合回路,并使两边溶液保持电中性D.乙中有1 mol电子通过外电路时,正极有108 g Ag析出Cd的活动性强于Co,由乙可知Co的活动性强于Ag,即Cd的活动性强于Ag,故Ag Cd,B项错误。
答案B5.一种光化学电池的结构如图所示,当光照在表面涂有氯化银的银片上时,发生反应:AgCl(s)Ag(s)+Cl(AgCl)[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],Cl(AgCl)+e-Cl-(aq)。
下列说法正确的是()A.光照时,外电路电流由Y流向XB.光照时,Pt电极上发生的反应为2Cl--2e-Cl2↑C.光照时,Cl-向Ag电极移动D.光照时,电池总反应为AgCl(s)+Cu+(aq)Ag(s)+Cu2+(aq)+Cl-(aq)解析由题意可知Ag电极上的反应为AgCl+e-Ag+Cl-,故Ag电极为正极,Pt电极为负极。
高中常见电极反应式的书写汇总

电极反应方程式一、原电池电极反应方程式1.Cu─H2SO4─Zn原电池正极:2H+ + 2e- == H2↑负极:Zn—2e- == Zn2+总反应式:Zn + 2H+ == Zn2+ + H2↑2.Cu─FeCl3─C原电池正极:2Fe3+ + 2e- == 2Fe2+负极:Cu —2e- == Cu2+总反应式:2Fe3+ + Cu == 2Fe2+ + Cu2+ 3.钢铁在潮湿的空气中发生吸氧腐蚀正极:O2 + 2H2O + 4e- == 4OH-负极:2Fe—4e- == 2Fe2+总反应式:2Fe + O2 + 2H2O == 2F e(O H)2↓4.钢铁在潮湿的空气中发生析氢腐蚀正极:2H+ +2e- == H2↑负极:Fe —2e- == Fe2+总反应式:Fe +2H+ == Fe2+ +H2↑5.氢氧燃料电池(中性介质)正极:O2 + 2H2O + 4e- == 4OH-负极:2H2—4e-== 4H+总反应式:2H2 + O2 == 2H2O6.氢氧燃料电池(酸性介质)正极:O2 + 4H+ + 4e- == 2H2O负极:2H2—4e-== 4H+总反应式:2H2 + O2 == 2H2O7.氢氧燃料电池(碱性介质)正极:O2 + 2H2O + 4e- == 4OH-负极:2H2—4e- + 4OH- == 4H2O总反应式:2H2 + O2 == 2H2O8.铅蓄电池(放电)正极(PbO2) :PbO2 + 2e- + 24SO-+ 4H+ == PbSO4↓+ 2H2O负极(Pb) :Pb—2e- + 24SO-== PbSO4↓总反应式:Pb + PbO2 + 4H+ + 224SO-== 2PbSO4↓+2H2O9.Al─NaOH─Mg原电池正极:6H2O + 6e- == 3H2↑+ 6OH-负极:2Al —6e- + 8OH- == 22AlO-+ 4H2O总反应式:2Al + 2OH- + 2H2O == 22AlO-+ 3H2↑10.CH4燃料电池(碱性介质)正极:2O2 + 4H2O + 8e- == 8OH-负极:CH4—8e- + 10OH- ==23CO-+ 7H2O总反应式:CH4 + 2O2 + 2OH- == 23CO-+ 3H2O 11.熔融碳酸盐燃料电池(Li2CO3和Na2CO3熔融盐作电解液,CO作燃料):正极:O2 + 2CO2 + 4e- == 223CO-(持续补充CO2气体)负极:2CO + 223CO-—4e- == 4CO2总反应式:2CO + O2 == 2CO212.银锌纽扣电池(碱性介质)正极(Ag2O) :Ag2O + H2O + 2e- == 2Ag + 2OH-负极(Zn) :Zn + 2OH-—2e- == ZnO + H2O总反应式:Zn + Ag2O == ZnO + 2Ag二、电解电极反应方程式1.电解CuCl2溶液阳极:2Cl-—2e- == Cl2↑阴极:Cu2+ + 2e- == Cu总反应式:2Cl- + Cu2+ ==== Cl2↑ + Cu2.电解精炼铜阳极(粗铜):Cu —2e- == Cu2+阴极(纯铜) :Cu2+ + 2e- == Cu总反应式:无3.电镀铜阳极(纯铜):Cu—2e- == Cu2+阴极(待镀金属,如Fe):Cu2+ + 2e- == Cu总反应式:无4.电解饱和食盐水阳极:2Cl-—2e- == Cl2↑阴极:2H2O + 2e- == H2↑ + 2OH-总反应式:2Cl- + 2H2O ==== H2↑+ Cl2↑ + 2OH-5.电解HCl溶液阳极:2Cl- - 2e- == Cl2↑阴极:2H+ + 2e- == H2↑总反应式:2Cl- + 2H+==== Cl2↑ + H2↑6.电解NaOH溶液阳极:4OH-—4e- == O2↑ + 2H2O阴极:4H2O + 4e- == 2H2↑ + 4OH-总反应式:2H2O ==== 2H2↑+ O2↑7.电解H2SO4溶液阳极:2H2O —4e- == O2↑ + 4H+阴极:4H+ +4e- == 2H2↑总反应式:2H2O ==== 2H2↑ + O2↑8.电解KNO3溶液阳极:2H2O —4e- == O2↑ + 4H+阴极:4H2O + 4e- == 2H2↑ + 4OH-总反应式:2H2O ==== 2H2↑ + O2↑9.电解CuSO4溶液阳极:2H2O—4e- == O2↑ + 4H+电解电解电解电解电解电解阴极:2Cu2+ + 4e- == 2Cu↓总反应式:2Cu2+ + 2H2O ==== 2Cu↓+ O2↑+ 4H+ 10.电解AgNO3溶液阳极:2H2O—4e- == O2↑ + 4H+阴极:4Ag+ + 4e- == 4Ag↓总反应式:4Ag+ + 2H2O ==== 4Ag↓+ O2↑ + 4H+ 11.铅蓄电池充电阳极:PbSO4—2e- + 2H2O == PbO2 +24SO-+ 4H+阴极:PbSO4 + 2e- == Pb + 24SO-总反应式:2PbSO4 + 2H2O ==== Pb + PbO2 + 4H+ +224SO-B2H6(g) + 3O2(g) ==== B2O3(s) + 3H2O(l);ΔH = - 2165 kJ·mol-1电解电解电解。
高中化学第四章第一节原电池练习(含解析)新人教版选修4(最新整理)

2019年高中化学第四章第一节原电池练习(含解析)新人教版选修4 编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019年高中化学第四章第一节原电池练习(含解析)新人教版选修4)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019年高中化学第四章第一节原电池练习(含解析)新人教版选修4的全部内容。
第一节原电池选题表知识点基础过关能力提升原电池的设计1原电池原理2,3,4,511原电池原理的应用6,912综合应用7,8,1013,14基础过关(20分钟)1。
在理论上不能用于设计原电池的化学反应是( A )A.H2SO4(aq)+BaCl2(aq)BaSO4(s)+2HCl(aq)ΔH<0B.2CH3OH(l)+3O2(g)2CO2(g)+4H2O(l)ΔH〈0C。
4Fe(OH)2(s)+2H2O(l)+O2(g)4Fe(OH)3(s)ΔH〈0D.3Cu(s)+8HNO3(aq)3Cu(NO3)2(aq)+2NO(g)+4H2O(l)ΔH<0解析:A属于复分解反应,不是氧化还原反应,不能用于设计原电池,符合题意;B、C、D属于自发的氧化还原反应,能设计成原电池.2。
(2018·广西贵港高二期中)原电池原理的发现和各式各样电池装置的发明是化学对人类的一项重大贡献,关于如图所示原电池的说法正确的是( C )A.将电能转化为化学能的装置B.电子由铜片经导线流向锌片C。
锌片为负极,发生氧化反应D。
铜片上发生的反应为Cu2++2e—Cu解析:该装置为原电池,将化学能转化为电能的装置,A错误;原电池中,电子从负极流向正极,即由锌片经导线流向铜片,B错误;活泼性强的金属作负极,负极上Zn失电子,发生氧化反应,C正确;铜片上发生的反应为2H++2e—H2↑,D错误。
人教版选修4第四章《电化学基础》核心知识与全章分节分层练习 +答案+全解全析
第四章《电化学基础》全章核心知识与分节分层练习本章重要而易错核心知识点1.双液电池中,若电解质溶液为AgNO3溶液,则盐桥不能含KCl,因为会生成AgCl沉淀。
2.粒子流向:电子流向——原电池中:从负极开始→导线→正极截止(电子不能通过电解质溶液)电解池中:直流电源负极→导线→阴极截止,然后活性阳极或溶液中的阴离子失电子→阳极→直流电源正极(电子不能通过电解质溶液)离子移动方向:原电池中:“阴负阳正”即阴离子移向负极,阳离子移向正极。
电解池中:“阴阳阳阴”即阴离子移向阳极,阳离子移向阴极。
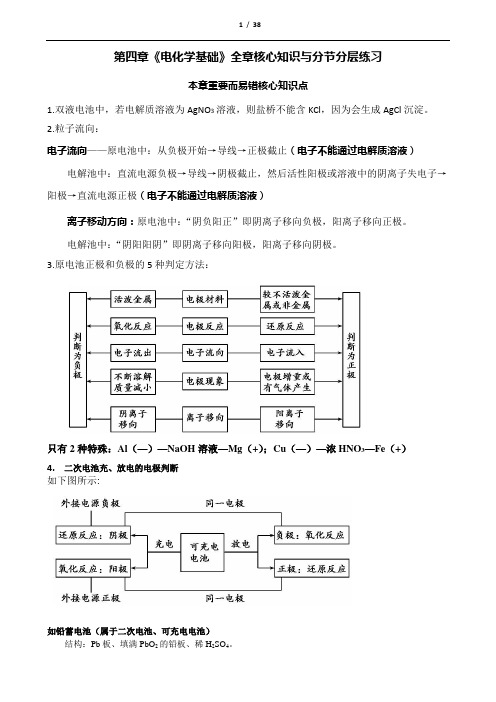
3.原电池正极和负极的5种判定方法:只有2种特殊:Al(—)—NaOH溶液—Mg(+);Cu(—)—浓HNO3—Fe(+)4.二次电池充、放电的电极判断如下图所示:如铅蓄电池(属于二次电池、可充电电池)结构:Pb板、填满PbO2的铅板、稀H2SO4。
.放电反应(原电池):负极:Pb-2e-+ SO42- = PbSO4正极:PbO2 +2e-+4H+ + SO42- = PbSO4 + 2H2O充电反应(电解池):阴极:PbSO4 +2e-= Pb+ SO42-阳极:PbSO4 -2e- + 2H2O = PbO2 +4H+ + SO42-总反应式:Pb + PbO2 + 2H2SO42PbSO4 + 2H2O简单理解:充电要恢复放电前的样子。
即:放电时原电池负极失电子后,充电时要补回来,故原负极电极要接电源负极成阴极;放电时原电池正极得电子后,充电时要把电子失去,故原正极电极要接电源正极成阳极。
5.书写原电池中的电极反应式时,(1)一定要首先找出题目给出的溶液的酸、碱性,经确认无误后再用H+(酸溶液)或OH-(碱溶液)来平衡电荷。
(2)有些题目中未直接告诉酸碱性,则看电池总反应式,若总反应式中出现碱,则为碱性溶液,则必须用OH-(碱溶液)来平衡电荷。
(3)不在水溶液中进行的原电池反应,一般不能用H+或OH-平衡电荷。
高中化学选修4电化学电极反应书写专题训练及解析
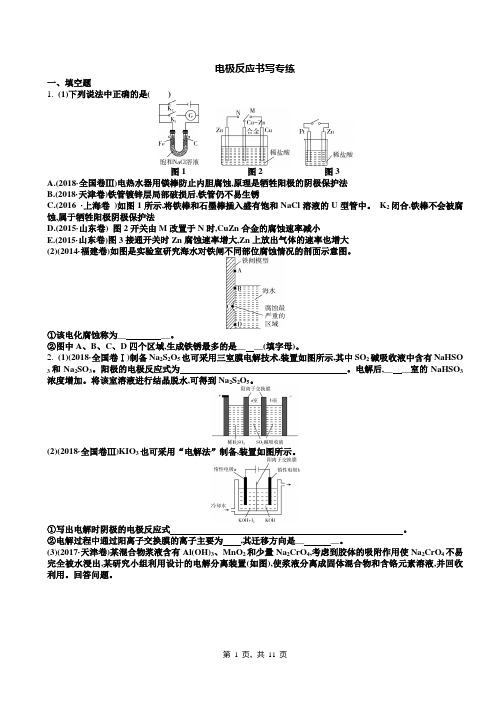
电极反应书写专练一、填空题1. (1)下列说法中正确的是()图1图2图3A.(2018·全国卷Ⅲ)电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法B.(2018·天津卷)铁管镀锌层局部破损后,铁管仍不易生锈C.(2016 ·上海卷)如图1所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。
K2闭合,铁棒不会被腐蚀,属于牺牲阳极阴极保护法D.(2015·山东卷) 图2开关由M改置于N时,CuZn合金的腐蚀速率减小E.(2015·山东卷)图3接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大(2)(2014·福建卷)如图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为__ __。
②图中A、B、C、D四个区域,生成铁锈最多的是__ __(填字母)。
2. (1)(2018·全国卷Ⅰ)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO 和Na2SO3。
阳极的电极反应式为。
电解后,__ __室的NaHSO3 3浓度增加。
将该室溶液进行结晶脱水,可得到Na2S2O5。
(2)(2018·全国卷Ⅲ)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式。
②电解过程中通过阳离子交换膜的离子主要为,其迁移方向是__ __。
(3)(2017·天津卷)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4,考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(如图),使浆液分离成固体混合物和含铬元素溶液,并回收利用。
回答问题。
用惰性电极电解时,CrO2-4能从浆液中分离出来的原因是____,分离后含铬元素的粒子是__ __;阴极室生成的物质为__ __(写化学式)。
3. (1)(2018·天津卷)O2辅助的Al—CO2电池工作原理如图所示。
(完整版)电极反应式书写练习答案
正极 :3O2+ 12e-+12H+=6H2O
总方程式 :2CH3OH+3O2=2CO2+4H2O 15.CO 燃料电池
(1).熔融盐 (铂为两极、 Li 2CO3 和 Na2CO3 的熔融盐作电解质, CO 为负极燃气, 空气与 CO2 的混合气为正极助燃气)
负极 :2CO-4e-+2CO32-=4CO2
负极 :Zn-2e-=Zn2+
正极
:2MnO
2+
2NH
+
4
+2e-=2MnO(OH)
+
2NH
3↑
2
2. PbO2+Pb+2H2SO4=2PbSO4+2H2O 负极 :Pb- 2e-+SO42-=PbSO4 正极 :PbO2+2e-+4H++ SO42-=PbSO4+2H2O
3. 海水做电解质溶液 :5MnO 2+2Ag +2NaCl=Na2Mn 5O10+2AgCl 负极 :2Ag-2e-+ 2Cl=2AgCl 正极 :5MnO 2+2e-=Mn 5O102-
负极 :3Zn-6e-+6OH-=3Zn(OH) 2
正极 :2FeO42-+8H2O+6e-=2Fe(OH)3+10OH-
3
电极反应式书写练习
一、写出电极反应式和总方程式
1.
G
Fe
Cu
负极 :Fe- 2e-=Fe2+
正极 :2Fe3+ 2e-=2Fe2+
FeC3l 溶液
2.
G
Fe
Zn
总方程式 2Fe3++Fe=3Fe2+
负极 :Zn- 2e-=Zn2+ 正极 :Cu2++2e-=Cu
CuSO4 溶液
总方程式 Zn+Cu2+=Zn2++Cu
总方程式 :2Al+2OH-+ 2H2O=2AlO2-+3H2↑
原电池电极反应式的书写专题练习(附答案)
原电池电极反应式的书写专题训练1、伏打电池:(负极—Zn,正极—Cu,电解液—H2SO4)负极:正极:总反应离子方程式Zn + 2H+ == H2↑+ Zn2+负极:Zn–2e-==Zn2+正极:2H++2e-==H2↑2、铁碳电池(析氢腐蚀):(负极—Fe,正极—C,电解液——酸性)负极:正极:总反应离子方程式Fe+2H+==H2↑+Fe2+负极:Fe–2e-==Fe2+正极:2H++2e-==H2↑3、铁碳电池(吸氧腐蚀):(负极—Fe,正极—C,电解液——中性或碱性)负极:正极:总反应化学方程式:2Fe+O2+2H2O==2Fe(OH)2;(铁锈的生成过程) 负极:2Fe–4e-==2Fe2+正极:O2+2H2O+4e-==4-OH4Fe(OH)2+O2+2H2O==4Fe(OH)3 ;2Fe(OH)3==Fe2O3 +3 H2O4.铝镍电池:(负极—Al,正极—Ni,电解液——NaCl溶液)负极:正极:总反应化学方程式:4Al+3O2+6H2O==4Al(OH)3 (海洋灯标电池)负极:4Al–12e-==4Al3+正极:3O2+6H2O+12e-==12-OH5、普通锌锰干电池:(负极——Zn,正极——碳棒,电解液——NH4Cl糊状物)负极:正极:总反应化学方程式:Zn+2NH4Cl+2MnO2=ZnCl2+Mn2O3+2NH3+H2O负极:Zn–2e-==Zn2+正极:2MnO2+2NH4++2e-==Mn2O3 +2NH3+H2O6、碱性锌锰干电池:(负极——Zn,正极——碳棒,电解液KOH糊状物)负极:正极:总反应化学方程式:Zn +2MnO2 +2H2O == Zn(OH)2 + MnO(OH)负极:Zn + 2OH– 2e-== Zn(OH)2 正极:2MnO2 + 2H2O + 2e-==2MnO(OH) +2OH-7、银锌电池:(负极——Zn,正极--Ag2O,电解液NaOH )负极:正极:总反应化学方程式:Zn + Ag2O == ZnO + 2Ag负极:Zn+2OH-–2e-== ZnO+H2O 正极:Ag2O + H2O + 2e-== 2Ag + 2OH-8、镁铝电池:(负极--Al ,正极--Mg ,电解液KOH )负极(Al): 正极(Mg ):总反应化学方程式: 2Al + 2OH - + 6H 2O = 2【Al (OH )4】-+ 3H 2↑ 负极(Al): 2Al + 8OH -+6e - = 2【Al (OH )4】- 正极(Mg ): 6H 2O + 6e -= 3H 2↑+6OH – 9、高铁电池 (负极--Zn ,正极--碳,电解液KOH 和K 2FeO 4)正极: 负极:总反应化学方程式:3Zn + 2K 2FeO 4 + 8H 2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH正极:2FeO 42- + 8H 2O +6e -==2Fe(OH)3 + 4OH – 负极: 3Zn + 6OH – 6e -== 3Zn(OH)2 10、镁/H 2O 2酸性燃料电池正极: 负极:总反应化学方程式:Mg+ H 2SO 4+H 2O 2=MgSO 4+2H 2O镁/H 2O 2酸性燃料电池 正极:2H ++H 2O 2=2H 2O 负极:Mg –2e -== Mg 2+ 11、铅蓄电池:(负极—Pb 正极—PbO 2 电解液— 稀硫酸)负极: 正极:总化学方程式 Pb +PbO 2 + 2H 2SO 4==2PbSO 4+2H 2O负极: Pb -2e -+SO 42-==PbSO 4 正极: PbO 2+2e -+4H ++SO 42-==PbSO 4+2H 2O 12、镍镉电池(负极--Cd 、正极—NiOOH 、电解液: KOH 溶液)放电时负极: 正极:总化学方程式 Cd + 2NiOOH + 2H 2O===Cd(OH)2 + 2Ni(OH)2负极: Cd -2e — + 2 OH – == Cd(OH)2 正极: 2NiOOH + 2e — + 2H 2O == 2Ni(OH)2+ 2OH –13、氢氧燃料电池:总反应方程式: 2H 2 + O 2 === 2H 2O(1)电解质是KOH 溶液(碱性电解质)负极: 正极:2H 2 – 4e - + 4OH — === 4H 2O 正极:O 2 + 2H 2O + 4e -=== 4OH — (2)电解质是H 2SO 4溶液(酸性电解质)负极: 正极:负极:2H 2 –4e - === 4H + 正极:O 2 + 4H + + 4e -=== 2H 2O (3)电解质是NaCl 溶液(中性电解质)负极: 正极:放电充电负极:2H2– 4e-=== 4H+正极:O2 + 2H2O + 4e-=== 4OH—14、甲醇燃料电池(注:乙醇燃料电池与甲醇相似)(1)碱性电解质(铂为两极、电解液KOH溶液)正极:负极:总反应化学方程式:2CH3OH + 3O2 + 4KOH=== 2K2CO3 + 6H2O正极:3O2 + 12e-+ 6H2O=== 12OH-负极:2CH3OH – 12e-+ 16OH—=== 2CO32-+12H2O (2)酸性电解质(铂为两极、电解液H2SO4溶液)正极:负极:总反应式2CH3OH + 3O2 === 2CO2 + 4H2O正极:3O2 + 12e-+ 12H+ == 6H2O 负极:2CH3OH –12e-+2H2O==12H++2CO215、CO燃料电池(铂为两极、电解液H2SO4溶液)总反应方程式为:2CO +O2 =2CO2正极:负极:正极:O2 + 4e-+ 4H+ == 2H2O 负极:2CO – 4e-+ 2H2O== 2CO2 +4H+16、甲烷燃料电池(1)碱性电解质(铂为两极、电解液KOH溶液)正极:负极:总反应方程式:CH4 + 2KOH+ 2O2 === K2CO3 + 3H2O正极:2O2 + 4H2O + 8e-== 8OH- 负极:CH4 + 10OH—-8e-== CO32-+ 7H2O(2)酸性电解质(铂为两极、电解液H2SO4溶液)总反应方程式:CH4 + 2O2 === CO2 + 2H2O 正极:负极:正极:2O2 + 8e-+ 8H+ == 4H2O 负极:CH4-8e-+ 2H2O == 8H+ + CO217、肼(N2H4)燃料电池(电解质溶液是20%~30%的KOH溶液)总反应方程式:N2H4+ O2 === N2 +2H2O正极:负极:正极:O2 + 2H2O + 4e-== 4OH- 负极:N2H4+ 4OH—– 4e-=== N2 +2H2O18、H2、Cl2电池(铂为两极,一极为H2,另一极为Cl2,电解质溶液是20%~30%的KOH溶液)正极:负极:总反应方程式:正极:Cl2+ 2e-== 2 Cl-负极:H2+ 2OH—– 2e-===2H2O总反应方程式:Cl2+ H2+ 2OH—==2 Cl-+2H2O19、Ag、Cl2电池(负极—Ag 、正极—铂,通入Cl2,电解液: 1 mol·L-1盐酸)正极:负极:总反应方程式:2Ag+ Cl2==2 Ag Cl正极:Cl2+ 2e-== 2 Cl-负极:2Ag+2 Cl-– 2e ==2 Ag Cl20、H2、N2电池(铂为两极,一极为H2,另一极为N2,电解质溶液是盐酸、氯化铵溶液)正极:负极:总反应方程式:3H2 + N2 +2HCl==2 NH4Cl正极:N2 +8H++ 6e-== 2 NH4+ 负极:3H2– 6e ==6H+21、氢氧电池:一极为H2,另一极为空气与CO2的混合气,电解质为熔融K2CO3(盐)负极:正极:总反应方程式2H2 + O2 === 2H2O负极:2H2– 4e-+2CO32-=== 2CO2↑+2H2O 正极:O2 + 4e-+2CO2 === 2CO32—22、固体酸燃料电池(一极通入空气,另一极通入H2;电解质是CsHSO4固体传递H+)负极:正极:总反应方程式2H2 + O2 === 2H2O负极:2H2–4e-=== 4H+正极:O2 + 4H+ + 4e-=== 2H2O23、新型燃料电池(一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体)正极:负极:总反应方程式:2C4H10+13O2=8CO2+10H2O正极:13O2+ 52e-==26O2- 负极:2C4H10+26O2- – 52e-==8CO2+10H2O24、CO电池(一极为CO,另一极为空气与CO2的混合气,Li2CO3和Na2CO3的熔融盐作电解质)正极:负极:总反应方程式O2 +2CO==4CO2正极:O2 +4e-+2CO2 =2CO32-负极:2CO+2CO32-– 4e-==4CO225、Li-Al/FeS电池(一级是Li-Al合金,一极是粘有FeS的石墨,电解质是Li2CO3熔融盐)正极:负极:总反应方程式:2Li+FeS=Li2S+Fe正极:2Li++FeS+2e—=Li2S+Fe负极:2Li-2e-=2Li +[练习1] Al和Cu作电极所构成的原电池(1)电解质溶液为稀硫酸:Al作______极, Cu作______极.负极反应____________ 正极反应___________总反应式_____________________(2)电解质溶液为浓硝酸:Al作______极, ②Cu作______极.负极反应____________ 正极反应___________总反应式_____________________(3)电解质溶液为NaOH溶液:①Al作______极, ②Cu作______极,负极反应____________ 正极反应___________总反应式_____________________(4)电解质溶液为NaCl溶液:①Al作______极, ②作Cu ______极.负极反应____________ 正极反应___________总反应式_________________________(5)Al和Mg作电极所构成的原电池, 电解质溶液为NaOH溶液①Al作___极, ②Mg作___极,负极反应____________ 正极反应___________总反应式_________________________[练习2] 丙烷燃料电池(铂为两极、正极通入O2和CO2、负极通入丙烷、电解液有三种)1.电解质是熔融碳酸盐(K2CO3或Na2CO3)负极反应________________ 正极反应________________总电池反应式为2.酸性电解质(电解液H2SO4溶液)负极反应________________ 正极反应________________总电池反应式为3.碱性电解质(铂为两极、电解液KOH溶液)负极反应________________ 正极反应________________总电池反应式为[练习3]乙醇燃料电池(铂为两极、正极通入O2和CO2、负极通入丙烷、电解液有三种)1.酸性电解质(电解液H2SO4溶液)负极反应___________ 正极反应________总电池反应式为2.碱性电解质(铂为两极、电解液KOH溶液)负极反应________________ 正极反应________________总电池反应式为[练习5]铁碳电池(析氢腐蚀):(负极—Fe,正极—C,电解液——酸性)负极反应________________ 正极反应________________总电池反应式为[练习6]铝镍电池:(负极—Al,正极—Ni,电解液——NaCl溶液)负极反应________________ 正极反应________________总电池反应式为[练习7]普通锌锰干电池:(负极——Zn,正极——碳棒,电解液——NH4Cl糊状物)负极反应________________ 正极反应________________总电池反应式为[练习8]肼(N2H4)燃料电池(电解质溶液是硫酸)总反应方程式:N2H4+ O2 === N2 +2H2O 正极:负极:[练习9]H2、N2电池(铂为两极,一极为H2,另一极为N2,电解质溶液是KOH溶液)正极:负极:。
选修四 原电池电极反应书写练习
原电池一、基本原电池1、Fe / FeCl3溶液/ Pt2、Cu / FeCl3溶液/石墨负:负:正:正:总:总:3、 Fe /海水/石墨4、Al /海水/石墨负:负:正:正:总:总:5、Al /浓HNO3溶液/ Cu6、Mg / NaOH溶液/ Al负:负:正:正:总:总:二、重要一次性电池1.干电池 Zn /ZnCl2 NH4Cl/ MnO2总:Zn + 2MnO2+ 2NH4Cl = ZnCl2 + Mn2O3 + 2NH3+ H2O 负:。
正:。
2.锌锰碱性电池Zn / KOH溶液/ MnO2总:Zn + 2MnO2+ 2H2O = Zn(OH)2 + 2MnOOH负:。
正:。
3.纽扣电池 Zn / KOH溶液/ Ag2O 总:Zn + Ag2O = ZnO+ Ag负:。
正:。
4. Li /LiAlCl4 SOCl2/石墨总:4Li + 2SOCl2= 4LiCl+ S + SO2负:。
正:。
三、重要充电电池1.铅蓄电池 Pb / H2SO4溶液/ PbO2放电时的电池反应为:。
放电时:负极正极。
充电时:阴极阳极。
2.爱迪生电池 Fe/ KOH溶液/ Ni2O3放电时的电池反应为:Fe + Ni2O3 + 3H2O = Fe(OH)2 + 2Ni(OH)2放电时:负极正极。
充电时:阴极阳极。
3.镍氢电池 H2/ KOH溶液/ NiOOH放电时的电池反应为:2NiOOH + H2 = 2Ni(OH)2放电时:负极正极。
充电时:阴极阳极。
4.嵌入锂的碳材料 /固体电解质(主要传导Li+) / LiMn2O4放电时的电池反应为:Li + LiMn2O4= Li 2Mn 2O 4放电时:负极正极。
充电时:阴极阳极。
四、重要燃料电池1.氢氧燃料电池⑴. H2 / KOH溶液/ O2⑵、H2 / NaCl溶液/ O2负:负:正:正:⑶、H2 /固体电解质(主要传导O 2-) / O2⑷、H2 /固体电解质(主要传导H+) / O2负:负:正:正:2.甲烷燃料电池⑴.CH4 / H2SO4溶液/ O2总:。
选修4-----电极反应总结答案
电极反应总结一次电池1.碱性锌锰电池(负极—Zn、正极—C、电解液KOH 、MnO2的糊状物)负极:Zn + 2OH– 2e-== Zn(OH)2正极:2MnO2 + 2H2O + 2e-==2MnOOH +2 OH-2、银锌电池:(负极—Zn、正极--Ag2O、电解液NaOH )负极:Zn+2OH––2e-== Zn(OH)2正极:Ag2O + H2O + 2e-== 2Ag + 2 OH-二次电池3、铅蓄电池放电时:负极:Pb-2e-+SO42-= PbSO4充电时:阳极:PbSO4-2e-+2H2O = PbO2+4H+ +SO42-增重19.2g 增重12.8 g4、高铁电池:(负极—Zn、正极---石墨、电解质为浸湿固态碱性物质)放电时负极:3Zn -6e- + 6 OH–== 3 Zn(OH)2 减小充电时阴极:3Zn(OH)2 +6e-==3Zn + 6 OH–增大燃料电池5、氢氧燃料电池总反应都是:2H2+ O2=2H2O酸性电解质:负极:H2—2e-=2H+正极:O2+4e-+4H+=2 H2O碱性电解质:负极:H2—2e-+2OH-=2 H2O 正极:O2+4e-+2 H2O=4OH-熔融氧化物电解质负极:H2—2e-+ O2- = H2O 正极:O2+4e-= 2O2-6、甲烷燃料电池酸性电解质总:CH4+2 O2+= CO2+2H2O负极:CH4 -8e-+ 2H2O =CO2+8H+正极:2O2+8e-+8H+= 4H2O碱性电解质总:CH4+2 O2+2OH-= CO32-+3H2O负极:CH4 -8e-+ 10OH-=CO32-+7H2O 正极:2O2+8e-+4H2O= 8OH-7、甲醇燃料电池①酸性电解质电池总反应:2CH3OH + 3O2 == 2CO2 + 4H2O负极:2CH3OH + 2H2O ==2CO2 + 12H++ 12e-正极:3O2 + 12H++ 12e-==6H2O②碱性电解质电池总反应:2CH3 OH +3O2+4OH-= 2CO32-+6H2O负极:2CH3OH -12e-+ 16OH-=2CO32-+12H2O 正极:3O2 + 12e-+ 6H2O ===12OH-8、析氢腐蚀——水膜酸性较强:负极:Fe- 2e-==Fe2+ 正极:2H+ + 2e-== H2↑9、吸氧腐蚀——水膜酸性不强..负极:2Fe- 4e-==2Fe2+ 正极:O2 + 2H2O + 4e-== 4OH-电池总反应:2Fe + 2H2O + O2 == 2Fe(OH)24Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中常见的原电池电极反应式的书写练习一、一次电池1、伏打电池:(负极—Zn ,正极—Cu ,电解液—H 2SO 4)负极: 正极: 总反应离子方程式 Zn + 2H + == H 2↑+ Zn 2+2、铁碳电池(析氢腐蚀):(负极—Fe ,正极—C ,电解液——酸性)负极: 正极: 总反应离子方程式 Fe+2H +==H 2↑+Fe 2+3、铁碳电池(吸氧腐蚀):(负极—Fe ,正极—C ,电解液——中性或碱性)负极: 正极: 总反应化学方程式:2Fe+O 2+2H 2O==2Fe(OH)2; (铁锈的生成过程)4.铝镍电池:(负极—Al ,正极—Ni ,电解液——NaCl 溶液)负极: 正极: 总反应化学方程式: 4Al+3O 2+6H 2O==4Al(OH)3 (海洋灯标电池)5、普通锌锰干电池:(负极——Zn ,正极——碳棒,电解液——NH 4Cl 糊状物)负极: 正极: 总反应化学方程式:Zn+2NH 4Cl+2MnO 2=ZnCl 2+Mn 2O 3+2NH 3+H 2O6、碱性锌锰干电池:(负极——Zn ,正极——碳棒,电解液KOH 糊状物)负极: 正极: 总反应化学方程式:Zn +2MnO 2 +2H 2O == Zn(OH)2 + MnO(OH)7、银锌电池:(负极——Zn ,正极--Ag 2O ,电解液NaOH )负极: 正极 : 总反应化学方程式: Zn + Ag 2O == ZnO + 2Ag8、镁铝电池:(负极--Al ,正极--Mg ,电解液KOH )负极(Al): 正极(Mg ): 总反应化学方程式: 2Al + 2OH - + 2H 2O = 2AlO 2-+ 3H 2↑9、高铁电池 (负极--Zn ,正极--碳,电解液KOH 和K 2FeO 4)正极: 负极:总反应化学方程式:3Zn + 2K 2FeO 4 + 8H 2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH10、镁/H 2O 2酸性燃料电池 正极: 负极:总反应化学方程式:Mg+ H 2SO 4+H 2O 2=MgSO 4+2H 2O二、充电电池1、铅蓄电池:(负极—Pb 正极—PbO 2 电解液— 稀硫酸)负极: 正极: 总化学方程式 Pb +PbO 2 + 2H 2SO 4==2PbSO 4+2H 2O2、镍镉电池(负极--Cd 、正极—NiOOH 、电解液: KOH 溶液)放电时负极: 正极: 总化学方程式 Cd + 2NiOOH + 2H 2O===Cd(OH)2 + 2Ni(OH)2三、燃料电池1、氢氧燃料电池:总反应方程式: 2H 2 + O 2 === 2H 2O(1)电解质是KOH 溶液(碱性电解质)负极: 正极:(2)电解质是H 2SO 4溶液(酸性电解质)负极: 正极: 放电 充电(3)电解质是NaCl溶液(中性电解质)负极:正极:2、甲醇燃料电池(注:乙醇燃料电池与甲醇相似)(1)碱性电解质(铂为两极、电解液KOH溶液)正极:负极:总反应化学方程式:2CH3OH + 3O2 + 4KOH=== 2K2CO3 + 6H2O(2)酸性电解质(铂为两极、电解液H2SO4溶液)正极:负极:总反应式2CH3OH + 3O2 === 2CO2 + 4H2O3、CO燃料电池(铂为两极、电解液H2SO4溶液)正极:负极:总反应方程式为:2CO +O2 =2CO24、甲烷燃料电池(1)碱性电解质(铂为两极、电解液KOH溶液)正极:负极:总反应方程式:CH4 + 2KOH+ 2O2 === K2CO3 + 3H2O(2)酸性电解质(铂为两极、电解液H2SO4溶液)正极:负极:总反应方程式CH4 + 2O2 === CO2 + 2H2O5、肼(N2H4)燃料电池(电解质溶液是20%~30%的KOH溶液)正极:负极:总反应方程式:N2H4+ O2 === N2 +2H2O四、非水电池1、氢氧电池:一极为H2,另一极为空气与CO2的混合气,电解质为熔融K2CO3(盐)负极:正极:总反应方程式2H2 + O2 === 2H2O2、CO电池(一极为CO,另一极为空气与CO2的混合气,Li2CO3和Na2CO3的熔融盐作电解质)正极:负极:3、一次性锂电池:(负极--金属锂,正极--石墨,电解液:LiAlCl4-SOCl2)负极:正极:总反应化学方程式8Li+3SOCl2 === Li2SO3 +6LiCl +2S4、Li-Al/FeS电池(一级是Li-Al合金,一极是粘有FeS的石墨,电解质是Li2CO3熔融盐)正极:负极:总反应方程式:2Li+FeS=Li2S+Fe5、镁电池(一极是Mg,一极是粘有Mo3S4的石墨,电解质是MgSO4熔融盐)正极:负极:总反应方程式:x Mg+Mo3S4=Mg x Mo3S46、新型燃料电池(一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体)正极:负极:总反应方程式:2C4H10+13O2=8CO2+10H2O7、固体酸燃料电池(一极通入空气,另一极通入H2;电解质是CsHSO4固体传递H+)负极:正极:总反应方程式2H2 + O2 === 2H2O答案一、一次电池1、伏打电池:负极:Zn–2e-==Zn2+正极:2H++2e-==H2↑2、铁碳电池(析氢腐蚀):负极:Fe–2e-==Fe2+正极:2H++2e-==H2↑3、铁碳电池(吸氧腐蚀):负极:2Fe–4e-==2Fe2+正极:O2+2H2O+4e-==4-OH4Fe(OH)2+O2+2H2O==4Fe(OH)3 ;2Fe(OH)3==Fe2O3 +3 H2O4.铝镍电池:负极:4Al–12e-==4Al3+正极:3O2+6H2O+12e-==12-OH5、普通锌锰干电池:负极:Zn–2e-==Zn2+正极:2MnO2+2NH4++2e-==Mn2O3 +2NH3+H2O6、碱性锌锰干电池:负极:Zn + 2OH– 2e-== Zn(OH)2 正极:2MnO2 + 2H2O + 2e-==2MnO(OH) +2OH-7、银锌电池:负极:Zn+2OH-–2e-== ZnO+H2O 正极:Ag2O + H2O + 2e-== 2Ag + 2OH-8、镁铝电池:负极(Al):2Al + 8OH-+6e-=2AlO2-+4H2O 正极(Mg):6H2O + 6e-=3H2↑+6OH–9、高铁电池正极:2FeO42- + 8H2O +6e-==2Fe(OH)3 + 4OH–负极:3Zn + 6OH– 6e-== 3Zn(OH)210、镁/H2O2酸性燃料电池正极:2H++H2O2=2H2O 负极:Mg–2e-== Mg 2+二、二次电池(又叫蓄电池或充电电池)1、铅蓄电池:放电时:负极:Pb-2e-+SO42-==PbSO4正极:PbO2+2e-+4H++SO42-==PbSO4+2H2O 2、镍镉电池放电时负极:Cd-2e—+ 2 OH– == Cd(OH)2 正极:2NiOOH + 2e—+ 2H2O == 2Ni(OH)2+ 2OH–三、燃料电池1、氢氧燃料电池(1)电解质是KOH溶液(碱性电解质)负极:2H2– 4e-+ 4OH— === 4H2O 正极:O2 + 2H2O + 4e-=== 4OH—(2)电解质是H2SO4溶液(酸性电解质)负极:2H2–4e-=== 4H+正极:O2 + 4H+ + 4e-=== 2H2O(3)电解质是NaCl溶液(中性电解质)负极:2H2– 4e-=== 4H+正极:O2 + 2H2O + 4e-=== 4OH—2、甲醇燃料电池(1)碱性电解质正极:3O2 + 12e-+ 6H2O=== 12OH-负极:2CH3OH – 12e-+ 16OH—=== 2CO32-+12H2O (2)酸性电解质正极:3O2 + 12e-+ 12H+ == 6H2O 负极:2CH3OH –12e-+2H2O==12H++2CO23、CO燃料电池正极:O2 + 4e-+ 4H+ == 2H2O 负极:2CO – 4e-+ 2H2O== 2CO2 +4H+4、甲烷燃料电池(1)碱性电解质正极:2O2 + 4H2O + 8e-== 8OH—负极:CH4 + 10OH—-8e-== CO32-+ 7H2O(2)酸性电解质正极:2O2 + 8e-+ 8H+ == 4H2O 负极:CH4-8e-+ 2H2O == 8H+ + CO25、肼(N2H4)燃料电池正极:O2 + 2H2O + 4e-== 4OH—负极:N2H4+ 4OH—– 4e-=== N2 +2H2O四、非水体系电池1、氢氧燃料电池负极:2H2– 4e-+2CO32-=== 2CO2↑+2H2O 正极:O2 + 4e-+2CO2 === 2CO32—2、CO电池(一极为CO,另一极为空气与CO2的混合气,Li2CO3和Na2CO3的熔融盐作电解质)正极:O2 +4e-+2CO2 =2CO32-负极:2CO+2CO32-– 4e-==4CO23、一次性锂电池:负极:8Li -8e-=8 Li + 正极:3SOCl2+8e-=SO32-+2S+6Cl-4、Li-Al/FeS电池正极:2Li++FeS+2e—=Li2S+Fe负极:2Li-2e-=2Li +5、镁电池正极:x Mg2++Mo3S4+2x e-=== Mg x Mo3S4负极:x Mg-2x e-===x Mg2+6、新型燃料电池正极:13O2+ 52e-==26O2- 负极:2C4H10+26O2- – 52e-==8CO2+10H2O7、固体酸燃料电池负极:2H2–4e-=== 4H+正极:O2 + 4H+ + 4e-=== 2H2O。
