配位化合物(习题参考答案)
配位化学复习题及答案

配位化学复习题及答案配位化学是无机化学的一个重要分支,它研究金属离子与配体形成配位化合物的过程和性质。
以下是一些配位化学的复习题及答案,供参考:一、选择题1. 什么是配位化合物?A. 含有金属离子的化合物B. 含有配体的化合物C. 金属离子与配体通过配位键结合形成的化合物D. 只含有金属元素的化合物答案:C2. 配位化合物中的配位键是由什么构成的?A. 金属离子和非金属离子之间的离子键B. 金属离子和配体之间的共价键C. 金属离子提供的空轨道和配体提供的孤对电子D. 配体之间的共价键答案:C3. 下列哪个不是常见的配体?A. 水分子B. 氨分子C. 二氧化碳分子D. 硫氰酸根离子答案:C4. 配位数是指什么?A. 配体的数量B. 配位化合物中的金属离子数量C. 与中心金属离子直接相连的配体数量D. 配位化合物中的总原子数量答案:C5. 什么是内界和外界?A. 内界是配体,外界是金属离子B. 内界是金属离子,外界是配体C. 内界是配位化合物的中心,外界是配位化合物的外围D. 内界和外界都是配体答案:B二、填空题6. 配位化合物的化学式通常表示为[M(L)_n]^z+,其中M代表______,L代表______,n代表______,z代表______。
答案:中心金属离子;配体;配位数;电荷数7. 配位化合物的几何构型取决于配位数,例如,四面体、平面正方形、八面体等。
当配位数为4时,常见的几何构型是______。
答案:四面体8. 配位化合物的稳定性可以通过______来衡量,它与配体的电子供体能力有关。
答案:配位常数9. 配位化合物的光学活性是由于分子的______性造成的。
答案:手性10. 在配位化学中,硬酸和硬碱倾向于形成______,而软酸和软碱倾向于形成______。
答案:硬配位键;软配位键三、简答题11. 简述什么是配位化学中的“软硬酸碱理论”?答案:软硬酸碱理论是由R. P. Pearson提出的,它根据中心金属离子和配体的相对电负性差异,将它们分为硬酸、软酸、硬碱和软碱。
配位化学试题及答案

配位化学试题及答案一、选择题(每题2分,共10分)1. 配位化学中,配体与中心原子通过什么键结合?A. 离子键B. 共价键C. 配位键D. 氢键答案:C2. 以下哪个不是配位化合物的特点?A. 含有配位键B. 含有金属离子C. 含有非金属离子D. 含有配体答案:C3. 配位化学中,配位数指的是什么?A. 配体的数量B. 中心原子的电荷数C. 配体的电荷数D. 配体的价电子数答案:A4. 以下哪种配位化合物的几何构型是八面体?A. [Co(NH3)6]3+B. [Fe(CN)6]4-C. [Ni(CO)4]D. [PtCl6]2-答案:B5. 配位化学中,内球络合物与外球络合物的区别是什么?A. 配体的种类不同B. 配位键的数目不同C. 配位键的强度不同D. 配位键的类型不同答案:C二、填空题(每题2分,共10分)1. 在配位化学中,中心原子与配体之间的键被称为________。
答案:配位键2. 配位化合物的化学式中,通常用方括号表示________。
答案:配位离子3. 配位化学中,配体与中心原子之间的键角通常小于________。
答案:180度4. 配位化合物的命名中,配体的名称通常放在中心原子的名称________。
答案:之前5. 配位化学中,配体的配位能力与其________有关。
答案:电子密度三、简答题(每题5分,共10分)1. 简述配位化学中的配位键形成机制。
答案:配位键的形成机制是指配体向中心原子提供孤对电子,而中心原子提供空轨道,两者通过共享电子对形成配位键。
2. 描述一下配位化学中的几何异构现象。
答案:在配位化学中,几何异构是指具有相同化学式但不同空间排列的配位化合物。
例如,[Co(NH3)4Cl2]Cl·H2O可以存在两种不同的几何异构体:顺式和反式。
四、计算题(每题10分,共20分)1. 已知一个配位化合物的化学式为[Cu(NH3)4]SO4,计算其中心原子Cu的氧化态。
配位化合物(习题参考答案)
由(2)、(3)计算结果看出,AgCl 能溶于稀 NH3·H2O,而 AgBr 须用浓 NH3·H2O 溶解。 12.解: (1)[HgCl4]2− + 4 I−
K =
ψ
K fψ ([HgI 4 ] 2 − ) K fψ ([HgCl 4 ] )
= 5.78 ×10 14
K ψ 很大,故反应向右进行。
y = 0.49
可见 KCN 可溶解较多的 AgI。 10.解:设 1.0 L 1.0 mol·L−1 氨水可溶解 x mol AgBr,并设溶解达平衡时 c([Ag(NH3)2]+) = x mol·L−1(严格讲应略小于 x mol·L−1)c(Br− ) = x mol·L−1 AgBr(s) + 2NH3·H2O [Ag(NH3)2]+ + Br− + 2H2O 平衡浓度/(mol·L−1) 6.0 − 2 x x x
(2)[Cu(CN)2]− + 2NH3·H2O [Cu(NH3)2]+ + 2CN− + 2H2O
−
Kψ =
K fψ ([Cu(NH 3 ) 2 ] + ) K fψ ([Cu(CN) 2 ] )
= 7.24×10−14
(3)[Fe(NCS)2]+ + 6F−
[FeF6]3− + 2SCN−
+
Kψ =
PDF 文件使用 "pdfFactory" 试用版本创建
[CoF6]3-
[Ru(CN)6]4-
[Co(NCS)4]2―
6.解:已知:[MnBr4]2―μ=5.9 B.M,[Mn(CN)6]3―μ=2.8 B.M。 由: µ= n(n+2) 式求得:
无机答案第11章 配位化合物

第11章 配位化合物习 题1.给出下列中心金属离子的特征配位数:(a)Cu+;(b)Cu2+;(c)Co3+;(d)Zn2+;(e)Fe2+;(f)Fe3+。
2.按照摩尔导电率的大小将下列配合物排序:(a)K[Co(NH3)2(NO2)4];(b)[Cr(NH3)3(NO2)3];(c)[Cr(NH3)3(NO2)] 3 [Co(NO2)6]2;(d)Mg[Cr(NH3)(NO2)5]。
3.解释为什么EDTA钙盐可作为铅的解毒剂?为什么用EDTA的钙盐而不能用游离的EDTA?4.指出下列配离子中金属元素的氧化态:(1) [Cu(NH3)4]2+;(2) [Cu(CN)2]-;(3) [Cr(NH3)4(CO3)]+;(4) [Co(en)3]2+;(5) [CuCl4]2-;(6) Ni(CO)4.5.命名下列配合物:(1)K3[Co(NO3)6];(2)[Cr(Py)2(H2O)2Cl2];(3)[Cr(H2O)5Cl]Cl2•H2O;(4)K2[Ni(en)3];(5)[Co(NH3)4(NO2)Cl]Cl;(6)K3[Fe(C2O4)3]•3H2O;(7)K2[Cu(C2H2)3];(8)[Pt(Py)4][PtCl4].6.根据下列配合物的名称,写出其化学式:(1)亚硝酸•溴三氨合铂(Ⅱ);(2)一水合二氨•二乙二胺合铬(Ⅲ);(3)溴化硫酸根•五氨合钴(Ⅳ);(4)六氟合铂(Ⅳ)酸钾。
7.画出配离子[Cr(NH3)(OH)2Cl3]2-所有可能的几何异构体。
8.指出下列配合物中配位单元的空间构型并画出它们可能存在的几何异构体:(1)[Pt(NH3)2(NO2)Cl];(2)[Pt(Py)(NH3)ClBr];(3)[Co(NH3)2(OH)2Cl2];(4)K4[Co(NH3)2(NO2)4];(5)[Ni(NH3)3(OH)3];(6)[Ni(NH3)2Cl2].9.配离子[Cr(en)2Cl2]+存在几种几何异构体,哪种异构体可以表现出旋光活性,画出这些异构体。
第7章作业题解(配位化合物)

=4
3.2⇒ n=2 p3 正四面体 外轨型
[Mn(CN)6]4-
Mn2+:3d54s2 → 3d5
1.8 ⇒ n=1
d2sp3
正八面体
内轨型
[Co(NH3)6]3+
Co3+:3d74s2
0⇒
d2sp3
正八面体
内轨型
→ 3d64s0
n=0
5. (1) [Cd(NH3)4]2+,正四面体形
Cd2+: 4d105s2 → 4d10 应为sp3杂化,m=0(n=0)。
2 3 2] 3
Ksp, AgBr 2.89 1013 7.7 1013 22.25
x2 x K 22.25, 即 4.717 2 2.0 2 x (2.0 2 x) x 0.9mol dm 3
12.在100 cm3 K[Ag(CN)2]浓度为0.15 mol· -3的溶液中加入0.10 dm mol· 3KI溶液50 cm3,是否有AgI沉淀产生?若在上述混合溶 dm 液中加入0.20 mol· -3KCN溶液50 cm3,是否有AgI沉淀产生? dm 解:(1)已知:K稳,[Ag(CN)2]- = 1.26×1021, Ksp(AgI) = 1.5×10-16 c{[Ag(CN)2]-} = 0.15×100/(100+50) = 0.10 mol· -3 dm c(I-) = 0.10×50/(100+50) = 0.033 mol· -3 dm [Ag(CN)2]- ⇌ Ag+ + 2CN平衡浓度 / mol· -3 dm 0.10-x x 2x c{[ Ag(CN ) 2 ] } 0.10 x K稳 1.26 1021 c( Ag ) c 2 (CN ) x (2 x )2
结构化学 配位化合物的结构和性质习题及答案

一、填空题
1. 在氮分子与金属形成配位键M-N≡N时,N2的轨道上的一对电子提供给金属原子空轨道,形成键,另一方面又以轨道与金属d轨道形成键,因此在N2的络合物中由于键的形成,使N2活化了。
二、选择题
1. CO与过渡金属形成羰基配合物时,CO键会( C )
A. 不变
B.加强
C. 削弱
D.段裂
2. 配合物中心离子的d轨道在正方形场中,将分裂成几个能级【C 】
A. 2
B. 3
C. 4
D. 5
3. 物质颜色的产生是由于吸收了【D 】
A. 红外光
B. 微波
C. 紫外光
D. 可见光
4. Ni(3d84s2)与CO形成羰基配合物Ni(CO)n,式中n是【C 】
A. 6
B. 3
C. 4
D. 5
三、回答问题
1. 请分析蔡斯盐K [PtCl3(C2H4)]中乙烯与Pt2+之间的成键情况。
(蓝色),吸水后变为粉红色,试用配位场理论解释2. 硅胶干燥剂中常加入CoCl
2
其原因。
解:Co2+为d7构型,在无水CoCl2中,Co2+受配体Cl-的作用d轨道能级发生分裂,7个d电子按电子排布三原则填充在分裂后的轨道上,当电子发生d-d跃迁时,吸收波长为650~750nm的红光,因而显示蓝色。
但CoCl2吸水后变为[Co(H2O)6]Cl2,即由相对较强的配体H2O取代了相对较弱的配体Cl-,引起d轨道分裂能变大,使d电子发生d-d跃迁时吸收的能量增大,即吸收光的波长缩短(蓝移),[Co(H2O)6]Cl2吸收波长为490~500nm的蓝光,因而呈粉红色。
配位化学习题(答案参考)

配位化合物(01)1.历史上记录的第一种人工合成的配位化合物是( D )A.硫酸六氨合钴(II)B.普鲁士蓝C.硫酸四氨合铜(II)D.氯化二氨合银(I)2.配位化学的奠基人是( D)A.阿仑尼乌斯B.路易斯C.鲍林D.维尔纳3.下列说法中错误的是( C)A 配合物的形成体通常是过渡金属元素B 配键是稳定的化学键C 配键的强度可以和氢键相比较D 四面体配合物中,不存在顺反几何异构现象4.下列说法中正确的是(D )A 配位原子的孤电子对越多,其配位能力就越强B 电负性大的元素充当配位原子,其配位能力也强C CH3-C-OH配体是双齿配体D 在[Cu(en)2]2+中,Cu2+的配位数是412.下列说法中错误的是(D )A.对于Ni2+来说,当配位数为6时,无论是强场或弱场配体本位,只能采用SP3d2杂化B.对Ni2+来说,当本位数为4时,随配体的不同可采取dsp2或SP3杂化C.无论中心离子杂化轨道是d2sp2或SP3d2,其构型均为八面体形D.配合物中,由于存在配键,所以配合物都是弱电解质13.下列配体的本位能力的强弱次序为(B )->NH3>NCS->H2O>X-->NH3>NCS->H2O>X-C.X->H2O>CH->NH3>NCS-D.X->CN->H2O>NH3>NCS-14.在配位分子3KNO2.Co(NO3)2中,配位数为(D )A 3B 4C 5D 627.1 共价键和配位共价键的区别是什么?在NH4+离子中分别有多少个共价键和配位共价键?如何对其进行区分?解配位共价键是指一对电子由两个原子共享,且此电子是由其中的一个原子提供的;共价键是指一对共用电子对,一旦形成这两种键就没有区别。
在NH4+离子中有四个共价键,其中有一个是配位共价键。
27.4 求下列配位化合物的中心原子的配位数分别是多少?(a) [Mo(CN)8]4-中的钼(b)Cu(en)22+中的铜(en为乙二胺)解(a) 8 (b) 427.7 指出下列各金属中心离子的特征配为数:(a) CuⅠ(b) CuⅡ(c)AlⅢ(d) CoⅢ(e) ZnⅡ(f) FeⅡ(g) FeⅢ(h) AgⅠ。
配位化学试题及答案

配位化学试题及答案一、选择题(每题2分,共10分)1. 下列哪项不是配位化合物的特点?A. 含有中心原子或离子B. 含有配位键C. 含有离子键D. 含有配体答案:C2. 配位化合物的几何构型通常由什么决定?A. 配体的电荷B. 配体的数目C. 配体的电子排布D. 中心原子的氧化态答案:B3. 配位化学中,路易斯碱是指什么?A. 能够提供电子的分子或离子B. 能够接受电子的分子或离子C. 能够提供空轨道的分子或离子D. 能够接受空轨道的分子或离子答案:B4. 下列哪种配体是单齿配体?A. 乙二胺(en)B. 1,3-丙二胺(pn)C. 环己二胺(cn)D. 四齿配体答案:A5. 配位化合物的命名中,配体的名称通常放在什么位置?A. 中心原子的前面B. 中心原子的后面C. 配位化合物的前面D. 配位化合物的后面答案:A二、填空题(每题2分,共10分)1. 配位化学中,中心原子或离子与配体之间形成的化学键称为______。
答案:配位键2. 一个中心原子或离子最多可以与______个配体形成配位键。
答案:63. 配位化合物的配位数是指______。
答案:中心原子或离子周围配体的数量4. 配位化合物的命名中,配体的数目通常用希腊数字表示,其中“二”表示______。
答案:二5. 配位化合物的命名中,配体的电荷通常用罗马数字表示,其中“Ⅱ”表示______。
答案:+2三、简答题(每题5分,共20分)1. 简述什么是内界和外界,并举例说明。
答案:内界是指配位化合物中中心原子或离子与配体形成的配位单元,外界是指配位单元以外的部分。
例如,在[Co(NH3)6]Cl3中,[Co(NH3)6]是内界,Cl3是外界。
2. 什么是螯合配体?请举例说明。
答案:螯合配体是指能够通过多个配位点与中心原子或离子形成配位键的配体。
例如,乙二胺(en)可以与金属离子形成螯合配位化合物。
3. 配位化合物的稳定性与哪些因素有关?答案:配位化合物的稳定性与中心原子或离子的电荷、配体的类型、配位数以及配体与中心原子或离子之间的配位键强度等因素有关。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
30mL = 2.99 mol · L−1 100mL 50.0mL c (Ag+) = 0.100 mol · L−1 × = 0.0500 mol · L−1 100mL (1) Ag+ + 2NH3·H2O [Ag(NH3)2]+ + 2H2O 平衡浓度/(mol·L−1) x 2.99 − 0.100 +2 x 0.0500 − x
Kψ =
{c ( [Ag (NH
{ c (NH 3
3 )2 ]
}{ } × {c(Ag )} {c(Ag )} · H O) }
+
) c (I - )
2
+ +
2
= K fψ ( [Ag (NH 3 ) 2 ] + ) · K sp (AgI) = 9.54×10−10
ψ
PDF 文件使用 "pdfFactory" 试用版本创建
(2)[Cu(CN)2]− + 2NH3·H2Oቤተ መጻሕፍቲ ባይዱ[Cu(NH3)2]+ + 2CN− + 2H2O
−
Kψ =
K fψ ([Cu(NH 3 ) 2 ] + ) K fψ ([Cu(CN) 2 ] )
= 7.24×10−14
(3)[Fe(NCS)2]+ + 6F−
[FeF6]3− + 2SCN−
+
Kψ =
K fψ ([FeF6 ] 3− ) K fψ ([Fe (NCS) 2 ] )
= 8.91×10 10
K ψ 很大,故该反应向右进行。
*13.解: (1)[Ni(CN)4]2− + 2e− 对于电极反应:Ni2+ + 2e−
2+ ψ 2+ 2+ − ψ 2−
Ni + 4CN− Ni
E (Ni /Ni) = E (Ni /Ni) + (0.0592 V / 2) lg c( Ni 2 + ) / c ψ
则 c (Cu 2 + ) = cψ / K fψ ([Cu(NH3)4]2+) = 4.8×10−14 mol·L−1
E ψ ([Cu(NH3)4]2+/Cu) = E (Cu2+/Cu)
= E ψ (Cu2+/Cu) +
0.0592 V lg{c (Cu 2 + )} = −0.054 V 2
在 c (NH3·H2O) = 1.0 mol·L−1 的溶液中: NH3·H2O 平衡浓度/(mol·L−1) 1.0 − x
y = 0.49
可见 KCN 可溶解较多的 AgI。 10.解:设 1.0 L 1.0 mol·L−1 氨水可溶解 x mol AgBr,并设溶解达平衡时 c([Ag(NH3)2]+) = x mol·L−1(严格讲应略小于 x mol·L−1)c(Br− ) = x mol·L−1 AgBr(s) + 2NH3·H2O [Ag(NH3)2]+ + Br− + 2H2O 平衡浓度/(mol·L−1) 6.0 − 2 x x x
第 8 章 配位化合物(习题参考答案)
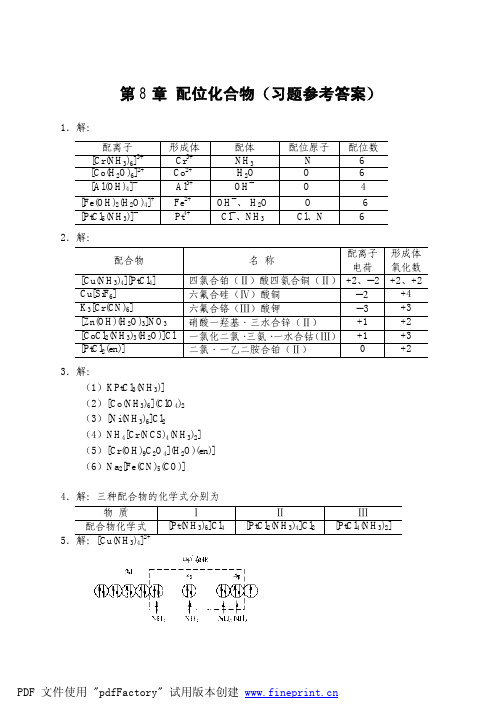
1.解: 配离子 [Cr(NH3)6]3+ [Co(H2O)6]2+ [Al(OH)4]― [Fe(OH)2(H2O)4]+ [PtCl5(NH3)]― 2.解: 配合物 [Cu(NH3)4][PtCl4] Cu[SiF6] K3[Cr(CN)6] [Zn(OH)(H2O)3]NO3 [CoCl2(NH3)3(H2O)]Cl [PtCl2(en)] 3.解: (1)KPtCl3(NH3)] (2)[Co(NH3)6](ClO4)2 (3)[Ni(NH3)6]Cl2 (4)NH4[Cr(NCS)4(NH3)2] (5)[Cr(OH)9C2O4](H2O)(en)] (6)Na2[Fe(CN)5(CO)] 4.解:三种配合物的化学式分别为 物 质 配合物化学式 5.解:[Cu(NH3)4]2+ Ⅰ [Pt(NH3)6]Cl4 Ⅱ [PtCl2(NH3)4]Cl2 Ⅲ [PtCl4(NH3)2] 配离子 电荷 四氯合铂(Ⅱ)酸四氨合铜(Ⅱ) +2、―2 六氟合硅(Ⅳ)酸铜 ―2 六氟合铬(Ⅲ)酸钾 ―3 +1 硝酸一羟基·三水合锌(Ⅱ) +1 一氯化二氯· 三氨· 一水合钴 (Ⅲ) 0 二氯·一乙二胺合铂(Ⅱ) 名 称 形成体 氧化数 +2、+2 +4 +3 +2 +3 +2 形成体 Cr3+ Co2+Al3+ Fe2+Pt4+配体 NH3 -H2O OH― OH―、-H2OCl―、NH3配位原子 N OOO -Cl、N 配位数 664 -6 6-
Ni + 4CN 则 因此 [Ni(CN)4]
{
}
c( Ni ) = c / K fψ ([Ni(CN)4]2−) = 5.03×1032 mol·L−1
2+
E ψ ([Ni(CN)4]2−/Ni)= E (Ni2+/Ni)
PDF 文件使用 "pdfFactory" 试用版本创建
3 2 3 + + 2
x
0.30 + 2 x
2
= 1.12×107
0.10 − x = 1.12×107 2 x(0.30 + 2 x) x = 9.9×10− 8 即 c(Ag+) = 9.9×10− 8mol·L−1 c([Ag(NH3)2]+) = (0.10 − x ) mol·L−1 ≈0.10 mol·L−1 c(NH3·H2O) = (0.30 + 2 x ) mol·L−1 ≈0.30 mol·L−1
ψ K sp ( AgCl)
c (Cl ) / c
−
ψ
c ψ =1.77×10−8 mol·L−1
0.0500 c ψ = 0.502 mol·L−1 −8 7 1.77 × 10 × 1.12 × 10
(3)c(Br−) = 0.120 g ÷ 119.00 g·mol−1 ÷ 0.1 L = 0.0101 mol·L−1
x2 = 9.54×10−10 2 (6.0 − 2 x)
同上方法: 平衡浓度/(mol · L−1)
x = 1.9×10−4 AgI(s) + 2CN− 1.0 − 2 y
[Ag(CN)2] − y
+
I− y
ψ K ψ = K fψ ( [Ag (CN) 2 ] − ) · K sp (AgI) = (1.26×1021) × (8.52×10−17) = 1.07×105
{c ([Cu (NH ) ] )} {c (Cu )} { c (NH ) }
3 4 2+
x
4
=
0.050 − x = 2.09×1013 4 x( 2.8 + 4 x )
0.050 =2.1×1013, x =3.9×10−17 4 x (2.8)
c([Cu(NH3)4]2+) ≈0.050 mol·L−1,c(NH3·H2O) ≈2.8 mol·L−1 若在此溶液中加入 0.010 mol NaOH(s),即:c(OH− ) = 0.50 mol·L−1
PDF 文件使用 "pdfFactory" 试用版本创建
起始浓度/(mol·L−1) 平衡浓度/(mol·L )
−1
Ag+ + 2NH3·H2O 0.50 − 2 × 0.10
[Ag(NH3)2]+ + 2H2O 0.10 0.10 − x
K fψ =
{c ( [Ag (NH ) ] )} {c (Ag )} { c (NH · H O ) }
ψ J = 5.40×10−12 > K sp (AgBr) = 5.35×10−13
故有 AgBr 沉淀形成。 欲阻止 AgBr 沉淀形成, c(NH3·H2O) ≥
0.0500 c ψ = 9.18 mol·L−1 −11 7 5.30 × 10 × 1.12 × 10
[HgI4]2− + 4Cl−
ψ K ψ = K fψ ( [Ag (NH 3 ) 2 ]+ ) · K sp (AgBr) = 5.99×10−6
x2 = 5.99×10−6 2 (1.0 − 2 x)
x = 2.4×10−3
故 1.0 L 1.0 mol·L−1 NH3·H2O 可溶解 1.9×10−4 mol AgBr。 则 100mL 1.0 mol·L−1 NH3·H2O 只能溶解 AgBr 的克数为 2.4×10−3 mol·L−1 × 0.10 L × 187.77 g·mol−1 = 0.045 g < 0.10 g 即 0.10 g AgBr 不能完全溶解于 100mL 1.00 mol·L−1 的氨水中。 11.解:c(NH3·H2O) = 9.98 mol·L−1
混合冲稀后:c(NH3·H2O) = 9.98 mol·L−1 ×
K fψ 较大,故可近似计算 K fψ =
0.0500mol · L−1 (2.89mol · L ) (x mol · L )
−1 2 −1
= 1.12×107,
x = 5.35×10−10
即 c (Ag+) = 5.35×10−10 mol·L−1 c([Ag(NH3)2]+) = 0.0500 mol·L−1, c(NH3·H2O) = 2.89 mol·L−1 (2)加入 0.0745 g KCl(s):c(Cl−) = 0.0100 mol·L−1
