《配位化合物》习题答案
中国药科大学《无机化学》第四章配位化合物习题及答案

中国药科大学《无机化学》第四章配位化合物习题及答案一、选择题1. 对于配合物中心体的配位数,说法不正确的是………………………………………()(A) 直接与中心体键合的配位体的数目(B) 直接与中心体键合的配位原子的数目(C) 中心体接受配位体的孤对电子的对数(D) 中心体与配位体所形成的配价键数2. [Ni(CN)4]2-是平面四方形构型,中心离子的杂化轨道类型和d电子数分别是……()(A) sp2,d7(B) sp3,d8(C) d2sp3,d6(D) dsp2,d8二、填空题3. 配合物[PtCl(NH3)5]Br和[Co(NO2)(NH3)5]2+ 存在的结构异构体的种类和结构简式分别为_______________________________ 和_______________________________________。
4. 已知铁的原子序数为26,则Fe2+在八面体场中的晶体场稳定化能(以△0 =10 Dq表示)在弱场中是_____________ Dq,在强场中是______________ Dq。
5. 对于八面体构型的配离子,若中心离子具有d7电子组态,则在弱场中,t2g轨道上有____个电子,e g轨道上有____个电子;在强场中,t2g轨道上有____个电子,e g轨道上有____个电子。
三、问答题6. 试举例说明π 配合物与π酸配合物的区别。
7. 画出[CoCl2(NH3)2(H2O)2]+配离子的几何异构体。
参考答案一、选择题1. (A)2. (D)二、填空题3. 电离异构体[PtBr(NH3)5]Cl键合异构体[Co(ONO)(NH3)5]2+4. -4 Dq;-24 Dq5. 5,2;6,1三、问答题6.π配合物:由配体提供π电子给中心体原子(离子)的空轨道,形成配位σ 键,例蔡斯盐[PtCl3(C2H4)]-。
Pt – C2H4间存在σ 键及反馈d -π*π键π酸配合物:由CO、NO等一类π酸配体(π受体)与金属原子或d电子较多的过渡金属原子、离子形成的配合物,一方面它们可以提供孤对电子与中心体形成配位σ 健,另一方面,它有空的π轨道可接受来自中心体原子上d轨道上积累的负电荷,配体本身是Lewis 碱,又是Lewis酸。
化学竞赛题库配位化合物答案

ONOOH , ONOOH
NO2 + OH
x=x=1 2 1 3
4x + (+1) ´ 7 + ( -2) ´ 3 = -1 3y + ( -1) ´ 3 + ( +1) ´ 4 = 0
β-PdCl2
Cl Pd Cl
Cl Pd Cl
Cl Pd Cl
Cl Pd Cl
2.该反应的分步反应方程式为 (1) PdCl2 + 2Cl PdCl42PdCl42- + CH2=CH2 [Pd(C2H4)Cl3] + Cl
-
[Pd(C2H4)Cl3] + H2O [Pd(C2H4)(H2O)Cl2] + Cl ………… 总反应方程式为 PdCl2 + C2H4 + H2O (2) Pd2+采取 dsp2 杂化 (3) C2H4 与 Pd2+之间存在 σ 配键与反馈 π 键 Pd + CH3C
-
O H
+ 2HCl
+ +
2
五、1.∵配合物(C)为单核、电中性分子,其分子量为 含 H 原子个数为:
462.85 ´ 0.0523 = 24 (个) 1.008
M Mn 54.69 = = 462.85 0.1187 0.1187
形成(C)的配体是由 2 分子(A)与 1 分子(B)失去 2 分子水后形成的:
CHO
H2N
H H H B C O (A)
H Na
+
H H
B C
O O
Na+ (B)
CH3 O H3C B B O O B CH3 (C) H3C O B
配位化学习题(答案参考)

配位化合物(01)1.历史上记录的第一种人工合成的配位化合物是( D )A.硫酸六氨合钴(II)B.普鲁士蓝C.硫酸四氨合铜(II)D.氯化二氨合银(I)2.配位化学的奠基人是( D)A.阿仑尼乌斯B.路易斯C.鲍林D.维尔纳3.下列说法中错误的是( C)A 配合物的形成体通常是过渡金属元素B 配键是稳定的化学键C 配键的强度可以和氢键相比较D 四面体配合物中,不存在顺反几何异构现象4.下列说法中正确的是(D )A 配位原子的孤电子对越多,其配位能力就越强B 电负性大的元素充当配位原子,其配位能力也强C CH3-C-OH配体是双齿配体D 在[Cu(en)2]2+中,Cu2+的配位数是412.下列说法中错误的是(D )A.对于Ni2+来说,当配位数为6时,无论是强场或弱场配体本位,只能采用SP3d2杂化B.对Ni2+来说,当本位数为4时,随配体的不同可采取dsp2或SP3杂化C.无论中心离子杂化轨道是d2sp2或SP3d2,其构型均为八面体形D.配合物中,由于存在配键,所以配合物都是弱电解质13.下列配体的本位能力的强弱次序为(B )->NH3>NCS->H2O>X-->NH3>NCS->H2O>X-C.X->H2O>CH->NH3>NCS-D.X->CN->H2O>NH3>NCS-14.在配位分子3KNO2.Co(NO3)2中,配位数为(D )A 3B 4C 5D 627.1 共价键和配位共价键的区别是什么?在NH4+离子中分别有多少个共价键和配位共价键?如何对其进行区分?解配位共价键是指一对电子由两个原子共享,且此电子是由其中的一个原子提供的;共价键是指一对共用电子对,一旦形成这两种键就没有区别。
在NH4+离子中有四个共价键,其中有一个是配位共价键。
27.4 求下列配位化合物的中心原子的配位数分别是多少?(a) [Mo(CN)8]4-中的钼(b)Cu(en)22+中的铜(en为乙二胺)解(a) 8 (b) 427.7 指出下列各金属中心离子的特征配为数:(a) CuⅠ(b) CuⅡ(c)AlⅢ(d) CoⅢ(e) ZnⅡ(f) FeⅡ(g) FeⅢ(h) AgⅠ。
配位化学试题及答案

配位化学试题及答案一、选择题(每题2分,共10分)1. 下列哪项不是配位化合物的特点?A. 含有中心原子或离子B. 含有配位键C. 含有离子键D. 含有配体答案:C2. 配位化合物的几何构型通常由什么决定?A. 配体的电荷B. 配体的数目C. 配体的电子排布D. 中心原子的氧化态答案:B3. 配位化学中,路易斯碱是指什么?A. 能够提供电子的分子或离子B. 能够接受电子的分子或离子C. 能够提供空轨道的分子或离子D. 能够接受空轨道的分子或离子答案:B4. 下列哪种配体是单齿配体?A. 乙二胺(en)B. 1,3-丙二胺(pn)C. 环己二胺(cn)D. 四齿配体答案:A5. 配位化合物的命名中,配体的名称通常放在什么位置?A. 中心原子的前面B. 中心原子的后面C. 配位化合物的前面D. 配位化合物的后面答案:A二、填空题(每题2分,共10分)1. 配位化学中,中心原子或离子与配体之间形成的化学键称为______。
答案:配位键2. 一个中心原子或离子最多可以与______个配体形成配位键。
答案:63. 配位化合物的配位数是指______。
答案:中心原子或离子周围配体的数量4. 配位化合物的命名中,配体的数目通常用希腊数字表示,其中“二”表示______。
答案:二5. 配位化合物的命名中,配体的电荷通常用罗马数字表示,其中“Ⅱ”表示______。
答案:+2三、简答题(每题5分,共20分)1. 简述什么是内界和外界,并举例说明。
答案:内界是指配位化合物中中心原子或离子与配体形成的配位单元,外界是指配位单元以外的部分。
例如,在[Co(NH3)6]Cl3中,[Co(NH3)6]是内界,Cl3是外界。
2. 什么是螯合配体?请举例说明。
答案:螯合配体是指能够通过多个配位点与中心原子或离子形成配位键的配体。
例如,乙二胺(en)可以与金属离子形成螯合配位化合物。
3. 配位化合物的稳定性与哪些因素有关?答案:配位化合物的稳定性与中心原子或离子的电荷、配体的类型、配位数以及配体与中心原子或离子之间的配位键强度等因素有关。
全国高中生化学竞赛试题3 配位化合物(答案)
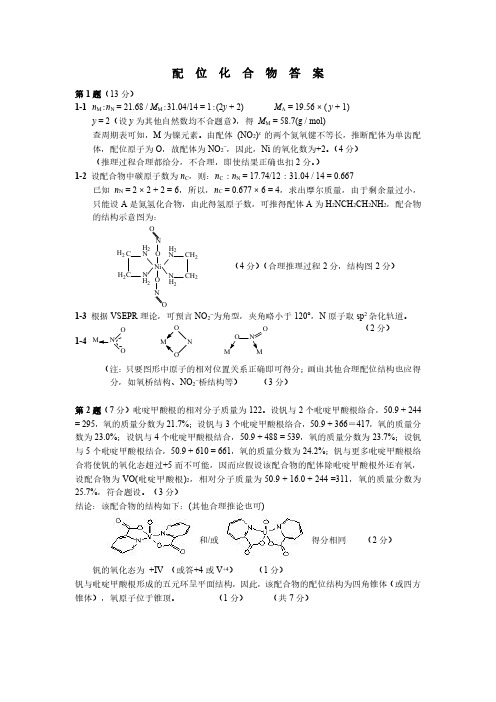
配位化合物答案第1题(13分)1-1n M :n N =21.68/M M :31.04/14=1:(2y +2)M A =19.56×(y +1)y =2(设y 为其他自然数均不合题意),得M M =58.7(g /mol)查周期表可知,M 为镍元素。
由配体(NO 2)x 的两个氮氧键不等长,推断配体为单齿配体,配位原子为O ,故配体为NO 2-,因此,Ni 的氧化数为+2。
(4分)(推理过程合理都给分,不合理,即使结果正确也扣2分。
)1-2设配合物中碳原子数为n C ,则:n C :n N =17.74/12:31.04/14=0.667已知n N =2×2+2=6,所以,n C =0.677×6=4,求出摩尔质量,由于剩余量过小,只能设A 是氮氢化合物,由此得氢原子数,可推得配体A 为H 2NCH 2CH 2NH 2,配合物的结构示意图为:N C CN NC C N H 2H 2H 2H 2H 2H 2H 2H 2Ni NNOO OO(4分)(合理推理过程2分,结构图2分)1-3根据VSEPR 理论,可预言NO 2-为角型,夹角略小于120°,N 原子取sp 2杂化轨道。
1-4O NONOOON O (2分)(注:只要图形中原子的相对位置关系正确即可得分;画出其他合理配位结构也应得分,如氧桥结构、NO 2-桥结构等)(3分)第2题(7分)吡啶甲酸根的相对分子质量为122。
设钒与2个吡啶甲酸根络合,50.9+244=295,氧的质量分数为21.7%;设钒与3个吡啶甲酸根络合,50.9+366=417,氧的质量分数为23.0%;设钒与4个吡啶甲酸根结合,50.9+488=539,氧的质量分数为23.7%;设钒与5个吡啶甲酸根结合,50.9+610=661,氧的质量分数为24.2%;钒与更多吡啶甲酸根络合将使钒的氧化态超过+5而不可能,因而应假设该配合物的配体除吡啶甲酸根外还有氧,设配合物为VO(吡啶甲酸根)2,相对分子质量为50.9+16.0+244=311,氧的质量分数为25.7%,符合题设。
无机化学习题-配位化合物答案

化,形成四配位平面四方配离子 5d8 的 8 个 d 电子全部配对, m = n(n + 2) B. M. = 0。
Pt(IV)应为 d2sp3 杂化,形成内轨型六配位八面体配离子。
该配合物实际化学式可能有:
65.39 y + 16 + 59.024 ´ (2 y -1)
81.39 y
= 0.516 解得 y ≈ 4
183.44 y - 102.048
∴(A)的化学式为 Zn4O(CH3COO)6
2.4ZnCO3 + 6CH3COOH
ZnO(CH3COO)6 + 4CO2 + 3H2O
3.Zn2+为 3d10,Zn2+周围有 4 个 O 原子,∴Zn2+离子采取 sp3 杂化
4.2948 + 14.476x = 3.024 + 15.12x, 0.644x = 1.2708, x = 2
∴Al 为+3 氧化态,Al3+采取 sp3 杂化。
H NEt3
NEt3 H
NEt3 H
Al
H
NEt3
H
Al
H
H
Et3N
NEt3 (非极性分子)
Al H
H
因它们都有对称面,所以都不存在对映体。
十六、1.H C
O
H + CH3OH C
O
(B) LiAlH4
(C) SiCl4
(D) (CH3)2NH (E)
6
N (E)为
H2C H3C N H3C
络合物(配位化合物)(习题及答案)
第九章络合物(配位化合物)一、选择题1.下列离子中属于低自旋的是(C)A.[C oF6]3-B.[FeF6]3-C.[Fe(CN)6]3-D.[MnCl4]2-(μ=5.88)2.下列分子或离子能做螯合剂的是(D)A.H2N—NH2B.CH3COO—C.HO—OH D.H2NCH2CH2NH23.中心原子以sp3杂化轨道形成络离子时,其空间构型为(D)A.直线型B平面四边形C.正八面体D.正四面体4.下列试剂中能溶解Zn(OH)2、AgBr、Cr(OH)3、Fe(OH)3四种沉淀的是(B)A. 氨水B.氰化钾溶液C 硝酸 D.盐酸5.已知Co(NH3)63++e=Co(NH3)62+的Eθ=0.10V , Eθ(Co3+/Co2+)=1.84V,以下叙述正确的是(C)A.K fθCo(NH3)62+]=K fθ[Co(NH3)63+]B. K fθ[Co(NH3)62+]>K fθ[Co(NH3)63+]C. K fθ[Co(NH3)62+]<K fθ[Co(NH3)63+]D.都不对6.[Ni(CN)4]2—为平面四方形构型,中心离子杂化轨道类型和d电子分别是(D)A.sp2,d7B.sp3,d8C.d2sp3,d6D.dsp2,d8二、填空题1.碳酸氯·硝基·四氨合铂(Ⅳ)的化学式为[Pt(NH3)4(NO2)Cl]CO3,配体是NH3、NO2、Cl,配位原子是N、Cl ,配位数是62.氨水装在铜制容器中,发生配位反应,生成了[Cu(NH3)4]2+,使容器溶解。
3.向Cu2++4NH3=[Cu(NH3)4]2+体系中加入NH3,平衡将向正方向移动,加入CN—, 平衡将向逆方向移动(填正、逆)4.实验测得[Fe(CN)6]3-络离子的磁矩为1.7B.M.,则中心离子Fe3+采用了__d2sp3____杂化形式,是_内_轨型络合物。
5.[Ag(S2O3)2]3-的K fθ=a,[ AgCl2]-的K fθ=b则[Ag(S2O3)2]3-+ 2Cl-= [ AgCl2]-+ 2 S2O32-的平衡常数为b/a。
无机及分析化学(习题含答案)-配位化合物
第九章 配位化合物与配位滴定法习题1.是非判断题1-1中心离子的未成对电子数越多,配合物的磁矩越大。
1-2配合物由内界和外界组成。
1-3配位数是中心离子(或原子)接受配位体的数目。
1-4配位化合物K 3[Fe(CN)5CO]的名称是五氰根·一氧化碳和铁(Ⅱ)酸钾。
1-5一般说来,内轨型配合物比外轨型配合物稳定。
1-6配合物中由于存在配位键,所以配合物都是弱电解质。
1-7同一种中心离子与有机配位体形成的配合物往往要比与无机配合体形成的配合物更稳定。
1-8配合物的配位体都是带负电荷的离子,可以抵消中心离子的正电荷。
1-9电负性大的元素充当配位原子,其配位能力强。
1-10在螯合物中没有离子键。
1-11配位物中心离子所提供杂化的轨道,其主量子数必须相同。
1-12配合物的几何构型取决于中心离子所采用的杂化类型。
1-13外轨型配离子磁矩大,内轨型配合物磁矩小。
1-14配离子的配位键越稳定,其稳定常数越大。
1-15氨水溶液不能装在铜制容器中,其原因是发生配位反应,生成[Cu(NH 3)4]2+,使铜溶解。
1-16在配离子[Cu(NH 3)4]2+解离平衡中,改变体系的酸度,不能使配离子平衡发生移动。
1-17已知[HgI 4]2-的4θβ=K 1,[HgCl 4]2-的4θβ=K 2,,则反应[HgCl 4]2-+4I -=[HgI 4]2-+4Cl -的平衡常数为K 1/K 2。
1-18 [Cu(NH 3)3]2+ 的积累稳定常数β3是反应[Cu(NH 3)2]2+ + NH 3⇔[Cu(NH 3)3]2+的平衡常数。
1-19已知θϕ[Fe 3+/Fe 2+]=0.77V ,电极反应[Fe(C 2O 4)3]3-+ e=[Fe(C 2O 4)2]2-+ C 2O 42-,在标准状态时,θϕ的计算式为:θθθθθϕϕc O C c c O C Fe c c O C Fe c Fe F /)(/])([/])([lg 0592.0)/e 2422242334223---+⋅++(= 。
第十一章配位化合物
第十一章 配位化合物 首 页 习题解析 本章练习 本章练习答案 章后习题答案 习题解析 [TOP]例7-1 固体CrCl 3·6H 2O 的化学式可能为〔Cr(H 2O)4Cl 2〕Cl·2H 2O 或〔Cr(H 2O)5Cl 〕Cl·H 2O 或〔Cr(H 2O)6〕Cl 3,今将溶解有0.200gCrCl 3·6H 2O 的溶液流过一酸性阳离子交换柱,在柱上进行离子交换反应: X n+(aq) + n (RSO 3H) (RSO 3)n X + n H +(aq)配合物正离子 阳离子交换树脂 交换后的交换树脂 交换下来的H+ 交换下来的H +用0.100mol·L -1NaOH 标准溶液滴定,计耗去22.50mL ,通过计算推断上述配合物的正确化学式〔已知Mr(CrCl 3·6H 2O)=266.5〕。
析 根据题中条件可知离子的物质的量与配合物的电荷数有确定的关系,因此只要确定离子的物质的量即可求出配离子的电荷,进而求出配合物的化学式。
解 0.200gCrCl 3•6H 2O 的物质的量为1mol 1000mmol mol266.5g 0.200g 1⨯⋅-=0.75mmol 滴定测得 n (H +)=22.50mL×0.100mol·L -1=2.25mmol由交换反应式知:1mol X n+可交换出n mol H +。
因0.75 mmol CrCl 3•6H 2O 交换出2.25 mmol 的H +,由此可得1 :n = 0.75 :2.25 n = 3即X n+为X 3+,所以配正离子只能是[Cr(H 2O)6]3+,配合物为[Cr(H 2O)6]Cl 3。
例7-2(1)根据价键理论,画出[Cd(NH 3)4]2+(μ=0μB )和[Co(NH 3)6]2+(μ=3.87μB )的中心原子与配体成键时的电子排布,并判断空间构型。
(完整版)配位化合物习题及解析
《配位化合物》作业参考解析1. 下列说法正确的是A. 配合物的内界和外界之间主要以共价键相结合B. 中心原子与配体之间形成配位键C. 配合物的中心原子都是阳离子D. 螯合物中不含有离子键【B】A、D:一般认为配合物的内界和外界之间主要以离子键相结合,因此螯合物中内界和外界之间是可以存在离子键的;C:中心原子可以是阳离子,也可以是中性原子,例如[Ni(CO)4];B:中心原子与配体化合时,中心原子提供杂化过的空轨道,配体提供孤对电子,而形成配位键。
2. 下列配合物命名不正确的是A. [Co(H2O)(NH3)3Cl2]Cl 氯化二氯·三氨·一水合钴(Ⅲ)B. [Cr(NH3)6][Co(CN)6] 六氰合钴(Ⅲ)酸六氨合铬(Ⅲ)C. K[Co(NO2)3Cl3] 三硝基·三氯合钴(Ⅲ)酸钾D. H2[PtCl6] 六氯合铂(Ⅳ)酸【C】根据配体命名顺序,先无机后有机,先阴离子后中性分子,同类配体根据配位原子在字母表中的先后顺序进行命名。
对于C中的配合物而言,NO2-以N原子为配位原子时,命名为硝基,带一个负电荷,氯离子也是阴离子,同类配体,根据配位原子在字母表中的先后顺序,Cl-离子在前,NO2-离子在后,因此该配合物应该命名为“三氯·三硝基合钴(Ⅲ)酸钾”。
3. 下列配离子具有正方形或者八面体形结构,其中CO32-最有可能作为双齿配体的是A. [Co(NH3)4(CO3)]+B. [Co(NH3)5(CO3)]+C. [Pt(en)(NH3)(CO3)]D. [Pt(en)2(NH3)(CO3)]2+【A】根据题意,配离子具有正方形结构时,配位数为4,形成四个配位键;具有八面体结构时,配位数为6,形成6个配位键。
B:[Co(NH3)5(CO3)]+ 配离子中,已有5个氨作为配体,氨是单齿配体,形成5个配位键,因此该配离子中,CO32-离子只能是单齿配体,这样就形成了6个配位键;C:[Pt(en)(NH3)(CO3)] 配合物中,乙二胺(en)为双齿配体,形成2个配位键,氨为单齿配体,形成1个配位键,因此CO32-离子只能是单齿配体,这样就形成了4个配位键;D:[Pt(en)2(NH3)(CO3)]2+ 配离子中,乙二胺(en)为双齿配体,2个en形成4个配位键,氨为单齿配体,形成1个配位键,因此CO32-离子只能是单齿配体,这样就形成了6个配位键;A:[Co(NH3)4(CO3)]+ 配离子中有4个氨为配体,形成4个配位键,因此CO32-离子必须是双齿配体,这样就形成了4个配位键,如果CO32-离子是单齿配体,那么配离子的配位数为5,这与题意不符。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分子总电荷数和常见配体、阴、阳离子电荷计算得到;(3)一般 2+表示带 2 个正电荷,-2
表示该离子为-2 价。
2. 答:如下表:
化合物名称
分子式
硫酸四氨合铜(II)
[Cu(NH3)4]SO4
氯化二氯·三氨·一水合钴(III)
[CoCl2(NH3)3 (H2O)]Cl
四氯合金(III)酸钾
K[AuCl4]
( ) ( ) K θ = c [Ag(CN )2 ]− ⋅ c2 (NH 3 ) = c [Ag(CN )2 ]− ⋅ c2 (NH 3 )⋅ c( Ag + ) ( ) ( ) ( ) ( ) c [Ag(NH 3 )2 ]+ ⋅ c2 CN − c(Ag + ) ⋅ c2 CN − ⋅ c [Ag(NH 3 )2 ]+
)=0.20-2(0.10-x)=2x,将数据代入总反应平衡常数表达式得:
( ) K θ
0.10 ⋅ 0.202 =
=
K
θ f
[Ag(CN )2 ]−
1.3 ×1021 =
( ) x ⋅ (2x)2
[ ] K
θ f
Ag(NH 3 ) 2 +
1.1×107
⇒ x = 2.0 ×10−6 (mol ⋅ L−1 )
上海海洋大学
基础化学
习题答案
熊振海
(6) 因为磁矩为 2.8,所以中心离子单电子数为 2。又因为中心离子 Ni2+价电子构型为 3d8, 所以中心离子价电子层没有空轨道,所以杂化类型为 sp3d2。因此,配合物为内轨型 , 空间构型应为正八面体。
* 此类题目的解题格式如第一小题下划线字体,需要熟练掌握如何根据磁矩判断中心离子单 电子数和价电子构型、进而判断价电子层的空 d 轨道数目,然后结合配位数(也就是孤电子 对数目)就可以判定杂化轨道类型,进而判断成键轨道类型和空间构型。
[ ] [ ] Q =
Ag +
r
Cl −
r
= 1.3×10−3 × 0.1000 = 1.3 ×10−4 1
>
K
θ sp
(AgCl
)
所以,有沉淀析出。
* 第三解法比觉简捷,供大家领会贯通。
10. 解:欲使溶液中不致析出 AgBr 沉淀,则:
Q(
AgBr)
≤
K
θ sp
( AgBr)
( ) [ Ag + ]r
1
= 0.050 ×
× 0.050
1.1×107 ×1.77 ×10−10
( ) = 1.1 mol ⋅ L−1
c(
NH
+ 4
)
=
c0
(
NH
3
)
−
c(NH
3
)
=
4.0
−
1.1
≈
2.9
(mol·L-1)
( ) pH
=
pK
θ a
+ lg c(NH 3 ) = 14 + lg 1.77 ×10−5
c(
NH
上海海洋大学
基础化学
习题答案
熊振海
《配位化合物》
对应习题:王仁国主编 《无机及分析化学》第 1 版 第十章
1. 答:如下表:
中心离子
配位体
配位原子
配位数 配离子电荷
[Cu(en)2]SO4
Cu2+
en
N
4
2+
Na3[Co(NO2)6]
Co3+
NO
− 2
N
6
3-
[Pt(NH3)2Cl2]
Pt2+
NH3、Cl-
N、Cl
4
0
[Ni(CO)4]
Ni
CO
C
4
0
K4[Fe(CN)6]
Fe2+
CN-
C
6
4-
[Cr(Br)2(H2O)4]Br
Cr3+
Br-、H2O
Br、O
6
1+
Na2[SiF6]
Si4+
F-
F
6
2-
K2[HgI4]
Hg2+
I-
I
4
2-
* (1)常见配位体的配位原子、配位数、电荷数应熟记;(2)中心离子、配离子电荷根据
=
[ Ag(NH 3 )2 ]+ 0.5[NH 3 ]3r
r
[ ] 1/3
⇒
[NH 3 ]r
=
⎛ ⎜
[ Ag(NH 3 )2 ]+ r
⎞ ⎟
⎜⎝
0.5K
θ f
([
Ag
(
NH
3
)
2
]+
)
⎟⎠
因此得,开始析出沉淀时:
[ ] [ ( ] ) ( ) Cl−
r
=
K
θ sp
AgCl
⋅
K
θ f
[ Ag(NH 3 )2 ]+
≤
K
θ sp
(
AgBr
)
[Br − ]r
=
5.35 ×10−13 0.020
=
0.050 − x
x(0.50 − 4(0.050 −
x))4
查表得:
K
θ f
([Zn(NH
3
)4
]2+
)
=
3.0
×109
,由于此稳定常数较大,反应平衡时
Zn2+浓度非
常小,所以 0.050-x≈0.050,代入数据并解方程得:
x = 2.1×10−9
所以:
c([Zn(NH 3 )4 ]2+ ) = 0.05 mol·L-1; c(Zn2+)=2.1×10-9 mol·L-1; c[NH3]=0.30mol·L-1;
即:溶液中有 AgCl 沉淀生成。
解 2:
开始析出沉淀前,溶液中的 Ag+浓度为:
[ ] [ ( ] ) Ag +
r
=
⎛ ⎜ ⎜⎝
[ 4K
Ag
θ f
[
(NH 3 )2 Ag ( NH
]+ 3)
2
r
]
+
1/3
⎞ ⎟ ⎟ ⎠
为了析出沉淀,应满足如下条件:
[ Ag + ]r [Cl − ]r
≥
K
θ sp
(
] Ag(NH 3 )2 + r Cl − r Ag + r
K
θ f
K
θ sp
[ ] 沉淀开始产生时, [ Ag(NH 3 )2 ]+ =0.050 mol·L-1,[Cl-]=0.050 mol·L-1,因此:
上海海洋大学
基础化学
习题答案
熊振海
[ ] [ ] [ ] NH3 r = K θ ⋅ Cl − r [ Ag(NH 3 )2 ]+ r
0.52 / 3
⋅
[ Ag(NH 3 )2 ]+
1/ 3 r
1/3
( ) 1.77 ×10−10 × 1.1×107 1/ 3
= 0.52/3 × 0.101/ 3
( ) = 1.3 ×10−7 mol ⋅ L−1
因此,开始析出沉淀时 KCl 的质量为:
m(KCl)=[Cl-]·Mr(KCl)=1.3×10-7×74.56=9.7×10-6(g)<7.46g
上海海洋大学
基础化学
习题答案
液中浓度较大的物质为未知变量,会得出很难求解的高次方程。
9. 解 1:总反应方程式为:
Ag
(
NH
3
)
+ 2
+ Cl −
=
AgCl
↓
+2NH 3
反应的平衡常数为:
[ ] K θ =
[NH 3 ]r2
=
[NH 3 ]r2 ⋅ Ag + r
[ ] [ ] [ ] [ ] [ ] Cl − r ⋅ [ Ag(NH 3 )2 ]+ r Cl − r ⋅ Ag + r ⋅ [ Ag(NH 3 )2 ]+ r
1
( ) =
K
θ sp
(AgClFra bibliotek)⋅
K
θ f
[ Ag(NH 3 )2 ]+
[ ] [ ( ] ) [ ] ( ) ⇒
Cl −
r
=
K
θ sp
AgCl
⋅
K
θ f
[ Ag(NH 3 )2 ]+
[ Ag(NH 3 )2 ]+ r
⋅
NH 3
2 r
又:
[ ] [ ] K
θ f
([
Ag ( NH
3
)
2
]+
)
=
[ Ag(NH 3 ) 2 ]+ r [NH 3 ]2r [ Ag + ]r
解 3: n(KCl) = m(KCl) = 7.46 = 0.100(mol)
Mr(KCl) 74.56
又由[ Ag(NH3 )2 ]+ 稳定常数表达式得:
[ ] ( ) Ag +
r
=3
K
θ f
0.10 [ Ag(NH 3 )2 ]+
⋅4
0.10 =3
1.1×107 × 4
= 1.3 ×10−3
因此:
( ) =
K
θ f
[Ag(CN )2 ]−
