蛋白灰度分析软件使用
鹿龙再生汤Ⅱ号方对化疗后骨髓抑制的作用机制

网络出版时间:2023-05-0916:29:18 网络出版地址:https://kns.cnki.net/kcms/detail/34.1086.R.20230508.1432.054.html鹿龙再生汤Ⅱ号方对化疗后骨髓抑制的作用机制崔伟伟1,2,彭 飞1,2,秦婷婷1,2,胡灿红1,2,郁兆婧1,3,方志军1,2,朱建华3,4(1.南京中医药大学附属中西医结合医院,2.江苏省中医药研究院,江苏南京 210028;3.南通良春国医堂,江苏南通 226001;4.南通大学附属医院,江苏南通 226001)收稿日期:2022-11-10,修回日期:2023-01-15基金项目:江苏省重点研发计划(社会发展)专项(NoBE2021753);江苏省中医药研究院自主科研项目重点项目(NoBM2018024 2019005)作者简介:崔伟伟(1982-),女,学士,副主任中药师,研究方向:中药药理学,E mail:cuiweiwei8855@sina.com;彭 飞(1982-),男,博士生,研究方向:中医药抗肿瘤,共同第一作者,E mail:pengfei_82@163.com;方志军(1965-),男,主任中医师,研究方向:中医药治疗肿瘤,通信作者,E mail:1248256089@qq.com;朱建华(1947-),女,主任中医师,研究方向:中医临床,通信作者,E mail:zjh47@126.comdoi:10.12360/CPB202112055文献标志码:A文章编号:1001-1978(2023)05-0986-08中国图书分类号:R 332;R289 5;R322 2;R329 25;R735 3摘要:目的 探讨鹿龙再生汤Ⅱ号方对荷瘤裸鼠骨髓抑制的干预作用机制。
方法 肠癌荷瘤裸鼠随机分为5组:对照组、化疗组、化疗加利可君片组,化疗加鹿龙再生汤Ⅱ号方高、低剂量组,连续灌胃给药10d。
d4-10,除对照组外,均腹腔注射氟尿嘧啶(5 Fu)25mg·kg-1。
蛋白灰度值计算

蛋白灰度值计算随着健身风潮的兴起,蛋白质在人体健康和运动中所起的作用日益受到人们的关注。
而如何衡量蛋白质的含量,就成为了许多健身爱好者和科研人员关注的重点。
其中一个重要的指标就是蛋白质的灰度值,本文将对蛋白质灰度值的计算方法进行详细介绍。
1. 什么是蛋白质灰度值?蛋白质灰度值是指蛋白质在图像中的灰度平均值。
它反映了蛋白质在照片上的亮度。
蛋白质分子越多,其灰度值越高。
2. 蛋白质灰度值如何计算?蛋白质灰度值的计算方法有多种,以下是其中两种常用的方法。
方法一:使用软件进行计算通过使用一些图像处理软件,如ImageJ,可以方便地计算出蛋白质的灰度值。
具体步骤如下:1) 打开ImageJ软件,在“File”菜单中选择“Open”选项,打开需要计算灰度值的图片。
2) 选择“Image”菜单中的“Adjust”选项,然后单击“Auto Threshold”选项,进行图片二值化。
3) 在“Analyze”菜单中选择“Measure”选项,测量图片的灰度值。
方法二:自行编程计算唯一的缺点是需要具备一定的计算机编程能力。
具体步骤如下:1) 图片处理提取需要计算灰度值的图片,并可进行自动二值化处理和噪声去除。
这可以通过Python等编程语言的图形处理库实现。
2) 灰度值计算使用图像处理库中的函数计算图片的灰度值。
根据计算出的灰度值的统计结果,可以得到蛋白质的灰度值。
3. 蛋白质灰度值的影响因素有哪些?蛋白质灰度值的影响因素有很多,以下是一些重要的影响因素。
1) 蛋白质浓度:蛋白质浓度越高,其灰度值越高。
2) 图片亮度、对比度:在图片中,蛋白质的灰度值受图片亮度和对比度的影响,需要进行调整。
3) 照片质量:如果照片质量差,如不均匀的光线、模糊等,可能会对蛋白质灰度值的计算造成质量影响。
4. 为什么需要计算蛋白质灰度值?蛋白质的含量是检测某些生物学过程如老化、肿瘤、疾病等非常重要的指标。
通过计算蛋白质的灰度值,不仅可以了解蛋白质的含量,还可以通过照片上的灰度分布了解蛋白质的分布情况,对某些生物学过程更加了解。
Western blot(蛋白印迹法)详细步骤

Western blot(蛋白印迹法)详细步骤一、组织的研磨准备:研钵、研磨棒、EP管、药匙、液氮、液氮匙、自封袋、一次性手套、棉手套步骤:①用研磨棒将装有冻存组织的EP管敲碎,取出组织,在研钵中盛满液氮,用力敲碎组织,研磨。
②研磨过程中一旦液氮干了,立即加入液氮,保持研磨在液氮中进行,直至组织呈干粉状。
③用在液氮中浸泡过的药匙将研磨好的粉末盛入新的EP管中。
④装有组织粉末的EP管现在液氮中保存,待所有组织都研磨结束后装入自封袋,于-80℃保存。
注意:1.研钵使用前要用锡纸包口、研磨棒用锡纸包头,在烘箱中烘烤180℃至少3h 以上。
2.组织研磨成粉末后待液氮全部挥发后再将组织粉末装管。
3.每种样品都最好留有副管,备用。
二、裂解提蛋白准备:裂解液配制比例RIPA:PMSF=1000:10=100:1若需要加入蛋白酶抑制剂,则比例一般为1:1000(即1ml裂解液加1μl蛋白酶抑制剂)步骤:①将RIPA和PMSF按比例混匀,加入到装有组织粉末的EP管中,一般加入300~500μl左右(浓度尽量高点)。
②盖好盖子,在冰上裂解30~40min.③到时间后于4℃,12000rpm离心10min,取上清液转移到新的离心管中,于-20℃保存。
注意:1.裂解液加入后用手指弹一下混匀,当加入量很少时,成粘稠状,有必要时应用枪头混匀。
三、BCA法测定蛋白浓度(BCA试剂盒)准备:BCA试剂盒(BCA试剂A、BCA试剂B、蛋白标准液)、酶标板、酶标仪、摇床步骤:①按1:15或1:30稀释待测样品,即取1μl样品+14μl水。
③按50体积BCA试剂A加1体积BCA试剂B(50:1)根据样品数量配制BCA工作液。
④每个标准品孔加入200μl BCA工作液,样品孔加入待测样品10μl和200μlBCA工作液,充分混匀,在摇床上震荡30s,37℃放置30min,于492nm下测定OD值。
⑤标准曲线以蛋白含量(μg)为横坐标,吸光度为纵坐标,根据样品的吸光度可以在标准曲线上查得相应的蛋白含量。
如何用photoshop计算蛋白条带的灰度值

如何用photoshop计算蛋白条带的灰度值?
在western blot或者DNA电泳条带中,经常需要半定量统计条带的灰度值,比较常用的是用ImageJ这个软件来统计,但是如果不熟悉操作很容易得出错误的统计数据。
本文从原理到操作告诉你如何用photoshop来统计灰度值首先进行实际操作之前我们先来理解下什么叫做灰度值
如上图所示,灰度值就是从黑到白渐变过程中对应的数值。
0代表黑色,255代表白色。
上图所示正常western blot条带和反向之后的条带。
上图的箭头分别指出了条带以及背景对应的区域。
在正常条带中条带的值约为20,背景值为80;在反向图片中,条带的值约为200,背景值为130。
我们习惯了条带越粗亮灰度值越大,因此我们一般是对其进行反向之后测量。
在这里一定要去掉背景,至于为什么要去掉背景,在此不多说了(视频教程里将详细介绍)请看下面图片:那么接下来开始我们今天的教程:打开图片,因为图片有点倾斜,我们需要将其摆正,有两种方法进行拉直,第一种是将图层旋转(Ctrl+T,然后旋转至其摆正),另外一种是使用标尺工具,在左边快捷栏中安卓吸管工具不放,选择标识工具,然后在条带上面从左边点按住鼠标不放一直拖动到最右边,最后点击拉直图层即可。
点击菜单栏的“窗口”,选
择直方图,弹出下面面板。
(整理)实验步骤-westernbloting实验流程-5临床医.

Western blotting实验流程实验流程共分为6步:1 待测蛋白的准备;2 蛋白电泳;3 转膜;4 抗体结合;5 曝光;6 灰度值统计分析。
一、待测蛋白的准备1.细胞蛋白的提取:(1)拿出六孔培养板,去培养液,PBS洗细胞两遍,根据细胞密度每孔加50~100µl细胞裂解液(含1%的蛋白酶抑制剂PMSF,现用现配),冰上放置10分钟裂解。
(2)将培养板置于冰上,用细胞刮挂下细胞,每孔刮一分钟左右(刮不同孔细胞需用PBS 或水冲洗细胞刮,洗后甩干),收集裂解液于1.5ml EP管中,置于冰上裂解20分钟,期间需用振荡器振荡混匀3次,每次15秒左右(3)12000rpm,4℃冷冻离心5min左右,收集上清置于新EP管,存于-80℃。
2. BCA法蛋白溶液浓度测定(具体步骤按试剂盒说明书)(1)配制BCA工作液:打开37℃恒温箱预热加温,取出BCA标准品与蛋白样品解冻,配BCA工作液,A:B=50:1,A液总量=(8个标准蛋白+待测蛋白数量)*200µl,B液总量=(8个标准蛋白+待测蛋白数量)*4µl,配好后混匀。
(2)配制BCA标准品与标准曲线:用PBS稀释好标准品,按说明书将标准品加入到96孔板中,再补加PBS到一样体积。
(3)配制蛋白样品:每孔加入5µl蛋白原液,补加PBS稀释(稀释可节省蛋白,记住稀释倍数,蛋白较多时也可不稀释直接加蛋白原液测;蛋白孔可做2~3个平行孔,测量时取平均值较准)(4)加入BCA工作液:每孔各加200µl已配好的工作液,盖上板盖混匀30秒,37℃孵育30min,放好蛋白样品。
(5)测蛋白浓度:打开酶标仪预热10分钟以上,孵育完后取出96孔板冷却到室温,用移液枪去除小气泡,用纸巾擦干96孔板板度水珠,调节酶标仪波长,放入打印纸,打开96孔板板盖,在570nm波长下读取数值,空白孔可设可不设。
(具体按酶标仪操作说明,可以测几次选取)(6)计算浓度:用EXCELL表格制作标准直线方程,计算待测蛋白浓度(若稀释测量的记住要乘以稀释倍数才是最终蛋白浓度),然后以每个条带最低浓度那组蛋白为标准计算各组蛋白上样体积与细胞裂解液RIPA的补加体积。
western blot试验操作指南

蛋白表达研究系列之——Western Blot试验操作指南目录目录 (1)一、总蛋白的提取 (2)1 试验类型和蛋白类型 (2)2 样品组织类型 (3)3 蛋白表达峰度判断 (4)4 总蛋白提取的基本步骤 (4)4.1细胞样品总蛋白的提取操作步骤 (5)4.2组织样品总蛋白的提取操作步骤 (5)二、总蛋白BCA定量 (6)三、SDS-PAGE凝胶电泳 (7)四、转膜 (8)五、信号增强剂处理膜 (9)六、封闭、一抗孵育、二抗孵育 (9)1 封闭 (9)2 一抗孵育 (9)3 二抗孵育 (13)七、曝光显色 (14)八、灰度分析 (15)九、抗体及相关溶液配制 (15)1 抗体 (17)2 相关溶液配制表 (17)蛋白检测相对于DNA/RNA的检测来讲要困难许多,Western Blot作为蛋白检测的经典方法短时间内仍然无法被取代。
Western Blot的原理并不复杂,网上有很多这方面的材料,这里不作过多的介绍。
虽然原理、操作并不复杂,但做好Western Blot、得到满意的图片并非易事。
其操作过程中涉及到:蛋白提取、电泳、转膜、杂交、显色、抗体的选择、试剂的选择、设备应用等诸多内容,其中每一个环节的差错对最后的试验结果都会产生不小的影响,最终导致试验失败。
很多同学都在抱怨自己的Western Blot没有信号、目的条带太弱、杂带太多、条带弯曲、泳道中有涂抹状背景等诸多问题,大部分情况都会最终把矛头指向抗体,认为这个抗体质量不好。
抗体质量肯定会对试验产生相当重要的影响,但绝不是全部。
你的操作方法可能是对的,但,是否合理、是否适合你的试验要求,你可能未必了解。
我们课题组Western Blot的任务量极重(每年ECL的用量都在5L以上),课题组里面的一些同学总是在不停的问我关于条件优化的问题,我不可能为每一个人找到问题的关键点,因此,写一份关于Western Blot的系统性材料非常有必要,希望你们可以针对自己的问题,自我分析、自我解决,这样也能锻炼你们独立解决问题的能力。
image j蛋白灰度分析步骤
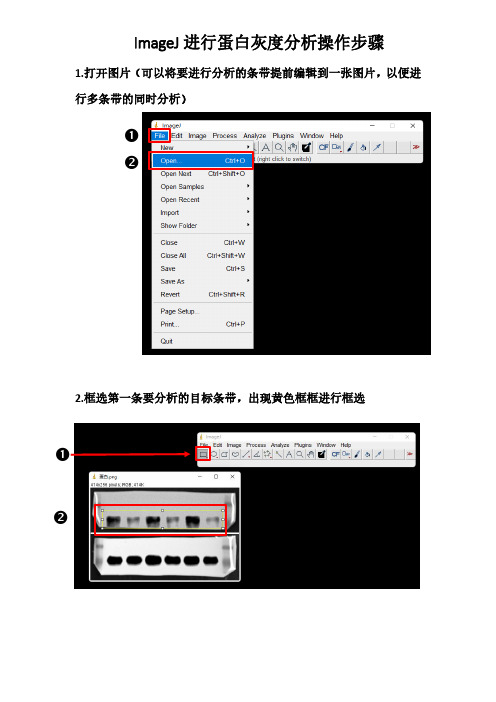
❷ ❷ 1.打开图片(可以将要进行分析的条带提前编辑到一张图片,以便进
行多条带的同时分析)
2.框选第一条要分析的目标条带,出现黄色框框进行框选
❶
❶
ImageJ 进行蛋白灰度分析操作步骤
3.将选出的条带设置为第一条要分析的条带
❶
❷
❸
4.框选下一条蛋白条带区域,操作位直接用鼠标左键移动第一条黄色框至下一条要分析的条带处
5.将框选的第二条条带设置为要进行分析的区域(如果有更多条带分析,则重复第二条带的操作步骤)
❶
❷
❸6.点击Plot Lanes,跳转至下一步
7.选择直线工具,画出各条带永道的封闭面积,然后使用魔术棒点击各条带灰度封闭取峰图,
得到result 框中定量灰度结果。
❶
❷
❸。
基于AMPK

收稿日期:2022-05-23基金项目:广西中医药大学研究生教育创新计划项目(YCSZ2019009;YCSZ2020009;YCXJ2021014);广西壮族自治区教育厅广西研究生教育创新计划资助项目(JGY2014086)作者简介:朱海滨(1997-),男,江西抚州人,硕士,主要从事抗炎免疫药理研究,(电话)137****6474(电子信箱)****************;通信作者,杨柯(1975-),男,广西柳州人,教授,主要从事抗炎与免疫研究,(电话)134****0102(电子信箱)************************。
朱海滨,曾春晖,唐木兰,等.基于AMPK/mTORC1自噬通路研究二氢杨梅树皮素对损伤A549细胞的保护作用[J ].湖北农业科学,2023,62(9):175-180.基于AMPK/mTORC1自噬通路研究二氢杨梅树皮素对损伤A549细胞的保护作用朱海滨,曾春晖,唐木兰,池鑫宇,邓浩健,李雨君,方静,徐浩亮,杨柯(广西中医药大学药学院/广西高校中药药理重点实验室,南宁530200)摘要:为研究二氢杨梅树皮素(APS )对脂多糖(LPS )诱导A549细胞损伤模型的保护作用及其对AMPK/mTORC1自噬通路的影响,随机分为正常组、模型组、APS 高中低浓度组(80、40、20μg/mL )。
除正常组外,其余各组用30μg/mL LPS 诱导8h 构建A549细胞损伤模型,APS 干预24h 后,MTT 法检测A549细胞存活率、荧光法检测上清液LDH 漏出量、Elisa 法检测上清液TNF-α含量、MDC 法细胞检测自噬体形成情况、自噬双标mRFP-GFP-LC3检测细胞自噬流情况,Western blot 法检测p-AMPK/AMPK 、p-mTOR/mTOR 以及自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ、P62蛋白表达水平。
AMPK 抑制剂(CC )干预验证试验,随机分为正常组、模型组、LPS+APS 组、LPS+CC 组、LPS+APS+CC 组,APS 与CC 共培养时间24h 后,采用Western blot 法检测p-AMPK/AMPK 、p-mTOR/mTOR 以及自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ、P62蛋白表达水平。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
精品课件
(3)Measure---count/size---measure---select measurements, 选择IOD 为测量值, 调整结果显示方式:Options-label style 改为mesurement,选择 IOD 为显示值。
精品课件
(4)接下来有2 种方法选择目的蛋白区域(即找出 AOI,area of interest, IPP 核心元件):魔棒和 手绘轨迹法。
精品课件
(2) Quantity One :有泳道-轨迹测定 法,等高线/手绘选取目的区域测定法等 方法
• ⅰ.泳道-轨迹测定法:先剔除一系列背景,再选择泳道(lane), 然后分析条带(band),最后使用高斯建模得出灰度分析值 (Gauss Model trace)特点:感觉比较科学,重复性好,但十 分繁琐,而且有时不能正确反应灰度。
精品课件
Thank you
精品课件
蛋白灰度分析
精品课件
蛋白灰度分析软件
•蛋白灰度分析软件有:Image-Pro Plus,Quantity One,Image J 等~~ (1)Image-Pro Plus 综合性能最好,操作简便结果可靠!因为它 有强大的IOD 算法,能准确反应蛋白灰度~~但需要靠魔棒或轨迹法 选取目的蛋白区域,有一定的主观性,不过蛋白灰度测定本身就是 半定量分析-----测量值本身就没有一定标准,不同软件测量值不 同,即使相同软件重复测量数值也不一定相同,因此只要测定数值 能反应目的蛋白变化趋势,测量值相对偏差不大即可~~~
精品课件
(5)count/size---edit-----convert AOI to object---得出IOD 值
精品课件
(6)若测下一条带,则点NEW AOI 按钮,再按以上方法选 择AOI (7)可以count/size---view---measurement data 显示或 输出测量值
• ⅱ.等高线-手绘选取目的区域测定法:通过等高线或手绘选取目 的蛋白区域,最简便,但重复性不太好。
精品课件
(3)Image J 最坑爹,它用魔棒选取区 域测定灰度,可是有时很难选中所需区域, 而且方法繁琐,不推荐!!
精品课件
Image-Pro Plus 分析蛋白灰度教程
• 说明:目的蛋白的灰度=目的蛋白IOD 值/ 相应内参IOD 值 • 1. 使用Photoshop 剪切出目的区域(只含western bolt 条带,
如 Image-Pro Plus 打开文件,剔除背景:
(1) 放大镜放大目的区域
精品课件
(2) Measure---calibration---intensity--options----image,选择背景最大value 值-----ok-------ok----system----close
