大鼠灌注取脑培训资料
大鼠灌注取脑之欧阳音创编

大鼠灌注取脑用途:1.用于常规HE染色,免疫组化分析。
2.冰冻切片可以不做脑组织固定。
3.不可用于western blot和PCR。
4.如果观察脑组织的缺血、损伤或其它病变时,不作灌注固定,而是在取出脑组织后作固定,将大大影响效果。
原理:心脏灌流术能够快速冲净血液并在动物死亡前进行组织的前固定,避免了组织的自溶现象,是脑组织切片观察的常用方法。
多聚甲醛使组织蛋白发生交联,以保持蛋白的原位和表面结构不变,从而能使其对应的抗体准确检测其表达位置和量。
必要性:1.脑组织较软,且细胞成分不易保留,脑组织是较易软化的组织之一,血供也较为丰富,所以最好是在取脑组织前用4%多聚甲醛灌注固。
2.经前固定后,取脑操作时,可减少脑组织损伤。
3.脑内血液都在,HE染色后,可去除红细胞背景影响。
大鼠灌注取脑标准操作规程(SOP):流程:1)麻醉2)开胸3)心脏左心室穿针,剪开右心耳4)生理盐水冲水5)4%多基甲醛固定6)取脑7)保存或切片.具体过程:大鼠经深度麻醉后,固定于自制的手术木板上,置于解剖盘中,开胸暴露并游离出心脏,经左心室插入灌流针并固定, 切开右心耳,先灌注冰冻无菌生理盐水(4℃)XmL,直到肝和肺脏颜色转白及右心房流出液澄清,后再灌注冰冻(4℃)4%多聚甲醛XmL,断头取脑,多聚甲醛浸泡固定24小时。
Tips:1.多聚甲醛的配置:一般方法为:4%多聚甲醛PBS缓冲液配法:称取40g PFA溶于装有500mlDEPC水的玻璃容器(烧杯或烧瓶)中,持续加热磁力搅拌至60~65℃,使成乳白色悬液。
用1.0mol/L的NaOH值至7.4,使呈清亮状(滴加),再加入约500ml PBS,充分混匀(在冰浴或冷水浴中),可再检测一下pH,过滤后定容至1000ml,室温或4℃保存备用。
简便方法:先配好PBS,称好相应的多聚甲醛,37℃水浴或温箱密封放置2天,就能全溶。
若是很急,55℃水浴一天,期间不时震荡。
注意,4%的多聚甲醛需临用前配制,配制后需过滤去除小的杂质,避免心脏灌流时造成栓塞影响灌流效果。
大鼠灌注取脑培训资料

大鼠灌注取脑1.用于常规HE 染色,免疫组化分析。
2.冰冻切片可以不做脑组织固定。
3.不可用于western blot 和PCR 。
4.如果观察脑组织的缺血、损伤或者其它病变时,不作灌注固定,而是在取出脑组织后作固定,将大大影响效果。
心脏灌流术能够快速冲净血液并在动物死亡前进行组织的前固定,避免了组织的自溶现象,是脑组织切片观察的常用方法。
多聚甲醛使组织蛋白发生交联,以保持蛋白的原位和表面结构不变,从而能使其对应的抗体准确检测其表达位置和量。
1.脑组织较软,且细胞成份不易保留,脑组织是较易软化的组织之一,血供也较为丰富,所以最好是在取脑组织前用4%多聚甲醛灌注固。
2.经前固定后,取脑操作时,可减少脑组织损伤。
3.脑内血液都在,HE 染色后,可去除红细胞背景影响。
1) 麻醉2)开胸3)心脏左心室穿针,剪开右心耳4)生理盐水冲水5)4%多基甲醛固定6)取脑7)保存或者切片.大鼠经深度麻醉后,固定于自制的手术木板上,置于解剖盘中,开胸暴露并游离出心脏,经左心室插入灌流针并固定, 切开右心耳,先灌注冰冻无菌生理盐水(4℃)XmL,直到肝和肺脏颜色转白及右心房流出液澄清,后再灌注冰冻(4℃)4% 多聚甲醛XmL,断头取脑,多聚甲醛浸泡固定24 小时。
1.多聚甲醛的配置:普通方法为:4%多聚甲醛PBS 缓冲液配法:称取40g PFA 溶于装有500mlDEPC 水的玻璃容器(烧杯或者烧瓶)中,持续加热磁力搅拌至60 ~ 65℃,使成乳白色悬液。
用1.0mol/L 的NaOH 值至7.4,使呈清澈状(滴加),再加入约500ml PBS,充分混匀(在冰浴或者冷水浴中),可再检测一下pH,过滤后定容至1000ml,室温或者4℃保存备用。
简便方法:先配好PBS ,称好相应的多聚甲醛,37℃水浴或者温箱密封放置2 天,就能全溶。
若是很急,55℃水浴一天,期间不时震荡。
注意,4%的多聚甲醛需临用前配制,配制后需过滤去除小的杂质,避免心脏灌流时造成栓塞影响灌流效果。
大鼠灌注固定实验报告

一、实验目的1. 掌握大鼠灌注固定技术操作步骤。
2. 观察灌注固定后大鼠组织器官的结构变化。
3. 分析灌注固定过程中可能出现的问题及解决方法。
二、实验材料1. 实验动物:健康成年大鼠,体重200-250g。
2. 实验仪器:手术器械、手术显微镜、注射器、输液器、灌注针、剪刀、血管钳等。
3. 实验试剂:4%多聚甲醛固定液、生理盐水、注射用无菌注射用水等。
三、实验方法1. 动物处死:采用过量麻醉剂使大鼠处死,确保动物在处死过程中无痛苦。
2. 灌注固定:按照以下步骤进行大鼠灌注固定:(1)准备灌注液:将4%多聚甲醛固定液加入500ml输液用玻璃瓶中,加入适量生理盐水,搅拌均匀。
(2)解剖:在手术显微镜下解剖大鼠,暴露心脏。
(3)穿刺心脏:用灌注针从心脏穿刺,插入主动脉。
(4)灌注固定:将注射器连接到灌注针,缓慢注入固定液,直至大鼠肝脏逐渐变为白色。
(5)继续灌注:待肝脏变白后,继续灌注固定液,直至大鼠全身变白。
(6)终止灌注:观察大鼠四肢抽动,表明灌注液进入大脑,待抽动完全停止,全身组织器官固定良好。
3. 取材:将固定好的大鼠组织器官取出,放入4%多聚甲醛固定液中浸泡。
四、实验结果1. 灌注固定后,大鼠组织器官结构清晰,细胞形态良好。
2. 部分大鼠在灌注固定过程中出现心脏破裂,导致灌注失败。
3. 部分大鼠在灌注固定过程中出现血压下降,需及时调整灌注速度。
五、实验讨论1. 灌注固定是研究组织器官形态结构的重要技术手段,操作过程中需严格按照步骤进行,确保固定效果。
2. 动物处死时,应避免过度麻醉,以免影响固定效果。
3. 灌注固定过程中,要注意观察动物的生命体征,及时发现并解决可能出现的问题。
4. 灌注固定液的选择应根据实验需求进行,如需观察细胞形态,可选择4%多聚甲醛固定液。
5. 实验过程中,要注意无菌操作,避免污染。
六、实验结论本次实验成功完成了大鼠灌注固定,取得了良好的固定效果。
通过观察灌注固定后大鼠组织器官的结构变化,为后续实验研究提供了良好的基础。
大鼠灌注固定取脑

大鼠灌注固定取脑大鼠灌注固定取脑准备物品:37℃的温生理盐水500ml、10%的中性甲醛或4%的多聚甲醛固定液500 ml、500 ml的输液瓶2个、输液管2副、三通1个,镊子、剪刀、止血钳各2把、灌注针(将12号注射用针头的针尖掐断磨钝圆、光滑即可)1个、麻醉剂、步骤1)将两个输液瓶中分别装满生理盐水和固定液并将输液管安装在生理盐水瓶上并调整好,使管内没有气泡。
2)将动物麻醉,数分钟后,待动物前后肢放松,即可准备灌注。
3)将已麻醉的动物仰卧在解剖台上,固定四肢,用左手持镊子夹起腹部皮肤,右手持剪刀自腹部剪一小口,由此沿腹中线和胸骨剑突中线向上将皮肤剪至下颌,分离皮下组织,将皮肤翻向两侧,再沿腹中线和胸骨中线向上剪开胸骨,沿膈肌向两侧剪开,并用止血钳将胸骨和胸部的皮肤钳紧,将止血钳翻向外侧以充分暴露心脏。
小心用镊子将心包打开,滴一些生理盐水保持湿润。
4)分离出主动脉,穿一根丝线,准备结扎灌针。
5)将左心室尖用眼科剪刀剪开一小口,将灌注针插入心室并送至主动脉内,用丝线结扎牢固,使之不能退出,打调节阀,灌注生理盐水,灌注时的灌流量约20 ml/分钟。
时,剪开右心耳,使血液排出。
观察肝脏逐渐变为白色为止6)旋转三通使之对准灌注液,开始灌注固定液。
固定液进大鼠血管后,逐渐出现四肢抽动,表明灌注液进入大鼠大脑,待抽动完全停止,全身组织器官变硬后即可取材。
7)取脑:枕骨大孔处用剪刀横断,小心地于枕骨大孔斜插入剪刀剪开顶骨,用止血钳掰断两边地顶骨,注意嗅球上地顶骨也要仔细去掉,用剪刀于一侧剪断视神经并探到颅底,就可以将整块的脑组织翘起。
取出的脑在同样固定液中4℃再固定4-6小时。
8)保存或切片注意事项:1、将灌注针插入主动脉内是灌注固定的关键,也是难点。
首先准确找到主动脉,这是此步骤的要点。
可用温生理盐水将胸腔内的血液冲洗干净,用眼科镊子轻轻夹住心外膜(夹的越少越好,以免影响取材)将心脏向左上方提起,即可看清主动脉,又可使灌注针很容易地插入主动脉内。
灌流取脑

大鼠灌注固定取脑准备物品:37℃的温生理盐水500ml、10%的中性甲醛或4%的多聚甲醛固定液500 ml、500 ml的输液瓶2个、输液管2副、三通1个,镊子、剪刀、止血钳各2把、灌注针(将12号注射用针头的针尖掐断磨钝圆、光滑即可)1个、麻醉剂、步骤1)将两个输液瓶中分别装满生理盐水和固定液并将输液管安装在生理盐水瓶上并调整好,使管内没有气泡。
2)将动物麻醉,数分钟后,待动物前后肢放松,即可准备灌注。
3)将已麻醉的动物仰卧在解剖台上,固定四肢,用左手持镊子夹起腹部皮肤,右手持剪刀自腹部剪一小口,由此沿腹中线和胸骨剑突中线向上将皮肤剪至下颌,分离皮下组织,将皮肤翻向两侧,再沿腹中线和胸骨中线向上剪开胸骨,沿膈肌向两侧剪开,并用止血钳将胸骨和胸部的皮肤钳紧,将止血钳翻向外侧以充分暴露心脏。
小心用镊子将心包打开,滴一些生理盐水保持湿润。
4)分离出主动脉,穿一根丝线,准备结扎灌针。
5)将左心室尖用眼科剪刀剪开一小口,将灌注针插入心室并送至主动脉内,用丝线结扎牢固,使之不能退出,打调节阀,灌注生理盐水,灌注时的灌流量约20 ml/分钟。
时,剪开右心耳,使血液排出。
观察肝脏逐渐变为白色为止6)旋转三通使之对准灌注液,开始灌注固定液。
固定液进大鼠血管后,逐渐出现四肢抽动,表明灌注液进入大鼠大脑,待抽动完全停止,全身组织器官变硬后即可取材。
7)取脑:枕骨大孔处用剪刀横断,小心地于枕骨大孔斜插入剪刀剪开顶骨,用止血钳掰断两边地顶骨,注意嗅球上地顶骨也要仔细去掉,用剪刀于一侧剪断视神经并探到颅底,就可以将整块的脑组织翘起。
取出的脑在同样固定液中4℃再固定4-6小时。
8)保存或切片注意事项: 1、将灌注针插入主动脉内是灌注固定的关键,也是难点。
首先准确找到主动脉,这是此步骤的要点。
可用温生理盐水将胸腔内的血液冲洗干净,用眼科镊子轻轻夹住心外膜(夹的越少越好,以免影响取材)将心脏向左上方提起,即可看清主动脉,又可使灌注针很容易地插入主动脉内。
大鼠线栓(MCAO)模型+灌注取脑+TTC染色
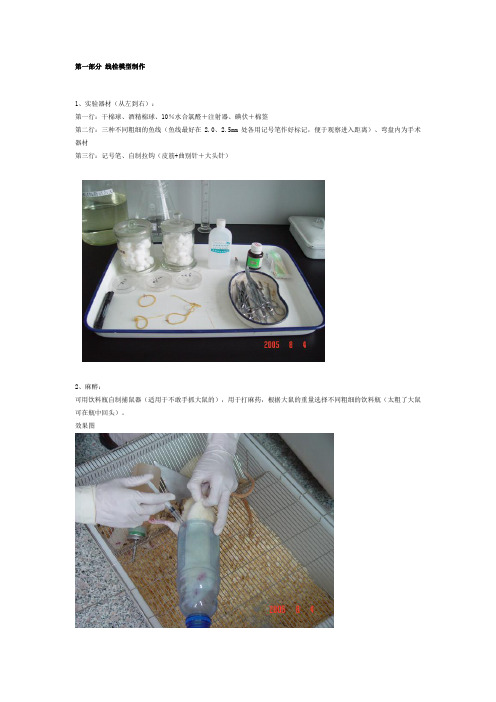
第一部分 线栓模型制作1、实验器材(从左到右):第一行:干棉球、酒精棉球、10%水合氯醛+注射器、碘伏+棉签第二行:三种不同粗细的鱼线(鱼线最好在2.0、2.5mm处各用记号笔作好标记,便于观察进入距离)、弯盘内为手术器材第三行:记号笔、自制拉钩(皮筋+曲别针+大头针)2、麻醉:可用饮料瓶自制捕鼠器(适用于不敢手抓大鼠的),用于打麻药,根据大鼠的重量选择不同粗细的饮料瓶(太粗了大鼠可在瓶中回头)。
效果图3、麻倒后绑在手术台上。
4、剪去颈前的鼠毛,碘伏消毒。
5、沿经部正中切开皮肤。
说明:切开皮肤前最好将结扎动脉的线事先剪好(后面会用到)。
6、钝性分离皮下组织。
如图:大鼠腹侧可见事先剪好的结扎线。
7、分离到气管前肌后,沿右侧胸锁乳突肌腱向下分离,见到颈动脉鞘后可上拉钩。
8、分离动脉鞘。
如图:分离好后见光滑的颈总动脉。
9、分离出颈总、颈外、颈内动脉,结扎颈总、颈外动脉,注意中间那根线不要系紧,用来插鱼线时防止出血的。
10、夹闭颈内动脉,用眼科剪将颈总动脉剪一小口。
11、插入鱼线,鱼线进入颈内动脉后按图中注释方法插(成功率在90%以上)。
说明:(1)这一步鱼线选择是关键,根据大鼠重量(作的多了后根据动脉粗细就可选择了)选鱼线。
我们的经验是:250g以下的选0.26mm的线,250-300g的选0.26mm蘸腊的或0.28的都可以。
(2)如果遇到鱼线怎么也查不进去的情况,可让大鼠休息一会,换细点的鱼线再试,这种情况不一定都是进到翼腭动脉了,我曾解剖过4例这种情况的大鼠,有三例都是在如颅的地方卡住了,可惜我们手里没有0.24mm的鱼线。
(3)通过实践,我们认为结扎或夹闭翼腭动脉没有必要,按我们的方法,熟练的话,从切开到缝合完毕也就是15分钟,算上准备工作(如麻醉、消毒等)半小时也可以搞定了,这样一上午两人作10只大鼠不成问题。
(4)我们体会最好用蘸腊的鱼线作模型,好处是进线深度控制的好,不容易出现蛛网膜下腔出血。
大鼠灌注固定取脑

优点:可用单人用注射器直接完成,不用输液管架,而且平均每只仅需5~10ml固定液,时间也仅为5~10min。
注意事项:1)开胸时不要伤到心脏 2)心脏穿刺最好用留置针,软,不宜穿通室间隔,见血即退针芯.插针部位是心尖部,方向向中线.3)生理盐水冲血管,到右心耳流出无色液体.4)多基甲醛固定成功的表现是SD鼠四肢抽搐.5)先断头再一步一步取脑6)根据你实验设计,需要切片的部位,有重点的取,常见的体表标志是前囟和外耳道.7)去颅骨后脑表面有一层硬脑膜,要去掉.
5 灌流:缓慢灌注PBS 10ml,见到老鼠两前肢及两肺变白可改灌注多聚甲醛,多聚甲醛的灌流也同PBS。
6 灌注成功的标志:刚开始灌注时老鼠剧烈抽动;成功后老鼠后肢绷直,尾部竖起成一直线;所灌注的脑组织白而硬。
7 取脑:分离除去后颈部肌肉 ,用弯镊小心取出脑组织。
8 后固定:灌流后的脑组织置于4%PFA置4度冰箱内进行后固定,时间>2h,过夜最好。
3.制作灌注装置,用两瓶塑料包装的生理盐水,一瓶底部开口,倒出盐水,倒置灌入多聚甲醛,悬挂,输液器链接,远端结一个三通后到一个输液器粗针头端
2. 经心脏行灌注固定:麻醉,剪开胸廓,见到搏动的心脏,心尖插入灌注针头,止血钳固定,剪开右心耳,开放静脉血,首先快速滴入生理盐水100-200ml,再注入4%多聚甲醛300-350ml固定液
大鼠灌注固定取脑科研实验
具体方法:
1. 配好4%多聚甲醛PBS缓冲液,配法:称取40g PFA溶于装有500ml DEPC水的玻璃容器(烧杯或烧瓶)中,持续加热磁力搅拌至60~65℃,使成乳白色悬液。用1.0mol/L的NaOH直至7.0,使呈清亮状(滴加),再加入约500ml PBS,充分混匀(在冰浴或冷水浴中),可再检测一下pH,过滤后定容至1000ml,室温或4℃保存备用。
灌注取脑

大鼠灌注取脑流程一、麻醉10%水合氯醛(0.4ml/100g)腹腔注射二、开胸1、沿两侧肋弓剪开皮肤,打开腹腔,用一血管钳夹持剑突并向上提拉。
2、用弯剪在膈肌与胸骨柄相连处剪一小口,造成人工气胸,然后向两侧顺延,剪断膈肌及肋骨,夹持剑突的血管钳将剑突连带胸廓上翻固定,充分暴露心脏。
三、穿刺将灌注针插入主动脉内是灌注固定的关键,也是难点。
1、首先准确找到主动脉,这是此步骤的要点。
可用温生理盐水将胸腔内的血液冲洗干净,用眼科镊子轻轻夹住心外膜(夹的越少越好,以免影响取材)将心脏向左上方提起(剪开心包壁层的前壁,暴露升主动脉和肺动脉干的根部)。
2、穿刺之前要用适当大小的血管钳夹住心室以固定心脏,但不要夹得过紧,要让心腔内留有一定的间隙。
用小剪刀在心尖处先剪开一个小口,再插入穿刺针。
3、插入时动作要慢,针尖方向不要偏向右侧,以免刺入右心房,如果感到有阻力,则将针退后、调整方向重新进针,直到进入主动脉,灌注针进入主动脉后可在心脏的上方看到其位置,灌注针进入主动脉的长度最好为3~5毫米,然后用丝线扎紧。
4、灌注针插入成功后,用小剪刀剪开右心耳。
四、灌注1、用量(夹闭腹主动脉)4℃生理盐水(50-100ml/只),4℃的4%多聚甲醛(50-100ml/只)2、速度先快后慢,共用30分钟左右3、成功标志生理盐水:右心耳流出液体血色较浅基本澄清,肺脏、眼珠、爪子迅速变白是排出血液的有效观察指标。
多聚甲醛:刚开始灌注时老鼠前肢剧烈抽动(下肢不抽动证明腹主动脉夹闭完全);前肢及颈部僵硬;所灌注的脑组织白而硬。
五、取脑1、枕骨大孔处用剪刀横断,小心地于枕骨大孔斜插入剪刀剪开顶骨。
2、用止血钳掰断两边地顶骨,注意嗅球上地顶骨也要仔细去掉。
3、用剪刀于一侧剪断视神经并探到颅底,就可以将整块的脑组织翘起。
六、保存取出的整个脑组织块再置于4%多聚甲醛4℃保存。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
简便方法:先配好PBS,称好相应的多聚甲醛,37C水浴或温箱密封放置2
天,就能全溶。若是很急,55E水浴一天,期间不时震荡。注意,4%的多聚甲 醛需临用前配制,配制后需过滤去除小的杂质,避ຫໍສະໝຸດ 心脏灌流时造成栓塞影响灌流 效果。
2.制作灌注装置,用两瓶塑料包装的输液瓶装灌注液。同时配好输液器备用。
大鼠灌注取脑
大鼠灌注取脑
用途:
1.用于常规HE染色,免疫组化分析。
2.冰冻切片可以不做脑组织固定。
3.不可用于western blot和PCR。
4.如果观察脑组织的缺血、损伤或其它病变时,不作灌注固定,而是在取出脑 组织后作固定,将大大影响效果。
原理:
心脏灌流术能够快速冲净血液并在动物死亡前进行组织的前固定,避免了组织的 自溶现象,是脑组织切片观察的常用方法。多聚甲醛使组织蛋白发生交联,以保 持蛋白的原位和表面结构不变,从而能使其对应的抗体准确检测其表达位置和 量。
2.暴露心脏这一步骤,容易损伤肺、心脏或者肝脏,“夹持剑突并向上提拉,用 弯剪在膈肌与胸骨柄相连处剪一小口,造成人工气胸”,人工气胸后,肺萎缩, 胸腔里的空间增大,提拉剑突后,不容易损伤肺、心及肝脏,出血少。
3.经心脏灌注,有时穿刺针会误进右心室,那样灌注主要在肺循环起作用,体 循环的血液影响不大。所以观察将穿刺针插入到主动脉内可以确保起到体循环 灌注冲洗血液的效果,脑组织的血液冲干净后,才不会影响免疫组化的效果, 不然到处都是红细胞造成的背景染色。
竖起成一直线;所灌注的脑组织白而硬。
7.去颅骨后脑表面有一层硬脑膜,要去掉。
常见问题:
1.灌注取脑不可用于Western blot及PCR的原因。
答:多聚甲醛使组织蛋白发生交联,以保持蛋白的原位和表面结构不变,从而 能使其对应的抗体准确检测其表达位置和量。
Western中,要用去污剂使各种蛋白发生变性、解聚,并变成统一的线性肽链, 从而能够用凝胶电泳进行分子量的梯度分离。多聚甲醛会影响蛋白的解聚,从 而使其无法用凝胶分离。
1多聚甲醛的配置:
一般方法为:4%多聚甲醛PBS缓冲液配法:称取40g PFA溶于装有
500mlDEPC水的玻璃容器(烧杯或烧瓶)中,持续加热磁力搅拌至60〜65C,
使成乳白色悬液。用1.0mol/L的NaOH值至7.4,使呈清亮状(滴加),再加 入约500ml PBS,充分混匀(在冰浴或冷水浴中),可再检测一下pH,过滤后
另外,WB和免疫组化所使用抗体的抗原表位也不同,WB的抗体一般识别蛋 白的一级结构,所以可能也无法识别甲醛处理的蛋白。
PCR要提RNA,RNA非常容易降解,必须新鲜取组织,然后尽快超低温冷藏 或者马上抽提,否则非常容易降解。灌注固定的组织,原则上是能够提得出DNA和RNA的,但是肯定会有较多的降解,一般不会这样做。
4.灌注时注意排空输液管中的气泡不然容易气栓,影响灌注效果。一定要看到 大鼠较剧烈抽搐,不然证明灌注不好。
5.关于生理盐水的温度的选择,有人认为因为是快速冲刷血管里的血液,低温 造成血管收缩,灌注的效果反而没有室温的好。但是用低温的认为,低温有利 于组织完整。
6.灌注成功的标志:刚开始灌注时老鼠剧烈抽动;成功后老鼠后肢绷直,尾部
保存或切片
具体过程:
大鼠经深度麻醉后,固定于自制的手术木板上,置于解剖盘中,开胸暴露并游离出 心脏,经左心室插入灌流针并固定,切开右心耳,先灌注冰冻无菌生理盐水
(4C)XmL,直到肝和肺脏颜色转白及右心房流出液澄清,后再灌注冰冻(4C)4%多聚甲醛XmL,断头取脑,多聚甲醛浸泡固定24小时。
Tips:
必要性:
1.脑组织较软,且细胞成分不易保留,脑组织是较易软化的组织之一,血供也
较为丰富,所以最好是在取脑组织前用4%多聚甲醛灌注固。
2.经前固定后,取脑操作时,可减少脑组织损伤。
3.脑内血液都在,HE染色后,可去除红细胞背景影响。
大鼠灌注取脑标准操作规程(SOP):
流程:
1)麻醉2)开胸3)心脏左心室穿针,剪开右心耳4)生理盐水冲水5)4%多基甲醛固定6)取脑7)
2.没有灌注固定的大鼠脑组织,能不能做切片和免疫组化?
答:如果没有灌注固定,而是直接取材然后放入固定液中,可以进行免疫组化 染色,只是效果不如灌注固定的好,尤其是要做电镜时更明显。有的标记蛋白 要求较高,固定不好就难以染好。
3.用4%多聚甲醛固定但保存了2周才做石蜡切片,不知对免疫组化有无影响? 答:固定时间过长蛋白多肽链都交连在一起了,抗原性就很弱了,很可能没有阳 性结果,抗原修复时一般的修复很难把抗原性恢复•可能会有影响,但不会太 大。固定时间长,抗原修复时间也要长一些。
夹闭腹主动脉:只灌注上肢及头脑,固定的好又快,又省试剂。先灌注生理盐 水约100ml,见到老鼠两前肢及两肺变白可改灌注多聚甲醛。多聚甲醛用
100ml以下即可。
灌注成功的标志:刚开始灌注时老鼠前肢剧烈抽动(下肢不抽动证明腹主动脉 夹闭完全);前肢及颈部僵硬;所灌注的脑组织白而硬。
注意事项:
1.多聚甲醛气味刺激,配置时做好自我保护。
3.10%水合氯醛按4mL/100g的剂量腹腔注射麻醉动物。
4.沿两侧肋弓剪开皮肤,打开腹腔,用一血管钳夹持剑突并向上提拉,用弯剪 在膈肌与胸骨柄相连处剪一小口,造成人工气胸,然后向两侧顺延,剪断膈肌 及肋骨,夹持剑突的血管钳将剑突连带胸廓上翻固定,充分暴露心脏,直视下 穿刺针左心室心尖处,用血管钳固定。
4.灌注多长时间?灌注液多少?
看了很多经验,每个人的灌注液用量都不一样,灌注速度也能没有很清楚的说 法,灌注时间也不确定。我的总结为,还是看灌注成功的标志。现将看到的比 较详细的处理方法列出。灌注速度,大家比较公认的是先快后慢。
短期灌注:采用心脏穿刺快速灌注20min,其中生理盐水灌注50~100mL,4%多 聚甲醛缓冲液灌注150mL0
5.快速滴注生理盐水(室温),同时剪开右心耳。约注入100~150mL,至流出液体 血色较浅基本澄清,停止灌注。肝脏、眼珠、爪子迅速变白是排出血液的有效 观察指标。
6.继续用4%多聚甲醛灌流250ml固定。
7.后固定:灌流后的脑组织置于4%PFA置4度冰箱内进行后固定,时间>2h,过夜最好。
补充:
还有一种省时省剂的方法。
