原子物理 第四章碱金属原子
原子物理学褚圣麟第四、五章复习

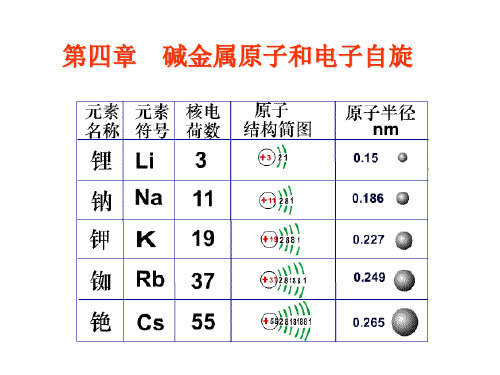
第四章:碱金属原子和电子自旋锂、钠、钾、铷、铯、钫化学性质相仿、都是一价、电离电势都比较小,容易被电离,具有金属的一般性质。
一、碱金属原子的光谱1、四个线系(锂为例):其他碱金属光谱系相仿,只是波长不同主线系:波长范围最广,第一条线是红色的,其余在紫外,系限2299.7埃;第一辅线系(漫线系):在可见部分;第二辅线系(锐线系):第一条线在红外,其余在可见部分;伯格漫线系(基线系):全在红外。
2、巴尔末氢原子光谱规律: ,5,4,3),1-21(1~22===n nR v H λ 碱金属原子光谱:2*∞-~~nR v v n = R 为里德伯常数,当,所以∞v ~是线系限的波数,且有效量子数*n 不是整数,Δ==-*n TR n 3、碱金属原子的光谱项:22*Δ)-(n R n R T == 4、同一线系的有效量子数与主量子数差别不大;与某一量子数对应不同线系的有效量子数差别明显,引进角量子数加以区分:5、每一线系线系限波数恰好是另一线系第二谱项值中最大的那个。
共振线:主线系第一条。
6、碱金属原子氢原子能级的比较n 很大时,碱金属原子能级 很接近氢原子能级;n 较小时,碱金属原子能级 与氢原子能级相差大; 且n 相同,l 不同的能级高低差别很大。
二、原子实极化和轨道贯穿:原子=原子实+价电子1、原子实:碱金属原子中的电子具有规则组合,共同点是在一个完整的结构之外,多余一个电子,这个完整而稳固的结构称为原子实。
由于原子实的存在,发生原子实的极化和轨道在原子实中的贯穿。
2、价电子:原子实外的那个电子称作价电子。
价电子在较大的轨道上运动,与原子实结合不是很强,容易脱离。
它决定元素的化学性质,在较大的轨道上运动。
3、原子实的极化:由于价电子的电场的作用,原子实中带正电的原子核和带负电的电子的中心发生微小相对位移,于是负电的中心不再在原子核上,形成一个电偶极子。
① 角量子数l 小:轨道偏心率大(椭圆),极化强,能量影响大;② 角量子数l 大:轨道偏心率小(接近圆),极化弱,能量影响小。
原子物理 (4)

-e
2021/1/12
24
二、原子实极化与轨道贯穿
1、原子实极化 (影响小)
价电子产生的电场,使原子实中原子核和电子的中心会发 生微小的相对位移。原子实中的电子的中心不在原子核上,形 成一个电偶极子。
+-
P (z 1)el
虚线:极化前
实线:极化后
2021/1/12
25
原子实极化 的作用 极化产生的电偶极子的电场作用于价电子,使它受到除库
R (n p )2
R
R
第二辅线系: vsn (3 p )2 (n s )2
n=3.4.5… np 3s n=4.5.6…. ns 3 p
第一辅线系:
vdn
R (3 p )2
R (n d )2
n=3.4.5….. nd 3 p
柏格曼系:
R
R
v fn (3 d )2 (n f )2
s,l=0
0.40
n* 1.589 2.596 3.598 4.599 5.599 6.579
T 28581.4 12559.9 7017.0 4472.8 3094.4 2268.9 主线系 p, l=1 n* 1.960 2.956 3.954 4.954 5.955 6.954 0.05
第一辅
用2两021/个1/1量2 子数 n, l 来描述
4
类比H原子光谱
v
RH
(1 m2
1 n2
)
m=1,2,3……; 对每个m, n=m+1,m+2,m+3……构成谱线系
n n>m
m
每一个线系的每一条光谱线的波数都可表示为两个光谱项
之差
vn
第四章 碱金属原子与电子自旋

( n* < n)
11
原子物理学 zsw2622@
二、碱金属原子光谱的精细结构
1. 光谱情况
若用分辨本领较高的仪器观察, 若用分辨本领较高的仪器观察,会发现碱金属的光谱一 般由两条或三条谱线组成,而不是单一的谱线, 般由两条或三条谱线组成,而不是单一的谱线,这称为光谱 线的精细结构。 线的精细结构。 二辅系: ns →2 p ( n = 3,4,...) 二辅系:
% vmax = 28581.4cm−1
% 基线系 v∞ → 一辅线系 vmax = 412202.5cm−1 %
Li原子光 原子光 谱公式
% svn = % pvn = % dvn = % fvn =
R
( 2−∆ )
p
2
− − − −
R
( n −∆s )
R
p
2
(n = 3, 4,...) (n = 2,3,...) (n = 3, 4,...) (n = 4,5,...)
光谱项和 n*的确定 的确定
% % % vn = v∞ −Tn = v∞ − R % % Tn = 2 = v∞ − vn n*
R n*2
原子光谱 的一般规 律
线系谱线的 波数
3
一般不为整 数 线系波数 原子物理学 zsw2622@
Li光谱项值和有效量子数 光谱项值和有效量子数
2
原子物理学 zsw2622@
1. 碱金属原子的光谱公式
几种碱金属元素原子光谱具有相仿的结构, 几种碱金属元素原子光谱具有相仿的结构,比较容易观察 到的有四个谱线系:主线系、第二辅线系、 到的有四个谱线系:主线系、第二辅线系、第一辅线系以及基 线系( 线系(Bergmann系)。 系 对每个谱线系的光谱进行测量和数据处理, 对每个谱线系的光谱进行测量和数据处理,可以获得每条 谱线的波数及系限波数(最大波数),如表所示。 ),如表所示 谱线的波数及系限波数(最大波数),如表所示。
第四章碱金属

2.956 3.954 4.954 5.955 6.954
v~
12202.5
68R6H2.5312438n912.2,
n 4,5,6,
3046.9 2239.4
2.999
v~
638R.95H959.5412453.08n01120.2,
Enl
n
hcR
l
2
hcR
Z *2 n2
价电子的轨道也为椭圆轨道,能级由两个量子数n、l (nφ) 决定。但在碱金属原子中,有两种重要的运动对能级有较大的
影响,这两种运动就是:原子实的极化和轨道的贯穿。
1、原子实的极化
原子实带有一个单位正电荷,
价电子在其Coulomb场中运动。但是,
价电子对原子实的作用会使原子核
s 和p对应的为偏心率很大的轨
道,在这些轨道上,价电子很可能
穿入原子实,形成轨道贯穿效应。
而这种效应,对价电子的能级有较
+
大的影响。
价电子在原子实外时,原子实的 有效电荷数Z*=1,能级接近氢能级; 价电子贯穿原子实时,价电子比原子 实中部分电子更接近原子核,所以 Z*>1 。则
Applied Physics
解:共振线波长意为主线系第一谱线,将上述波长依次记为
, , , , pmax d max f max p
即 pmax
5893 A,dmax
8193 A, f max
18459 A,p
2413 A
由前面分析可知:
两个辅线系的线系限相同,等于主线系第二光谱项的最大 值;柏格曼系的线系限,等于第一辅线系第二光谱项的最 大值;主线系的线系限,等于表中第二辅线系的第一项,
原子物理学 课件-第四章 碱金属原子和电子自旋

光谱项: 能级因极化下降不太多 ii、价电子进入原子实内:
原子物理学
iii、 都很大,价电子轨道离原子实很远,极化, 贯穿不再发生,碱金属原子能级与氢原子能级差别小。
原子物理学
§4.3 碱金属原子光谱精细结构 一、精细结构
用高分辩本领的光谱仪观察碱金属光谱,每条谱 线又由更精细的两条或三条谱线组成。 例:钠,主线系第一谱线,
二、价电子运动:决定光谱、化学性质 (1)价电子远离原子实: 大, 大, 能级接近氢原子
(2)价电子靠近原子实: 小, 小,两种情况: 原子实极化,轨道贯穿。
原子物理学
1、原子实极化: 没有价电子作用时,原子实内部正、负 电荷中心重合。
价电子靠近原子实,正、负电荷中心不再重合,原 子实被极化形成电偶极子,偶极子电场反作用于电 子,产生附加吸引力,引起能量降低。
Ⅰ:
Ⅱ:
柏:
元素 234567
原子物理学
§4.2 碱金属光谱解释 原子实极化 轨道贯穿
一. 碱金属原子实模型
括号内电子排布 形成稳定完整结 构
原子物理学
原子实:碱金属原子中,除价电子以外的其余部 分,是一稳定结构,带单位正电荷。
原子实=核+2个电子. 占据 轨道
原子实=核+10个电子,占据 轨道,以下类推。
用极化概念解释同一 的能级分裂:
同一
小,轨道偏心率大, 价电子靠近原子实,极 化很强,能级下降多;
大,轨道偏心率小, 价电子远离原子实,极 化很弱,能级下降少
引起同一 . 由于 不同 的能级分裂
原子物理学
2、转道贯穿 当价电子处于 小,偏心率大的轨道上运动时,其 轨道可能贯入原子实内部,引起能级降低的 现象。
原子物理第4章

Automic Physics 原子物理学
第四章:碱金属原子和电子自旋
碱金属元素: 锂Li、钠Na、钾K、铷Rb、铯Cs、钫Fr 原子序数: Li 3、Na 11、K19、Rb 37、Cs55、Fr87
R R , n 3,4, 2 2 p n s 2
主线系 第二辅线系
~ n
~ n
R R , n 3,4, 2 2 p n d 2
R R , n 4,5, 2 3 d n f 2
第一辅线系 柏格曼线系
2 2
11 2 12 2 2 1
22 22 1
2 2 32 2 2 1
2 2
2 2 32 32 2 2 1
2 2 32 4 2 32 2 2 1
back
next
目录
结束
第四章:碱金属原子和电子自旋
第二节:原子实的激化和轨道贯穿
R R , n 4,5, 3 一辅 2 n 柏格 2
2000
1000
主线系
第一辅线系
第二辅线系
柏格曼线系
2500
3000
4000
5000
波长埃
7000
10000 20000
第四章:碱金属原子和电子自旋
第一节:碱金属原子的光谱
主线系 第二辅线系 第一辅线系 柏格曼线系
原子实激化:
e
原子物理学4
s
电子的自旋轨道耦合
电子围着原子核做圆周运动, 原子的总磁矩和总角动量都来 源于电子的轨道运动和电子的 自旋。 j l s 总磁矩:
总角动量: P j Pl Ps
价电子
e
Ze
由量子力学可知,Pj也是量子化的, 相应的 总角动量量子数用 j 表示,且有
§4.4 电子自旋同轨道运动的相互作用
电子的自旋
Uhlenbeck and Goudsmit 在1925年提出: 实验依据: (1)史特恩-盖拉赫实验出现偶数分裂的事实 (2)碱金属原子光谱的精细结构
P 电子具有某种方式的自旋; s s ( s 1), s 1 2
相对于外磁场方向,自旋角动量Ps在空间只能取朝上和 P 1 朝下两种取向: s B Psz ms , ms z 自旋磁矩和自旋角动量的关系是:
碱金属原子态的符号:
电子态符号:l 0 ,1, 2 , 3 ,
s, p , d , f ,
比如: n=3时,3s, 3p, 3d
原子态符号:由价电子的诸量子数来描述
L 0 ,1, 2 , 3 , S , P , D , F ,
s 1 2 L l: j ls: ,2 s 1 2 :
2
j
*
j ( j 1) l ( l 1) s ( s 1)
c
j
l
*2
l
*
2
s
*
讨论: (1) n和l相同,s不变,只有j不同,不同的j值具有不同 的能量
l 0 时, j l s l 1 / 2 l 0 时, j l s l 1 / 2,或
原子物理第四章

3)与 s 对应的磁矩,由 r L 式知, 轨道磁矩 l 与轨道角动量 L 之间的对应 关系是
e l L 2m
(3)
back
next
目录
结束
与此相类比, s 与相应的
s 之间也应有
(4)
相应的对应关系,这个对应关系是
e s S m
S s(s 1)
(1)
next 目录 结束
其中S 称为自旋量子数
back
2)
有2l +1个空间取向,则 s 也应该有 2s+1个空间取向
L
S z ms h
ms s, s 1,…-s (2)
实验表明,对于电子来说
1 s 2
1 1 ms , 2 2
即
s
有两个空间取向。
hv E Em En
1 1 Rhc (4) ' 2 2 (n l ) (m l )
back next 目录 结束
所以碱金属光谱的波数为
~
1 1 v R ' 2 2 (n l ) (m l )
nL mL
'
back
(5)
next
目录
结束
第三节、碱金属原子光谱的精细结构
• 一、光谱的精细结构 • 1、概念 • 2、光谱的精细结构的特点 • 二、光谱的精细结构和能量的联系 • 三、结论
第四节:电子的自旋同轨道运动的相互作用
史特恩-盖拉赫实验中出现偶数分裂的事实 启示人们,电子的轨道运动似乎不是全部的 运动。换句话说,
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
hcR En 2 (n Δ )
R T(n,) 2 (n Δ )
2 ep 4 0 2 ( 2 1)
与氢原子的差别
(1)能量由(n, )两个量子数决定,主量子数 相同,角量子数不同的能级不相同。各能级均低 于氢原子相应能级。 (2)对同一n值,不同值的能级,值较大的能级 与氢原子的差别较小;对同一值,不同n值的能级, n值较大的能级与氢原子的差别较小。 (3)n很大时,能级与氢的很接近,少数光谱线 的波数几乎与氢的相同。
1 1 3 ( 1) 2 2 2 1 pS , z mS 2
e s ps me
s,z
e e ms B me 2m e
电子的自旋轨道耦合
电子绕核运动时,既有轨道角动量 L ,又有 自旋角动量 S, 这时电子状态和总角动量 J 有关。 J LS 这一角动量的合成,叫自旋轨道耦合。
-e
价电子远离原子实
二、原子实极化、轨道贯穿
1.原子实极化(形成电偶极子),使电子又受到电 偶极子的电场的作用,能量降低,同一n值,越小 ,极化越强。 2.轨道贯穿(电子云的弥散),对于那些偏心率很 大的轨道, 接近原子实的那部分还可能穿入原子 实发生轨道贯穿,这时Z*>1,从而使能量降低。 3.光谱项为: RZ 2 T n2
2.本节中心: 电子自旋;
Rhc Z E 3 n l (l 1)
2
*
原子态:
n
2 s 1
lj
一. 电子自旋 (electron spin)
m核 me
核 e
核 的影响很小
1925年乌伦贝克(G.E.Uhlenbeck)和古兹
米特(S. Goudsmit)根据施 — 盖实验的事实, 提出了大胆的假设: 电子不是质点,它有固有的
双层能级
2.量子力学观点:
轨道角动量 pl l (l 1) l * , plz ml
l = 0, 1, 2…(n1) l — 轨道量子数,
ml 0, 1, 2, … , l
ml — 轨道磁量子数
自旋角动量也应有 pS s(s 1) s* ,
pS , z mS
l n n *
R n* T
3.光谱项
锂原子的四个线系,可用下列公式表示:
主线系:
第一辅线系:
~
~
R R ~ 2s np (2 s) 2 (n p) 2
R R ~ 2 p nd (2 p) 2 (n d ) 2
图4.1 锂的光谱线系
Δ 几个光谱名词 一个线系的 线系限 :同一线系中最大的波数,或波数 公式中的第一个光谱项(不动的光谱项)。 原子的 共振线:该原子从基态到第一激发态吸收的谱 线。一个原子共振线只有一条。 一个线系的 主线:该线系的第一条谱线或该线系的波 数最小的谱线。
二、线系公式
H原子光谱:
由量子力学可知,J 也是量子化的, 相应的
总角动量量子数用 j 表示, l 0 时,J S,j s 1 / 2; l 0 时,j l s l 1 / 2,或 j s l 1/ 2 l
(L、S平行) (L、S反平行)
原子总角动量Pj
1 p j (l ) 2
pj pl
j ( j 1) 1.94 , p j '
j ( j 1) 0.87 ,
ps
114.08 , 65.9 pl 与 ps 夹角是锐角.
pl
pj
35.3 ,
144.7
ps
1 0 0 2 , mvr sin pl (电子对原子实) c
Z *e pl B 2 3 4 0 m c r 1
3.夹角
cos
(pj pj pj ) 2 pl ps
2
2
2
4.附加能量
Els s B cos
e ps m
Z *e pl ( p j 2 pl 2 ps 2 ) 2 3 2 pl ps 4 0 m c r 1
第二辅线系: 柏格曼系:
~
~
R R ~ 2 p ns (2 p) 2 (n s) 2
R R ~ 3d nf (3 d ) 2 (n f ) 2
T R R n *2 n 2
碱金属原子光谱项:
li 原子跃迁图:
pj
pl
ps
ps
pl
pj
1 p j (l ) 2
p原子 p原子实 p价电子 p价电子
电子总角动量量子数
j ls
二.能级分裂 1. 电子自旋磁矩的附加能量:
1 jl 2 1 jl 2
Els s B cos
n, l
, Els s B 0 0, Els s B 0
4.3 碱金属原子光谱的精细结构 1. 引入: 用高分辨率的仪器观察谱线,发现一条→二/三条 2.本节中心: 谱线精细结构→能级分裂
一.实验事实 主线 系: 二 辅 一 辅
~
增加
线系 限
第4 条
第3 条
第2 条
第1 条
主线 系: 二 辅 一 辅
~
线系 限
增加
主线系: 二辅 :
~ 常数; ~ 两个
pl 与 ps 夹角是钝角.
pl
pj
s 绕Bl 进动, l 绕Bs 进动, 无外场时, p j 是恒矢量. pl , ps均绕p j 进动, pl , ps 夹角保持不变 。
ps
电子自旋与轨道相互作用能的计算: Els s B cos
4.1 碱金属原子光谱
引入: 碱金属光谱→能级→结构 中心: 碱金属原子光谱规律:四系; 三端; 两数; 一定则. 一. 碱金属原子光谱------结构相近, 明显分线系
主线系(Principle series): 红光, 紫外E>3.0, E<1.6 第一辅线系(Diffuse series):可见光, 由轮廓弥散的谱 线组成. (漫线系) 第二辅线系(Sharp series):红外, 可见光,由轮廓细锐 的谱线组成.(锐线系) 基线系(Bergmann series): 红外,与氢线系类似, E<1.6
Li原子
s
4s
p
d
f
4
3
4p 3p
4d 3d
4f
3s
2
特点:
四系谱线,四个线系;
2s Li基态
2p
三个终端:2s,2p,3d; 二个量子数:n, l ;
一条选择定则:
l 1
注:除四线系外,高能级到 低能级的跃迁也有,只是强 度小与1/n3成正比.
4.能级图
0 10000 20000 30000 40000
* 2 *2 *2 *2
Z e j l s 2 2 2 3 4 0 m c r 2 1
据1926年托马斯的相对论处理:
Li原子 p d f
4p
4d 3d
4f
3p
2
2s Li基态
2p
s
4 3 4s
p
d
f
4p
3p
4d 3d
4f
3s
2
2s Li基态
2p
主线系:
1 ~ ~ , ~ 0; ~ 只有一个 ~ ;
二辅:
~ 常数; ~ 两个
n 增加,ΔE下降
d
一辅 : 左右两成分间隔取决于P能级双层,与二辅线同.
1 1 ~ T ( m) T ( n ) R ( 2 2 ) m n
R ~ ~ T (m) 2 当 n 时, m
系限.
n Tm* Tn*
1.有效量子数
1 1 R R( ) 2 2 m* n* n *2
氢原子:主量子数n 是整数 碱金属原子 n *m * 不是整数有效量子数 2.量子数亏损
右边两成分取决于d能级双层,
f
一辅:
~
1 ~ ~ , ~; ~ 只有两个 ~ ;
1辅最大
~
2辅
~
主最大
结论: S为单能级,其它p,d,f,e等为双能级, 同一个l, n 增加,ΔE下降.
4.4 电子自旋同轨道运动相互作用
1.引入.:为什么单价原子光谱 有双线精细结构?
与核结合的很松,可以把内层电子和原子核看 作一个整体称为原子实。价电子绕原子实运动 ,原子的化学性质及光谱都决定于这个价电子 。
锂原子的价电子的轨道:n*
≥ 2 钠原子的价电子的轨道:n* ≥ 3 原子实的有效电荷数 :Z*=Z-(Z-1)=1
价电子远离原子实运动
相当于价电子在n 很大的轨道上运动, 价电子与原子实间的作用很弱,原子实电 荷对称分布,正负电荷中心重合在一起。 有效电荷为+e,价电子好象处在一个单位 正电荷的库仑场中运动,与氢原子模型完 全相似,所以光谱和能级与氢原子相同。
1.电子自旋磁矩
e s ps m
e s m
ps 3 0.87 2
1 1 ( 1) 3 B 2 2
1 psz ms ms 2 2
e sz ms B m
2.轨道运动的磁场
B
B
-e -e
0 Z *ev r B 4 r3
