有机物的结构与性质汇总
有机物性质归纳
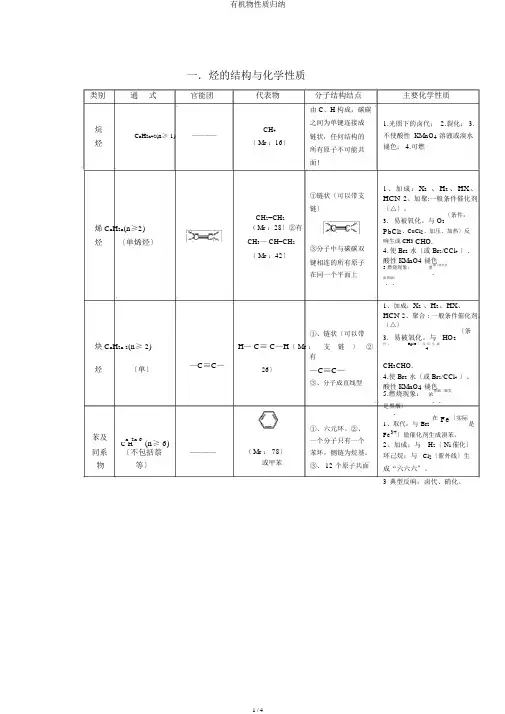
一.烃的结构与化学性质类别通式官能团烷C n H2n+2(n≥ 1)————烃烯C n H2n(n≥2)烃〔单烯烃〕炔C n H2n-2(n≥ 2)代表物分子结构结点由 C、H 构成,碳碳之间为单键连接成CH4链状,任何结构的〔 Mr :16〕所有原子不可能共面!①链状〔可以带支链〕CH2=CH2(Mr :28〕②有CH3— CH=CH2③分子中与碳碳双〔 Mr :42〕键相连的所有原子在同一个平面上①、链状〔可以带H— C≡ C—H〔Mr:支链〕②有主要化学性质1.光照下的卤代;2.裂化;3.不使酸性 KMnO4溶液或溴水褪色; 4.可燃1、加成:X2、H2、HX、HCN2、加聚:一般条件催化剂〔△〕。
3.易被氧化。
与 O2〔条件:PbCl2、CuCl2、加压、加热〕反响生成 CH3CHO.4.使 Br2水〔或 Br2/CCl4〕、酸性 KMnO4褪色5.燃烧现象:黑烟〔炔类是.浓黑烟〕..1、加成:X2、H2、HX、HCN 2、聚合 : 一般条件催化剂。
〔△〕3.易被氧化。
与 HO2〔条件:HgSO 〕反应生成4烃〔单〕—C≡C—26〕—C≡C—③、分子成直线型CH3CHO.4.使 Br2水〔或 Br2/CCl4〕、酸性 KMnO4褪色5.燃烧现象:浓黑烟〔烯类..是黑烟〕.苯及n 2n-6(n≥ 6)C H同系〔不包括萘————物等〕(Mr : 78〕或甲苯①、六元环。
②、一个分子只有一个苯环,侧链为烷基。
③、 12 个原子共面1、取代:与 Br2在Fe〔实际是Fe3+〕做催化剂生成溴苯。
2、加成:与H2〔 Ni 催化〕环己烷;与Cl2〔紫外线〕生成“六六六〞。
3典型反响:卤代、硝化。
二.烃的衍生物的结构与化学性质类别通式一卤代烃:卤代R—X烃多元饱和卤代烃:Cn H2n+2-m X m一元醇:R—OH醇饱和多元醇:C n H2n+2O m醚R—O—R′酚醛酮羧酸酯官能团卤原子—X醇羟基—OH醚键酚羟基—OH醛基羰基羧基酯基代表物C2H5Br(Mr : 109〕CH3OH(Mr : 32〕C2 H5 OH(M r : 46〕C2H5O C2H5(M r : 74〕(M r : 94〕HCHO(M r : 30〕(M r : 44〕(M r : 58〕(M r : 60〕HCOOCH3(M r : 60〕(M r : 88〕分子结构结点主要化学性质卤素原子直接与烃基 1.与 NaOH 水溶液共热发生取结合代反响生成醇β-碳上要有氢原子才 2.与 NaOH 醇溶液共热发生消能发生消去反响去反响生成烯羟基直接与链烃基结1.跟活泼金属反响产生 H22.跟卤化氢或浓氢卤酸反响生合, O—H 及 C—O 均成卤代烃有极性。
大学化学有机化合物的结构与性质

大学化学有机化合物的结构与性质一、引言在化学领域中,有机化合物是一个重要的研究领域。
它们由碳和氢构成,但也可以包含其他元素,如氧、氮、硫等。
有机化合物的结构对其性质起着决定性的影响。
本文将介绍有机化合物的结构和一些常见的性质。
二、有机化合物的结构有机化合物的基本结构由碳原子的连接方式决定。
碳原子可以通过共价键连接,形成直链、支链、环状等不同的结构。
其中,直链化合物的碳原子按照直线连接,支链化合物则出现了分支结构。
环状化合物则是由碳原子形成了闭环结构。
三、有机化合物的物理性质1. 溶解性有机化合物的溶解性受到其分子结构的影响。
通常,极性化合物更容易溶解于极性溶剂,而非极性化合物更容易溶解于非极性溶剂。
例如,醇类化合物具有极性羟基,因此更容易溶解于水等极性溶剂中。
2. 沸点和熔点有机化合物的沸点和熔点与分子间的相互作用力有关。
分子间较强的相互作用力会导致较高的沸点和熔点。
例如,氢键是较强的相互作用力,因此含氢键的化合物通常具有较高的沸点和熔点。
3. 导电性有机化合物的导电性较差,因为它们大多数是非金属元素构成。
除了一些特殊情况,如含有金属离子的配合物,大部分有机化合物不会导电。
四、有机化合物的化学性质1. 燃烧反应大多数有机化合物都可以燃烧,生成二氧化碳和水。
这是由于它们含有碳和氢,燃烧时碳与氧气反应形成二氧化碳,氢与氧气反应形成水。
2. 氧化还原反应有机化合物可以进行氧化和还原反应。
氧化反应是指化合物失去电子,还原反应是指化合物获得电子。
这些反应对于有机合成和生物化学有着重要的意义。
3. 反应活性有机化合物的反应活性与其官能团和键的稳定性有关。
不同的官能团会对化合物的反应性产生巨大的影响。
例如,酮和醛中的羰基是一个常见的反应中心,具有较高的反应活性。
五、有机化合物在生活中的应用有机化合物广泛应用于生活中的各个方面。
例如,醋酸乙酯作为溶剂广泛用于涂料和胶水;丙酮作为溶剂用于胶水和去油剂;乙二醇用于制造塑料等。
有机化合物的结构与性质总结知识点总结

有机化合物的结构与性质总结知识点总结有机化合物的结构与性质总结有机化合物是由碳原子与氢原子以及其他元素的原子通过共价键连接而成的化合物。
它们是生命体中的基本组成部分,也是许多化学过程中不可或缺的原料。
本文将对有机化合物的结构与性质进行总结,并探讨其在化学中的应用。
一、有机化合物的结构有机化合物的结构可以通过其分子式和结构式来表示。
分子式是由化合物中各个原子的符号及其个数组成的简略表达式,如C6H12O6表示葡萄糖。
结构式则更为详细地展示了各个原子之间的连接关系。
有机化合物的结构中包含着碳原子的特殊性质。
碳原子有着四个价电子,因此它可以与其他四个原子形成共价键。
这种四个原子或基团分布在碳原子周围的结构被称为碳原子的化学环境。
根据碳原子周围的基团不同,化合物的性质也会有所不同。
二、有机化合物的性质1. 物理性质有机化合物的物理性质主要包括颜色、气味、溶解性、密度和沸点等。
不同的有机化合物由于其结构的不同,具有不同的物理性质。
例如,醇类化合物由于其分子中带有羟基(-OH)团,因此具有较高的沸点和相对较好的溶解性。
2. 化学性质有机化合物的化学性质是指其与其他化合物或物质发生化学反应的能力。
有机化合物的化学性质主要受到其分子结构和功能团的影响。
例如,醛类化合物具有较强的氧化性,容易与氧发生反应生成羧酸。
3. 功能团对性质的影响在有机化合物中,功能团是一类具有特定化学性质和反应活性的原子或原子团。
不同的功能团会赋予化合物特定的性质和反应特点。
例如,羧酸功能团的存在使得化合物具有较强的酸性,可以与碱反应生成盐。
三、有机化合物的应用有机化合物广泛应用于生命科学、医药、农业和化工等领域。
1. 生命科学许多有机化合物是生命体内必需的物质,如氨基酸、核酸和糖类等。
它们在蛋白质合成、遗传信息传递和能量代谢等生命活动中起到重要作用。
2. 医药有机化合物在药物研发和制造中起着关键的作用。
许多药物都是由有机化合物合成而成的,如抗生素、抗癌药物等。
有机物的结构和性质
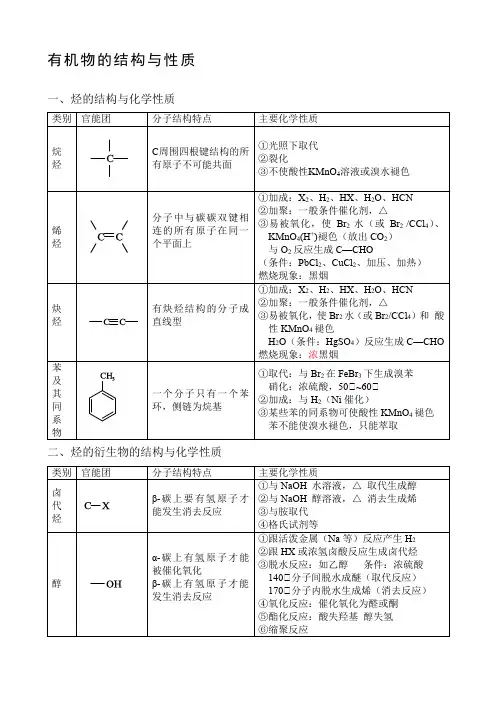
有机物的结构与性质一、烃的结构与化学性质二、烃的衍生物的结构与化学性质油脂硬脂酸C17H35COOH软脂酸C15H31COOH油酸C17H33COOH亚油酸C17H31COOH①(碱性)水解反应(皂化反应)(酸性)水解反应②氢化反应蛋白质生物大分子①与酸、碱反应②水解③盐析:加饱和NaCl,(NH4)2SO4④变性:重金属盐,加热,紫外线,甲醛,酒精,强酸,强碱⑤颜色反应(含有苯环)[生物催化剂]浓硝酸黄色固态物质⑥灼烧分解三、有机物官能团反应使酸性KMnO4溶液褪色:①碳碳双键②碳碳三键③苯的同系物(α-碳上有氢原子)④醇(α-碳上有氢原子)⑤酚羟基⑥醛基能与Br2水反应褪色:①碳碳双键②碳碳三键③酚羟基④醛基萃取褪色:苯、甲苯、四氯化碳等有机溶液能发生水解反应的官能团有:①碳卤键②酯基③酰胺基能与Na或K反应放出H2的官能团有:①醇羟基②酚羟基③羧基④磺酸基(如右图)能与NaOH溶液发生反应的官能团有:①酚羟基②羧基③酯基、酰胺基④碳卤键⑤磺酸基能与Na2CO3溶液反应的官能团有:①酚羟基(无气体)②羧基(放出CO2)③磺酸基能与NaHCO3溶液反应的官能团有:①羧基②磺酸基能与银铵溶液发生银镜反应,与氢氧化铜悬浊液反应生成砖红色沉淀的官能团有:①醛基能与FeCl3发生显色反应的是:①酚羟基能与H2发生加成反应(即能被还原)的官能团有:①碳碳双键②碳碳三键③醛基④酮羰基⑤苯环不易与H2发生加成反应的官能团有:①羧基②酯基能发生氧化和还原反应的官能团有:①碳碳双、三键②醛基能被氧化(具有还原性,可燃性除外)的官能团有:①碳碳双键②醇羟基③酚羟基根据相似相溶原理,有机物常见官能团中,亲水基团:醇羟基、醛基、酮羰基、羧基、磺酸基憎水基团:硝基、酯基、碳卤键四、有机物的结构(1)同系物:指结构相似、分子组成相差若干个“CH2”原子团的有机化合物;一般出现在有机化学中,且必须是同一类物质(含有相同且数量相等的官能团,羟基例外)(2)同分异构体:指分子式相同、结构不同的化合物(3)同素异形体:由同样的单一化学元素组成,因排列方式不同,而具有不同性质的单质(4)顺反异构:(顺)(反)(5)手性碳原子:注意碳原子所在结构是否有对称性例如:被氢气加成后分子的手性碳原子个数:五、有机反应机理1.Markovnikov rules:当发生亲电加成反应(如卤化氢和烯烃的反应)时,亲电试剂中的正电基团(如氢)总是加在连接电子基团较少的碳原子上,而负电基团(如卤素)则会加在连接电子基团较多的碳原子上。
有机物结构和性质总结

③加聚:nCH2=CH2 ①加成:CH≡CH+Br2 CHBr=CHBr 碳 碳 CH≡CH+HCl CH2=CHCl 三键, 较 不 ②氧化:被酸性高锰酸钾溶液氧化,使高锰酸钾溶液褪色 稳定 2C2H2+5O2 4CO2+2H2O 有浓烈黑烟 ①取代: 大 π 平面正 键, 较 六边形 稳定
乙炔 C 2H 2
苯酚 (石炭酸) 羟基—OH
乙醛 CH3CHO
醛基—CHO
无色液体, ②氧化:2CH3CHO+O2 2CH3COOH 有刺激性 气味, 和水 (银镜反应)CH3CHO+2Ag(NH3)2OH 互溶 CH3COONH4+2Ag↓+3NH3+2H2O CH3CHO+2Cu(OH)2 CH3COOH+Cu2O+2H2O
- +
①弱酸性:CH3COOH CH3COO +H 乙酸(醋 无色液体, 酸性比碳酸强 酸)CH3COO 羧基—COOH 有酸味, 和 ②酯化:CH3COOH+HOC2H5 CH3COOC2H5+H2O H 水互溶 一般羧酸脱羟基、醇脱氢 ①酸催化水解(可逆): 无色液体, CH3COOC2H5+H2O CH3COOH+C2H5OH 乙酸乙酯 有香味, 微 CH3COOC2H 酯基—COOR 溶于水, 比 ②碱催化水解(不可逆): 5 水轻 CH3COOC2H5+NaOH CH3COONa+C2H5OH
有机物结构和性质总结: 有机物结构和性质总结
一、烃类代表物的结构和性质 结构简式 空间构 结构特 型 点 主要化学性质及特点 ①与酸性高锰酸钾溶液、溴水均不反应 ②取代: 甲烷 CH4 全 部 正四面 单键, CH4+Cl2 体 较 稳 CH2Cl2+Cl2 定 CH3Cl+HCl CHCl3+HCl CH3Cl+Cl2 CHCl3+Cl2 CH2Cl2+HCl CCl4+HCl
有机化合物的结构与性质

有机化合物的结构与性质有机化合物是由碳和氢元素以及其他非金属元素构成的化合物。
它们在自然界中广泛存在,是生命体的基本构成单元。
有机化合物的结构对其性质具有决定性影响,包括物理性质和化学性质。
一、有机化合物的结构1.碳骨架结构有机化合物的主要特征是碳骨架结构,碳原子可以通过共价键形成直线、分支、环状等多种结构。
根据所含的碳原子数目,有机化合物可分为烷烃、烯烃、炔烃、芳香烃等。
2.官能团有机化合物中常出现官能团,它是一个或多个原子团,决定了化合物的化学性质。
常见的官能团包括羟基、羰基、羧基、胺基等。
官能团的存在使得有机化合物具有一定的化学反应性。
3.立体化学有机化合物的结构还涉及立体化学,包括立体异构体和手性。
其中,立体异构体是同分子式但结构不同的化合物,手性则指分子镜像不可重叠,具有非对称中心的特性。
二、有机化合物的性质1.物理性质有机化合物的物理性质主要与其分子结构相关。
例如,分子量较大的有机化合物具有较高的沸点和熔点,短链的烷烃具有较低的沸点和熔点。
此外,有机化合物还具有溶解性、密度、光学性质等。
2.化学性质有机化合物的化学性质主要由其分子结构和官能团决定。
不同的官能团对应不同的化学反应。
例如,烃类在充足氧气条件下可以燃烧,产生二氧化碳和水;醇类可以发生酸碱反应等。
3.活性有机化合物通常具有较高的活性。
这是由于碳原子能与其他原子形成多种共价键,从而增加了反应的可能性。
有机化合物的活性不仅使其成为合成化合物的重要基础,也使其具有广泛的应用价值,例如用作药物、材料等。
结论有机化合物的结构与性质紧密相关。
通过对有机化合物的结构进行分析,我们能够了解其物理性质和化学性质,为实际应用提供依据。
有机化合物在日常生活中扮演着重要的角色,深入研究其结构与性质对于促进科学发展和推动技术创新具有重要意义。
有机物的结构和性质
有机物的结构和性质有机物是指由碳原子和氢原子以及其他一些元素构成的化合物。
它们在自然界和人类生活中有着极其重要的地位,广泛存在于生物体内和环境中。
有机物的结构和性质具有多样性和复杂性,以下将从分子结构、化学键、官能团以及物理性质等几个方面进行探讨。
一、分子结构有机物的分子结构通常由碳原子骨架和连接在骨架上的官能团组成。
碳原子具有四个价电子,可以与其他原子或官能团形成共价键。
根据碳原子骨架的不同,有机物可以分为链状、环状和支链等不同结构类型。
链状有机物是最简单的结构,如甲烷(CH4)和乙烷(C2H6)。
环状有机物由碳原子形成环状结构,如苯环(C6H6)。
支链有机物在链状结构上连接了其他官能团,如异丙基(CH3CHCH3)。
二、化学键有机物中常见的化学键包括共价键、极性键和芳香键。
共价键是由两个非金属元素共用电子对形成的化学键,是最常见的化学键类型。
极性键是由两个不同元素之间的电子云分布不均匀而形成的化学键,具有部分离子性。
芳香键是苯环中相邻的π电子共轭系统形成的特殊化学键,具有稳定性和共轭性。
三、官能团官能团是有机物分子中具有特定化学性质和功能的基团。
常见的官能团包括羟基(-OH)、胺基(-NH2)、羰基(C=O)和羧基(-COOH)等。
官能团的存在决定了化合物的化学性质和反应性。
四、物理性质有机物的物理性质受分子大小、分子量、分子极性以及分子间作用力等因素的影响。
其中,分子大小和分子量决定了有机物的相态(例如固体、液体或气体)和沸点、熔点等物理性质。
分子极性则影响有机物的溶解性和极性反应性。
此外,分子间作用力包括弱键、范德华力、氢键等,也会对有机物的物理性质产生重要影响。
总结起来,有机物的结构和性质是相互关联的。
它们的多样性和复杂性使得有机化学成为一门广泛研究的学科,为人类社会提供了丰富的化学物质基础,也为生命科学和药物研发提供了重要支持。
对有机物结构和性质的深入了解,有助于我们更好地探索和利用这些重要的化合物。
常见有机物结构和性质
模块五常见有机物结构和性质一、甲烷、乙烯、乙炔和苯的分子组成、结构特征、主要性质有机物分子组成结构特征主要化学性质甲烷CH4饱和烃,正四面体,易取代:CH4+Cl2――→光CH3Cl+HCl;难氧化,不能使酸性高锰酸钾溶液褪色;燃烧时产生明亮淡蓝色火焰,CH4+2O2――→点燃CO2+2H2O。
乙烯C2H4不饱和烃,平面结构,CH2===CH2易加成:CH2==CH2+Br2→CH2BrCH2Br;易氧化:使酸性KMnO4溶液褪色;燃烧时,火焰明亮伴有黑烟,C2H4+3O2――→点燃2CO2+2H2O。
乙炔C2H2不饱和烃,直线形结构,CH≡CH 易加成:CH≡CH+Br2→CHBr==CHBr,CHBr==CHBr+Br2→CHBr2CHBr2;易氧化:使酸性KMnO4溶液褪色;燃烧时,火焰明亮伴有浓黑烟,2C2H2+5O2――→点燃4CO2+2H2O。
苯C6H6平面结构,碳碳键是介于单键和双键之间的独特的键,易取代:+HNO3――→浓H2SO455~60 ℃+H2O;能加成、难氧化;燃烧时,火焰明亮伴有浓黑烟,2C6H6+15O2――→点燃12CO2+6H2O。
二、石油的分馏、裂化、裂解的主要原理及产物三、煤的气化、液化和干馏的主要原理及产物四、乙醇、乙醛和乙酸的分子组成、主要性质2CH 3CH 2OH→2CH 3CH 2ONa +H 2↑; ②催化氧化生成乙醛:2CH 3CH 2OH +O 2――→Cu △2CH 3CHO +2H 2O ;③酯化反应:(见乙酸的性质)成乙酸:2CH 3CHO +O 2――→催化剂△2CH 3COOH ;③与银氨溶液水浴生成银镜(银镜反应):CH 3CHO +2Ag(NH 3)2OH2Ag↓+CH 3COONH 4+3NH 3+H 2O ;④与新制Cu(OH)2悬浊液反应生成砖红色沉淀:CH 3CHO +2Cu(OH)2+NaOH Cu 2O↓+CH 3COONa +3H 2O 。
(完整版)【非常详细】有机化学知识点归纳
有机化学知识点归纳一、有机物的结构与性质1 、官能团的定义:决定有机化合物主要化学性质的原子、原子团或化学键。
原子: —X官能团 原子团(基): —OH 、—CHO (醛基) 、—COOH (羧基) 、C 6H 5— 等化学键: C=C 、—C≡C—2、常见的各类有机物的官能团,结构特点及主要化学性质(1)烷烃A) 官能团:无 ;通式: C n H 2n+2;代表物: CH 4B) 结构特点:键角为 109°28′,空间正四面体分子。
烷烃分子中的每个 C 原子的四个价键也都如此。
C) 物理性质: 1.常温下,它们的状态由气态、液态到固态,且无论是气体还是液体,均为无色。
一般地, C1~C4 气态, C5~C16 液态, C17 以上固态。
2.它们的熔沸点由低到高。
3.烷烃的密度由小到大,但都小于 1g/cm^3 ,即都小于水的密度。
4.烷烃都不溶于水,易溶于有机溶剂D) 化学性质:①取代反应(与卤素单质、在光照条件下)CH 4 + Cl 2 CH 3Cl + HCl , CH 3Cl + Cl 2 CH 2Cl 2 + HCl ,……。
点燃②燃烧 CH 4 + 2O 2 CO 2 + 2H 2O高温C 16H 34 催化剂C 8H 18 + C 8H 16加热、加压④烃类燃烧通式: C x H t + (x +y )O 2 点———燃 xCO 2 + y H 2O 4 2⑤烃的含氧衍生物燃烧通式 : C x H y O z + (x +y - z )O 2 点———燃 xCO 2 + yH 2O 4 2 2E) 实验室制法:甲烷: CH 3 COONa + NaOHOCH 4 个 +Na 2 CO 3△注: 1.醋酸钠:碱石灰=1: 3 2.固固加热 3.无水(不能用 NaAc 晶体) 4.CaO :吸水、稀释 NaOH 、不是催化剂(2)烯烃:A) 官能团: C=C ;通式: C n H 2n (n≥2);代表物: H 2C=CH 2B) 结构特点:键角为 120° 。
有机物基础知识总结
有机物基础知识总结有机物是由碳元素构成的化合物,其在自然界中广泛存在并具有广泛的应用。
本文将总结有机物的基础知识,包括有机物的组成、结构、性质以及其在生活中的应用。
一、有机物的组成有机物通常由碳、氢和其他少量元素(如氧、氮、硫等)构成。
碳是有机化合物的主要组成元素,其特殊的电子结构使得碳原子具有形成巨大多样性有机分子的能力。
二、有机物的结构有机物的结构可以分为线性、分支和环状结构。
线性结构是指碳原子按照直线排列的结构,例如甲烷(CH4)。
分支结构是指碳原子之间存在分支连接的结构,例如异丙基(CH(CH3)2)。
环状结构是指碳原子形成环状排列的结构,例如苯环(C6H6)。
三、有机物的性质1. 燃烧性:有机物在适当的条件下能燃烧,并释放出能量和二氧化碳。
例如,乙醇(CH3CH2OH)在火焰中被完全氧化产生二氧化碳和水。
2. 溶解性:有机物通常具有较好的溶解性,尤其是在有机溶剂中。
由于有机物中常含有极性官能团(如羟基、胺基等),使得其能够与溶剂形成氢键或其他相互作用力。
3. 反应活性:有机物常常具有较高的反应活性,可以进行各种各样的化学反应。
例如,醇可以和酸反应生成酯类物质。
四、有机物的应用1. 药物:有机合成药物广泛应用于医学领域,可以治疗各种疾病。
例如,阿司匹林是一种常用的非处方药,用于缓解头痛和退热。
2. 塑料:有机物的聚合反应可用于制备各种塑料。
塑料在日常生活中得到广泛应用,如聚乙烯用于制作塑料袋,聚丙烯用于制作塑料家具等。
3. 燃料:有机物可以被用作能源来源,如石油中的烃类化合物可用于汽车燃料。
此外,生物质燃料也是一种可再生的有机物燃料。
4. 农药和化肥:有机合成的农药和化肥被广泛用于农业生产中,用于提高农作物的产量和质量。
总结:有机物是由碳元素构成的化合物,其具有多样性的结构和性质。
有机物在生活中有着广泛的应用,包括药物、塑料、燃料等。
通过对有机物基础知识的了解,我们可以更好地理解和应用有机化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第10 题常见有机物的结构与性质题组一常见有机物的性质及应用[ 解题指导]1.掌握两类有机反应类型(1) 加成反应:主要以烯烃和苯为代表,碳碳双键、苯环可以发生加成反应。
(2) 取代反应:烷烃、苯、乙醇和乙酸均容易发生取代反应。
2.区分三个易错问题(1) 不能区分常见有机物发生反应的反应类型。
如塑料的老化发生的是氧化反应,不是加成反应,单糖不能发生水解反应等。
(2) 不能灵活区分有机反应的反应条件。
如苯与溴水不反应,只与纯液溴反应。
(3) 不能准确地对有机物进行分类。
如油脂不是高分子化合物。
3.牢记三种物质的特征反应(1) 葡萄糖:在碱性、加热条件下与银氨溶液反应析出银;在碱性、加热条件下与新制氢氧化铜悬浊液反应产生砖红色沉淀。
(2)淀粉:在常温下遇碘变蓝。
(3) 蛋白质:浓硝酸可使蛋白质变黄,发生颜色反应。
4.同分异构体判断时必记的三个基团丙基(C3H 7 —)有2种,丁基(C4 H 9—)有4种,戊基(C5H11 —)有8种。
[挑战满分](限时10 分钟)1 .下列涉及有机物的性质的说法错误的是( )A •乙烯和聚氯乙烯都能发生加成反应-可编辑修改-B .将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色C .黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了D • HNO 3能与苯、甲苯、甘油、纤维素等有机物发生反应,常用浓硫酸作催作剂 答案 A取代,甘油、纤维素中存在 一OH ,能与HNO 3发生取代反应,而这两种取代反应均需浓硫酸作催化剂。
2 .下列说法中不正确的是 ()A •有机化合物中每个碳原子最多形成4个共价键B .油脂、淀粉、蛋白质在一定条件下都能发生水解反应C .用溴水既可以鉴别甲烷和乙烯,也可以除去甲烷中的乙烯D .乙烯和苯均能发生氧化反应,说明乙烯和苯分子中均有碳碳双键 答案 D解析 苯分子没有碳碳双键,苯的燃烧是苯的氧化反应,与分子中是否含有碳碳双键无关, D 项错误。
3 .有机化合物与我们的生活息息相关,下列说法正确的是( )A .甲苯的硝化、油脂的皂化均可看作取代反应B .蛋白质水解生成葡萄糖,放出热量,提供生命活动的能量C .石油裂解的目的是为了提高轻质液体燃料的产量和质量D .棉花和合成纤维的主要成分是纤维素解析"E-CH —CHs-Jr 1 \ / 1 c=c Cl ,其中不含/ \A 项错误;2Cu + 02=====2Cu0 , CuO + CH 3CH 2OH ――^CH 3CH0 + Cu + H 2O , B 项,C 项正确;苯、甲苯上的一H 被一NO 2聚氯乙烯结构简式为,则不能发生加成反应,正确;CH 3CH 2OHCH 3COOH答案A解析蛋白质水解生成氨基酸, B 项错误;石油裂解的目的是为了获得更多的乙烯、丙烯等化工基本原料,C项错误;合成纤维不属于纤维素,D项错误。
4 .下列说法正确的是( )A •糖类、油脂、蛋白质在一定条件下都能发生水解反应B. 植物油的主要成分是高级脂肪酸C. 棉、麻、羊毛完全燃烧都只生成C02和H20D .乙烷的二氯取代物有两种同分异构体答案D解析A项,糖类中的单糖不能发生水解反应;B项,植物油的主要成分是不饱和高级脂肪酸的甘油酯;C项,羊毛的主要成分为蛋白质,完全燃烧时还生成氮的化合物等;D项,二氯乙烷中,两个氯原子可在同一个碳原子上,也可以在两个碳原子上,共两种结构。
5.下列说法正确的是( )A •乙烷与氯气在光照条件下发生加成反应B.将石蜡油(液态烷烃混合物)加强热分解生成的气体都是烷烃C •甲苯能够使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色D •乙醇能够被酸性的高锰酸钾溶液直接氧化成乙酸答案D解析A项,发生取代反应,错误;B项,烷烃裂解生成小分子的烯烃和烷烃,错误;C项, 甲苯能使酸性高锰酸钾溶液褪色,但不能使溴的四氯化碳溶液褪色,错误。
6 •下列与有机物的结构、性质有关的叙述正确的是()A •苯、油脂均不能使酸性KMnO 4溶液褪色-可编辑修改-B.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应C.葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体D •乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同答案C解析油脂中的不饱和高级脂肪酸的甘油酯含有碳碳双键,能使酸性KMnO 4溶液褪色,A项错误;甲烷和氯气的反应属于取代反应,乙烯和Br2的反应属于加成反应,B项错误;葡萄糖和果糖的分子式相同,但结构不同,互为同分异构体,C项正确;乙醇、乙酸中的官能团分别为羟基、羧基,D项错误。
7.下列关于苯的叙述正确的是()A •反应①为取代反应,有机产物与水混合浮在上层B. 反应②为氧化反应,反应现象是火焰明亮并伴有浓烟C. 反应③为取代反应,只生成一种产物D .反应④中1 mol苯最多与3 mol H 2发生加成反应,是因为苯分子含有3个碳碳双键答案B解析A项,反应①是苯的卤代反应,生成的溴苯不溶于水,密度比水大,故在下层;B项,反应②为苯的燃烧反应,因其含碳量高,故燃烧时伴有浓烟;C项,反应③为苯的硝化反应,属于取代反应,得到硝基苯和水;D项,反应④是苯的加成反应,但苯中不含有碳碳双键,苯分子中的碳碳键是一种介于单键和双键之间的独特的键。
8 •有机反应类型较多,形式多样。
下列反应中属于加成反应的是()①2CH 3CH2OH + 2Na —>2CH3CH2ONa + H2?催化剂② CH 2===CH 2+ H 20 ――^ C 2H 5OH-催化剂③(C 6H io 05)n (淀粉)+ n H 20――^n C 6H i2O 6(葡萄糖)D .②④答案 D选项 甲乙A 乙醇转化为乙烯乙烯与HCI 作用制备氯乙烷 B甲烷与氯气反应制备四氯化碳乙烯通入酸性KMnO 4溶液中C葡萄糖与新制Cu (OH ) 2悬浊液作用转化为葡 萄糖酸 苯与液溴反应制备溴苯D乙酸乙酯在稀硫酸存在下与水反应 乙醇与冰醋酸反应生成乙酸乙酯答案 D解析 A 中甲为消去反应,乙为加成反应;B 中甲为取代反应,乙为氧化反应;C 中甲为氧化反应,乙为取代反应; D 中两个反应都是取代反应。
10 .下列各组中的反应,属于同一反应类型的是 ( )A •乙醇和乙酸制乙酸乙酯;苯的硝化反应B. 乙烷和氯气制氯乙烷;乙烯与氯化氢反应制氯乙烷C. 葡萄糖与新制氢氧化铜共热;蔗糖与稀硫酸共热 D .乙醇和氧气制乙醛;苯和氢气制环己烷C .①③ ④B .③④+讥催化剂答案A解析乙醇和乙酸制乙酸乙酯和苯的硝化反应都属于取代反应,A项符合题意;乙烷和氯气制氯乙烷属于取代反应,乙烯与氯化氢反应制氯乙烷属于加成反应;葡萄糖与新制氢氧化铜共热属于氧化反应,蔗糖与稀硫酸共热属于水解反应;乙醇和氧气制乙醛属于氧化反应,苯和氢气制环己烷属于加成反应。
题组二有机物的结构特点和同分异构体判断[挑战满分](限时10分钟)1 .下图甲、乙表示的是两种有机化合物,对于图中表示的有机化合物的结构与性质的描述正确的是()A•表示的是同一种物质B. 甲中是否混有乙,可用加入金属钠是否产生气体进行检验C. 都能发生氧化反应D •乙表示的分子结构中含有碳碳双键答案C解析甲表示乙醇,乙表示乙酸,A项错误;乙醇和乙酸都可与钠反应放出气体,B项错误;乙酸中含有碳氧双键,不是碳碳双键,D项错误。
2 •下列有关同分异构体数目的叙述中正确的是()A •戊烷有2种同分异构体B. C8H io中只有3种属于芳香烃的同分异构体C. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种D . CH3CH2CH2CH3光照下与氯气反应,只生成1种一氯代烃答案CCH.解析A项,戊烷有3种同分异构体;B项,有CH-.4种同分异构体; C项,丙基的同分异构体有2种,所以取代苯环上的氢原子分别得到邻、间、对各3种同分异构体,共6种, 正确; D项,光照条件下的取代反应,得到2种一氯代物。
3 •下列物质在给定条件下的同分异构体数目正确的是()A . C4H10属于烷烃的同分异构体有3种B.分子组成是C5H10O2属于羧酸的同分异构体有5种C.分子组成是C4H8O属于醛的同分异构体有3种D •结构简式为的一溴代物有5种答案D解析C4H10属于烷烃的同分异构体有2种:正丁烷和异丁烷,A项错误;分子组成的C5H10O2的属于羧酸的同分异构体可写成C4H9 —COOH,丁基有4种,故属于羧酸的同分异构体有4种,B项错误;分子组成为C4H8O属于醛的有机物可写成C3H7—CHO,丙基有2种,故属于醛的同分异构体有2种,C项错误;甲基环己烷的一溴代物有5种,其取4.下列说法正确的是( )A .氟苯所有原子都处于同一平面B .聚丙烯的结构简式可表示为CH 3— CH — CH 2C .分子式为C 3H 6O 的有机物只含有一种官能团答案 A解析 苯分子中的所有原子共面, 故其中一个氢原子被氟原子取代的产物氟苯中的所有原子-Fen —CH 2i也共面,A 项正确;聚丙烯的结构简式应为丨,B 项错误;分子式为C 3H 6O的有机物,若其结构简式为 CH 2===CHCH 2OH ,则含有羟基和碳碳双键两种官能团, C 项碳碳双键之间的特殊的键,结构不相似,化学性质也不相似,D 项错误。
5 . (2015海南,5)分子式为 C 4H 10O 并能与金属钠反应放出氢气的有机物有 (不含立体异构)()A . 3种B . 4种C . 5种D . 6种 答案 B解析 分子式为C 4H 10O 并能与金属钠反应放出氢气的有机物属于醇类,因 一C 4H 9有4种同分异构体,故对应的醇也有4种同分异构体,即选 B 。
6 .分子式为C 4H 8CI 2的同分异构体有(不考虑立体异构)( )A . 7种B . 8种D . 10 种中含有独立的碳碳单键和碳碳双键,而C . 9种的结构相似,化学性质相似错误;解析碳主链为c—c—C —C时,两个Cl原子在同一个碳原子上的同分异构体为2种,两C个Cl原子在不同碳原子上的同分异构体为4种;碳主链为c—C—C时,两个Cl原子在同一个碳原子上的同分异构体为1种,两个Cl原子在不同碳原子上的同分异构体为2种,共9种。
7 •分子式为C5H12O的醇与和它相对分子质量相同的一元羧酸进行酯化反应,生成的酯共有的种数(不考虑立体异构)为()A. 15B. 16C. 17D. 18答案B解析分子式为C5H12O的醇有8种,与其相对分子质量相同的一元羧酸的分子式为C4H8O2,其同分异构体有2种,所以它们形成的酯一共有 2 X 8 = 16种,B项正确。
8 •某有机物的分子式为C4H8O2,下列有关其同分异构体数目的说法中错误的是()A •属于酯类的有4种B. 属于羧酸的有2种C. 既含有羟基又含有醛基的有3种D •存在分子中含有六元环的同分异构体答案C解析分子式为C4H8O2的酯的同分异构体有甲酸丙酯、甲酸异丙酯、乙酸乙酯、丙酸甲酯4种,A项正确;分子式为C4H8O2的羧酸的同分异构体有丁酸、2-甲基丙酸2种,B项正确;既含有羟基又含有醛基的有5种,即丁醛中除醛基外,另外三个碳原子均可单独连有羟基,2-甲基丙醛中除醛基外,另外两个甲基碳原子可连有羟基及与醛基相连的碳原子上也可以连有羟基,C项错误;通过分子式可写出含有4个碳原子和2个氧原子的六元环,D12列含有12个苯环,且有11 X 2个无氢碳原子,故其分子中含有的碳原子数为 12 X 6 = 72,氢原子数为12 X 6 — 11 X 2= 50 ,即分子式为C 72 H 50 , B 项正确。
