锰元素介绍
锰元素
生
器官中: 肌肉/p.p.m.: 0.2 - 2.3
物
血/mg dm-3 : 0.0016 - 0.075
数
日摄入量/mg: 0.4 - 10
据
骨/p.p.m.: 0.2 - 100 人(70Kg)均体内总量/mg: 12
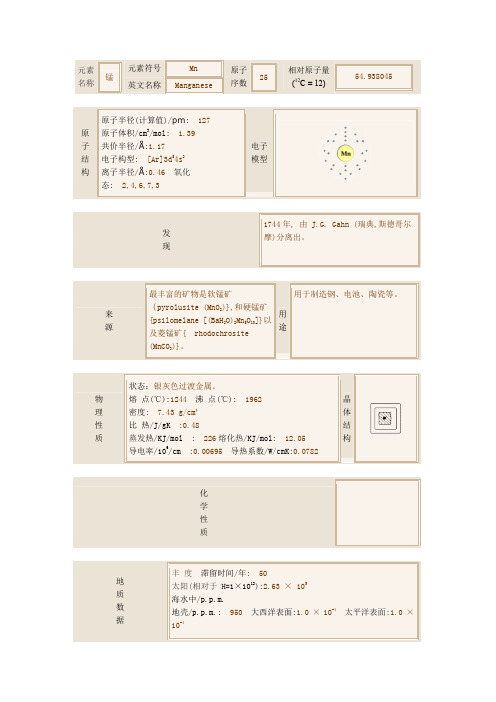
电子 模型
1744 年, 由 J.G. Gahn (瑞典,斯德哥尔
发
摩)分离出。
现
最丰富的矿物是软锰矿
用于制造钢、电池、陶瓷等。
来
{pyrolusite (MnO2)},和硬锰矿 用
源
{psilomelane [(BaH2O)2Mn5O10]}以 途
及菱锰矿{ rБайду номын сангаасodochrosite
(MnCO3)}。
元素 锰
名称
元素符号 英文名称
Mn Manganese
原子 25
序数
相对原子量 (12C = 12)
54.938045
原子半径(计算值)/pm: 127 原 原子体积/cm3/mol: 1.39 子 共价半径/Å:1.17 结 电子构型: [Ar]3d54s2 构 离子半径/Å:0.46 氧化
态: 2,4,6,7,3
地
太阳(相对于 H=1×1012):2.63 × 105
质
海水中/p.p.m.
数
地壳/p.p.m.: 950 大西洋表面:1.0 × 10-4 太平洋表面:1.0 ×
据
10-4
大气/p.p.m.(体积): 大西洋深处: 0.96 × 10-4 太平洋深 处:0.4 × 10-4
人体中含量 肝/p.p.m.: 3.6 - 9.6
状态:银灰色过渡金属。
高考--常考元素--锰、碍、铼

高考--常考元素--锰副族(锰 Mn ,锝 Tc ,铼 Re )一、物理性质:锰单质的性质:金属锰是银白色金属,粉末状的锰为灰色。
活泼金属二、化学性质:存在形态:以Mn 2+ 最稳定,而锝(Ⅱ)、铼(Ⅱ)则不存在简单离子。
22222H Mn )(2H Mn H (s)Mn(OH)O 2H Mn +→++→+++稀与氧、卤素等非金属反应:34222432MnF MnF F Mn F)(X MnX X Mn O Mn ΔO 23Mn 和−→−+≠−→−+−→−+在氧化剂存在下与熔融的碱作用:O 2H MnO 2K 3O 4KOH 2Mn 2422+−−→−++熔融锰是钢的一种重要添加剂,因为它能脱除氧和硫.制备:3MnO 2 = Mn 3O 4 + O2 (直接反应太过剧烈) 3Mn 3O 4 + 8A1 = 9Mn + 4A12O 3 三:锰的化合物Mn 的价电子构型:3d 54s 2 Mn 的氧化值呈连续状:从+2~+7。
常见氧化值:+7,+6,+4和+2。
常见化合物:KMnO 4 ,K 2MnO 4,MnO 2, MnSO 4和MnCl 2。
除MnO 2外,余者均易溶于水,含锰离子分别为:。
和,+--2244Mn MnO MnO水溶液中锰的各种离子及其性质氧化值 +7 +6 +3 +2 颜色 紫红色 暗绿色 红色 淡红色 d 电子数 d 0 d 1 d 4 d 5 存在于溶液中的条件:中性 pH >13.5 易歧化 酸性 1、Mn(VII)化合物 溶液的酸度不同,MnO4被还原的产物不同:O 3H 5SO 2Mn 6H 5SO 2MnO 2242234++−→−++-++---24222342OHSO 32MnO O H 3SO 2MnO ++−→−++---OH SO 2MnO )(OH 2SO 2MnO 224-24234++−→−++----浓O 8H CO 102Mn 6H O C 5H 2MnO 2224224++−→−++++- (2) 不稳定性 遇酸分解O H 23O 4MnO )(H 44MnO 2224++−→−++-微酸 微碱性分解O H 2O 4MnO OH 44MnO 22244++−→−+----4MnO -24MnO +362O)H (Mn +262O)H (Mn见光分解4KMnO 4 + 2H 2O = 4MnO 2↓ + 3O 2↑ + 4KOH (光照也能使其分解,因此应保存在棕色试剂瓶中) 加热22424O (s)MnO MnO K C 2202KMnO ++−−−−→−︒>A) 歧化法, 酸性介质中, 有利于歧化:3 MnO 42- +4 H + = MnO 2 + 2MnO 4- + 2H 2O 3 MnO 42- + 2 CO 2 = MnO 2 + 2 MnO 4- + 2 CO 32-在中性或弱碱性溶液中也发生歧化反应,但趋势及速率小: 3 MnO 42- + 2 H 2O = 2 MnO 4- + MnO 2 + 4 OH - (3)高锰酸钾的制备以软锰矿为原料 (MnO 2) 制备高锰酸钾,先制K 2MnO 4: 3 MnO 2 + 6 KOH + KClO 3 = 3 K2MnO 4 + KCl + 3 H 2O 从 K 2MnO 4 制 KMnO 4 有三种方法。
锰 百度百科

锰百科名片锰是一种化学元素,锰英文为Manganese,拼音为měng)。
它的化学符号是Mn,它的原子序数是25,是一种过渡金属。
目录基本性质发现过程元素描述元素来源锰的用途相关资料锰-- 和精神科关系最密切的金属元素一、锰的生理功能二、锰的盈缺和健康三、锰的日推荐量和食物中的来源四、锰的主要食物来源有哪些?职业性慢性锰中毒诊断标准从营养学角度看锰的简介食物来源代谢吸收生理功能生理需要过量表现锰缺乏症植物中的锰基本性质发现过程元素描述元素来源锰的用途相关资料锰-- 和精神科关系最密切的金属元素一、锰的生理功能二、锰的盈缺和健康三、锰的日推荐量和食物中的来源四、锰的主要食物来源有哪些?职业性慢性锰中毒诊断标准从营养学角度看锰的简介食物来源代谢吸收生理功能生理需要过量表现锰缺乏症植物中的锰展开编辑本段基本性质元素符号:Mn元素原子量:54.94化合价:+2、+3、+4、+6和+7元素类型:金属元素体积弹性模量:120(GPa)原子化焓:280.3 (kJ /mol @25℃)热容:26.32 J /(mol· K)导电性:0.0069510^6/(cm ·Ω )原子体积:7.39(立方厘米/摩尔)锰(5张)元素在太阳中的含量:10(ppm)元素在海水中的含量:太平洋表面:0.0001(ppm)地壳中含量:950(ppm)质子数:25中子数:30相对原子质量:55原子序数:25所属周期:4所属族数:VIIB电子层分布:2-8-13-2氧化态及代表物质[1]:主要:Mn+2 Mn2+ K4[Mn(CN)6]其它:Mn-3 Na3[Mn(CO)4]Mn-1 Na[Mn(CO)5]Mn0 Mn Mn2(CO)10 K6[Mn(CN)6]Mn+1 K5[Mn(CN)6]Mn+3 MnF3 K3[Mn(CN)6]Mn+4 MnO2 K2[MnF6] MnF4Mn+5 Na3MnO4Mn+6 MnO42-Mn+7 MnO4- MnO3F晶体结构:晶胞为体心立方晶胞,每个晶胞含有2个金属原子。
锰
锰锰,化学符号是Mn,它的原子序数是25,灰白色,是一种过渡金属,性坚而脆,潮湿处会氧化。
1774manganese(锰)。
锰可用铝热法还原软锰矿制得。
外围电子层排布:3d5 4s2电子层分布:2-8-13-2化合价:+2、+3、+4、+6和+7晶体结构:晶胞为体心立方晶胞,每个晶胞含有2个金属原子。
锰在元素周期表上位于第四周期,第VIIB族,属于比较活泼的金属,加热时能和氧气化合,易溶于稀酸生成二价锰盐。
常见化合价:+2,+4,+7,+6+3价的锰和+6价的锰均比较容易发生歧化反应:2Mn3++2H2O ══Mn2++MnO2↓+4H+3MnO42-+4H+══2MnO4-+MnO2↓+2H2OMn较稳定,不容易被氧化,也不容易被还原。
MnO4和MnO2有强氧化性。
在碱性溶液中,Mn(OH)2不稳定,易被空气中的氧气氧化为MnO2;MnO4也能发生歧化反应,但反应不如在酸性溶液中进行得完全。
下面列出部分其化合价对应的化合物:Mn-3:Na3[Mn(CO)4] Mn-1:Na[Mn(CO)5] Mn0:MnMn2(CO)10,K6[Mn(CN)6] Mn+1:K5[Mn(CN)6] Mn+2:MnO ,二价锰盐Mn+3:MnF3,K3[Mn(CN)6]Mn+4:MnO2 ,K2[MnF6] ,MnF4 Mn+5:Na3MnO4Mn+6:MnO42- Mn+7:MnO4-,MnO3F ,KMnO4在空气中易氧化,生成褐色的氧化物覆盖层。
它也易在升温时氧化。
氧化时形成层状氧化锈皮,最靠近金属的氧化层是MnO(一氧化锰),而外层是Mn3O4(四氧化三锰):2Mn+O2══2MnO3Mn+2O2══Mn3O4在高于800℃的温度下氧化时,MnO的厚度逐渐增加,而Mn3O4层的厚度减少。
在800度以下出现第三种氧化层Mn2O2。
在约450℃以下最外面的第四层氧化物MnO2是稳定的。
锰和铁化学性质相似,常温与水反应缓慢,当自身高温时,反应迅速,水变为氢气,锰被氧化,形成复杂氧化物:Mn+H2O ══Mn3O4+H2↑(高温)锰易溶于稀酸,并有氢气放出,生成二价锰离子:锰和浓硫酸、浓硝酸等氧化性酸反应生成二氧化硫、二氧化氮,自身被氧化成二价锰:Mn+H2SO4══MnSO4+H2↑Mn+2H2SO4══MnSO4+2H2O+SO2↑Mn+4HNO3══Mn(NO3)2+2H2O+2NO2↑锰和锰矿是有些极大的分别的。
锰元素存在形式

锰元素在自然界中主要以以下几种化合物形式存在:
1. 氧化物:
- 二氧化锰(MnO2),是常见的锰矿物之一,例如出现在软锰矿和黑锰矿中。
- 四氧化三锰(Mn3O4),这种形式的锰氧化物存在于某些锰矿石中。
2. 碳酸盐:
- 碳酸锰(MnCO3),在自然界中以菱锰矿的形式存在。
3. 氢氧化物:
- 氢氧化锰—氧化锰矿石,这类矿石中含有不同比例的氢氧化锰(Mn(OH)2)和氧化锰。
4. 硫化物:
- 在一些情况下,锰还以硫化物形式存在,如硫化锰(MnS),虽然它们在自然界的分布不如氧化物和碳酸盐常见。
5. 其他复合矿石:
- 还有各种混合型的矿石,如氧化锰—碳酸锰矿石、硫化锰—氧化锰矿石等。
此外,在高温或特定条件下,锰还可以形成金属态的同素异形体,包括α-Mn、β-Mn、γ-Mn等。
不过在自然环境中,这些纯金属形态并不常见,而是在工业冶炼过程中可以得到。
锰元素的作用

锰元素的作用锰是一种重要的金属元素,广泛存在于地壳中。
它的化学性质非常活泼,能与许多元素形成化合物。
锰在自然界中主要以矿石的形式存在,包括菱锰矿、辉锰矿等。
锰元素具有多种重要的作用,对人类和环境都具有重要意义。
首先,锰在生物体中起到了重要的作用。
它是人体内多种酶的组成部分,参与了许多重要的生物化学反应。
例如,锰对于脂肪和碳水化合物的代谢以及骨骼的正常生长起着重要作用。
锰还参与了神经传导、免疫功能以及抗氧化过程等,对于维持人体的正常生理功能非常重要。
其次,锰在钢铁生产中扮演着重要的角色。
钢铁中添加适量的锰能够提高钢铁的强度和韧性,同时显著改善钢铁的可铸性和耐蚀性。
锰也被用于生产锰钢,锰钢具有极高的强度和硬度,广泛应用于制造机械零件、铁道和桥梁等重要结构。
此外,锰还被用于制造武器和军事设备,在军事工业中具有重要地位。
此外,锰还具有重要的环境作用。
它可以被用作土壤修复剂,用于改善受污染的土壤中的重金属含量。
锰还可以用于水处理,起到去除水中有害物质和重金属的作用。
锰离子可以氧化甘油醇,使其转化为无害的酮醇,从而用于净化废水和污染物的处理。
最后,锰还被用于制造一些重要的化学品和产品。
例如,锰酸钾是一种重要的化学氧化剂,在有机合成中广泛使用。
锰盐可以用于制备染料、颜料和漂白剂,被广泛应用于纺织、造纸、皮革和印刷等工业中。
锰也可以用于催化剂的制备,促进一些重要的化学反应的进行。
综上所述,锰作为一种重要的金属元素,具有多种重要的作用。
它在人体内起到了重要的生物学功能,对于人体的生理活动至关重要。
锰在钢铁生产中发挥着重要的作用,提高了钢铁材料的性能。
同时,锰在环境修复和废水处理中也具有重要的作用。
锰还被用于制造一些重要的化学品和产品,广泛应用于各个行业。
通过充分发挥锰的作用,可以为人类的生产生活带来更多便利与进步。
锰

符号:Mn 符号:Mn 原子序数:25 原子序数:25 价电子层结构:3d 价电子层结构:3d54s2 属于第4周期、 族元素。 Mn 属于第4周期、第Ⅷ族元素。
Mn
常见的价态:+ 、+ 、+7 常见的价态:+2、+ 、+ :+ 、+4、+ 也可见:+ 、+ 、+6 也可见:+1、+ 、+ :+ 、+3、+ 天然稳定的放射性核素,有三种同素异形体。 天然稳定的放射性核素,有三种同素异形体。 锰最重要矿是软锰矿; 锰最重要矿是软锰矿;近年来在深海发现大量的 锰矿——锰结核。 锰结核。 锰矿 锰结核
[接触机会] 接触机会]
锰矿开采、运输、加工、电池、锰中毒通 常只限于采矿和精炼矿石的人,长期接触 锰可引起类似帕金森综合征或Wilson病那 锰可引起类似帕金森综合征或Wilson病那 样的神经症状. 样的神经症状.
来源:食物、 来源:食物、水、空气 茶叶、蔬菜、谷物、 茶叶、蔬菜、谷物、牛奶 吸收:在胃液溶解度低,主要经十二指肠吸收; 吸收:在胃液溶解度低,主要经十二指肠吸收; 职业接触者,呼吸道为主; 职业接触者,呼吸道为主; 仅有机锰可经皮肤吸收。 仅有机锰可经皮肤吸收。
锰
分布于所有器官和组织, 分布于所有器官和组织,肝脏和胰腺最丰富 血液 红细胞 80%-90% 80%-90% %-90
锰广泛分布于生物圈内,但是人体内含量甚微。成年人体内锰的总 量约为200-400umol,分布在身体各种组织和体液中。骨、肝、胰、 肾中锰浓度较高;脑、心、肺和肌肉中锰的浓度低于20nmol/g;全 血和血清中的锰浓度分别为200nmol/L和20nmol/L。锰在线粒体中的 浓度高于在细胞浆或其它细胞器中的浓度,所以线粒体多的组织锰 浓度较高。在1913年已经知道锰是动物组织的成分之一,但从1931 年才陆续在多种实验动物中发现缺锰的表现,从而确认锰是动物的 必需微量元素之一。
锰及锰矿石性能介绍

锰及锰矿石性能介绍(编者:梅虹)一.锰的基本知识1.简要说明——金属锰,是化学元素周期表中第四周期的第七族元素,原子量为54.94,元素符号为Mn,英文名称为“manganese”,在1774年由瑞典的甘恩,用软锰矿和木炭在坩埚中共热,发现一纽扣大的锰粒,由此发现了锰。
锰为银白色金属,质坚而脆。
密度7.20g/cm3,熔点1244+3℃,沸点1962℃。
化合价+2、+3、+4、+6和+7。
其中以+2价(Mn2+的化合物)、+4价(二氧化锰,为天然矿物)和+7价(高锰酸盐,如KMnO4)为稳定的氧化态,在固态状态时它以四种同素异形体存在。
锰的电离能为7.435电子伏特,在空气中易氧化,生成褐色的氧化物覆盖层。
它也易在升温时氧化,氧化时形成层状氧化锈皮,最靠近金属的氧化层是MnO,而外层是Mn3O4。
在高于800℃的温度下氧化时,MnO的厚度逐渐增加,而Mn3O4层的厚度减少。
在800度以下出现第三种氧化层Mn2O2。
在约450℃以下最外面的第四层氧化物MnO2是稳定的。
能分解水且溶于稀酸,并有氢气放出,生成二价锰离子。
锰在加热条件下,粉状的锰与氯、溴、磷、硫、硅及碳元素都可以化合。
锰在地球岩石圈中以及硅酸盐相的陨石中表现有强烈的亲石性质,但在岩石圈上部则有强烈的亲氧性质,锰与铁在岩石圈中以及陨石中虽有许多相似的化学性质,但锰并不亲铁。
2.锰矿石基本分类详述锰元素广泛存在于各种矿石中,但有工业开发价值的含锰矿石则锰含量至少必须在6%以上,并统称为“某锰矿石”。
锰矿石的分类方法很多,按矿矿床成因类型分为沉积型、变质型、风化型等锰矿石;按矿石中的铁、锰含量分为锰矿石和铁锰矿石;按工业用途分为冶金用锰矿和化工用锰矿。
近几年,国内又提出一种以矿石工业特性为依据的新分类方法。
此外,还有一种按矿物的自然类型和所含伴生元素分为碳酸锰矿石、氧化锰矿石、混合型矿石及多金属矿石。
本方法是对锰矿石的类基本上是采用公认的按矿物的自然类型和所伴生元素的分类方法,其详细分类如下:碳酸锰矿石:是指矿石中所含以各种碳酸盐锰矿物形态存在的锰,其含量占矿石中锰含量总量的85%以上者。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
锰
锰是一种化学元素,原子序数是25,是一种过渡金属。
元素符号:Mn元素原子量:54.94
物化性质
银白色金属,质地坚而脆。
密度7.20克/立方厘米。
熔点1244℃,沸点2097℃。
化合价+2、+3、+4、+6和+7。
其中以+2(Mn2+的化合物)、+4(二氧化锰,为天然矿物)和+7(高锰酸盐,如KMnO4)、+6(锰酸盐,如K2MnO4)为稳定的氧化态。
锰的生理作用
锰(Mn)是几种酶系统包括锰特异性的糖基转移酶和磷酸烯醇丙酮酸羧激酶的一个成分,并为正常骨结构所必需。
其摄入量差别很大,主要取决于是否食入含量丰富的食品,如非精制的谷类食物,绿叶蔬菜和茶。
此微量元素的通常摄入量为每天2~5mg,吸收率为5%~10%。
成年人每日锰供给量为每千克体重0.1 mg。
食物中茶叶、坚果、粗粮、干豆含锰最多,蔬菜和干鲜果中锰的含量略高于肉、乳和水产品,鱼肝、鸡肝含锰量比其肉多。
一般荤素混杂的膳食,每日可供给5毫克锰,基本可以满足需要。
当正常人出现体重减轻、性功能低下、头发早白可怀疑锰摄入不足。
锰的生理功能可概括如下:
1.可促进骨骼的生长发育。
2.保护细胞中细粒体的完整。
3.保持正常的脑功能。
4.维持正常的糖代谢和脂肪代谢。
5.可改善肌体的造血功能。
锰的危害
在生产中,锰是应用很广的几种金属之一,近年来,出现了多起关于锰中毒的报
道。
职业性锰中毒是由于长期吸入含锰深度较高的锰烟及锰尘而致,慢性锰中毒是职业锰中毒的主要类型。
多见于锰铁冶炼、电焊条的制造与电焊作业以及锰矿石的开采、粉碎、染料或干电池的生产等作业的工人。
职业性慢性锰中毒是长期接触锰的烟尘所引起的以神经系统改变为主的疾病。
早期表现为神经衰弱综合征和植物神经功能紊乱。
中毒较明显时,出现锥体外系损害,并可伴有精神症状。
严重时可表现为帕金森氏综合征和中毒性精神病。
根据职业性慢性锰中毒诊断标准,
具有头晕、头痛、容易疲乏、睡眠障碍、健忘等神经衰弱综合征的表现,以及肢体疼痛、下肢无力和沉重感等症状。
若再有下列情况之一者,可列为观察对象:
a)有多汗、心悸等植物神经功能紊乱的表现;
b)尿锰或发锰超过本地区正常值上限。
轻度中毒
除上述症状外,具有下列情况之一者,可诊断为轻度中毒:
a)肯定的肌张力增高;
b)肌张力增高虽不肯定,但手指有明显震颤,腱反射亢进;并有容易兴奋、情绪不稳定、对周围事物缺乏兴趣等精神情绪改变。
重度中毒
具有以下情况之一者,可诊断为重度中毒:
a)明显的锥体外系损害
表现为帕金森氏综合征:四肢肌张力增高,伴有静止性震颤,可引发出齿轮样强直;并可出现对指或轮替试验不灵活、不准确,闭目难立征阳性,言语障碍,或步态异常、后退困难等运动障碍。
b)中毒性精神病
有显著的精神情绪改变,如感情淡漠、反应迟钝、不自主哭笑、强迫观念、冲动行为等。
早期可用金属络合剂如依地酸二钠钙等治疗,并适当给予对症治疗。
出现明显的锥体外系损害或中毒性精神病时,治疗原则与神经精神科相同;对观察对象,六个月至一年复查一次,进行动态观察,并根据病情发展趋势,适当处理。
凡诊断为锰中毒者,包括已治愈的病人,不得继续从事锰作业。
轻度中毒者治愈后可安
排其它工作;重度中毒者需长期休息。
预防措施
针对工业锰中毒,我们可以从一下几个方面进行工作。
♦控制车间浓度
♦生产环境和设备
♦工艺改进或改造
♦养成良好的个人卫生习惯
♦企业加强培训,让职工了解到锰毒的危害
♦企业组织定期检查
具体来说,矿山开采、爆破、粉碎、筛选等过程用湿式作业,如水风钻进行钻孔、水封爆破、喷雾降尘减少粉尘飞扬;车间采取机械通风或自然通风,减少空缺陷中锰尘浓度;焊剂、焊条、蓄电池生产过程中拌料、过筛等,采取密闭和吸尘装置,避免锰尘飞扬;加强个人防护,戴滤膜口罩,饭前注意清洗,不在车间内吃东西、吸烟,下班后进行沐浴再回家;加强作业工人的职业卫生知识培训提高职工的自我防护意识和能力;定期开展现场职业病危害因素检测与评价,发现问题,及时解决;定期组织职工做好职业性健康监护,如半年或一年一次检查,以早发现、早诊断、早治疗中毒病人。
事故案例
在2006 年5 月份的职业性健康查体中发现某机械厂铆焊车间5 名行车女工均有不同程度的慢性锰中毒表现,随后送泰安市职业病防治院诊治。
刘某、王某等5 人均是某机械厂铆焊车间行车女工。
年龄及工龄情况:女工1,28岁,工龄8年;女工2,32 岁,工龄9年;女工3,36岁,工龄13年;女工4,38 岁,工龄15年;女工5,39岁,工龄15 年。
平均年龄34岁,平均工龄12年。
5 人入厂前均健康,近2~3年开始出现不同程度的头晕、头痛、疲乏、多梦、健忘等神经衰弱综合征,感觉日渐加重,伴有多汗、心悸、双下肢沉重感,主诉夜间常发生腓肠肌痉挛现象,查体:体温正常,心率85~92 次/ min,律整,3 人伴有明显的手指和眼睑震颤,腱反射明显亢进,病理反射均为引出,1人肌胀力增高明显,其余肌胀力无明显增高。
实验室检查: 血常规、尿常规均在正常范围,
肝功正常,尿锰测定为0.08~0.35 mg/ L,高于国内报告的正常人尿锰的含量0.002~0.005 mg/ L。
心电图检查有2人呈窦性心律不齐,肺部X 光显示有3 人肺纹理增重,送泰安市职业病医院,根据GBZ 3- 2006 职业性慢性锰中毒诊断标准,女工3、女工4、女工5被诊断为职业性慢性轻度锰中毒,女工1、女工2被诊断为锰中毒观察对象,按慢性锰中毒治疗原则处理,均有不同程度的好转。
对现场进行职业卫生调查后,发现车间建于70 年代,两部行车,门窗无玻璃密封,车间高约5 m,设有天窗(半数关闭),无局部通风排尘装置,无换风扇,以锰铁焊条为主进行焊接,无固定焊接位置,无职业卫生操作规程。
车间共有职工43人,男性36人,铆焊工,年龄20~45岁,平均34岁,工龄2~20 年,平均15 年,无慢性锰中毒者。
女性7 人,行车工,年龄25~39岁,平均32岁,工龄8 ~17年,平均工龄1 年。
3人被诊断为慢性轻度锰中毒。
根据市疾病控制中心2004~2006年对该单位铆焊车间作业岗位的检测资料可知,电焊作业岗位空气中短时间电焊烟尘的浓度为28~35 mg/ m3,行车工操作岗位(驾驶室内)短时间电焊烟尘的浓度为42~78 mg/ m3,高于电焊操作岗位。
对个人防护与职业卫生培训调查后知,电焊工人均配有防护面罩和防护眼镜,行车女工无防尘(或防毒)口罩,所有职工均未进行职业卫生知识培训或健康教育,职业卫生防护知识匮乏。
讨论
1 生产工艺落后、无有效的防尘、防毒措施是造成行车女工慢性锰中毒的主要原因传统的手工焊接,以含高锰的锰铁焊条为主要原料,致使产生的电焊烟光含有大量的锰化合物,车间内无有效的通风排尘、毒设施,产生的大量烟尘不能及时排出,车间内空气中电焊烟尘的浓度超过国家职业卫生标准,尤其是行车驾驶室内最高达78 mg/ m3,长期在这样的环境中工作(行车工平均工龄13 年),吸入了大量的含锰化合物烟尘,导致行车女工发生了慢性轻度锰中毒。
2 职业卫生知识匮乏、个人防护差也是引起这次中毒的一个重要原因调查发现,该厂从未对职工进行任何形式的职业卫生防护知识培训,职工的职业卫生防护知识匮乏,对电焊烟尘的危害认识不足,防护意识差,行车驾驶室门窗玻璃损坏未及时更换,工作期间未
佩戴防护用品,职业性健康查体也不及时,这些都加快了中毒事故的发生。
3 电焊作业工人未发生中毒事故与其作业岗位电焊烟尘的浓度较低、个人防护相对比较好(均有防护面罩和防护眼镜)有关电焊作业岗位烟尘的浓度低于行车作业岗位可能是车间门敞开,电焊烟尘上升由天窗向外排出而天窗敞开数量少,烟尘不能及时排出所致。
