酸碱盐氧化物分类
酸碱盐氧化物的概念并举例

酸碱盐氧化物的概念并举例酸碱盐氧化物是一类重要的日常化学化合物,它们可以从影响我们生活和社会活动、工业中的诸多应用中看出其重要性。
那么,什么是这类化合物?它们又有什么特性?本文将对酸碱盐氧化物进行深入地剖析,并以一些具体实例来说明这类化合物的概念和特性。
首先要认识酸碱盐氧化物,需要明确它们的定义。
酸碱盐氧化物,也可以称为“加成性离子化合物”,其特征是氧原子由碱或酸中的一部分原子衍生,结果形成一个具有离子性质的化合物。
换句话说,这类化合物是由一个或多个带有正电荷离子(如氯离子、钾离子)和负电荷离子(如碳酸根)组成的化合物。
需要指出的是,酸碱盐氧化物的特质特性受到原子配位的影响,即该离子的配位性质。
要明白这一点,我们需要知道酸碱盐氧化物在氧化剂和受体之间的作用,以及它们之间的交互反应。
基本上,在酸碱盐氧化物的作用下,受体中的氧原子有可能会被氧化剂中的氧原子所替代,并形成新的离子,以及新的化合物。
要说明酸碱盐氧化物的概念,一些实例可以作为参考。
比如,氢氧化钠(NaOH)是一种重要的酸碱盐氧化物,它是由氢离子和碳酸根离子组成的化合物,结构表示如下:Na+ + OH- 。
同样,氯化钠(NaCl)也是一种重要的酸碱盐氧化物,它是由氯离子和碳酸根离子组成的化合物,结构如下:Na+ + Cl- 。
此外,硝酸盐是一种重要的酸碱盐氧化物,它是由两个元素氮和氧组成的混合物。
它主要由三种离子组成:氮离子(NO3-)、氯离子(Cl-)和钾离子(K+)。
硝酸盐的表示如下:NO3- +Cl- + K+ 。
最后,醋酸(CH3COOH)也是一种重要的酸碱盐氧化物,它是由两个元素碳和氧组成的混合物,其结构如下:H3COO- + H+ 。
总之,酸碱盐氧化物是一类重要的日常化学化合物,它们由一个或多个带有正电荷离子和负电荷离子组成的化合物,它们的性质特征受到原子配位的影响,它们是由氧化剂和受体之间的作用,以及它们之间的交互反应形成的。
高一化学酸碱盐知识点总结

高一化学酸碱盐知识点总结化学酸碱盐分类酸:定义:电离时生成的阳离子全部(唯一)是H+的化合物分类:1. 按照在水溶液中是否能完全电离强酸:HCI HBr HI HNO3 H2SO4 HMnO4 HCI04(高氯酸)弱酸:HClO (次氯酸)HF CH3COOH H2SO3 H2S H3PO4 H2CO32. 根据一分子酸可电离出的氢离子的个数一元酸:HCI HBr HI HNO3 HMnO4 HCIO4 HCIO HFCH3COOH二元酸:H2SO4 H2SO3 H2S H2CO3三元酸:H3PO43. 根据酸根中是否含氧含氧酸:HNO3 H2SO4 HMnO4 HCI04 HCIO H2SO3 H3PO4CH3COOH H2CO3无氧酸:HCI HBr HI HF4. 根据水溶性可溶性酸:除硅酸外的其他酸,如:HCI H2SO4 HMnO4 CH3COOH 难溶性酸:H2SQ3 (硅酸)5. 根据挥发性难挥发性酸:H2SO4 H3PO4挥发性酸:HCI (浓)HBr HI HNO3 (浓)HF H2SO3 H2S CH3COOH H2CO36. 根据有机物与无机物分类标准有机酸:CH3COOH无机酸:HCI HBr HI HNO3 H2SO4 HMnO4 HCIO4 HCIOHF CH3COOH H2SO3 H2S H3PO4 H2CO37按照氧化性强弱氧化性酸:H2SO4 (浓)HMnO4 HCIO4 HCIO HNO3 (稀、浓)非氧化性酸:HCI HBr H2SO4 (稀)HF H3PO4 H2CO3弱酸电离:HCIO H CIOH 2CO3 H HCO 3分步电离:2HCO 3 H CO32性质:酸的通性:1.酸能与酸碱指示剂反应,酸能使紫色石蕊试剂变红2. 酸能与金属活动性顺序中位于氢之前的活泼金属反应,生成相应的盐和氢气H 2SO4 Zn ZnSO4 H 22HCl Fe FeCl2 H 23. 酸能与碱发生反应,生成相应的盐和水Ba(OH )2 H2SO4 BaSO4 2H 2O 2Al(OH)3 3H 2SO4 Al2(SO4)3 6H 2O4. 酸能与盐反应,生成新盐和新酸CaCO3 2HCl CaCl2 CO2 H 2OBa( NO3)2 H 2SO4 BaSO4 2HNO35. 酸能与碱性氧化物反应,生成相应的盐和水CaO 2HNO3 Ca( NO 3) 2 H 2OCuO H 2SO4 CuSO4 H 2O酸的有关反应规律1. 强酸制弱酸Na2CO3(aq)S0〈少)Na2SO3 CO2 H 2S CuSO4 CuS H 2SO42. 高沸点酸制低沸点酸微热NaCl (s) H2SO4(浓) NaHSO4 HCL强热NaNO3(s) H 2SO4(浓) NaHSO4 HNO33. 易溶酸制难溶酸HCl Na2Si3 H 2SiO3 2NaCl 碱:定义:电离时生成的阴离子全部(唯一)是0H-的化合物分类:1. 根据在水溶液中是否能完全电离强碱:NaOH KOH Ba(OH)2 Ca(OH)2 弱碱:NH3?H2O Fe(OH)2 Cu(OH)2 Mg(OH)2 Mn(OH)2 Zn(OH)2 Fe(OH)3 Al(OH) 32. 根据一分子碱最多电离出的氢氧根离子的个数一元碱:NaOH KOH NH3?H2O二元碱:Ba(OH)2 Ca(OH)2 Fe(OH)2 Cu(OH)2 Mg(OH)2 Mn(OH)2 Zn(OH)2三元碱:Fe(OH)3 Al(OH) 33.根据水溶性可溶性碱:NaOH KOH Ba(OH)2 Ca(OH)2难溶性碱:Fe(OH)2 Cu(OH)2 Mg(OH)2 Mn(OH)2 Zn(OH)2 Fe(OH)3 Al(OH)3强碱电离:KOH K OHBa(OH)2 Ba2 2OH弱碱电离:4 NH3?H2O NH4 H2OFe(OH)3 Fe5 3OH性质:碱的通性:1.碱能与酸碱指示剂反应,使紫石蕊试剂变蓝,使酚酞试剂变红2.碱能与酸发生中和反应,生成相应的盐和水NaOH HCl NaCl H 2OCu(OH)2 H 2SO4 CuSO4 H 2O碱的有关反映规律:1. 强碱制弱碱(较强碱制较弱碱)3NaOH FeCl3 Fe(OH )3 3NaCl2KOH ( NH 4 )SO4 K2SO4 NH3 H 20 3NH3?H20 AlCl3 Al(OH )3 3NH 4ClNaOH与H 3PO4(物质的量之比) 1:1)NaOH H3PO4 NaH 2PO4 H2O 2:1)2NaOHH3PO4 Na2HPO4 2H 20 3:1)3NaOH H 3PO4Na3PO4 3H 2O4 碱能与酸性氧化物反应,生成相应的盐和水Ca(OH )2 CO2 (少)CaC03 H 2O2NaOH S03(少) Na2SO4 H 2O5 碱能与盐反应,生成新盐和新碱2NaOH CuSO4 Na2SO4 Cu(OH)2 Ba(OH )2 CuSO4 BaSO4 Cu(OH)2盐:定义:由金属阳离子或铵根离子与酸根离子构成的化合物叫盐分类:1?根据水溶性分为易溶盐与难溶盐钠盐、钾盐、铵盐、硝盐均为易溶盐氯化物除AgCI,硫酸盐除BaSO4 PbSO4 CaSO4等一般易溶弱酸盐除钠盐、钾盐、铵盐一般难溶(CH3C00)Ca (CH3C00)Cu 等是可溶的(CH3C00)Pb是可溶但难电离的2. 根据多兀酸遇见中和反应的程度所得的产物分为正盐:NaCI Na3PO4 CuS04 CaC03酸式盐:NaHC03 NaHP04 NaH2P04 Ca(HC03)碱式盐:CU2(0H)2C03(碱式碳酸铜)Mg(OH)CI (碱式氯化镁)酸式盐电离: 2NaHC03 Na H C03碱式盐电离:Cu2(0H )2C03 2Cu320H C0;盐的通性:仁盐能与酸反应,生成相应的盐和水2. 盐能与碱反应,生成相应的盐和水3. 盐能与盐反应,生成新盐4. 盐能与金属发生置换反应盐的有关反应规律:1. 正盐+多元酸=酸式盐心C02 Ca(0H)2 CaC03 H20C02(多)Ca(0H)2 Ca(HC03)2 ' )CaC03 C02 H20 Ca(HC03)2氧化物3 酸式盐+碱=正盐+水+碱(或正盐)碳酸氢钠溶液中滴入少量氢氧化钙溶液:Ca(0H) 2+2NaH 2O3===CaCO3 J +Na2C0 3+2H20定义:只有两种元素组成的化合物,其中一种是氧元素分类:1. 按组成分:金属氧化物:FeO MnO2 ZnO CuO Fe2O3 Fe3O4 Al 2O3 HgO CaO非金属氧化物:CO2 CO SO2 SO3 P2O5 N2O5 CI2O7 Mn 2O7 SiO2 H2O2. 按性质分:酸性氧化物:CO2 CO SO2 SO3 P2O5 N2O5 CI2O7 Mn 2O7SiO2 H2O碱性氧化物:Na2O K2O BaO CaO CuO Fe2O3两性氧化物:BeO,AI 2O3,Ga2O3 (镓),ZnO,GeO 2,Sb2O3,Bi z O s,TQ2,ZrO 2不成盐氧化物:H2O NO CO N2O NO2 N2O4 TeO ClO 2 I2O4 特殊氧化物:H2O2 Na2O2 Fe3O4酸性氧化物:与碱反应只生成盐和水的氧化物(酸酐)酸性氧化物的通性:1. 与碱反应只生成盐和水CO2+NaOH=Na2CO3+H2O2. 与碱性氧化物反应只生成盐SiO2+CaO=CaSiO33. 部分酸性氧化物溶于水得到相应的酸Mn 2O7+H20=2H MnO4碱性氧化物:与酸反应只生成盐和水的氧化物碱性氧化物的通性:1. 与酸反应只生成盐和水Fe s O3+H2SO4=Fe2(SO4)3+3H2O2. 与酸性氧化物反应只生成盐Na2O+SO3=Na2SO43. 少数碱性氧化物溶于水得到相应的碱CaO+H2O=Ca(OH)2注:金属氧化物可能是碱性氧化物、两性氧化物、酸性氧化物或特殊氧化物非金属氧化物可能是酸性氧化物、不成盐氧化物、特殊氧化物氢氧化钙溶液中滴入少量碳酸氢钠溶液:Ca(0H) 2+NaH 203===CaC0 3 J +Na0H+H 20。
酸碱盐氧化物的命名

1、酸的命名的分类与命名
(1)含氧酸:分子中含有氧原子的酸,如:H2SO4、HNO3、H3PO4、H2CO3等。
含氧酸的命名,一般是根据组成中除氢和氧之外的某元素而称之为“某酸”,如:H2SO4叫硫酸、H3PO4叫磷酸、H2CO3叫碳酸,但HNO3习惯叫硝酸。
(2)无氧酸:分子中不含有氧原子的酸,如HCl、HF、H2S等,命名一般是在氢字后面加上另一元素的名称,叫氢某酸。
如HCl叫氢氯酸(习惯叫“盐酸”)、HF叫氢氟酸、H2S叫氢硫酸等。
2、碱的命名:氢氧化某或氢氧化亚某
Fe(OH)3氢氧化铁Fe(OH)2氢氧化亚铁NaOH氢氧化钠
练习:氢氧化钙氢氧化镁氢氧化铝氢氧化铜3、盐的命名:从右向左读作“某化某”或“某酸某”
NaCl氯化钠FeCl3氯化铁FeCl2氯化亚铁Na2SO4硫酸钠
练习:碳酸钙碳酸钠氯化铁
氯化亚铁氯化钙氯化铜硫酸铜
4、氧化物命名:氧化某
Fe2O3 氧化铁 Fe3O4四氧化三铁 FeO氧化亚铁。
2015.9知识点:常见的酸和碱
是氧化剂,
是还原剂,
被氧化,
NH4Cl 铵根
NaOH 氢氧根
H2SO4 硫酸根
H2CO3 碳酸根
HNO3 硝酸根
铵根中 N 为-3 价;硫酸根中 S 为+6 价;碳酸根中 C 为+4 价;硝酸根中 N 为+5 价。
四、金属活动性顺序和复分解反应发生的条件: 1.金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg ⑴判断金属与酸反应时:金属必须排在(H)前面;酸不可用硝酸。 ⑵判断金属与盐反应时:必须同时满足①排在前面的金属;②可溶性盐。
七、其他: 1.物质的学名、俗名及化学式: ⑴水银、汞、Hg ⑵金刚石、石墨、C;硫磺、S;红磷、白磷、P ⑶干冰、固体 CO2 ⑷生石灰、氧化钙、CaO;氨气、NH3(碱性气体) ⑸盐酸、氢氯酸、HCl;氢硫酸、H2S;亚硫酸、H2SO3 ⑹熟石灰、消石灰、Ca(OH)2;苛性钠、烧碱、火碱、NaOH;氨水、NH3· H2O(碱) ⑺纯碱、Na2CO3;碳酸钠晶体、纯碱晶体、Na2CO3· 10H2O;碳酸氢钠、小苏打、NaHCO3;亚硝酸钠、NaNO2 (工业用盐) ;胆矾、蓝矾、硫酸铜晶体、CuSO4· 5H2O;铜绿、Cu2(OH)2CO3 ⑻甲烷、CH4;甲醇、CH3OH;酒精、乙醇、C2H5OH;醋酸、乙酸、 (冰醋酸)CH3COOH 2.常见混合物的主要成分: 煤:C; 石油:C、H、O 元素 水煤气:H2、CO 石灰石、大理石:CaCO3 天然气:CH4 石灰水、石灰乳、石灰浆:Ca(OH)2
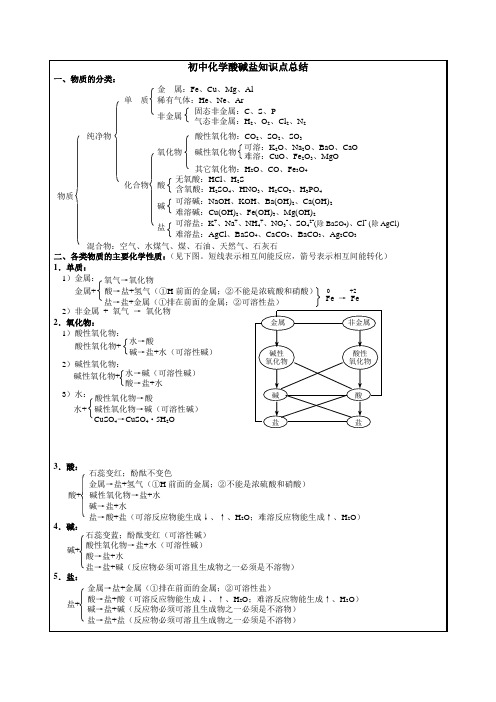
盐
金属+
Fe → Fe
非金属
0
+2
酸性 氧化物酸盐来自3.酸:石蕊变红;酚酞不变色 金属→盐+氢气(①H 前面的金属;②不能是浓硫酸和硝酸) 酸+ 碱性氧化物→盐+水 碱→盐+水 盐→酸+盐(可溶反应物能生成↓、↑、H2O;难溶反应物能生成↑、H2O) 4.碱: 石蕊变蓝;酚酞变红(可溶性碱) 酸性氧化物→盐+水(可溶性碱) 碱+ 酸→盐+水 盐→盐+碱(反应物必须可溶且生成物之一必须是不溶物) 5.盐: 金属→盐+金属(①排在前面的金属;②可溶性盐) 酸→盐+酸(可溶反应物能生成↓、↑、H2O;难溶反应物能生成↑、H2O) 盐+ 碱→盐+碱(反应物必须可溶且生成物之一必须是不溶物) 盐→盐+盐(反应物必须可溶且生成物之一必须是不溶物)
第二章 物质的分类和性质 第一讲

2012年 8.下列叙述中正确的是 A.医用酒精的浓度通常为95% B.单质硅是将太阳能转变为电能的常用材料 C.淀粉、纤维素和油脂都属于天然高分子化合物 D.合成纤维和光导纤维都是新型无机非金属材料
7、下列过程没有发生化学反应的是 2014年 A、用活性炭去除冰箱中的异味 B、用热碱水清除炊具上残留的油污 C、用浸泡过高锰酸钾溶液的硅藻土保鲜水果 D、用含硅胶、铁粉的透气小袋与食品一起密 封包装 7.食品干燥剂应无毒、无味、无腐蚀性及 环境友好。下列说法错误的是 2015年 A.硅胶可用作食品干操剂 B.P2O5不可用作食品干操剂 C.六水氯化钙可用作食品干燥剂 C.加工后具有吸水性的植物纤维可用作食 品干燥剂
氢化物的分类
1.定义:元素与氢化合生成的化合物。有且只有两种元素 组成 金属氧化物: NaH CaH2 LiH KH 非金属氧化物: CH4 NH3 H2O HF
酸的分类
1.定义:电离时生成的阳离子全部是氢离子(H+)的化合物叫做酸
氧化性酸: 浓H2SO4、HNO3 、HClO、HClO3、HClO4 含氧酸:H2SO4、 HNO3 、H3PO4 、 H2CO3 按是否 含氧: 无氧酸: HCl、HBr、HI、HF、H2S 一元酸: HCl、HBr、HNO3、CH3COOH 按提供氢 二元酸: H2SO4、H2CO3、H2C2O4 酸 离子数目: 多元酸:H3PO4 挥发性酸: HNO3、HCl、HF、HBr、HI、H2S 按挥发性: 难挥发性酸: H2SO4、H3PO4
5.锌钡白是一种白色颜料,其主要成分是难溶于水 的锌盐 和钡盐,它们是 [ ]. (A)ZnCO3和BaCl2 (B)ZnCl2和BaCO3 (C)ZnS和BaSO4 (D)ZnCO3和Ba(NO3)2
第03讲 酸碱盐的分类和命名-2024年初升高化学衔接讲义(人教版2019)(教师版)

01知识回顾02知识精讲03对点精练04易错辨析05基础测评06能力提升知识回顾酸、碱、盐的概念与常见分类1.概念概念酸电离时产生的阳离子全部是氢离子的化合物碱电离时产生的阴离子全部是氢氧根离子的化合物盐在水溶液中解离出金属离子(或铵根)和酸根离子的化合物2.酸的分类酸的分类从是否含氧来分含氧酸HNO 3、H 2CO 3、H 2SO 4无氧酸HCl 、HF 、H 2S 从氢原子数目来分一元酸HNO 3、HCl 、HF 、二元酸H 2S 、H 2CO 3、H 2SO 4三元酸H 3PO 43.碱的分类碱的分类从碱性强弱来分强碱NaOH 、Ba(OH)2、Ca(OH)2弱碱NH 3·H 2O 、Fe(OH)3从氢氧根数目来分一元碱NaOH 、NH 3·H 2O 二元碱Ba(OH)2、Ca(OH)2三元碱Fe(OH)3C、C2H5OH是有机物不属于酸,符合题意;D、Ca(OH)2是电离出的阴离子全部是氢氧根离子的化合物,属于碱,不符合题意。
故选C。
2.如图是“部分酸、碱和盐的溶解性表(室温)”中的一部分,据此判断下列说法正确的是()A.“溶挥”处物质的溶液具有挥发性B.“微”处物质的化学式为Mg2CO3C.氢氧化镁能溶于水D.“溶”处的物质属于碱【答案】A【解析】A.“溶挥”处物质的溶液具有挥发性,说法正确;B.“微”处物质是碳酸镁化学式是MgCO3,说法错误;C.氢氧化镁不能溶于水,说法错误;D.“溶”处的物质是碳酸铵属于盐,说法错误。
故选:A。
3.写出下列有关的化学方程式:①碳酸钙和醋酸溶液反应:CaCO3+2CH3COOH=Ca(CH3COO)2+CO2↑+H2O②硫酸铁和氢氧化钡溶液反应:Fe2(SO4)3+3Ba(OH)2=3BaSO4↓+2Fe(OH)3↓③硫酸铜溶液和铁反应:CuSO4+Fe=FeSO4+Cu④氯化钡溶液和碳酸钠溶液反应:BaCl2+Na2CO3=BaCO3↓+2NaCl易错辨析易错点1:复分解反应条件在应用中常被忽略复分解反应能否发生需要条件:反应物易溶于水,生成物有气体或水或沉淀中至少有一种。
物质及其反应的分类

酸性氧化物:能与碱反应生成盐和水的氧化物
1.SO2属于酸性氧化物,请写出SO2与足量KOH
溶液 反2应K的OH化+学方SO程2 式=。K2SO3 + H2O 属于碱性氧化物,请写出MgO与硫酸反应的
化学方程式。
MgO + H2SO4 = MgSO4 + H2O
例、某物质只含一种元素,此物质( D) A、一定是一种单质 B、一定是纯净物 C、一定是混合物 D、可能是纯净物,也可能是混合物
+2
CuO +
0
0
+1
H2 === Cu + H2O
化合价降低,被还原(还原反应)
得氧——化合价升高——氧化反应 失氧——化合价降低——还原反应
学以致用P7
所含元素化合价有 升降的反应是氧化 还原反应
2Na+Cl2=2NaCl
2Fe + 3Cl2
2FeCl3
H2 + Cl2
2HCl
Cl2+H2O
HCl+HClO
Ca(ClO)2+CO2+H2O=CaCO3+2HClO
2HClO
O2↑+ 2HCl
氧化还原反应与四种基本反应类型的关系: 化合反应 不都是 氧化还原反应 分解反应 不都是 氧化还原反应 置换反应 都是 氧化还原反应 复分解反应 都不是 氧化还原反应 思考: 有单质参加和生成的反应肯定是氧化还原反应吗?
活动性强的金属(除K、Ca、Na)置换出 活动性弱的金属
排在金属活动顺序表前面的金属(除K、Ca、 Na)可将其后面的金属从其盐溶液中置换出来。
酸、碱、盐在溶液中发生复分解反应需要一定 的条件。下列各组反应均可发生:Na2SO4溶 液与BaCl2溶液,Na2CO3溶液与盐酸,稀硫酸 与NaOH溶液。 (1)请写出反应的化学方程式。 (2)根据以上事实,你认为复分解反应的发生 需要什么条件?
高中化学常见酸碱盐

高中化学常见酸碱盐一.酸定义:在溶液中电离时阳离子完全是氢离子且能使紫色石蕊试液变红的化合物,其稀溶液的PH值小于7。
二.碱定义:在水溶液中电离出的阴离子全部是氢氧根离子,其水溶液的PH值大于7。
三.盐定义:金属离子或铵根离子(NH4+)与酸根离子或非金属离子结合的化合物。
四.酸的分类①.弱酸:是指在溶液中不完全电离的酸。
如用常用的HA去表示酸,那在水溶液中除了电离出质子H外,仍有为数不少的HA在溶液当中。
以下化学式可以表示这关系:HA(aq)↔H+(aq)+A-(aq)其溶液于平衡时,反应物及生成物的关系可用酸度系数(Ka)表示如下:Ka=[H+][A-]/[HA]Ka愈大(或是pKa值愈小),就代表有愈多的氢离子(H)生成,其pH值也就愈小。
弱酸的Ka值大约在1.8×10 和 55.5之间,或是pKa值大于-1.76(pka=-lgKa)。
因此,除了少数的酸被定义为强酸或超强酸外,大部分的酸均是弱酸。
②常见弱酸:H2CO3(碳酸)、HF(氢氟酸,较少见)、CH3COOH(也作C2H4O2乙酸,又叫醋酸)、H2S(氢硫酸)、HClO(次氯酸)、HNO2(亚硝酸,较少见)、H2SO3也为弱酸。
(弱酸的电离要使用可逆号)③.强酸:在溶液中完全电离的酸是强酸,强酸的电离使用等号。
pKa(酸度系数)<0(或=0)的为强酸。
(注:pKa 2左右为中强酸,7左右为弱酸)④.常见的强酸Ⅰ.无机强酸:硫酸(H2SO4)、硝酸(HNO3)、高氯酸(HClO4)、盐酸(HCl)、氢溴酸(HBr)、氢碘酸(HI)、氢砹酸(HAt)、氢碲酸(H2Te)、高溴酸(HBrO4)、氢叠碘酸(HI3)、氯酸(HClO3)、溴酸(HBrO3)、氟硅酸(H2SiF6)、氯铅酸(H2PbCl6)、偏磷酸(HPO3)、锇酸(OsO4·2H2O或写作H2[OsO4(OH)2])、高锰酸(HMnO4)、硒酸(H2SeO4)、高铁酸(H2FeO4)、氢硼酸(HBH4)、氟磺酸(HSO3F)、氰酸(HOCN)、硫氰酸(HSCN)Ⅱ.有机强酸:2,4,6-三硝基苯酚(HC6H2N3O7)、2,4,6-三硝基苯甲酸(HC7H2N3O8)、三氟乙酸(TFA,CF3COOH)、三氯乙酸(CCl3COOH)、甲磺酸(CH3SO3H)、苯磺酸(C6H5SO3H)、KMD酸(环乙硫醇磺酸,C6H10(SH)SO3H即C6H11S2O3)、乙二酸(H2C2O4俗称草酸)、2-氯乙硫醇(CH3CHClSH,一般视为强酸)五.碱的分类①.弱碱:弱碱是难溶于水不能发生完全电离的碱,一般属于不活泼金属形成的碱。
