物质的聚集状态PPT课件9 苏教版
合集下载
苏教版物质的聚集状态

“四同”:同温、同压、同体积、同微粒数
1、同温同压下,同体积的两种气体必含有相同数目 的分子。
2、同温同压下,同分子数目的两种气体必同体积。
3、在同温下,两种气体同体积又同分子数,则必然 同压。
理想气体状态方程
pV = nRT
p为压强 n为物质的量 T为温度
V为体积 R为常数
阿伏加德罗定律的推论
条件 n、p 相同
T、p 相同 T、p、V
相同
公式 VV12=TT12 ρρ12=MM21 MM12=mm12
结论 语言叙述
物质的量、压强相同的气体,其 体积与温度成正比 同温、同压下,气体的密度与其 相对分子质量(或是摩尔质量)成 正比 同温、同压下,体积相同的气体, 其相对分子质量与其质量成正比
2.14 g Fe与足量稀盐酸充分混合后,消耗HCl的物质的量
为多少?生成标准状况下的H2多少单升位?应上下一致 解析:Fe + 2HCl ===左右Fe关Cl系2 对+应 H2↑
56 g
2 mol
22.4 L
14 g
n(HCl)
n(HCl)=14 g5×62gmol=0.5 mol,
V(H2)=14
? 体积 (V)
粒子数 ×NA 物质的量
÷ρ
×ρ
(N) ÷NA
(n)
×M
÷M
质量
(m)
专题一 第一单元
物质的聚集状态 第一课时
铁水
钢铁
冰
水蒸汽
干冰
笔记!
一、物质的聚集状态
有规则的几何外形 晶体:
固态:
固定的熔点
1、 物质 的 聚集 状态
没有规则的几何外形
非晶态: 没有固定的熔点
教学课件:第一章-物质的聚集状态

气象观测
气态物质如空气中的水蒸气、二氧化碳等,用于气象观测和气候变 化研究,对环境保护和气候预测具有重要意义。
THANKS FOR WATCHING
感谢您的观看
气体定律与状态方程
1 2 3
理想气体定律
理想气体遵循玻意耳定律、查理定律和盖吕萨克 定律,这些定律描述了气体在不同条件下的状态 变化。
状态方程
理想气体的状态方程为PV=nRT,其中P表示压 强,V表示体积,n表示摩尔数,R表示气体常数, T表示温度。
实际气体近似
对于压强较大或温度较低的气体,实际气体可以 近似为理想气体。
04 气态物质
气体分子运动论
01
分子运动论的基本假设
气体由大量做无规则运动的分子组成,分子之间相互作用力可以忽略。
02
分子平均动能
气体分子的平均动能与温度成正比,温度越高,分子运动越剧烈。
03
分子分布
气体分子在空间的分布是均匀的,但在单位时间内与器壁碰撞的分子数
与气体分子速率大小有关,呈现出“中间多、两头少”的分布规律。
流动性
液体具有一定的流动性,可以流动 和变形。
液体的相变与热力学性质
熔点和沸点
熔点和沸点是液体物质的重要热 力学性质。
热容量和导热性
液体的热容量和导热性与温度有 关,不同液体有不同的热容量和
导热性。
相变过程
液体在一定条件下可以发生相变, 如蒸发或凝固。
液体中的溶解与扩散
溶解度
不同物质在液体中的溶解度不同。
气体的相变与热力学性质
相变
01
气体在一定条件下可以发生相变,例如液化、凝华等。相变过
程中气体的热力学性质会发生显著变化。
气态物质如空气中的水蒸气、二氧化碳等,用于气象观测和气候变 化研究,对环境保护和气候预测具有重要意义。
THANKS FOR WATCHING
感谢您的观看
气体定律与状态方程
1 2 3
理想气体定律
理想气体遵循玻意耳定律、查理定律和盖吕萨克 定律,这些定律描述了气体在不同条件下的状态 变化。
状态方程
理想气体的状态方程为PV=nRT,其中P表示压 强,V表示体积,n表示摩尔数,R表示气体常数, T表示温度。
实际气体近似
对于压强较大或温度较低的气体,实际气体可以 近似为理想气体。
04 气态物质
气体分子运动论
01
分子运动论的基本假设
气体由大量做无规则运动的分子组成,分子之间相互作用力可以忽略。
02
分子平均动能
气体分子的平均动能与温度成正比,温度越高,分子运动越剧烈。
03
分子分布
气体分子在空间的分布是均匀的,但在单位时间内与器壁碰撞的分子数
与气体分子速率大小有关,呈现出“中间多、两头少”的分布规律。
流动性
液体具有一定的流动性,可以流动 和变形。
液体的相变与热力学性质
熔点和沸点
熔点和沸点是液体物质的重要热 力学性质。
热容量和导热性
液体的热容量和导热性与温度有 关,不同液体有不同的热容量和
导热性。
相变过程
液体在一定条件下可以发生相变, 如蒸发或凝固。
液体中的溶解与扩散
溶解度
不同物质在液体中的溶解度不同。
气体的相变与热力学性质
相变
01
气体在一定条件下可以发生相变,例如液化、凝华等。相变过
程中气体的热力学性质会发生显著变化。
《物质的聚集状态》PPT课件

(1) (2) (3)
pi V总 = ni R T ( 2 )
p总V总 = n R T ( 1 )
式(2)/ 式(1) 得
pi p总
ni =
n
= xi
故 pi = p总•xi
即组分气体的分压等于总压与该
组分气体的摩尔分数之积。P7例题1-2
p总 Vi = ni R T ( 3 )
p总V总 = n R T ( 1 ) 又 式(3)/ 式(1) 得
由一种(或多种)物质分散于另一种物质所 构成的系统,称为分散系。
分散相: 被分散的物质。 分散介质: 容纳分散相的物质。
按聚集状态或分散质粒大小可对分散系进行分类。
4
按聚集状态分类的分散系
分散相 气体 液体 固体 气体 液体 固体 气体 液体 固体
分散介质 气体 液体 固体
实例 空气、天然气、焦炉气 云、雾 烟、灰尘 碳酸饮料、泡沫 白酒、牛奶 盐水、泥浆、油漆 泡沫塑料、木炭 豆腐、硅胶、琼脂 合金、有色玻璃
pV = nRT
(1-1)
p为气体压力,单位:Pa; V为气体体积,单位:m3; T为气体温度,单位:K;
n为气体的物质的量,单位:mol;
R为摩尔气体常数,取值8.314 Jmol-1K-1 。
8
Question 例1-1 某碳氢化合物的蒸汽,在100℃及
101.325 kPa时,密度ρ=2.55 g·L-1,由化 学分析结果可知该化合物中碳原子数与 氢原子数之比为1:1。试确定该化合物的 分子式。
Vi = ni V总 n
= xi 又有
pi = p总•xi
故
Vi pi = p总• V总
即组分气体的分压,等于总压与
苏教版高中化学必修一课件1-1-3物质的聚集状态

[复习]
1、在标准状况下,若两种气体所占体积不同,
其原因是
(D)
A、气体性质不同
B、气体分子的大小不同
C、气体分子间平均距离不同
D、气体的物质的量不同
2、在标准状况下,2 mol CO2的体积是多少? 44.8 L H2的物质的量是多少?它们所含的分子 数是否相同?
物质 质量
÷M
物质 ×NA
微粒
1、标准状况下(,错1,m物ol质任应何是物气质体的)体积都约是22.4L。
2、1m(o错l气,体应的标体明积条件约-为标22准.4状L况。)
3、标准状(况对下,,气1体m体ol积O与2和分N子2混种合类无气关体)的体积约 为22.4L。 4、2(2.错4L,气未体指所明气含体分体子积数是一否定在大相同于条11件.2下L气测定体)所含 的分子数。
高中化学课件
灿若寒星整理制作
1-1-3 物质的聚集状态
一、物质的聚集状态
固体
液体
气体
物质的 微观结构 微粒的运 宏观性质
聚集状态
动方式
固态 微粒排列紧密, 在固定位 有固定的形状,
微粒间空隙很小 置上振动 几乎不能被压缩
液态
微粒排列较紧密, 微粒间空隙较小
可以自由移动
没有固定的形状, 不易被压缩
(1)在温度、压强一定时,物质体积的大小取 决于物质所含微粒的数目、微粒的大小和微粒 之间的距离三个因素。
(2)当微粒数一定时,固、液态物质由于: ①内部紧密堆积,体积主要由微粒大小决定。 ②内部紧密堆积,改变温度、压强对体积影 响不大。 ③1mol不同固体、液体的体积不相等。
(3)气态物质: ①分子间距离比分子本身的体积大得多(约相差 10倍),体积主要由分子间距离决定。 ②体积受温度、压强的影响很大。 ③同温、同压下,同物质的量的气体体积基本相 等。
物质的聚集状态课件

等离子态是指气体中的 原子或分子在受到足够 的能量激发时,电子被 电离出来形成自由电子 和离子,呈现出一种高 度离解的状态,如太阳 和其他恒星。
物质聚集状态转变
物质聚集状态的转变是由于温度、压力、磁场等外部条件的变化而引起的。
聚集状态的转变通常伴随着物质物理性质和化学性质的显著变化。
在实际应用中,物质的聚集状态转变具有重要的意义,如工业生产中的结晶、升华、 熔化和凝固等过程,以及自然界中的天气变化、生命活动等过程。
理想气体定律
理想气体定律是描述气体压力、温 度和体积之间关系的一个基本定律, 它指出在一定温度下,气体的压力 与体积成反比。
03
液体
液体的分子运 动
分子运动
液体中的分子不断进行无 规则运动,这种运动受到 分子间相互作用力的影响。
分子间相互作用力
液体分子间存在相互作用 力,这种力使得分子在液 体状态下保持聚集状态。
晶格结构参数
描述晶体结构中原子或分子的间距和排列方式。
固体的基本性 质
1 2 3
热膨胀性 固体在温度变化时,体积发生改变。
电导率 固体材料中电子的迁移率,反映材料的导电性能。
光学性质 固体材料对光的吸收、反射和透射等性质。
固体的力学性 质
弹性
01
固体在外力作用下发生形变,形变与外力成正比,外力撤去后
工业生产 在工业生产中,研究物质的聚集状态有助于优化生产工艺 和提高产品质量,例如通过控制物质的聚集状态改善金属 的加工性能和机械性能。
THANKS
感谢您的观看
物质的聚集状态课件
目录
CONTENTS
• 物质的聚集状态研究的意义和应
01
物质的聚集状态简 介
物质的聚集状态定义
苏教版高中化学必修一113 物质的聚集状态 课件 共26张
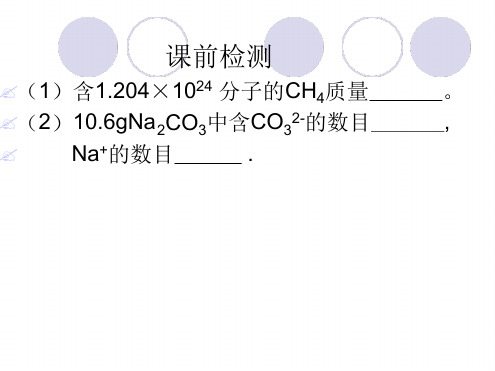
?标准状况下, n mol任何气体的体积约为 22.4n L。 ?标准状况下, 22.4 L 任何气体约含 6.02×1023个分子。
小结1、气体摩尔体积 Nhomakorabea?概念:1mol气体所占的体积。
?符号:Vm
?公式:Vm=
V n
?常用单位:L/mol(L·mol-1)和m3/mol。
2.标准状况下的气体摩尔体积 (Vm=22.4L/mol)理解要点:
2、不同聚集状态物质的结构与性质
物质的聚 集状态
微观结构
微粒的运动 宏观性质 方式
固态
微粒排列紧密, 在固定的位 有固定的形状 , 微粒间空隙很小 置上振动 几乎不能被压
缩
液态
微粒排列较紧密 ,可以自由 微粒间空隙较小 移动
没有固定的形 状,但不易被 压缩
微粒之间的 距 可以自由
气态 离较大
移动
没有固定的形 状,且容易被 压缩
归纳与整理
1.物质的量应用于方程式的计算的一般步骤: 1)正确写出化学反应方程式 2)根据方程式列出物质的量制比 3)列出已知量,未知量 4)列出比例关系式,求解 5)答
[讨论] 在一定温度和压强下,并不一定是标准 状况,1mol不同的气体体积是否相同?
?在同温同压下,相同分子数的气
体,其体积( 相同 );
5.标准状况( 温度0 oC、压强 1.01×105 Pa)
Vm =22.4L/mol
6.V、n、Vm 的关系:
n = —V— Vm
思考:1mol气体在任何状况下所占的体积是
不是相等?是不是都约为22 .4L?
辨析和应用
?1mol任何物质的体积在标准状况下都约为 22.4 L。
?1mol空气的体积在标准状况下约是22.4 L。 ?任何气体的体积在标准状况约为22.4 L 。
小结1、气体摩尔体积 Nhomakorabea?概念:1mol气体所占的体积。
?符号:Vm
?公式:Vm=
V n
?常用单位:L/mol(L·mol-1)和m3/mol。
2.标准状况下的气体摩尔体积 (Vm=22.4L/mol)理解要点:
2、不同聚集状态物质的结构与性质
物质的聚 集状态
微观结构
微粒的运动 宏观性质 方式
固态
微粒排列紧密, 在固定的位 有固定的形状 , 微粒间空隙很小 置上振动 几乎不能被压
缩
液态
微粒排列较紧密 ,可以自由 微粒间空隙较小 移动
没有固定的形 状,但不易被 压缩
微粒之间的 距 可以自由
气态 离较大
移动
没有固定的形 状,且容易被 压缩
归纳与整理
1.物质的量应用于方程式的计算的一般步骤: 1)正确写出化学反应方程式 2)根据方程式列出物质的量制比 3)列出已知量,未知量 4)列出比例关系式,求解 5)答
[讨论] 在一定温度和压强下,并不一定是标准 状况,1mol不同的气体体积是否相同?
?在同温同压下,相同分子数的气
体,其体积( 相同 );
5.标准状况( 温度0 oC、压强 1.01×105 Pa)
Vm =22.4L/mol
6.V、n、Vm 的关系:
n = —V— Vm
思考:1mol气体在任何状况下所占的体积是
不是相等?是不是都约为22 .4L?
辨析和应用
?1mol任何物质的体积在标准状况下都约为 22.4 L。
?1mol空气的体积在标准状况下约是22.4 L。 ?任何气体的体积在标准状况约为22.4 L 。
高中化学 专题1 化学家眼中的物质世界 1.1.4 物质的聚集状态课件 苏教版必修1.ppt
温度升高气体中微粒间的距离变大、 压强增大气体中微粒间的距离减小。
17
决定物质体积的主要因素
决定物质体积 的可能因素
决定固体和液体 体积的主要因素
决定气体体积 的主要因素
粒子的数目
粒子的大小 粒子的间距 可以忽略
可以忽略
18
【知识归纳】 气体摩尔体积
⑴定义:单位物质的量的气体所占的体积。
符号: Vm
21
例2.请判断下列说法是否正确?如不正确 请改正。
(1) 1molCO2的体积约为22.4L。 错, 1mol气体的体积与温度和压强有关。 (2) 1molCO2和CO的混合气体在标准状况下, 所占体积是22.4L。
错,1mol单一气体或混合气体在标准状况 下所占的体积都约是22.4L 。
22
(3) 在标准状况下,1molH2SO4的体积约是 22.4L。
65g
22.4L
13.0g
4.48L
最多可收到4.48L(标状)的氢气。
20
例1.请判断下列说法是否正确?如不正确 请改正。
(1) 1molCO2的体积约为22.4L。 (2) 1molCO2和CO的混合气体在标准状况下, 所占体积是22.4L。 (3) 在标准状况下,1molH2SO4的体积约是22.4L。 (4) 1molH2在20℃时体积一定大于22.4L。 (5) 当某气体的体积为22.4L时,它一定处于标准 状况下。
10
问题4.结合上述影响因素,从各状态物质 微观结构思考; ②在一定条件下,为什么1mol气体体积基本 相同呢?
气体比固体和液体更容易压缩,这说明气体 分子间的距离比固体和液体中的微粒之间 的距离大得多。在气体中,分子之间的距离 要比分子本身的体积大很多倍,当气体分子 数相同时,气体体积的大小主要决定于气体 分子间的平均距离,而相同 条件下不同 气体分子间的平均距离近似相等, 所以在相同状态下1mol气体的体积基本相11等。
17
决定物质体积的主要因素
决定物质体积 的可能因素
决定固体和液体 体积的主要因素
决定气体体积 的主要因素
粒子的数目
粒子的大小 粒子的间距 可以忽略
可以忽略
18
【知识归纳】 气体摩尔体积
⑴定义:单位物质的量的气体所占的体积。
符号: Vm
21
例2.请判断下列说法是否正确?如不正确 请改正。
(1) 1molCO2的体积约为22.4L。 错, 1mol气体的体积与温度和压强有关。 (2) 1molCO2和CO的混合气体在标准状况下, 所占体积是22.4L。
错,1mol单一气体或混合气体在标准状况 下所占的体积都约是22.4L 。
22
(3) 在标准状况下,1molH2SO4的体积约是 22.4L。
65g
22.4L
13.0g
4.48L
最多可收到4.48L(标状)的氢气。
20
例1.请判断下列说法是否正确?如不正确 请改正。
(1) 1molCO2的体积约为22.4L。 (2) 1molCO2和CO的混合气体在标准状况下, 所占体积是22.4L。 (3) 在标准状况下,1molH2SO4的体积约是22.4L。 (4) 1molH2在20℃时体积一定大于22.4L。 (5) 当某气体的体积为22.4L时,它一定处于标准 状况下。
10
问题4.结合上述影响因素,从各状态物质 微观结构思考; ②在一定条件下,为什么1mol气体体积基本 相同呢?
气体比固体和液体更容易压缩,这说明气体 分子间的距离比固体和液体中的微粒之间 的距离大得多。在气体中,分子之间的距离 要比分子本身的体积大很多倍,当气体分子 数相同时,气体体积的大小主要决定于气体 分子间的平均距离,而相同 条件下不同 气体分子间的平均距离近似相等, 所以在相同状态下1mol气体的体积基本相11等。
《物质的聚集状态》课件
ቤተ መጻሕፍቲ ባይዱ
能量
聚集态中物质分子之间的相互作用能量直接影响物质的熔点、沸点和凝固点等特性。
可逆性
聚集态之间的转变可以是可逆的,根据温度和压力的变化,物质可以在不同的聚集态之间进 行相互转化。
聚集态之间的转变
1
汽化和液化
2
在升高或降低压力时,物质可以从液
态转变为气态(汽化)或从气态转变
为液态(液化)。
3
熔化和凝固
了解聚集态的特性和转变机制可以帮助科学家们更深入地研究物质的性质,并应用于各 个科学领域。
3 教育意义
学习聚集态的知识有助于培养学生的观察力、实验能力和科学思维,增强他们对物质世 界的理解。
总结和展望
通过本PPT课件,我们对物质的聚集态有了更深入的了解。希望这些知识能 够激发您对科学的兴趣,并让您进一步探索物质世界的奥秘。
在升高或降低温度时,物质可以从固 态转变为液态(熔化)或从液态转变 为固态(凝固)。
升华和凝华
在一定条件下,某些物质可以直接从 固态转变为气态(升华)或从气态转 变为固态(凝华)。
应用和意义
1 工业应用
聚集态的转变和特性对于工业生产和物质处理具有重要意义,例如金属冶炼、化学反应 和材料制备等。
2 科学研究
液态是物质的另一种聚集态。 液态物质具有固定的体积,但 没有固定的形状。液态分子之 间的相互作用力较小,使得它 们可以流动。
气态
气态是物质的第三种聚集态。 气态物质具有可变的形状和体 积,分子之间的相互作用力非 常弱。气体可以自由地扩散和 混合。
聚集态的特征和性质
聚集度
聚集态中物质分子之间的接近程度和排列方式决定了物质的性质和特征。
《物质的聚集状态》PPT 课件
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
7.10cm3 9.99cm3 18.01cm3 58.39cm3 22.42L 22.42L 22.42L
1. 1 mol不同的固态或液态的物质,体积 不同。
2. 在相同状况下,1 mol气体的体积基本 相同。
3. 1 mol的固体和液体的体积较小, 1mol气体的体积较大。
1、为什么固体或液体的体积较小,而气体较大?
【定义】 气体摩尔体积
单位物质的量气体所占的体积叫做气
体摩尔体积。用 Vm 表示。
特例:
当气体处在标准状况(273K,101kPa) 下时,气体摩尔体积约为 22.4 L/mol。
单位: 升 / 摩
符号: L/mol 或 L. mol -1
标准状况下的气Βιβλιοθήκη 摩尔体积 注 (Vm=22.4L/mol)理解要点:
❖条件:标准状况(S.T.P) 意
❖对象:任何气体
(纯净气体,混和气体)
❖物质的量:1mol
结论
体积约为22.4L 22.4L是一个近似值
在标准状况下,1mol任何气体的体积都约 是22.4L。(或气体在标准状况下的摩尔体 积约是22.4L·mol-1)。
同温同压下,气体的体积只与气体物质 的量有关,而与气体分子的种类无关。同 温同压下1mol任何气体的体积都相等,但 未必等于22.4L。
[结论2] 在标准状况下,1mol任何气体 所占的体积 都约是22.4 L。
(标准状况是指压强为1个大气压,温度为0 ℃)
通常状态是压强为一个大气压,温度为20 ℃
思考:为什么相同条件下1摩尔固态和 液态物质体积不同,而1mol气态物质 的体积却相同?
【讨论】 影响物质体积大小的因素有哪些呢?
124个篮个乒球篮乓分球球散与与放12与1篮2紧篮球密球分堆分别在别紧一紧密起密堆,堆在哪在一个一起占起,据,哪空哪个间个体体积积大大??
Fe
固体
H2O
液体
H2
气体
不同聚集状态物质的结构与性质
物质的聚 集状态
微观结构
微粒的运 动方式
固态
微 微 很粒粒小排间列的紧空密隙,在置固上定振的动位
液态
微粒排列较紧 密,微粒间的 空隙较小
可以自 由移动
气态
微粒之间的 距离较大
可以自 由移动
宏观性质
有固定的形 状,几乎不 能被压缩
没有固定的 形状,但不 能被压缩
(1)微粒本身大小 (2)微粒数 (3)微粒间距离
思考: 为什么相同条件下1摩尔固态和液态 物质体积比1mol气态物质的体积小得多?
100℃1 mol H2O (g) (3.06×104 mL)
0℃1 mol H2O( 18 mL)
(体积扩大1700倍)
【实验启示】气体分子间的平均距离要比固 体和液体中粒子之间的平均距离大得多。
【启示】:气体微粒本身的大小几乎可以 忽略不计。
【结论】
影响固体、液体体积大小的因素:
微粒数、微粒本身大小
影响气体体积大小的因素:
微粒数、微粒间的距离
取决于温度和压强
温度对气体体积的影响
压强对气体体积的影响
当压强增大,气体分子间距离变小,气体体积变小。
相同的温度和压强下,含有相同分子数 的任何气体体积都相同。
说法错误。 因不是在标准状况下。 ⑸2×105Pa时,1molO2的体积小于22.4升。
说法错误。 不一定。
练习2、下列叙述中,正确的是( B、D ) A.1mol氢气的质量只有在标准状况下才约为2g B.在标准状况下某气体的体积是22.4L,则可认
为该气体的物质的量约是1mol。 C.在20℃时,1mol的任何气体的体积总比22.4L大 D.1mol氢气和氧气的混合气体,在标准状况下的 体积也约为22.4L
没有固定的 形状,且容 易被压缩
标准状况下1mol不同物质的体积
物质
1mol物质 的质量
密
度
1mol物质 的体积
Fe Al H2O
C2H5OH
H2 N2 CO
55.85g 26.98g 18.02g 46.07g 2.016g 28.02g 28.01g
7.86g/cm3 2.70g/cm3 0.998g/cm3 0.789g/cm3 0.0899g/L标况 1.25g/L标准状况 1.25g/L标准状况
练习1、下列说法是否正确 ?为什么? ⑴标准状况下任何气体的体积都约是 22.4L
说法错误。因未指明气体物质的量。 ⑵1摩尔二氧化碳占有的体积约为22.4 L
说法错误。因未指明气体所处的状况。 ⑶1 摩尔水在标准状况下的体积约为 22.4 L
说法错误。 因水在标准状况下不是气体。
练习1、下列说法是否正确 ?为什么? ⑷20℃时,1molO2的体积约22.4升。
1摩尔物质的体积
固态
液 态 气态(标准状况)
物质 铝 铁
水
乙醇 氢气
氮气
一氧 化碳
体积 9.99 7.11 18.06 58.39 22.425 22.416 22.408
cm3 cm3 cm3
cm3 L
L
L
示 意 图
【分析比较 】
[结论1]相同条件下,1摩尔不同固体或液
体物质的体积是 不相同
的。
练习3、下列说法正确的是( D )
A.在标准状况下1molH2O和1mol H2的体 积都约是22.4升。
B.2克氢气和44克CO2的体积相等。 C. 1mol某气体的体积为22.4升。
D. 在标准状况下,1克氢气和11.2升氧气 的物质的量相等。
关于气体摩尔体积的计算
气体体积(升) 物质的量(摩)=
专题1 第一单元 丰富多彩的化学物质
知识回顾:
粒子数 (N)
×NA ÷NA
物质的量
÷M
(n)
×M
?÷ρ ×ρ
体积
质量
(m)
【问题提问】:
1.在日常生活中,我们所接触的物质并不是单 个的原子或分子,而是他们的聚集体。物质的聚
集状态主要有固态 、液态 和气态 三种。
物质有固、液、气三种状态,三 种状态有何差异?从微观角度解 释这三种状态存在差异的原因
气体摩尔体积(升/摩)
n = V/Vm
练习6:
⑴标准状况下,0.500mol H2 占有的体积是 11.2 L。 ⑵标准状况下,2.00 mol O2 占有的体积是44.8 L。
2、为什么在相同状况下1mol固体或液体的体积 不相同?1mol气体的体积相同?
3、物质体积即物质所占据空间的大小取决于哪 些微观因素?
4、不同状态的物质体积主要取决于什么因素?
5、从微观角度看,温度和压强的改变会引起气 体分子怎样的变化?
【思考】
1mol任何粒子所含粒子数相同,那 么1 mol不同聚集状态的物质体积是否 相同呢?
