二氧化氯的工业制备
二氧化氯的制备及注意事项

二氧化氯的制备及注意事项一、原理:氯酸钠+盐酸法(全盐酸法或开斯汀法)。
反应方程式:NaClO3+2HCl= ClO2+1/2 Cl2+NaCl + H2O副反应为:2NaClO3+6HCl= 3Cl2+2NaCl+3 H2O通过理论计算可知:NaClO3+2HCl= ClO2+1/2 Cl2+NaCl + H2O106。
5/1。
56 +74/1.1= 67。
5/1+ 35。
5/.53+ 58.5/.87+ 18/.27 产生1吨二氧化氯需用1。
56吨氯酸钠、1.1吨氯化氢同时产生0。
53吨氯气、0。
87吨NaCl和0.27吨水.换算成氯酸钠溶液(1吨氯酸钠固体配2吨水),比重为1260kg/m3(20℃)体积为3.67m3。
氯化氢换算成盐酸(31%),比重为1160 kg/m3 (20℃)体积为3。
45m3.二、运行中的注意事项:1、反应温度:因为现场发生二氧化氯为化学反应,反应为吸热反应,所以对反应釜内温度要求较高。
据有关资料显示,反应釜内反应温度在50℃时原料转化率为50%。
在71℃时,原料转换率86%.当80℃时反应速度过快以副反应为主,氯气量大于二氧化氯量。
在现操作面板显示的温度为88℃—85℃为水浴温度不能真实代表反应釜内温度,特别在秋、春季当未点炉时,夜间氯库温度在—4—-5℃,点炉后氯库白天温度9℃,夜晚5℃。
而反应釜与水浴加热间隔着厚厚的PVC塑料板和聚四氟涂层(传热性不好),这一时期的加热如不及时,出液管温度会明显下降(反应效率特别低)。
建议对原料和进气加热,以弥补发生器加热量不足的问题,提高反应效率,降低副产物的产生量。
2、进气量的控制:进气的作用主要四个方面:(一)使原料充分混合,提高原料转换效率.(二)进气可降低二氧化氯的浓度,防止二氧化氯在发生器上部聚集发生爆炸。
(三)进气量的大小决定反应釜的液位,据厂家提供的资料,反应时间不应低于30min,但反应30min后,原料转换没有明显提高。
二氧化氯的制备化学题

二氧化氯是一种广谱杀菌消毒剂,工业上制取二氧化氯的化学方程式如下:2NaClO 3 +2NaCl+2H 2 SO 4═2ClO2↑+Cl2↑+2H2O+2Na 2 SO 4
完成下列计算:
(1)1molNaClO 3完全反应,得到气体的体积为33.6L(标准状况).
(2)为使上述反应产生的Cl 2 转化为ClO 2 ,将得到的混合气体和NaClO 2 反应,反应方程式为:2NaClO 2 +Cl 2═2ClO 2 +2NaCl
假设NaClO 3 的转化率为90%,Cl 2 的转化率为95%,计算由1mol NaClO 3 最终可制得的ClO 2 的物质的量为2mol.同时生成NaCl的物质的量为1mol.
答案:解:(1)由2NaClO 3 +2NaCl+2H 2 SO 4 ═2ClO 2 ↑+Cl 2 ↑+2H 2 O+2Na 2 SO 4 反应可知,2molNaClO 3 完全反应生成3mol气体,则1molNaClO 3 完全反应,得到气体的体积为1mol×3/2×22.4L/mol=33.6L,故答案为:33.6;
(2)由1molNaClO 3 发生反应生成1molClO 2 、0.5molCl 2 ,由两个反应可知,NaClO 3 ~1/2Cl 2 ~ClO 2 ~NaCl,则第二个反应中生成的ClO 2 为0.5mol×2=1mol,所以最终可制得的ClO 2 的物质的量为1mol+1mol=2mol,生成NaCl的物质的量为0.5mol×2=1mol.。
二氧化氯(ClO2)是如何制取的

二氧化氯(ClO2)是如何制取的我国自八十年代引进国外二氧化氯产品并开始研究其生产工艺以来,经过十几年的时间,不仅有了国产二氧化氯产品,而且生产工艺有了较大的提高,对二氧化氯作为氧化消毒剂的问题出也有了相当的认识和应用。
随着产品的广泛应用,促进了产品剂型的发展,目前已有二氧化氯发生器、稳定性二氧化氯、以及片剂等固态二氧化氯产品。
现将用于消毒的二氧化氯剂型情况综述如下。
1.二化氯发生器1.1二氧化氯的性质和制备二氧化氯是氯的氧化物,具有与氯气类似的刺激性气味,分子式ClO2,分子量67.457,熔点-59°C,沸点11°C,在室温下以气体形式存在,为一种黄绿色气体。
浓度增加时,颜色变为橙红色,气体二氧化氯极不稳定。
二氧化氯易溶于水,在20°C下溶解度为107.98mg/L,可制成不稳定的液体,其液体和气体对温度、压力和光均较敏感,当空气中的含量高于10%时,火花即可引爆[1],二氧化氯是一种不稳定的化合物,在水中可变成HClO2和HClO3.,在室温下每天约有2-10%的离解率[2],因此不利于大批量制备和运输,一般多在使用场所现用现制备。
二氧化氯发生器制备二氧化氯的方法主要有电解法和化学法,电解法使用广泛的是隔膜电解法,以食盐为原料,在电场的作用下生成含有二氧化氯,次氯酸钠、双氧水、臭氧的混合溶液,二氧化氯的浓度一般仅为10-30%左右,大多为氯气。
化学法主要有以氯酸钠和亚氯酸钠为原料的两类发生二氧化氯的方法。
在氯酸钠法生产二氧化氯过程中,若用氯离子作还原剂,则制得的二氧化氯存在纯度低的缺点,而亚氯酸钠法制得的二氧化氯比例高,一般在90%以上。
1.2设备和杀菌性能国外引进的发生器主要有Tetraralent公司、RioLindo公司、德国的Prominent等,李玲文等[3]报道了Tetraralent公司的二氧化氯协同消毒器的协同杀菌作用,该发生器利用电解食盐溶液,同时产生二氧化氯、氯气、臭氧和双氧水,溶于水中,协同杀菌,其杀菌效果优于上述任何一种消毒剂,实验结果还说明,电解槽的电解电压、电流、电解质浓度及阳极有效面积对消毒器的产气量都有影响。
二氧化氯的制备方法

二氧化氯的制备方法二氧化氯(ClO2)是一种重要的化学品,具有强氧化性和消毒能力,广泛应用于水处理、工业生产和医疗卫生等领域。
下面将介绍几种常见的二氧化氯的制备方法。
1.二氯化钠酸化法:将二次氯化钠固体(NaClO2)溶解在水中,然后加入酸(如盐酸)进行酸化反应。
反应过程中生成的二氯化钠(NaCl)被进一步氧化为二氧化氯。
反应方程式如下:4NaClO2+4HCl→4ClO2+2H2O+2NaCl此方法操作简单,并且生成的二氧化氯浓度较高。
2.氢氧化钠酸化法:将二氯化钠固体溶解在水中,然后加入氢氧化钠进行酸化反应。
反应过程中生成的二氯化钠被氧化为二氧化氯。
反应方程式如下:3NaClO2+2NaOH→2ClO2+NaCl+NaClO3+H2O该方法中,氢氧化钠作为酸化剂,同时产生了多余的氯酸钠(NaClO3)。
3.过硫酸盐法:将过硫酸钠固体溶解在水中,然后加入二氯化钠进行反应。
反应过程中生成的过硫酸钠(Na2S2O8)与二氯化钠反应生成二氧化氯。
反应方程式如下:2NaClO2+Na2S2O8+2H2O→2ClO2+2NaHSO4+NaCl该方法中,过硫酸钠作为氧化剂,在反应中被还原为硫酸钠(NaHSO4)。
4.氯酸钠酸化法:将氯酸钠溶解在水中,然后加入酸进行酸化反应。
反应过程中生成的氯酸钠被氧化为二氧化氯。
NaClO3+2HCl→ClO2+H2O+NaCl该方法操作简单,但由于氯酸钠的价格相对较高,制备成本较高。
总结:以上是几种常见的二氧化氯的制备方法,它们有各自的特点和适用范围。
在实际应用中需根据具体情况选择适合的制备方法,并注意操作安全。
二氧化氯是一种有毒气体,应严格控制其浓度和排放,防止对环境和人体健康造成危害。
二氧化氯的制法

二氧化氯的制法二氧化氯是一种强氧化剂,具有广泛的应用价值。
它可以用于水处理、消毒、漂白等领域。
本文将介绍二氧化氯的制法。
一种常见的二氧化氯制法是通过电解盐酸钠溶液来制备。
具体步骤如下:准备好所需的材料和设备。
需要准备的材料包括食盐(氯化钠)、盐酸和纯净水。
需要准备的设备有电解槽、电源、电极等。
接下来,将盐酸和纯净水按一定比例混合,制备成一定浓度的盐酸溶液。
这一步骤是为了提供所需的氯离子。
然后,将制备好的盐酸溶液倒入电解槽中,并将电解槽的两个电极分别连接到电源上。
通电后,电解槽中的盐酸溶液会发生电解反应。
在电解过程中,电极会释放出氯离子。
正极上的氯离子会与水分子发生反应,生成次氯酸根离子(ClO-)。
而负极上的水分子会发生水解,生成氢气和氢氧根离子(OH-)。
次氯酸根离子(ClO-)是二氧化氯的前体。
在电解槽中,次氯酸根离子会与盐酸溶液中的氯离子反应,生成二氧化氯(ClO2)。
通过适当的处理,可以将生成的二氧化氯气体收集起来。
二氧化氯气体可以用于水处理、消毒、漂白等不同的应用领域。
除了电解法,还有其他一些制备二氧化氯的方法。
例如,可以通过氯气与二氧化硫反应来制备二氧化氯。
这种方法需要严格控制反应条件,以确保反应的安全和高效进行。
二氧化氯是一种重要的化学品,具有广泛的应用。
通过电解盐酸钠溶液可以制备二氧化氯,这是一种常见的制备方法。
无论是电解法还是其他方法,制备二氧化氯都需要严格控制反应条件和操作过程,以确保安全和高效。
希望本文的介绍对您了解二氧化氯的制法有所帮助。
二氧化氯的制备方法
二氧化氯的制备二氧化氯是一种黄绿色具有刺激性气味的气体。
沸点11℃,凝固点-59℃,易溶于水。
液态或气态的二氧化氯都不安定,易挥发,易爆炸。
早在1811年就由英国化学家hu mphre y davey制得,但由于二氧化氯的不稳定性使得大规模的应用受到了限制。
直到近十几年来才引起人们的极大关注,国外正在积极开发和研制各种新产品,扩大应用范围。
目前国际上公认二氧化氯很有开发和应用的价值,市场前景广阔。
但是,二氧化氯在我国的应用尚不够广泛,为此本文将介绍有关二氧化氯的各种制备方法及在各领域中的应用。
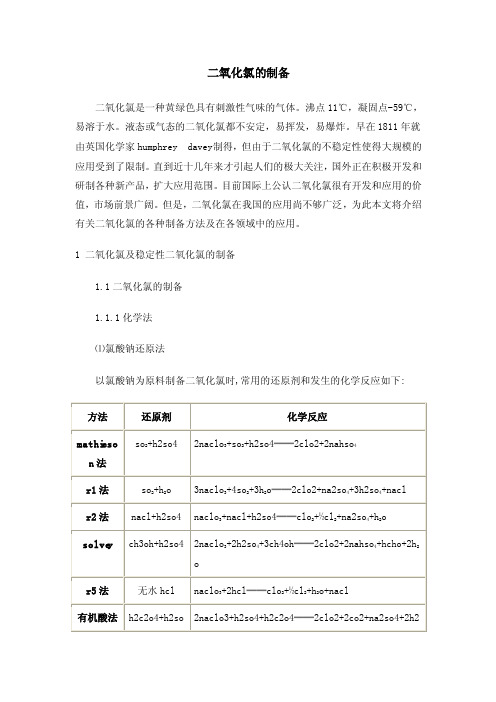
1 二氧化氯及稳定性二氧化氯的制备1.1二氧化氯的制备1.1.1化学法⑴氯酸钠还原法以氯酸钠为原料制备二氧化氯时,常用的还原剂和发生的化学反应如下:⑵亚氯酸钠氧化法a.与氯气反应2naclo2+cl2══2clo2+2naclb.与盐酸反应5naclo2+4hcl══4clo2+5nacl+2h2oc.与硫酸反应10nacl o2+5h2so4══8clo2+5na2so4+2hcl+4h2od.与酸化后的次氯酸钠反应naclo+hcl══nacl+hoclhcl+hocl+2naclo2══2clo2+2nacl+h2o1.1.2电解法目前仍采用亚氯酸盐电解氧化和氯酸盐电解还原法制备二氧化氯.此法较化学法制备的二氧化氯纯度高,但要求的电极材质高,电耗也较大.因此,目前在大规模的生产中,还无法与传统的化学法竞争.在饮用水消毒工艺中,也常用电解饱和浓度的食盐溶液制取二氧化氯,但反应过程中还伴生有氯气、臭氧、氢气等其他气体。
1.2稳定性二氧化氯的制备稳定性二氧化氯是80年代为推广应用二氧化氯而开发的新型产品。
它无色、无味、无毒、无腐蚀性,不易燃,不挥发。
二氧化氯的制备
二氧化氯的制备二氧化氯是一种极易爆炸的强氧化性气体,在生产和使用时必须尽量用稀有元素气体进行稀释,同时需要避免光照、震动或加热。
因此,二氧化氯的制备方法一直科学家长期寻求解决的问题。
目前,世界常用的二氧化氯制备方法主要集中为三种。
1.氯酸钠与浓盐酸反应法(Kestiog法)目前,欧洲一些国家主要采用氯酸钠(NaClO3)氧化浓盐酸的制备方法,化学反应方程式为:2NaClO3+4HCl(浓)=2NaCl+Cl2↑+2ClO2↑+2H2O。
此法的缺点主要是同时产生了大量的氯气,不仅产率低,而且产品难以分离,同时很有可能造成环境污染。
2.亚氯酸钠与氯气反应法我国的科学家经过科学探索,发现一种优于欧洲的制备方法,将经干燥空气稀释的氯气通入填充有固体亚氯酸钠(NaClO2)的反应柱内制得。
化学反应方程式为:2NaClO2+Cl2=2NaCl+2ClO2。
此法的特点是安全性好,没有产生毒副产品。
3.草酸还原法最近,科学家又研究出了一种新的制备方法,在酸性溶液中用草酸(H2C2O4)还原氯酸钠,化学反应方程式为:H2C2O4+2NaClO3+H2S O4 =△= Na2SO4+2CO2↑+2ClO2↑+2H2O和2KClO3+H2C2O4=K2CO3+CO2↑+2ClO2↑+H2O此法的最大特点是由于反应过程中生成的二氧化碳的稀释作用,大大提高了生产及储存、运输的安全性。
4.亚氯酸钠与盐酸反应法目前,常用的制备高纯二氧化氯的方法,化学反应方程式为:5NaClO2+4HCl=4ClO2+5NaCl+2H2O,此工艺产物中纯度一般高达95%以上,需要现场制备现场使用。
运用高耐腐材料制作的二氧化氯发生器能够满足应用。
5.氯酸钾与二氧化硫反应法优点是可以利用二氧化硫减少空气污染,化学反应方程式为:2KClO3+SO2=2ClO2+K2SO4、6.氯酸钠与亚硫酸钠反应法实验室常用氯酸钠(NaClO3)和亚硫酸钠(Na2SO3)用硫酸酸化,加热制备二氧化氯,化学反应方程式为:2NaClO3+Na2SO3+H2SO4==△==2ClO2↑+2Na2SO4+H2O编辑本段二氧化氯的用途二氧化氯因为其具有杀菌能力强,对人体及动物没有危害以及对环境不造成二次污染等特点而备受人们的青睐。
甲醇还原法生产二氧化氯的研究进展
或写作
6NaClO3 + CH3OH + 4H2SO4 = 6ClO2 + CO2 + 2Na3H(SO4)2+ 5 H2O (2)
目前该方法在造纸业中颇为流行,其特点是不需要催化剂,生产效率高,ClO2产品气纯净,但所需酸度较高,对反应器材质要求高。
因此通常需要不断加入少量Cl-以保证生产的平稳进行。
US.Pat.4770868提出,在反应器的结晶区引入甲醇可以大大减少甲醇的损耗,但由于副反应:
12NaClO3 + 3CH3OH + 8 H2SO4 = 12ClO2 + 3HCOOH + 4Na3H(SO4)2 + 9H2O (5)
循环利用甲酸势必造成反应介质溶液酸度增大,腐蚀性增强,对反应器材质的要求更高。另外,为避免循环给系统带回过多的水而使反应介质浓度下降,可附加一些装置通过共沸蒸馏、吸附法、膜分离技术等对冷凝循环液进行浓缩。
2.5 关于Na3H(SO4)2的处理
由于还原法生产二氧化氯是在强酸性环境(一般为H2SO4)还原氯酸钠,不可避免地要产生大量的倍半硫酸钠Na3H(SO4)2。一般工艺中将倍半硫酸钠结晶沉淀为盐块,过滤后从反应器中移出。这种盐块呈酸性,没有什么用途,还易造成环境污染。为解决这个难题,Scribner [9]提出,将结晶过滤出的倍半硫酸钠在温度40~70°C的条件下与浓度为2~4M的氯酸钠溶液混合、搅拌,通过复分解反应,利用同离子效应对Na2SO4溶解度的抑制,将倍半硫酸钠转化为无水硫酸钠,并将反应后含酸(总酸度可达4.8N)的氯酸钠溶液再加到ClO2反应器中,一方面转化了难以处理的倍半硫酸钠,另一方面又回收利用了副产物倍半硫酸钠中结合的酸。既保护环境,又节约费用,是值得提倡的好方法。
稳定性二氧化氯的制备方法
稳定性二氧化氯的制备方法二氧化氯不仅可用于纸浆、纺织品漂白等,还是一种广谱、高效的理想消毒剂,可广泛用于水处理、杀菌消毒、食品防腐、空气净化等领域[1],被世界卫生组织列为 A1 级安全消毒剂。
目前,生产二氧化氯主要有电解法和化学法两类[1,2]。
电解法即离子膜法,其生产设备复杂、一次性投资较大、运行费用高、易损坏,故应用较少.应用最多的是化学法,包括还原法和氧化法两类。
还原法根据所选用还原剂可分为四类:(1) HCl 为还原剂[3];(2) NaCl 为还原剂;(3)醇为还原剂[46];(4) SO2为还原剂。
氧化法用氧化剂氯气[7]或酸(盐酸、碳酸等)氧化亚氯酸钠来产生 ClO2。
Roensch 等[8]将二氧化碳气体通入到亚氯酸钠溶液中,制备了高安全性的二氧化氯溶液,其特点是投资少、工艺简单、易于控制、应用领域广。
二氧化氯是一种呈黄绿色或桔黄色的气态物质(冷凝时为红色液体,沸点 284K),具有一种同氯气相似的强刺激性气味,气体浓集到分压 6.66kPa 以上时有爆炸性。
二氧化氯在水中溶解度很大,但其水溶液很不稳定,对光很敏感,是一种难以储存、运输的危险物质。
它的这种特点使其在很长的时间内只能现场配制、现场使用,不利于散户使用,严重阻碍了其推广应用。
由于二氧化氯不与水发生化学反应,也不以二聚和多聚状态存在,因此可将其稳定在惰性溶剂或某些固态物质中,形成一定浓度的液态或固态稳定性二氧化氯.1 稳定性二氧化氯溶液的制备方法稳定性二氧化氯溶液无色、无味、无腐蚀、不易燃、不挥发、不分解,性质稳定,便于储存和运输。
其中 pH 对二氧化氯溶液的稳定性有较大的影响[4],pH 越大,溶液的稳定性越好,保存期越长.根据溶液 pH 的大小,液态稳定性二氧化氯可分碱性和中性两种制剂。
1.1 碱性条件下稳定性二氧化氯溶液的制备现在市场上普遍使用的是碱性的稳定性二氧化氯水溶液,其主要制备原料均为氯酸钠.根据所用还原剂的不同,其制备方法可分为以下两种。
二氧化氯工作原理
二氧化氯工作原理
二氧化氯(ClO2)是一种强氧化剂,可用于水处理、消毒和空气净化等领域。
其工作原理如下:
1. 混合物制备:二氧化氯可以通过将一定比例的氯气(Cl2)和二氧化氯气(ClO2)通过一个特殊的发生器混合而成。
2. 氧化反应:二氧化氯溶液一旦进入水体中,其分解释放出游离的氧原子。
这些氧原子可以与有机和无机物质相互作用,从而实现氧化反应。
二氧化氯的氧化能力比传统的消毒剂如氯气和次氯酸钠要强,因此能够更有效地消除有机物污染、杀灭细菌和病毒。
3. 活性氧供应:二氧化氯也可以释放出活性氧(O2⋅-、OH⋅等),这些活性氧具有很强的杀菌作用。
它们能够破坏微生物的核酸、蛋白质和脂质,从而导致其死亡。
4. 氧化还原反应:二氧化氯还可发生氧化还原反应,与其他物质中的还原剂(如亚硫酸盐、亚硝酸盐等)反应,从而使其被氧化为高价态。
总的来说,二氧化氯通过氧化反应、活性氧供应和氧化还原反应等多种作用机制,实现对有机和无机污染物的去除和杀菌消毒作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二氧化氯的工业制备
二氧化氯是一种常用的强氧化剂,具有较强的杀菌消毒能力,在工业上被广泛应用于水处理、漂白剂生产等领域。
下面将介绍二氧化氯的工业制备过程。
一、工业制备二氧化氯的原理
二氧化氯可以通过以下反应得到:
2NaClO3 + 4HCl → 2ClO2 + Cl2 + 2H2O + 2NaCl
二、工业制备二氧化氯的步骤
1. 选用合适的原料和设备。
通常使用氯酸钠(NaClO3)和盐酸(HCl)作为原料,同时需要选择合适的反应设备,保证反应的安全进行。
2. 混合原料。
按照一定的比例将氯酸钠和盐酸混合,形成反应物溶液。
通常采用连续进料的方式,即将氯酸钠和盐酸分别加入反应槽中,控制好进料速度和比例。
3. 反应生成二氧化氯。
混合原料后,通过控制反应温度和反应时间,使得反应物发生化学反应,生成二氧化氯。
4. 分离纯化二氧化氯。
由于反应产物中可能还包含其他气体或杂质,需要对反应产物进行分离纯化。
通常采用冷凝、吸附等方法,将二氧化氯从反应混合物中分离出来,得到纯净的二氧化氯。
三、工业制备二氧化氯的注意事项
1. 安全操作。
由于二氧化氯具有较强的氧化性和毒性,操作人员应佩戴防护设备,并按照安全操作规程进行操作。
2. 控制反应条件。
反应温度、反应时间等条件的控制对于反应效果和产物纯度具有重要影响,需要合理调控。
3. 设备维护保养。
反应设备需要定期维护保养,防止设备老化或损坏对反应过程产生影响。
4. 废气处理。
二氧化氯反应产生的废气需要经过处理,避免对环境造成污染。
四、工业制备二氧化氯的应用领域
1. 水处理。
二氧化氯具有较强的杀菌消毒能力,广泛应用于自来水、游泳池、污水处理等领域,可以有效杀灭细菌、病毒和藻类。
2. 漂白剂生产。
二氧化氯作为一种强氧化剂,可用于漂白剂的生产,如纸浆漂白、织物漂白等。
3. 化工原料。
二氧化氯还可以用作一些化工反应的氧化剂,参与有机合成反应等。
总结:
工业制备二氧化氯是通过混合氯酸钠和盐酸,控制反应温度和时间,分离纯化产物等步骤完成的。
在工业应用中,二氧化氯广泛用于水处理和漂白剂生产等领域,具有重要的应用价值。
在制备过程中需要注意安全操作、控制反应条件、设备维护保养和废气处理等问题,以确保制备过程的安全性和产物的质量。
