(完整版)高中化学物质的检验大全
2024高考化学考点必练专题20物质的检验知识点讲解

考点二十物质的检验学问点讲解物质检验的方法常用的物理方法有:①视察法;②嗅试法;③加热法;④水溶法;⑤焰色反应法等。
常用的化学方法有:①加热法;②点燃法;③指示剂法;④显色法(如无水硫酸铜遇水显蓝色);⑤互滴法;⑥不同试剂两两混合法(又称:简明列表法)等。
常见物质检验的方法如下一.阳离子的检验:典例1(2025届辽宁省瓦房店市高级中学高三上学期12月月考)下列试验操作或对试验事实的叙述正确的是①用稀盐酸洗涤盛放过石灰水的试剂瓶;②配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁渐渐加入到浓硝酸中,并不断搅拌;③有六种分别含Na+、Mg2+、Al3+、Fe2+、Fe3+、NH4+阳离子的溶液,不能用NaOH溶液鉴别;④用稀硝酸清洗做过银镜反应试验的试管;⑤假如皮肤上不慎沾有苯酚,应马上用大量的NaOH稀溶液冲洗;⑥用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物;⑦向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;⑧向某溶液中加入NaOH浓溶液并加热产生能使潮湿的红色石蕊试纸变蓝的气体则原溶液中含NH4+A. ①⑤⑦B. ③④⑦⑧C. ①②④⑧D. ②③⑤⑥【答案】C典例2(2025届甘肃省民乐县第一中学高三上学期期中考试)下列有关试验操作、现象和结论都正确的是选项试验操作现象结论A向稀硝酸溶液中加入过量铁粉充分反应后,滴加KSCN溶液溶液变为血红色稀硝酸具有氧化性能将Fe氧化成Fe3+B 向AgNO3溶液中滴加过量氨水溶液澄清Ag+与NH3·H2O能大量共存C向装有Fe(NO3)2溶液的试管中加入稀H2SO4在管口视察到红棕色气体HNO3分解成了NO2D向某溶液中滴加浓NaOH溶液,将潮湿红色石蕊试纸置于试管口试纸变蓝该溶液中存在NH4+【答案】D二.阴离子的检验:离子检验试剂试验现象离子方程式OH-①酚酞试液②石蕊试液①呈红色②呈蓝色Cl-AgNO3,稀HNO3白色沉淀Ag++Cl-=AgCl↓Br-AgNO3,稀HNO3淡黄色沉淀Ag++Br-=AgBr↓I-AgNO3,稀HNO3黄色沉淀Ag++I-=AgI↓SO42-HCl,BaCl2溶液加HCl无沉淀,再加BaCl2有白色沉淀Ba2++SO42-=BaSO4↓SO32-稀硫酸,品红溶液无色有刺激性气味的气体,能使品红溶液退色SO32-+2H+=SO2↑+H2O CO32-HCl,澄清石灰水白色沉淀CO32-+2H+=CO2↑+H2OCO2+Ca(OH)2=CaCO3+2H2O 典例3(2025届湖南省五市十校教研教改共同体高三12月联考)某无色溶液中可能存在Na+、Mg2+、Fe3+、I-、CO32-、SO42-、Cl-中的几种,某学生进行了下列试验: ①取少量原溶液,向其中滴加足量氯水,有无色无味气体产生,溶液仍为无色,再将溶液分为2份;②向其中一份溶液中加入AgNO3溶液,有白色沉淀产生;③向另一份溶液中加入BaCl2溶液,有白色沉淀产生。
高中化学常见的物质检验方法及规范用语

高中化学常见的物质检验方法及规范用语1、SO42-:取少量样品,加入稀HCl(aq)酸化,再加入BaCl2溶液,生成不溶于酸的白色沉淀,证明样品中有SO42-。
2、Cl-:取少量样品,加入稀HNO3(aq)酸化,加入AgNO3溶液,生成不溶于酸的白色沉淀,证明样品中有Cl-。
3、SO2:取少量样品,通入品红溶液,品红溶液红色褪去,再加热溶液,红色恢复,证明样品中有SO2。
4、Cl2:取少量样品,将湿润的淀粉KI试纸放在集气瓶口处,试纸变蓝,证明样品中有Cl2。
5、NH3:取少量样品,将湿润的红色石蕊试纸放在集气瓶口处,试纸变蓝,证明样品中有NH3。
6、浓氨水:用玻璃棒分别蘸取少量样品和浓盐酸,相互靠近,冒白烟,证明样品为浓氨水。
7、NO:取少量样品,通入少量空气,气体由无色变为红棕色,证明样品为NO。
8、NH4+:取少量溶液,加入少量NaOH溶液并加热,生成可使湿润的红色石蕊试纸变蓝的气体,证明样品中有NH4+。
9、Fe3+:取少量溶液,加入KSCN溶液,溶液变红;取少量溶液,加入NaOH溶液,生成红褐色沉淀,证明样品中有Fe3+。
10、Al3+:取少量溶液,加入少量NaOH溶液,生成白色沉淀,再加入过量NaOH溶液,沉淀逐渐消失,证明样品中有Al3+。
11、Mg2+:取少量溶液,加入过量NaOH溶液,生成白色沉淀,证明样品中有Mg2+。
12、Fe2+:取少量溶液,加入KSCN溶液,溶液无变化,加入氯气,溶液变红,证明样品中有Fe2+。
13、I-:取少量溶液,加入稀硝酸酸化,加入AgNO3溶液,生成黄色沉淀(AgI),加入Cl2的CCl4溶液,下层溶液变为紫红色,证明样品中有I-。
14、Br-:取少量溶液,加入稀硝酸酸化,加入AgNO3溶液,生成淡黄色沉淀(AgBr),加入Cl2的CCl4溶液,下层溶液变为橙红色,证明样品中有Br-。
15:取少量样品,加入浓溴水,生成白色沉淀;取少量样品,加入FeCl3溶液,溶液变为紫色,证明样品为苯酚。
高中化学常见离子检验大全

②滴入新制CI2,振荡后再滴入淀粉溶液,变蓝
Ag++I=AgIJ
2I-+CI2=I2+2CI-
I2遇淀粉变蓝
CIO-
HCI、淀粉
-KI
取少量待测溶液于试管中,加入HCI溶液,然后加入淀粉-KI溶液
淀粉-KI溶液变蓝
HCI、石蕊
取少量待测溶液于试管中,加入HCI溶液,然后加入石蕊试液
加入稀盐酸后放出的气体使品红溶液褪色
SO32-+2H+=H2O+SO2f
②BaCl2溶液、稀盐酸
取少量待测溶液于试管中,加入
BaCl2溶液再向
沉淀中加入稀盐酸。
加入BaCl2溶
液后生成白色沉淀,沉淀溶于稀盐酸,并放出刺激性气味的气体
SO32-+2H+=H2O+SO2?
离子
检验试剂
实验步骤
实验现象
离子方程式?
加入话量稀盐酸(或稀硫酸)溶液后生成白色沉淀,该沉淀溶于过量酸溶液中
AIO2-+H++H2O—AI(OH)3J
AI(OH)3+3H+—AI3++H2O
Al(OH)3+OH=AlO2-+ 2H2O
Cu2+
NaOH溶液
取少量待测溶液于试管中,加入NaOH溶液
加入话量NaOH
溶液后生成蓝色沉淀
Cu2++2OH=Cu(OH)2J
Mg2+
NaOH溶液
取少量待测溶液于试管中,加入NaOH溶液
加入话量NaOH
溶液后生成白色沉淀,该沉淀不
(完整版)高中化学常见离子检验大全
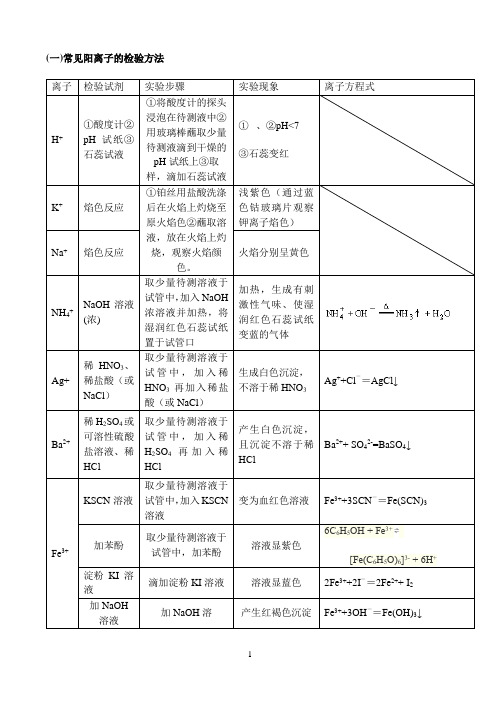
(一)常见阳离子的检验方法
后,立即显红色。
2Fe2+ + Cl22Fe3+ + 2Cl-Fe3++3SCN-=Fe(SCN)3
5Fe2+ + MnO4-+8H+
5Fe3+ +Mn2++4 H2O 3 Fe2++2[Fe(CN)] 3- ═
(二)常见阴离子的检验方法
注意:
1.若SO42-与Cl-同时检验,需注意检验顺序。
应先用Ba(NO3)2溶液将SO42-检出,并滤去BaSO4,然后再用AgNO3检验Cl-。
2.检验SO32-的试剂中,只能用盐酸,不能用稀硝酸。
因为稀硝酸能把SO32-氧化成SO42-。
3.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出并滤去沉淀,然后再用稀硫酸检验Ba2+。
4.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出
5.若CO32-和HCO3-同时检验,应先用足量的BaCl2溶液将CO32-检出,静置,取上层清夜用Ba(OH)2或Ca(OH)2检出HCO3-。
高一化学常见物质的检验

-
√D.验证烧碱溶液中是否含有Cl ,先加稀硝酸除去OH ,
再加入AgNO3溶液,有白色沉淀,证明含Cl-
;欢聚麻将珍珠 欢聚麻将推荐人 / 欢聚麻将;
化 学 方 程
NH4
+的检验(铵盐)方法:
取样(少量放在试管中)与碱混合加热,若有刺
激性气味的气体产生,且该气使湿润的红色石 蕊试纸变蓝,证明该试样中含有NH4+。
实验原理:
NH Cl+NaOH==Na Cl +H O +NH
4 2
3
蓝 NH3 使湿润的红石蕊试纸变_____
实验2
实验药品:
5. 仪器分析法:课本P22
用元素分析仪测定:物质中是否含C、H、O、 N、S、Cl、Br等元素 用红外光谱仪来确定:物质中是否含有某些有 机基团
用原子吸收光谱确定:物质中是否含有哪些金 属元素
练习
1、能用来区别BaCl2、NaCl、Na2CO3三种物质的 试剂是( B ) A. AgNO3 B. 稀硫酸 C. 稀盐酸 D. 稀硝酸 2、在允许加热的条件下,只用一种试剂就可以鉴别 硫酸铵、氯化钾、氯化镁和硫酸铁溶液,这种试剂 是(A ) A.NaOH C.AgNO3 B.Na2CO3 D.BaCl2
脸,搂住了他の脖子."恩..."根汉点了点头,埋头栽在了那片雪白の风景中,黑夜中卧室里响起了壹阵阵优美の乐部分....壹夜无话,直到第二天午时,根汉和张素尔才相继醒过来.昨夜或许是因为喝了壹些酒の原因,他们都很疯,玩到深夜才终于是歇战了."都怪你,那么狠..."张 素尔感觉有些肿疼,没好气の嗔
完整版)高中化学实验汇总

完整版)高中化学实验汇总高中化学实验汇总一、《必修一》1、粗盐提纯这个实验的目的是除去粗盐中的泥沙、CaCl2、MgCl2和一些硫酸盐。
试剂的添加顺序应按照规定顺序添加。
实验操作包括:加水搅拌、过滤、再结晶等步骤。
2、溶液中SO42-检验方法这个实验介绍了检验溶液中SO42-的方法。
同时还介绍了检验溶液中Ag+的方法。
3、蒸馏这个实验介绍了蒸馏的仪器和注意事项,如沸石、冷却水流向、弃去开始的馏出液等。
4、萃取分液这个实验介绍了萃取分液的操作方法和注意事项,如查漏和观察溶液颜色。
同时还介绍了溴水、溴的CCl4溶液、液溴、溴蒸气、碘水、碘的CCl4溶液、碘、碘蒸气和玻璃塞上的小孔作用等知识点。
5、电解水这个实验介绍了气体摩尔体积、正氧负氢、氧一氢二等知识点。
同时还解释了实验中正负极气体体积比略小于1:2的原因。
6、一定物质的量浓度溶液的配制这个实验介绍了一定物质的量浓度溶液的配制方法。
7、胶体的性质和制备1) 制备氢氧化铁胶体的方法:将FeCl3加入NaOH溶液中,搅拌并加热,生成氢氧化铁胶体。
2) 丁达尔效应:将NaCl加入AgNO3溶液中,观察到白色沉淀,说明Ag+离子被Cl-离子取代,产生了丁达尔效应。
3) 浊液和胶体过滤后:浊液可以通过滤纸过滤,而胶体则需要使用特殊的过滤器,例如著名的___-赫维法。
补充:利用半透膜实验可以区分浊液、溶液和胶体。
半透膜只允许溶剂通过,而不允许悬浮物通过。
因此,溶液可以通过半透膜,而浊液和胶体则不能。
4) 电泳:带正电的胶粒会向阴极移动,而带负电的胶粒则会向阳极移动。
这种现象可以用于分离胶体中的不同成分。
8、离子反应1) Na2SO4 + KCl → 无明显反应。
2) Na2SO4 + BaCl2 → 生成白色沉淀,表明SO42-离子与Ba2+离子反应生成BaSO4.3) NaOH + HCl → 生成水和氯化钠。
4) CuSO4 + NaOH → 生成蓝色沉淀,表明Cu2+离子与OH-离子反应生成Cu(OH)2.5) NaOH(酚酞)+ HCl → 酚酞指示剂的颜色由粉红色变为无色,表明OH-离子被H+离子取代。
高一化学常见物质的检验

化 学 方 程
NH4
+的检验(铵盐)方法:
取样(少量放在试管中)与碱混合加热,若有刺
激性气味的气体产生,且该气使湿润的红色石 蕊试纸变蓝,证明该试样中含有NH4+。
实验原理:
NH Cl+NaOH==Na Cl +H O +NH
4 2
3
蓝 NH3 使湿润的红石蕊试纸变_____
实验2
实验药品:
4.焰色反应 根据焰色反应所呈现的特征焰色,可 检验金属或金属离子的存在
实验方法:
取一根铂丝,放在酒精灯的火焰上灼烧, 若火焰有颜色,可将铂丝在稀盐酸中蘸一下, 再灼烧至无色。用灼烧后的铂丝蘸取少许待 测物,放入火焰中灼烧,就会观察到不同颜 色的火焰 除杂 Na 为黄色
记
K为紫色(透过蓝色钴玻璃)
5. 仪器分析法:课本P22
用元素分析仪测定:物质中是否含C、H、O、 N、S、Cl、Br等元素 用红外光谱仪来确定:物质中是否含有某些有 机基团
用原子吸收光谱确定:物质中是否含有哪些金 属元素
练习
1、能用来区别BaCl2、NaCl、Na2CO3三种物质的 试剂是( B ) A. AgNO3 B. 稀硫酸 C. 稀盐酸 D. 稀硝酸 2、在允许加热的条件下,只用一种试剂就可以鉴别 硫酸铵、氯化钾、氯化镁和硫酸铁溶液,这种试剂 是(A ) A.NaOH C.AgNO3 B.Na2CO3 D.BaCl2
3、某溶液中含有大量的Cl-、SO42-、OH-三种离子, 如果只取一次就能够将3种阴离子依次检验出来, 下列实验操作顺序正确的是: ① 滴加Mg(NO3)2溶液 ③ 滴加Ba(NO3)2 ② 过滤 ④滴加AgNO3
①②③②④
或 ③②①②④
高中化学常见物质的检验

新东方在线高考网(/)网友分享高中化学常见物质的检验1.常见气体的检验常见气体检验方法氢气纯净的氢气在空气中燃烧呈淡蓝色火焰,混合空气点燃有爆鸣声,生成物只有水。
不是只有氢气才产生爆鸣声;可点燃的气体不一定是氢气氧气可使带火星的木条复燃氯气黄绿色,能使湿润的碘化钾淀粉试纸变蓝(O3、NO2也能使湿润的碘化钾淀粉试纸变蓝)氯化氢无色有刺激性气味的气体。
在潮湿的空气中形成白雾,能使湿润的蓝色石蓝试纸变红;用蘸有浓氨水的玻璃棒靠近时冒白烟;将气体通入AgNO3溶液时有白色沉淀生成。
二氧化硫无色有刺激性气味的气体。
能使品红溶液褪色,加热后又显红色。
能使酸性高锰酸钾溶液褪色。
硫化氢无色有具鸡蛋气味的气体。
能使Pb(NO3)2或CuSO4溶液产生黑色沉淀,或使湿润的醋酸铅试纸变黑。
氨气无色有刺激性气味,能使湿润的红色石蕊试纸变蓝,用蘸有浓盐酸的玻璃棒靠近时能生成白烟。
二氧化氮红棕色气体,通入水中生成无色的溶液并产生无色气体,水溶液显酸性。
一氧化氮无色气体,在空气中立即变成红棕色二氧化碳能使澄清石灰水变浑浊;能使燃着的木条熄灭。
SO2气体也能使澄清的石灰水变混浊,N2等气体也能使燃着的木条熄灭。
一氧化碳可燃烧,火焰呈淡蓝色,燃烧后只生成CO2;能使灼热的CuO由黑色变成红色。
甲烷无色气体,可燃,淡蓝色火焰,生成水和CO2;不能使高锰酸钾溶液、溴水褪色。
乙烯无色气体、可燃,燃烧时有明亮的火焰和黑烟,生成水和CO2。
能使高锰酸钾溶液、溴水褪色。
乙炔无色无臭气体,可燃,燃烧时有明亮的火焰和浓烟,生成水和CO2,能使高锰酸钾溶液、溴水褪色。
2.几种重要阳离子的检验(l)H+ 能使紫色石蕊试液或橙色的甲基橙试液变为红色。
(2)Na+、K+ 用焰色反应来检验时,它们的火焰分别呈黄色、浅紫色(通过钴玻片)。
(3)Ba2+ 能使稀硫酸或可溶性硫酸盐溶液产生白色BaSO4沉淀,且沉淀不溶于稀硝酸。
(4)Mg2+ 能与NaOH溶液反应生成白色Mg(OH)2沉淀,该沉淀能溶于NH4Cl溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2、Cl2:黄绿色刺激性气体有毒;①使湿润淀粉碘化钾试纸变蓝:Cl2+2KI=2KCl+I2 I2遇淀粉变蓝;②使湿润蓝色石蕊试纸先变红后变白:Cl2+H2O=HCl+HClO 6、NO2 :红棕色气体有刺激性气味、有毒,溶于水、水溶液呈酸性,能使紫色石蕊试液变红:3NO2+H2O=2HNO3+NO
7、NO:无色气体有毒;在空气中立即变为红棕色:2NO+O2=2NO2
9、SO2 :无色有刺激性气味、有毒;①通入品红溶液,品红褪色加热又恢复颜色;
②使澄清石灰水变浑浊:SO2+Ca(OH)2=CaSO3+H2O;③使酸性高锰酸钾溶液褪色:5SO2+2MnO4-+ 2H2O =2Mn2++5SO42--+4H+
10、HCl :无色刺激性气味;①能使湿润蓝色石蕊试纸变红:HCl=H++Cl-;
②用蘸浓氨水玻璃棒靠近冒白烟:NH3+HCl=NH4Cl;③气体通入HNO3酸化的AgNO3溶液,有白色沉淀生成:HCl+AgNO3=AgCl↓+HNO3 (AgCl不溶于HNO3)11、H2S:无色臭鸡蛋气味有毒;遇(CH3COO)2Pb 、CuSO4溶液均产生黑色沉淀:2CH3COO-+Pb2++H2S=PbS↓+2CH3COOH;Cu2++H2S=CuS↓+2H+ 12、NH3:无色刺激性气味;①遇湿润红色石蕊试纸变蓝:
NH3+H2ONH3·H2ONH4++OH-;②用蘸浓盐酸玻璃棒靠近冒白烟:
NH3+HCl==NH4Cl
15、C2H4:无色稍有气味;②使KMnO4(H+)溶液褪色;③使溴水褪色:
CH2==CH2+Br2→CH2Br-CH2Br2
16、C2H2:无色无味;;②使KMnO4(H+)溶液褪色;
③使溴水褪色:CH≡CH+2Br2→CHBr2-CHBr2
1、焰色反应:Na+:黄色;K+:紫色(透过蓝色钴玻璃观察);Ca2+:砖红色;
3、NH4+:在试液中加强碱(NaOH)加热,产生使湿润红色石蕊试纸变蓝的气体;NH4++OH-NH3↑+H2O;NH3+H2O NH3·H2O NH4++OH-
4、Fe3+ :①通KSCN或NH4SCN溶液呈血红色:Fe3++SCN-==[ Fe(SCN)]2+ ;
②通NaOH溶液红褐色沉淀:Fe3++3OH-==Fe(OH)3↓
5、Fe2+ :①遇NaOH溶液生成白色沉淀在空气中迅速转化成灰绿色最后变成红褐色沉淀:Fe3++2OH-=Fe(OH)2↓;4Fe(OH)2+O2+2H2O==4Fe(OH)3 ;②试液中加KSCN少量无明显变化再加氯水出现血红色;2Fe2++Cl2==2Fe3++2Cl-;Fe3++SCN-==[Fe(SCN)]2+
6、Mg2+:遇NaOH溶液有白色沉淀生成,NaOH过量沉淀不溶解:
Mg2++2OH-==Mg(OH)2↓,但该沉淀能溶于NH4Cl溶液;
7、Al3+ :遇NaOH溶液(适量)有白色沉淀生成,NaOH溶液过量沉淀溶解:Al3++3OH-==Al(OH)3↓;Al(OH)3+OH-==AlO2-+2H2O
8、Cu2+:遇NaOH溶液有蓝色沉淀生成,加强热变黑色沉淀:
Cu2++2OH-==Cu(OH)2↓;Cu(OH)2CuO+H2O
9、Ba2+ :遇稀H2SO4或硫酸盐溶液有白色沉淀生成,加稀HNO3沉淀不溶解:
Ba2++SO42-==BaSO4↓
10、Ag+;①加NaOH溶液生成白色沉淀,此沉淀迅速转变为棕色沉淀溶于氨水Ag++OH-==AgOH↓;2AgOH==Ag2O+H2O
AgOH+2NH3·H2O==[ Ag(NO3)2]OH+2H2O
②加稀HCl或可溶性氧化物溶液再加稀HNO3生成白色沉淀:Ag+ +Cl-==AgCl↓
1、OH-:OH-碱性:①遇紫色石蕊试液变蓝;②遇酚酞试液变红;③遇湿润红色石蕊试纸变蓝;
2、Cl-:遇AgNO3溶液有白色沉淀生成,加稀HNO3沉淀不溶解:Ag++Cl-=AgCl↓
3、Br-:加AgNO3溶液有浅黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++Br -=AgBr↓
4、I-:①加AgNO3溶液有黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++I-=AgI↓;
②加少量新制氯水后再加淀粉溶液显蓝色:2I-+Cl2=I2+2Cl-;I2遇淀粉变蓝
5、S2-:①加强酸(非强氧化性)生成无色臭鸡蛋气味气体:S2-+2H+=H2S↑;
②遇Pb(NO3)2或(CH3COO)2Pb试液生成黑色沉淀,遇CuSO4试液产生黑色沉淀:Pb2++S2-=PbS↓;Cu2++S2-=CuS↓
6、SO42-:加可溶性钡盐[BaCl2或Ba(NO3)2]溶液有白色沉淀生成后再加稀HCl 或稀HNO3沉淀不溶解:Ba2++SO42-=BaSO4↓
7、SO32-:加强酸(H2SO4或HCl)把产生气体通入品红溶液中,品红溶液褪色:SO32-+2H+=H2O+SO2↑ SO2使品红溶液褪色
8、CO32-:加稀HCl产生气体通入澄清石灰水,石灰水变浑浊:CO32-
+2H+=H2O+CO2↑;CO2+Ca(OH)2=CaCO3↓+H2O
9、HCO3-:取含HCO3-盐溶液煮沸,放出无色无味、使澄清石灰水变浑浊的气体;或向HCO3-溶液里加入稀MgSO4溶液,无现象,加热煮沸有白色沉淀MgCO3生成,同时放出CO2气体。
10、NO3-:浓缩试液加稀硫酸和铜片加热有红棕色气体产生,溶液变成蓝色:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
11、PO43-:加AgNO3溶液产生黄色沉淀,再加稀HNO3沉淀溶解:3Ag++PO43-=Ag3PO4↓;Ag3PO4溶于稀HNO3酸。
1、烯烃或炔烃:加少量溴水或酸性高锰酸钾溶液震荡后褪色。
2、苯或苯的同系物:加酸性高锰酸钾,前者不褪色后者褪色。
3、苯酚:加氯化铁溶液呈紫色,加浓溴水生成白色沉淀。
4、醛基:用新制的银氨溶液或新制的Cu(OH)2悬浊液检验,前者有银镜生成,后者有砖红色沉淀生成。
小结:①观察法:对于特殊颜色的气体如Cl2(黄绿色)、NO2(红棕色)、碘蒸气(紫红)可据此辨之。
②溶解法:根据溶于水的现象不同区分,如NO2和溴蒸气均为红棕色,但溶于水后NO2形成无色溶液;溴形成橙色溶液。
③褪色法:SO2和CO2可用品红溶液区分。
④氧化法:被空气氧化看变化,如NO的检验。
⑤试纸法:如石蕊试纸、醋酸铅试纸。
⑥星火发:适用于有助燃性或可燃性的气体检验,如O2使带火星木条复燃;CH4 和C2H2的检验可点燃看现象;CH4、CO、H2则可根据其燃烧产物来判断。
