化学必修二专题3 第一单元 课时2
合集下载
人教版化学必修二全册精品讲义全课件

答案 深;固;难;差
名师解惑
一、元素的金属性、非金属性强弱的判断依据 1.金属性强弱的判断依据 (1)元素的单质与水或酸置换出氢气的反应越容易进行, 则其金属性越强。 (2)元素的最高价氧化物对应水化物的碱性越强,则其金 属性越强。 (3)金属元素的单质与盐在水溶液中进行置换反应,若A 置换出B,则A的金属性强于B。 (4)在金属活动性顺序表中,前者的金属性强于后者。 (5)金属阳离子的氧化性越强,则其单质的还原性越弱, 元素的金属性越弱(注:Fe的阳离子仅指Fe2+)。
3.Ⅷ族包括周期表中第8、9、10三个纵行,其余15个 纵行,每个纵行为一族,因此周期表18个纵行共16个族。
4.周期表中族的排列方式 1~7纵行:ⅠA→ⅡA→ⅢB→…→ⅦB 8、9、10纵行:Ⅷ 11~18纵行:ⅠB→ⅡB→ⅢA→…→ⅦA→0 5.过渡元素包括所有的副族元素和Ⅷ族元素,且都是 金属元素。
自学导引
一、碱金属元素
1.原子结构
元素
元素
核电
名称
符号 荷数
锂
Li
3
碱
金
钠
Na
11
属
钾
K
19
元
素
铷
Rb
37
原子结构 示意图
最外层 电子数
1
1
1
1
电子
原子
层数 半径/nm
2
0.152
3
0.186
4
0.227
5
0.248
铯
Cs
55
1
6
0.265
相同点:最外层均为1个电子。 不同点:随着核电荷数的增加,电子层数递增,原子半 径递增。 2.化学性质 (1)钾的化学性质的实验探究及其与钠的比较 ①钾的保存及取用方法
教案:必修2 专题3 有机化合物的获得与应用 第1单元 化石燃料与有机化合物3
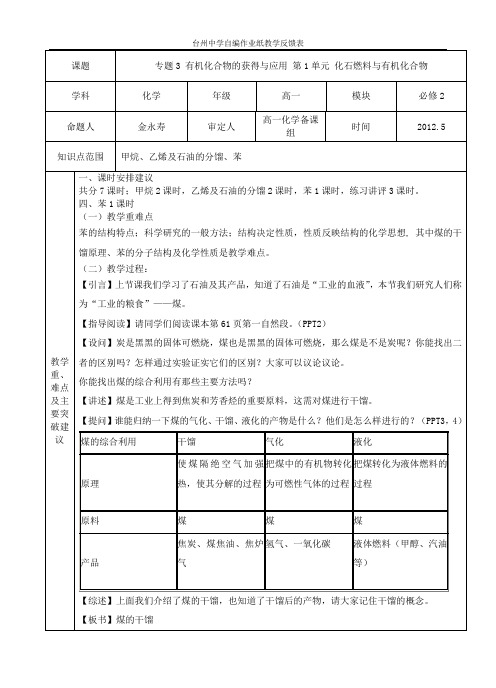
【讲解】 苯分子的结构特点: (1)苯分子是平面六边形的稳定结构; (2)苯分子中碳碳之间的 键是介于碳碳单键与碳碳双键之间的一种独特的键; (3)苯分子中六个碳原子等效,六个氢原
台州中学自编作业纸教学反馈表
子等效。 【问题解决】P67 【过渡】结构决定性质,苯具有哪些性质呢? 【板书】三、化学性质 【演示实验】观察与思考【实验 3】 1.可燃性 明亮的火焰,有黑烟。 【学生阅读】 P63 【提问】看看苯还有什么化学性质?这是一个什么反应类型? 【学生回答】取代反应 【板书】2.取代反应(PPT9) + Br2 + HO—NO2
台州中学自编作业纸教学反馈表
把煤隔绝空气加强热使它分解的过程,叫做煤的干馏。 【提问】大家议论,前面讲的石油分馏和今天讲的煤的干馏有何区别?(PPT5) 【点题]: 从煤焦油中分离得到一种重要的化工原料----苯。 我们今天要来认识的一种新的烃— —苯。 【板书】苯 【板书】一、苯的物理性质 【展示】苯样品 【演示实验] P66 观察与思考【实验 1] 向试管中滴入 3~5 滴苯,观察苯的颜色与状态。再向 试管中加入少量水,振荡后静置,观察发生的现象。 (PPT6) 【板书】 1.无色、有特殊气味的液体。 【板书] 2.比水轻、不溶于水,易溶于酒精等有机溶剂 3.沸点是 80.1℃,熔点是 5.5℃ 【过渡] 法拉第发现苯以后,法国化学家日拉尔立即对苯的组成进行测定,他发现苯仅有碳、 氢两种元素组成,其中碳元素的质量分数为 92.3%。苯蒸气的密度为同温同压下乙炔的 3 倍,你 能确定苯的分子式吗? 【板书]二、苯分子的结构 1.分子式:C6H6 【思考] 按照学习烷烃、 烯烃和炔烃的经验, 你能通过苯的分子式 C6H6 提出对苯分子结构的猜 想假设吗? 【学生活动] 写出可能的几种链烃的结构简式 A. CH≡C—CH2—CH2—C≡CH C. CH2=CH-CH=CH-C≡CH B. CH3—C≡C—C≡C-CH3 D. HC≡C-CH2-C≡C-CH3
苏教版高中化学选择性必修2物质结构与性质精品课件 专题3 晶体密度及晶胞参数的有关计算 (2)

2
1
6× =3,Z
2
EF,C 项正确;
的个数为
1
8× =1,
8
2.食盐晶体的晶胞结构如图所示。已知食盐的密度为ρ g·cm-3,其摩尔质量
为M g·mol-1,阿伏加德罗常数的值为NA,则在食盐晶体中Na+和Cl-的核间距
大约是( D )
A.
C.
3
2
A
3
2A
cm
cmB.D.38A
硝酸钾和木炭粉按一定比例混合而成的,爆炸时发生的反应为
2KNO3+S+3C══K2S+N2↑+3CO2↑。生成物K2S的晶体结构如图。下列有
关说法正确的是( D )
A.反应产物中N2的电子式为N︙︙N
B.1 mol CO2和1 mol N2含有的π键数目
之比为1∶2
C.K2S晶体中阴、阳离子的配位数分别为4和8
3 ×A
g·cm 。(2)该晶胞中 Co 个数为
(×10-7 )3
2+
-3
(59+16)×4
晶胞质量为
A
300
g
A
620
g=
A
=
3×1023
A · 3
300
g=
A
g,则晶体密度为
620
A
3
g·nm-3=
1
12×4+1=4,O2-个数为
1
1
8×8+6×2=4,
g,晶胞体积为(a×10-7 cm)3,故晶体的密度为
g·cm
g·cm
解析 1个氯化铯晶胞中有1个Cs+和1个Cl-,
1 mol氯化铯晶体的体积为NAa3 cm3、质量为M g,
1
6× =3,Z
2
EF,C 项正确;
的个数为
1
8× =1,
8
2.食盐晶体的晶胞结构如图所示。已知食盐的密度为ρ g·cm-3,其摩尔质量
为M g·mol-1,阿伏加德罗常数的值为NA,则在食盐晶体中Na+和Cl-的核间距
大约是( D )
A.
C.
3
2
A
3
2A
cm
cmB.D.38A
硝酸钾和木炭粉按一定比例混合而成的,爆炸时发生的反应为
2KNO3+S+3C══K2S+N2↑+3CO2↑。生成物K2S的晶体结构如图。下列有
关说法正确的是( D )
A.反应产物中N2的电子式为N︙︙N
B.1 mol CO2和1 mol N2含有的π键数目
之比为1∶2
C.K2S晶体中阴、阳离子的配位数分别为4和8
3 ×A
g·cm 。(2)该晶胞中 Co 个数为
(×10-7 )3
2+
-3
(59+16)×4
晶胞质量为
A
300
g
A
620
g=
A
=
3×1023
A · 3
300
g=
A
g,则晶体密度为
620
A
3
g·nm-3=
1
12×4+1=4,O2-个数为
1
1
8×8+6×2=4,
g,晶胞体积为(a×10-7 cm)3,故晶体的密度为
g·cm
g·cm
解析 1个氯化铯晶胞中有1个Cs+和1个Cl-,
1 mol氯化铯晶体的体积为NAa3 cm3、质量为M g,
人教版高中化学必修二课件3.2.1

合生成新的化合物的反应,其特点是:“断一加二,都进来”。“断一”是指双键 中的一个不稳定键断裂;“加二”是指加两个其他原子或原子团,每一个不饱 和碳原子上各加上一个。
22
首页
J 基础知识 ICHU ZHISHI
Z S 重点难点 HONGDIAN NANDIAN
随堂练习
UITANG LIANXI
探究一
③乙烯因为含有碳碳双键,能和溴水、H2、HX 等发生加成反应,能被酸 性高锰酸钾溶液氧化。
12
探究一
探究二
首页
J 基础知识 ICHU ZHISHI
Z S 重点难点 HONGDIAN NANDIAN
随堂练习
UITANG LIANXI
●名师精讲●
1.乙烯的分子结构特点
2.乙烯的性质特点 碳碳双键中的一个键易断裂,易发生加成反应。结构决定性质,乙烯的 化学性质(能被酸性高锰酸钾溶液氧化、发生加成反应)主要是由碳碳双键 所决定的,与碳氢键无关。
随堂练习
UITANG LIANXI
探究一
探究二
2.取代反应和加成反应的比较
类型
取代反应
反应物
结构特 含有易被取代的原子或原子团
征
生成物
两种(一般是一种有机物和一种无 机物)
碳碳键
变
无变化
化情况
结构变 化
等价替换式
实例
CH3CH3+Cl2 CH3CH2Cl+HCl
加成反应 不饱和的有机化合物(含双键 等)
原子仍共平面。
3.甲烷和乙烯都是可燃性气体,两者在空气中燃烧的现象有什么区别?
提示:甲烷在空气中燃烧,产生淡蓝色火焰,乙烯在空气中燃烧,火焰明
亮,并伴有黑烟。二者燃烧现象不同的原因是乙烯分子中含碳量高,在空气
22
首页
J 基础知识 ICHU ZHISHI
Z S 重点难点 HONGDIAN NANDIAN
随堂练习
UITANG LIANXI
探究一
③乙烯因为含有碳碳双键,能和溴水、H2、HX 等发生加成反应,能被酸 性高锰酸钾溶液氧化。
12
探究一
探究二
首页
J 基础知识 ICHU ZHISHI
Z S 重点难点 HONGDIAN NANDIAN
随堂练习
UITANG LIANXI
●名师精讲●
1.乙烯的分子结构特点
2.乙烯的性质特点 碳碳双键中的一个键易断裂,易发生加成反应。结构决定性质,乙烯的 化学性质(能被酸性高锰酸钾溶液氧化、发生加成反应)主要是由碳碳双键 所决定的,与碳氢键无关。
随堂练习
UITANG LIANXI
探究一
探究二
2.取代反应和加成反应的比较
类型
取代反应
反应物
结构特 含有易被取代的原子或原子团
征
生成物
两种(一般是一种有机物和一种无 机物)
碳碳键
变
无变化
化情况
结构变 化
等价替换式
实例
CH3CH3+Cl2 CH3CH2Cl+HCl
加成反应 不饱和的有机化合物(含双键 等)
原子仍共平面。
3.甲烷和乙烯都是可燃性气体,两者在空气中燃烧的现象有什么区别?
提示:甲烷在空气中燃烧,产生淡蓝色火焰,乙烯在空气中燃烧,火焰明
亮,并伴有黑烟。二者燃烧现象不同的原因是乙烯分子中含碳量高,在空气
2-1有机物中碳原子的成键特点及有机物的结构表示方法(课件)高中化学苏教版(2019)选择性必修3

2. (CH3)2C==C(CH3)C(CH3)==C(CH3)2中最多有几个碳原子共面, 最少有几个碳原子共面?
最少6个碳原子(因双键与双键之间的碳碳单键可以转动),最多 10个碳原子共面。
3. 请写出下列有机化合物的结构简式和键线式。
_C_H__2=_=_C__H_C__H_2_C__H_2_O_H______、____________________。
结构简式:在结构式的基础上,省略碳氢键,也可省略碳碳单键,还 可合并相同的部分。 例2. 写出正戊烷、1-丁烯的结构简式。 注意事项:
1.表示单键的“—”:C-H一般省略;其它单键可以省略;上下连接 “│”不能省略。 2.表示双键和三键的“=”和“≡”:C=C和C≡C不能省略;C=O可 以省略。 3.准确表示分子中原子成键的情况(原子间连接情况)
专题二 有机物的结构与分类 第一单元 有机化合物的结构 第1课时 有机物中碳原子的成键特点及结构的表示
方法
学习目标 1. 认识有机化合物的成键特点。 2. 熟知有机物分子形状与碳原子成键方式的关系。 3. 学会有机物分子结构的表示方法。
碳原子的成键特点
1. 你知道有机物种类繁多的原因吗? (1)有机物中碳原子间可以形成长短不一的碳链骨架 (2)同分异构现象的普遍存在 2. 请说出碳在周期表中的位置,它与其他原子之间易形成哪种类型的化学键? 碳原子在元素周期表中位于第二周期ⅣA族; 碳原子中含有4个价电子,可以跟其它原子形成4个共价键。
分子式: C2H4O2 O
结构简式: CH3 C OH
键线式:
O OH
分子式: C6H12O6 结构简式: CH2OH CHOH CHOH CHOH CHOH CHO
键线式: HO
高中化学选择性必修二 试卷讲义 学习笔记目录

第一章原子结构与性质1第一节原子结构/1第1课时能层与能级基态与激发态/1第2课时构造原理与电子排布式电子云与原子轨道/4第3课时泡利原理、洪特规则、能量最低原理/8微专题1核外电子排布的规范书写与应用/11第二节原子结构与元素的性质/13第1课时原子结构与元素周期表/13第2课时元素周期律/16微专题2元素推断与元素周期律的综合应用/20体系构建体验高考/22第二章分子结构与性质24第一节共价键/24第1课时共价键/24第2课时键参数——键能、键长与键角/27第二节分子的空间结构/30第1课时分子结构的测定和多样性价层电子对互斥模型/30 第2课时杂化轨道理论/35微专题3分子(或离子)空间结构与杂化轨道理论/38研究与实践制作分子的空间结构模型/40第三节分子结构与物质的性质/41第1课时共价键的极性/41第2课时分子间的作用力分子的手性/43第3课时分子结构对物质性质的影响/47体系构建体验高考/49第三章晶体结构与性质52第一节物质的聚集状态与晶体的常识/52微专题4关于晶胞结构的三个常考点/56第二节分子晶体与共价晶体/59第1课时分子晶体/59第2课时共价晶体/62第三节金属晶体与离子晶体/65第1课时金属晶体离子晶体/65第2课时过渡晶体与混合型晶体、晶体类型的比较/69第3课时晶体结构的计算常见晶体结构的比较与分析/72研究与实践明矾晶体的制备/76第四节配合物与超分子/77实验活动简单配合物的形成/81体系构建体验高考/83练透(另成册85~140、141~156), 答案精析(另成册157~203)。
高中化学苏教版必修2课件:专题3 第一单元 第二课时 石油炼制 乙烯
高温 D.CH3CH2CH2CH3――→C2H4+C2H6
解析:A 为取代反应,B 为氧化反应,D 为裂解。
答案:C
3.下列关于乙烯的说法正确的是
()
A.分子中的 6 个原子在同一平面上
B.通常状况下,是易溶于水的气体
C.与酸性高锰酸钾溶液的反应是加成反应
D.不能发生燃烧反应
解析:A 项,乙烯是平面分子,分子中的 6 个原子在同一平面
(包括石油气)
石油气、汽油、 主要产品 煤 油 、 柴 油 、 重
油、沥青等
优质汽油
乙烯、丙烯等
主要变 化类型
物理变化
化学变化
化学变化
2.直馏汽油和裂化汽油的区别
石油分馏、裂化所生产的汽油分别叫做直馏汽油和裂化
汽油,二者的区别如下:
获得方法
主要化学成分
鉴别方法
C5~C12的烷烃、 直馏 原油直接分馏, 环烷烃及少量的
烃断裂成乙烯、丙烯等小分子烃;催化裂化的目的是提高
汽油等轻质油的产量和质量,特别是提高汽油的产量。
答案:D
2.下图是石油分馏塔的示意图。a、b、c 三种馏分中 ( )
A.a 的沸点最高
B.b 的熔点最低
C.c 的平均相对分子质量最大 D.每一种馏分都是纯净物
解析
解析:石油经加热后从下部进入分馏塔中,随着气体的上升 温度逐渐降低,沸点高的馏分首先冷凝从下部流出,越往上 馏分沸点越低,故 a 处馏分沸点最低,A 错误;b 处馏分熔 点介于 a、c 之间,B 错误;C 处的平均相对分子质量是最大 的,C 正确;而石油分馏的馏分中都含有不同碳原子数的烃, 所以石油的馏分都是混合物,D 错误。 答案:C
2.乙烯的特征反应及应用 (1)乙烯的两个特征反应: ①能使溴水褪色(加成反应); ②能使酸性 KMnO4 溶液褪色(氧化反应)。 (2)鉴别甲烷和乙烯的方法: ①通入溴水中,褪色的为乙烯; ②通入酸性 KMnO4 溶液中,褪色的为乙烯; ③点燃时,火焰明亮并伴有黑烟的为乙烯。 (3)除去甲烷中混有乙烯的方法:溴水或溴的四氯化碳溶液, 不能使用酸性 KMnO4 溶液。
人教版高中化学必修二1.3《化学键(第二课时)》课件教学课件
第一章
第3节 化学键
第二课时
学习目标:
1、知道共价键的形成 2、认识化学键的含义
重难点
共价键的本质,用电子式表 示共价化合物的形成过程
【体验】
氢气与氯气反应
氯化氢的形成
【设疑】大家思考一下,氯气与氢气反应生成氯 化气的过程跟氯气与钠反应生成氯化钠 的过程有什么不同?
氯化氢的形成
【生成 】
二、共价键
含有共价键的化合物不一定是共价化合物
【设疑】HCl中,为什么H显+1价 ,为什么Cl 显-1价?为什么单质显0价?
+1 - 1
共用电子对偏向对其吸引力更 强的一方
H:H 共用电子பைடு நூலகம்不发生偏向
【生成】
共用电子对偏向一方原子
的共价键称为极性共价键
共用电子对不发生偏向
的共价键称为非极性共价键
【生成】
共价键 两种相同或不同 的非金属化合
原子
离子键
活泼金属与活 泼非金属化合
阴、阳离子
成键本质 化合物电子式
形成共用电子对
静电作用
Na +[ •X ••C••l •• ]-
【体验】 阅读:阅读课本p22思考
1、什么叫分子间作用力?它有何特点? 2、什么叫氢键?它有何特点? 3、分子间作用力和氢键 是化学键吗?
1.概念:
原子间通过共用电子对所形成的相互作用
成键微粒: 原子
注 共价键的实质:原子间的静电作用。 意 成键元素:非金属元素之间
【体验】 2.共价键的形成条件: 一般是非金属原子之间
共价化合物:以共用电子对形成分子的化合物
如:H2 N2 HCl H2O HF 等 3.共价键的表示方法 (1)电子式:
第3节 化学键
第二课时
学习目标:
1、知道共价键的形成 2、认识化学键的含义
重难点
共价键的本质,用电子式表 示共价化合物的形成过程
【体验】
氢气与氯气反应
氯化氢的形成
【设疑】大家思考一下,氯气与氢气反应生成氯 化气的过程跟氯气与钠反应生成氯化钠 的过程有什么不同?
氯化氢的形成
【生成 】
二、共价键
含有共价键的化合物不一定是共价化合物
【设疑】HCl中,为什么H显+1价 ,为什么Cl 显-1价?为什么单质显0价?
+1 - 1
共用电子对偏向对其吸引力更 强的一方
H:H 共用电子பைடு நூலகம்不发生偏向
【生成】
共用电子对偏向一方原子
的共价键称为极性共价键
共用电子对不发生偏向
的共价键称为非极性共价键
【生成】
共价键 两种相同或不同 的非金属化合
原子
离子键
活泼金属与活 泼非金属化合
阴、阳离子
成键本质 化合物电子式
形成共用电子对
静电作用
Na +[ •X ••C••l •• ]-
【体验】 阅读:阅读课本p22思考
1、什么叫分子间作用力?它有何特点? 2、什么叫氢键?它有何特点? 3、分子间作用力和氢键 是化学键吗?
1.概念:
原子间通过共用电子对所形成的相互作用
成键微粒: 原子
注 共价键的实质:原子间的静电作用。 意 成键元素:非金属元素之间
【体验】 2.共价键的形成条件: 一般是非金属原子之间
共价化合物:以共用电子对形成分子的化合物
如:H2 N2 HCl H2O HF 等 3.共价键的表示方法 (1)电子式:
苏教版高中化学必修二课件专题2-第3单元-第1课时
●新课导入建议 在我们生活中,手机用的电池,机动车上的铅蓄电池、 干电池等,这些电池的电能是如何转化来的?原理是什么? 这些问题本课时将给出答案。
●教学流程设计
演示结束
课标解读
重点难点
1.通过铜锌原电池的实验探 究,初步了解原电池原理。 2.了解化学电源的原理与应 用。 3.了解钢铁的电化学腐蚀。
(4)从反应类型上判断 发生氧化反应的是负极,发生还原反应的是正极。 (5)从反应现象上判断 溶解的是负极,有气泡产生或固体析出的是正极。 (6)从离子移动上判断 阴离子移向的是负极,阳离子移向的是正极。
原电池的组成条件 (1)有活泼性不同的两个电极。活泼的金属是电池的负 极,不活泼金属(或非金属导体)是电池的正极。 (2)有电解质溶液,且负极能与电解质溶液发生自发的氧 化还原反应; (3)构成闭合回路或接触。
1.原电池反应原理及应用。 (重点) 2.电极反应和电池反应的书 写。(重难点)
原电池原理
1.铜锌原电池 (1)装置:
(2)现象:Zn 片 逐渐溶解 ,Cu 片上有 大量气泡 产生,
电流计指针发生偏转。 (3)电子流向:由 锌极 流向 铜极 。 (4)电流方向: 铜极 →导线→ 锌极 。 (5)离子流向:电解质溶液中, H+、Zn2+
利用反应 Zn+2FeCl3===ZnCl2+2FeCl2 设计 一个原电池。在图中方格内画出实验装置图,并指出正极为 ________,电极反应式为____________________________;
负极为________,电极反应式为__________________。
【解析】 首先将已知的反应拆成两个半反应(即失去电 子和得到电子的反应):Zn-2e-===Zn2+,2Fe3++2e-===2Fe2 +;然后结合原电池的工作原理分析可知,该电极的负极应用 锌作材料,正极要保证 Fe3+得到负极失去的电子,一般可用 不能还原 Fe3+的材料(如铂、碳棒等)作正极,电解质溶液只 能用 FeCl3 溶液。
(苏教版)化学必修二同课异构课件:3.1.2烷、烃【A案】
相同 ①通式_____ 同 一类物质:碳、碳单键形成链状 ②是____ 同 ; ③组成元素_____ ④化学式量相差14n; ⑤结构相似但不完全相同; ⑥化学性质相似。
烷烃物理性质的递变性
1、C原子数目1~4,是气体;
C原子数目5~16,是液体; C原子数目16以上,是固体(常温下测定)
规律:CnH2n+2(n≥1)状态:气 液 固;熔沸点依次升高,相对 密度依次增大且小于1,均不溶于水。
2、用三个甲基、一个次甲基组成一种结构 CH3
CH3-CH- CH3 3、分别写出它们的分子式
C4H10
C4H10
烷烃的命名法:
1、习惯命名法 ⑴以烷烃分子中碳原子数命名。按分子中的 碳原子数称为“某烷”,碳原子数在10以 内用“天干数字”表示。“天干”:甲、 乙、丙、丁、戊、己、庚、辛、壬、癸。 ⑵碳原子数在10以上用中文数字表示。
③
属于同分异构体的是:
⑥
Cl
Cl
⑥CH3CH2CHCH(CH3)CH(CH3)CH3和 CH3CH2CH(CH3)CH(CH3)3
同位素、同素异形体、同系物、同分异构体 四概念的比较
概念 同位素 同素异形体 同系物 同分异构体 内 涵
质子数等,中子数 不等,原子之间
同一元素 形成的不 同单质 结构相似,组成 上差一个或n个CH2 相同分子式,不 同结构的化合物
CH 3CH 3 Cl 2 光照
丙烷、丁烷的一氯取代物有几种?
(3) 高温下发生裂解反应
C16 H 34 C8 H 18 C8 H 16
高温
同分异构体
1、化合物分子式相同而结构不同的现象, 叫做同分异构现象 具有相同分子式不同结构的化合物互称为同分异构体
烷烃物理性质的递变性
1、C原子数目1~4,是气体;
C原子数目5~16,是液体; C原子数目16以上,是固体(常温下测定)
规律:CnH2n+2(n≥1)状态:气 液 固;熔沸点依次升高,相对 密度依次增大且小于1,均不溶于水。
2、用三个甲基、一个次甲基组成一种结构 CH3
CH3-CH- CH3 3、分别写出它们的分子式
C4H10
C4H10
烷烃的命名法:
1、习惯命名法 ⑴以烷烃分子中碳原子数命名。按分子中的 碳原子数称为“某烷”,碳原子数在10以 内用“天干数字”表示。“天干”:甲、 乙、丙、丁、戊、己、庚、辛、壬、癸。 ⑵碳原子数在10以上用中文数字表示。
③
属于同分异构体的是:
⑥
Cl
Cl
⑥CH3CH2CHCH(CH3)CH(CH3)CH3和 CH3CH2CH(CH3)CH(CH3)3
同位素、同素异形体、同系物、同分异构体 四概念的比较
概念 同位素 同素异形体 同系物 同分异构体 内 涵
质子数等,中子数 不等,原子之间
同一元素 形成的不 同单质 结构相似,组成 上差一个或n个CH2 相同分子式,不 同结构的化合物
CH 3CH 3 Cl 2 光照
丙烷、丁烷的一氯取代物有几种?
(3) 高温下发生裂解反应
C16 H 34 C8 H 18 C8 H 16
高温
同分异构体
1、化合物分子式相同而结构不同的现象, 叫做同分异构现象 具有相同分子式不同结构的化合物互称为同分异构体
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
本 课 栏 目 开 关
⑥ 物质的是________。 A.①② F.④⑥ B.②③
⑦
其中,属于同系物
的是 ________;属于同分异构体的是 ________;属于同种 C.③④⑤⑥⑦ D.①③ E.③④⑤⑦
学习· 探究区
第2课时
解析
7 种物质均为烷烃,若碳原子数不同,则互为同系物;
若碳原子数相同,而结构不同,则互为同分异构体;若碳原 子数相同,且结构也相同,则为同一种物质。7 种物质的分子 式分别为①C5H12 ②C5H12 ③C6H14 ⑤C6H14 ⑥C6H14 ④C6H14 ⑦C6H14 。 所 以 ①② 中 任 一 物 质 与
本 课 栏 目 开 关
学习· 探究区
第2课时
3n+1 点燃 ②烷烃完全燃烧的通式为 CnH2n+2+ O2――→nCO2+(n 2 +1)H2O。 ③在光照条件下,烷烃与 Cl2、Br2 等卤素单质的气体发生取 代反应,生成多种卤代产物和相应的卤化氢气体。 CnH2n+ 2 光照 +X2――→CnH2n+1X+HX,CnH2n+1X 可与 X2 继续发生取代 反应。
学习· 探究区
第2课时
2.结构相似、分子组成上相差一个或若干个 CH2 原子团的物 质互为同系物。 (1)烷烃同系物分子式的通式为 CnH2n+2, 所以二十烷的分子 式为C20H42 。 (2)写出下列各烷烃的分子式。 ①烷烃 A 蒸气的密度是同温同压下 H2 的 36 倍: C5H12 。 ②烷烃 B 的分子中含有 200 个 H: C99H200 。
烃类化合物几乎都不溶于水,所以 B 也不正确;
烷烃与溴水、酸性高锰酸钾均不反应,故 D 不正确。
学习· 探究区
第2课时
探究点二
同系物
同分异构体
本 课 栏 目 开 关
1.观察比较甲烷、乙烷和丙烷的结构简式,你能看出它们之 间在分子组成上存在什么样的关系吗?
答案 相邻烷烃分子在组成上均相差一个 CH2 原子团。
本 课 栏 目 开 关
( A )
自我· 检测区
第2课时
4.有下列各组微粒或物质: A.O2 和 O3
13 B.12 C 和 6 6C
本 课 栏 目 开 关
C.CH3CH2CH2CH3 和
D.
和
E.CH3CH2CH2CH3 和 (1)______组两种微粒互为同位素。 (2)______组两种物质互为同素异形体。
( B )
本 课 栏 目 开 关
学习· 探究区
第2课时
2.下列属于烷烃特有性质的是 A.在空气中完全燃烧的产物为二氧化碳和水 B.它们几乎不溶于水 C.可与氯气在光照下发生取代反应
( C )
本 课 栏 目 开 关
D.可与溴水中的溴发生取代反应;可使酸性高锰酸钾溶液 褪色
解析 烃类化合物完全燃烧的产物均为二氧化碳和水, 因 此 A 不是烷烃的特有性质;
本 课 栏 目 开 关
学习· 探究区
第2课时
[活学活用] 1.下列关于烷烃的叙述,不正确的是 A.在烷烃分子中,只有单键 B.烷烃的通式为 CnH2n+2,符合该通式的烃不一定是烷烃 C.烷烃在一定条件下都能与 Cl2 发生取代反应 D.随着碳原子数的增加,烷烃的熔、沸点逐渐升高
解析 烷烃中的碳碳键、碳氢键均为单键;烷烃在一定条 件下都能与 Cl2 发生取代反应,取代反应是烷烃的典型性 质;随着碳原子数的增加,烷烃的分子间作用力增大,使 其熔、沸点逐渐升高;因烷烃分子中的氢原子已达饱和, 故符合 CnH2n+2 的有机物只能是烷烃。
学习· 探究区
第2课时
4.烷烃 (CnH2n+ 2)的习惯命名法 (1)当碳原子数 n≤ 10 时,用 甲、乙、丙、丁、戊、己、 庚、辛、壬、癸 表示;若 n>10 时,用中文数字表示。 如:C8H18 命名为 辛烷 , C18H38 命名为 十八烷 。 (2)当碳原子数 n 相同时,用 正、异、新 来区别。 如:CH3CH2CH2CH2CH3 称为 正戊烷 ,
本 课 栏 目 开 关
称为 异戊烷 ,
称为 新戊烷 。
学习· 探究区
第2课时
[归纳总结] (1)烷烃的结构特点 ①烷烃分子里碳原子间都以 单键 相连接, 每个碳原子最多 能以 4于等于 3 时)不在一条直线 上。直链烷烃空间构型是折线形或锯齿状。 (2)烷烃的化学性质 ①通常较稳定, 不能被酸性高锰酸钾溶液等强氧化剂氧化, 也不能与强酸、强碱发生反应。
探究点一 烷烃 1.由碳、氢两种元素组成的有机物称为烃,烃有多种,其中与 甲烷结构相似的有很多,如
本 课 栏 目 开 关
试归纳出它们的结构特点。
答案 这类物质的结构特点是每个碳原子形成四个共价 键,且原子之间只以单键相连成链状;碳原子的剩余价键 均与氢原子结合。
学习· 探究区
第2课时
2.烃分子中碳原子之间都以 碳碳单键 结合成链状,剩余价键均 与氢原子结合, 使每个碳原子的化合价都达到“ 饱和 ”, 这 样的烃叫做饱和链烃,也称烷烃。其分子通式为 CnH2n+2(n
化合物 。 甲烷 是组成最简单的烃。甲烷的组成与结构:
分子式 结构式 球棍模型 比例模型
CH4
结构特点 原子之间以 单键 结合,空间构型为 正四
面体 ,碳原子位于 正四面体的中心 。
知识· 回顾区
第2课时
2.通常状况下,甲烷的性质 稳定 ,与强氧化剂如 酸性KMnO4 、 强酸、 强碱等均 不 发生化学反应。 但在一定条件下可以燃烧,
答案
(异丁烷)都是烷烃,
本 课 栏 目 开 关
它们是同系物吗?比较二者的组成和结构,判断它们是否
二者分子式相同,组成上并不相差 CH2 原子团,故
它们不是同系物。二者结构相似,碳碳之间都是以单键结 合成链状,但结构并不相同,正丁烷无支链,异丁烷有支 链,所以它们互为同分异构体。
学习· 探究区
第2课时
本 课 栏 目 开 关
学习· 探究区
第2课时
[活学活用] 3.下列各组物质互为同系物的是 A.O2 和 O3 B.CH4 和 C3H8 C.CH3CH2CH2CH3 和(CH3)3CH
2 D.1 H 和 1 1H
( B )
本 课 栏 目 开 关
解析
结构相似,在分子组成上相差一个或若干个 CH2 原
本 课 栏 目 开 关
解析
烷 烃 分 子 组 成 的 通 式 为 CnH2n + 2 。 (1)Mr(A) =
D×Mr(H2)=36×2=72,14n+2=72, n=5, A 为 C5H12。 (2)2n +2=200,n=99,B 为 C99H200。
学习· 探究区
第2课时
3.CH3CH2CH2CH3(正丁烷)与 为同分异构体?
本 课 栏 目 开 关
③④⑤⑥⑦中任一物质均属于同系物;①②结构相同,属于 同 种 物 质 , ④⑥ 结 构 相 同 , 属 于 同 种 物 质 ; ③④⑤⑦ 或 ③⑤⑥⑦互为同分异构体。
答案 B、D E A、F
学习· 探究区
第2课时
本 课 栏 目 开 关
自我· 检测区
第2课时
1.下列物质中,不属于烷烃的是 A.CH4 B.C3H8 C.C4H8 D.C5H12
自我· 检测区
第2课时
本 课 栏 目 开 关
(3)______组两种物质属于同系物。 (4)______组两物质互为同分异构体。 (5)______组两物质是同一物质。
答案 (1)B
(2)A
(3)C
(4)E
(5)D
自我· 检测区
第2课时
本 课 栏 目 开 关
5.写出下列烷烃的分子式 (1)同温同压下,烷烃的蒸气密度是 H2 的 43 倍: C6H14 。 (2)分子中含有 22 个共价键的烷烃: C7H16 。 (3)分子中含有 30 个氢原子的烷烃: C14H30 。 (4)室温下相对分子质量最大的直链气态烷烃: C4H10 。
1 子团的物质互称为同系物。O2 和 O3 互为同素异形体;1 H
和2 1H 互为同位素;CH3CH2CH2CH3 和(CH3)3CH 分子式相 同,结构不同,互为同分异构体;只有 CH4 和 C3H8 满足同 系物的概念。
学习· 探究区
第2课时
4.有下列结构的物质:①CH3(CH2)3CH3 ②CH3CH2CH2CH2CH3 ④ ③CH3CH2CH2CH2CH2CH3 ⑤
本 课 栏 目 开 关
4.用结构简式写出戊烷(C5H12)的同分异构体。
答案 CH3CH2CH2CH2CH3、
、
。
学习· 探究区
第2课时
[归纳总结] (1)判断两种化合物互为同系物的关键是看: 同:两种物质属于同一类物质,物质结构相似 差:两种物质分子组成上相差一个或若干个 CH2 原子团 (2)判断两种化合物互为同分异构体的关键是 先看分子式是否相同(相对分子质量相同,但分子式不一定 相同); 再看结构是否不同(原子或原子团连接顺序不同, 空间排列 不同)。
本 可以发生取代反应。 课 栏 目 3.有机化合物的结构特点(碳原子成键类型具有多样性) 开 (1)每个碳原子能与其他原子形成 4 个共价键。 关
(2)碳原子与碳原子之间可以形成 单键 ( 或 叁键 ( )。
)、 双键 (
)
(3)碳原子之间彼此可通过共价键构成 碳链 或 碳环 。
学习· 探究区
第2课时
本 ≥1且n为整数) 。 课 栏 目 3.物质的组成、结构决定物质性质,这个规律在有机物中体现 开 关 得尤其明显。烷烃的化学性质与甲烷相似,请写出下列反应
的化学方程式(有机物写结构简式): (1)丙烷的燃烧: CH3CH2CH3+5O2
3CO2+4H2O 。
(2)光照条件下,乙烷与氯气发生取代反应(只要求写一氯取 CH3CH2Cl+HCl 。 代): CH3CH3+Cl2
