九年级化学生活中常见的盐5
课题11.1 生活中常见的盐(课件)人教版九年级化学下册

+
AB + CD →
+
AD + CB
新知学习 三、复分解反应的发生条件
【练一练】下列化学反应中,属于复分解反应的是( D ) A. Fe + CuSO4 === FeSO4 + Cu B. 2H2 + O2 === 2H2O C. CO2 + 2NaOH === Na2CO3 + H2O D. NaOH + HCl === NaCl + H2O
实验11-2 向盛有少量碳酸钠溶液的试管里滴入澄清石灰水, 观察并分析现象。
新知学习 二、碳酸钠、碳酸氢钠和碳酸钙
现象
碳酸钠溶液+澄清石灰水 出现白色沉淀
分析 可溶性碳酸盐和石灰水反应产生白色沉淀
化学方程式:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
新知学习 三、复分解反应的发生条件
物的溶液是否能发生反应。
NaOH溶液 NaCl溶液 K2CO3溶液 Ba(NO3)2溶液
稀硫酸 判断依据
能
不能
无气体、无
有水生成 沉淀、无水 生成
能
有气体 生成
能
有沉淀 生成
新知学习 三、复分解反应的发生条件
【练一练】组成相似的物质具有一些相似的化学性质。(1)向硫酸铜溶
液中加入氢氧化钠溶液,充分振荡,反应的化学方程式
C.盐酸用于配制药品
D.熟石灰用于配制波尔多液
【练一练】下列各组物质中,其成分或主要成分可以用同一化学式 表示的是( A )A.石灰石、大理石 B.纯碱、小苏打 C.生石 灰、消石灰 D.干冰、冰
新知学习 二、碳酸钠、碳酸氢钠和碳酸钙
想一想: 你还记得实验反应制取二氧化碳: CaCO3+2HCl=CaCl2+ CHO2C2↑O3 +H2O
初中盐的化学式大全

初中盐的化学式大全
在化学中,盐是由正离子和负离子组成的离子化合物。
以下是一些常见盐的化学式列表:
1.氯化钠(食盐):NaCl
2.硫酸钠(Glauber盐):Na₂SO₄
3.碳酸钠(小苏打):Na₂CO₃
4.硫酸钙:CaSO₄
5.碳酸钙:CaCO₃
6.硫酸铜(II):CuSO₄
7.硝酸钾:KNO₃
8.硝酸铵:NH₄NO₃
9.磷酸铵:NH₄H₂PO₄
10.硝酸钠:NaNO₃
11.硫酸铵:(NH₄)₂SO₄
12.磷酸钠:Na₃PO₄
13.硫酸铁(II):FeSO₄
14.硝酸铁(III):Fe(NO₃)₃
15.氢氧化钠:NaOH
这只是一小部分常见盐的例子,还有许多其他盐存在,每种都具有独特的化学式。
在盐中,正离子通常是金属离子,而负离子通常是非金属离子。
这种离子结构使得盐在化学和生活中都具有广泛的用途。
九年级化学生活中常见的盐

Na2CO3 + 2 HCl === 2NaCl + H2CO3 NaHCO3 + HCl === NaCl + H2CO3 (2)能与碱反应, 生成新盐和新碱
CO2↑+H2O CO2↑+H2O
Na2CO3 + Ca(OH)2 === CaCO3 ↓+ 2 NaOH
(3)能与某些盐反应
Na2CO3+ CaCl2==CaCO3 ↓+ 2NaCl
苏明远披上斗篷挡风,一边也絮叨:“大少爷真是孝心!诚然这雨大,老太太老爷太太们须不好走,奴婢们都侍候着,何必大少爷亲自打马巡路。”——这却也是嘉颜教的,便把苏明远打马下山的 鲁莽举止轻轻遮盖过了。苏明远进了自己院子,一干婢女围上来,又是番沐浴更衣的忙乱,换过家常衣服,乃是件青缎云字长衣,头发虽以布擦了又擦,一时全干 不了,且披撒着发散水气,又怕他夜中冒寒,正该阖好窗、笼着炭火盆细细慢慢的烘,他却又要出去。屋里一等丫头漓桃就生起气来,嗔道:“少爷这般呆不住, 干脆不要回来,越性把我们都遣了走,这才干净呢!”苏明远瞅了她一眼,摇头道:“你倒拘管起我来?”这时候雨仍大,料主子们没有一个像苏明远这般狂狷的 ,还是要在山上先躲躲雨,暂时回不来,而府中管事的老人们也多忙着准备接主子们冒雨回府的诸般事宜,没空来盯着这边的丫头片子们——纵然来盯,漓桃这 性子也不太怕的,爽爽利利回嘴:“婢子怎么敢拘管大少爷?阿弥陀佛,但愿太太说的那头亲事定下来,自有大少奶奶来管着大少爷哪!”苏明远 笑道:“真有个大少奶奶,看你还能这般畅意不能——我就为了你们着想,也不能让太太这上下便定了那什么亲事。”漓桃脸上倏然变了神色:“ 这是什么话?让人听着,大少爷叫人把婢子们想成怎样的人?”便到火盆边,从小丫头手里掠过火拨子,去整那炭火,动作说不上大,却跟那红炭 一般带着火气。苏明远看她真恼了,折身抚慰道:“你别急,我又不出府,无非是……去毓姑娘那边看看。她前阵子病得凶险,虽转好些,今日风雨大, 不知身体如何了。”漓桃不则声,却已把火拨子搁下,小丫头忙扶住了。漓桃亲去收拾雨具,是一顶月白里子暗金扣顶踯躅红羽毡帽、一袭墨澜闪翠鸭头裘、一双 圆头彩画沙棠屐,却又不直接穿戴,先将苏明远头发束了,又披一件湖色绣枝梅纹袍子,将那防水而不保暖的鸭头
新人教版化学九年级下册知识梳理-第十一单元-盐和化肥

第十一单元盐化肥教材知识梳理知识点一:常见的盐及其用途1.日常生活中所说的盐,通常指食盐(主要成分是);而化学中的盐是指一类组成里含有和的化合物。
2. 是重要的调味品。
它还有很多的用途,例如医疗上的,农业上用它来,还可以作为化工原料,还可以腌制食品延长保存时间。
公路上的积雪也可以用来消除等。
3. 是一种工业用盐,有毒、有咸味,外形与食盐相似,人若误食会引起。
4.碳酸钠俗称或。
在工业上,碳酸钠广泛用于玻璃、造纸、纺织和洗涤剂的生产等。
我国制碱工业的先驱— 发明了侯氏制碱法,这里的碱是指纯碱— (写化学式)。
5.天然存在的或的主要成分就是碳酸钙,它们都是重要的。
碳酸钙还可用作。
6.碳酸氢钠俗称。
碳酸氢钠是焙制糕点所用的的主要成分之一。
在医疗上,它是治疗的一种药剂。
碳酸氢钠跟碳酸钠一样能跟酸反应产生二氧化碳和水。
但碳酸氢钠又不同于碳酸钠的性质是:能产生碳酸钠、二氧化碳和水。
知识点二:复分解反应及其发生的条件7.两种互相交换成分,生成另外两种化合物的反应叫做反应。
只有当两种化合物互相交换成分,生成物中有生成时,复分解反应才可以发生。
8.常见沉淀:(写出其化学式)(1)蓝色沉淀:;(2)红褐色沉淀:;(3)既不溶于水也不溶于酸的白色沉淀:、;(4)溶于酸且能与酸反应产生气体的白色沉淀:、;(5)溶于酸且能治疗胃酸过多的白色沉淀:、。
9. 分析下列三个化学反应,回答问题①BaCO3+2HCl=BaCl2+H2O+CO2↑②K2CO3+2HNO3=2KNO3 + H2O+CO2↑③Na2CO3+H2SO4=Na2SO4+H2O+CO2↑(1)BaCO3、K2CO3、Na2CO3三种不同物质中,都含有的离子是,我们把这类盐叫做碳酸盐;(2)总结规律:碳酸盐能与酸反应生成气体;此外碳酸氢盐也能与酸发生反应生成该气体,例如蒸馒头揉面时需加入适量的,因为面团经过发酵后会产生乳酸等有机酸,与其反应生成二氧化碳气体,不但能除去面团中的酸味,还会使蒸出的馒头松软多孔。
生活中常见的盐 初中九年级化学上册课件

滤失败。(3)蒸发滤液需要使用蒸发皿盛装滤液和蒸发滤液,
蒸发时用玻璃棒不断搅拌,以防液滴迸溅,也可采取间歇加热
来防止液滴飞溅。(4)溶解时食盐没有完全溶解、蒸发时造成
液滴飞溅以及没有把精盐全部转移到称量纸上等,都会使制得
率偏低。
答案:(1)A (2)D (3)蒸发皿 间歇加热
(4)A、B、D
点击进入相应模块
点击进入相应模块
(2)不同氮肥的区别。
点击进入相应模块
【思考感悟】农田施肥时,草木灰不能和铵态氮肥混用,你知 道其中的道理吗? 提示:草木灰的主要成分是碳酸钾,其水溶液呈碱性,铵态氮 肥能与碱性物质反应生成氨气而挥发掉,从而造成氮的流失, 因此不能混用或混放。
点击进入相应模块
粗盐的提纯 【高频考点】实验步骤;操作目的;仪器及各步操作中玻璃棒 的作用;影响产率的因素分析等 1.实验装置
点击进入相应模块
【易错提醒】 1.对照实验流程图,明确各步操作的目的,所需仪器等。 2.产品制得率偏低即实际得到的精盐量比理论值偏少。
点击进入相应模块
【我的收获】(1)操作①是把较大的粗盐颗粒粉碎成较小的粗
盐颗粒,需要研磨,应选用研钵。(2)折叠滤纸应按图中A、B、
C的顺序,不能出现D中滤纸出现裂缝的情况,否则会导致过
OH-
NO3-
CO32-
K+
溶
溶
溶
Ba2+
溶
溶
不
Cu2+
不
溶
不
点击进入相应模块
(1)将甲、乙两车间的废水按适当的比例混合,可以变废为宝, 既能使废水中的Ba2+、Cu2+、OH-、CO32-等离子转化为沉淀除去, 又可以用上层清液来浇灌农田。清液中含有的溶质主要是 ________________(填写物质的化学式)。 (2)已知甲车间废水明显呈碱性,则乙车间废水中含有的阴离 子是_____________。 (3)根据以上溶解性表判断,Cu(NO3)2和Ba(OH)2溶液_____(填 “能”或“不能”)发生复分解反应。若能反应,写出化学方 程式:____________;若不能反应,写出理由:__________。
华师大版科学九年级上册1.4知识总结:几种重要的盐

盐的复习一、几种常见的盐1、氯化钠:化学式——NaCl俗称食盐无色晶体易溶于水,有咸味。
重要的化工原料——广泛用于制取氯气、盐酸、火碱、纯碱等工业方面;并在塑料、橡胶、合成纤维、医药、农药等工业方面有广泛的应用,也是日常生活重要的调味品。
2、碳酸钠:化学式——Na2CO3,俗称:纯碱白色粉末,易溶于水成无色溶液。
实验事实:无色碳酸钠溶液能使无色酚酞试液变红。
说明:碳酸钠的水溶液呈碱性。
一般情况下:碳酸盐如碳酸钠,碳酸钾(K2CO3)等均能与盐酸发生剧烈反应,有无色气体产生——该气体能使澄清的石灰水变浑浊,即生成CO2。
Na2CO3+2HCl→2NaCl+H2O+CO2↑K2CO3+2HCl→2KCl+H2O+CO2↑主要用途:重要的化工原料——玻璃、造纸、纺织、制药、精炼石油等方面用途显著。
3、硫酸铜:化学式——CuSO4无水硫酸铜为白色粉末,易溶于水,其水溶液为蓝色。
硫酸铜晶体含五个结晶水,为蓝色、因此俗称蓝矾或胆矾,化学式为——CuSO4·5H2O。
主要用途:是制农药波尔多液的重要原料,也广泛应用于印染,电镀等工业方面。
二、盐溶液的导电性——盐的定义1、盐溶液的导电性:实验事实证明:可溶性盐的水溶液,均具有导电性。
说明: 盐溶液中存在着自由移动的阴、阳离子,在电场作用下,自由移动的离子定向移动而形成电流,——导电。
可溶性盐在溶液里的电离: 以食盐、碳酸钾、硫酸铵等为例,其水溶液中的电离方程式为:2、盐的定义:由金属(或铵根)离子与酸根离子相结合而组成的化合物,叫盐。
三、盐的分类:1、从盐的组成上分(1)正盐: 只由金属(或铵根)离子及酸根离子组成,例:NaCl 、Na 2SO 4、NH 4NO 3、MgCl 2、K 2CO 3等。
(2)酸式盐:组成当中,除金属(或铵根)离子与酸根离子外,还有氢离子。
以碳酸氢铵,碳酸氢钠为例看酸式盐在其水溶液中的电离:NH 4HCO 3→NH 4++H ++CO 32-NaHCO 3→Na ++H ++CO 32- 电离出来的阳离子除H +外,还有其它阳离子——NH 4+、Na +,因此上述二者是盐而不是酸。
初中九年级化学下册《生活中常见的盐》(基础) 知识讲解
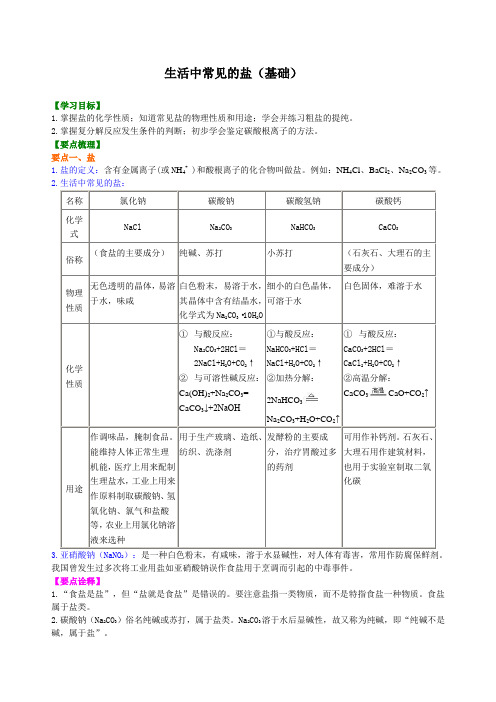
生活中常见的盐(基础)【学习目标】1.掌握盐的化学性质;知道常见盐的物理性质和用途;学会并练习粗盐的提纯。
2.掌握复分解反应发生条件的判断;初步学会鉴定碳酸根离子的方法。
【要点梳理】要点一、盐1.盐的定义:含有金属离子(或N H4+ )和酸根离子的化合物叫做盐。
例如:NH4Cl、BaCl2、Na2CO3等。
2.生活中常见的盐:名称氯化钠碳酸钠碳酸氢钠碳酸钙化学式NaCl Na2CO3NaHCO3CaCO3俗称(食盐的主要成分)纯碱、苏打小苏打(石灰石、大理石的主要成分)物理性质无色透明的晶体,易溶于水,味咸白色粉末,易溶于水,其晶体中含有结晶水,化学式为Na2CO3·10H2O细小的白色晶体,可溶于水白色固体,难溶于水化学性质①与酸反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑②与可溶性碱反应:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH①与酸反应:NaHCO3+HCl=NaCl+H2O+CO2↑②加热分解:2NaHCO3Na2CO3+H2O+CO2↑①与酸反应:CaCO3+2HCl=CaCl2+H2O+CO2↑②高温分解:CaCO3CaO+CO2↑用途作调味品,腌制食品。
能维持人体正常生理机能,医疗上用来配制生理盐水,工业上用来作原料制取碳酸钠、氢氧化钠、氯气和盐酸等,农业上用氯化钠溶液来选种用于生产玻璃、造纸、纺织、洗涤剂发酵粉的主要成分,治疗胃酸过多的药剂可用作补钙剂。
石灰石、大理石用作建筑材料,也用于实验室制取二氧化碳3.亚硝酸钠(NaNO2):是一种白色粉末,有咸味,溶于水显碱性,对人体有毒害,常用作防腐保鲜剂。
我国曾发生过多次将工业用盐如亚硝酸钠误作食盐用于烹调而引起的中毒事件。
【要点诠释】1.“食盐是盐”,但“盐就是食盐”是错误的。
要注意盐指一类物质,而不是特指食盐一种物质。
食盐属于盐类。
2.碳酸钠(Na2CO3)俗名纯碱或苏打,属于盐类。
Na2CO3溶于水后显碱性,故又称为纯碱,即“纯碱不是碱,属于盐”。
九年级化学下册第十一单元盐化肥课题1生活中常见的盐课件新人教版

CuSO4+2NaOH (4)盐+盐
Na2SO4+Cu(OH)2↓。
新盐+新盐
Na2SO4+Ba(Nቤተ መጻሕፍቲ ባይዱ3)2
BaSO4↓+2NaNO3。
化合物 的反应,叫做复分 沉淀 或有 气体 或有
生活中常见的盐 1.(2016成都)某同学将维生素C泡腾片放入水中,观察到有大量气泡冒出,根据泡腾片的 主要成分分析,该气体主要是( C )
A.O2 B.N2 C.CO2 D.水蒸气
复分解反应及其发生的条件
2.(2017内江)下列反应属于复分解反应的是( B )
A.CO2+H2O
H2CO3
B.2HCl+Ca(OH)2 CaCl2+2H2O
C.2KMnO4
K2MnO4+MnO2+O2↑
D.2Na+2H2O 2NaOH+H2↑
3.(2017菏泽)下列物质在水溶液中能大量共存的是( B )
无色的上层清液。为了确定沉淀和清液的成分,继续展开探究。
【实验1】 探究沉淀的成分。
【提出猜想】 Ⅰ.沉淀只有硫酸钡;Ⅱ.沉淀只有碳酸钡;Ⅲ.沉淀中含有硫酸钡和碳
酸钡。
梅梅取少量沉淀于试管中,滴加 过量的稀盐酸,沉淀部分溶解,有气泡产生 (请补
充完整实验操作和观察到的现象),证明了猜想Ⅲ是正确的。
【实验2】 探究清液的成分。
BaSO4↓+2HCl 。 2NaCl+H2O+CO2↑ 。
10.(实验探究题)玲玲在学习复分解反应时,对复分解反应的条件产生了兴趣,于是
她和小组内的同学仅用以下药品展开了探究活动。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十一单元课题 1 生活中常见的盐教学目标知识与技能1.认识几种生活中常见的盐,知道一些盐的性质和用途。
2.学会粗盐初步提纯的操作方法。
3.认识复分解反应及复分解反应发生的条件。
过程与方法
1 .让学生通过阅读教材相关部分内容,培养学生归纳整理知识的能力。
2.通过探究粗盐的初步提纯从中培养学生的观察能力、分析问题能力、实验操作能力。
3.通过比较碳酸盐的相关化学方程式,能简单的归纳出相同点,为复分解反应概念的引出作好铺垫。
4.通过相关资料的阅读,增加课外知识。
情感态度与价值观通过具体实验,既学会粗盐提纯基本操作,又消除了前面阅读整理知识的单一性,同时增加了学习化学的兴趣。
通过相关图片的展示,培养学生热爱社会热爱生活的情怀。
教学重点:
常见的盐的性质用途教学难点:
复分解反应及发生的条件教学方法:实验探究多媒体教学教学课时:二课时教学过程[ 第一课时] :情景导入:
同学们在家有没有做过饭烧过菜?烧菜过程中应加那些调味品?
解答小结:最主要的是加一些盐,厨房中的盐通常指食盐(主要成分
是NaCl)。
介绍导入:同学们,我们化学中的盐是指组成里含有金属离子和酸根离子的一类化合物,不仅仅指食盐,而且有些盐是有毒的,如我国曾发生过
多起因误将工业用盐亚硝酸钠(NaNO2)当作食盐用于烹调而引起
的中毒事件。
生活中常见的盐有碳酸钠(NaCQ,俗称纯碱、苏打)、碳酸氢钠(NaHCQ俗称小苏打)、高锰酸钾(KMnQ和大理石(主要成分为CaCQ等
指导阅读:
这节课我们一起来学习常见的盐, 请大家阅读教材P70—71 有关氯化钠的知识。
投影:有关食盐的图片或录象
思考下列问题:(投影)
①通过阅读教材,你对氯化钠有了哪些进一步了解?
②你所知道的氯化钠的组成如何?体每天对氯化钠的摄入量大约是
多少?为什么?能否过多地食用食盐?氯化钠有那些重要的用途?它在自然界的分布情况怎样?
投影:1.氯化钠的组成
2.氯化钠的用途
3.氯化钠的分布
(归纳、总结要根据新教材的特点,符合学生的认知规律,不一定要形成完整的概念。
)过渡:粗盐中含有较多的可溶性杂质和不溶性杂质(如泥沙等) ,可以通过什么方法除去泥沙等不溶性的杂质
引导讨论:
①粗盐初步提纯需要那些步骤?
②过滤器的准备需要那些仪器?滤纸如何使用?过滤操作时应注意
那些问题?
③整个操作过程中玻璃棒的作用有那些?
[ 活动与探究] :粗盐食盐溶解T过滤T蒸发T计算产率设计并完成探究报告。
录像:播放正确操作教师适当的引导:(作参考)1.过滤后的液体仍浑浊的原因:
①操作过程中液面可能高出滤纸的边缘
②滤纸被玻璃棒捅破2.产率偏低的原因:
③溶解时未充分搅拌。
④蒸发时液体可能被溅出。
⑤转移时固体可能洒落等。
总结:略作业:新学案教后:
第二课时:
投影: 天安门前的华表、人民大会堂的柱子、豪华酒店的地面等。
提问: 同学们看了这么多的图片,知道它们是用什么材料做成的吗?
(大理石)
介绍:
1.石灰石、大理石的主要成分是碳酸钙,谈们都是重要的建筑材料,碳酸钙还可用作补钙剂,如钙尔奇片的成分就是碳酸钙。
2.碳酸钠俗称纯碱,广泛用于玻璃、造纸、洗涤剂等的生产。
3、碳酸氢钠俗称小苏打,蒸馒头时可用它作发酵粉,医疗上可用于治疗胃酸过多,但不能治疗胃溃疡(易引起胃穿孔)。
提问: 1.我们已经学过二氧化碳的实验室制法,请同学们想一想制取二氧化碳的原料是什么?反应的原理是什么?演示:盐酸腐蚀含碳酸钙的建材
2.碳酸钠、碳酸氢钠能否也发生类似的反应呢?两位同学上讲台演示:
按照[实验11-1] 的实验要求,装置按图11-7。
两位同学同时演示。
演示[实验11-2] :
设问: 上面列出这些反应跟我们前面所学的化合反应、分解反应、置换反应有那些不同点?再比较这节中所出现的几个方程式,具有那些共同特征?上
述这些反应,它们都是由两种化合物相互交换成分,生成另两种化
合物的反应,这样的反应叫做复分解反应。
讨论: 1.酸和碱作用生成盐和水的反应是否也属于复分解反应?为什么?2.分析上述几个复分解反应的生成物有什么特点?
讲解: 酸碱盐之间并不是都能发生复分解反应的。
只有当两种化合物互相交换成分时,生成物中有气体或有沉淀或有水生成时,复分解反应才可以发生。
当然,复分解反应的条件在这节课上是不完善的,随着以后的学习,我们会了解的更多。
课堂练习:教材习题1、2、3。
课堂小结:本节课你知道了那些知识?学会了什么?作业: 新学案
教后:。
