硅及其化合物.ppt
合集下载
高一化学人教版必修第二册第五章第三节无机非金属材料—硅及其化合物PPT

(2)化学性质: ①弱酸性(石蕊不变红):只能与强碱发生
H2SiO3 + 2NaOH ==== Na2SiO3 + 2H2O ②不稳定:受热易分解。
加热
H2SiO3 == H2O + SiO2 (3)用途 硅酸溶胶,经干燥脱水就形成硅酸干胶,称为 “硅胶" 常常用做干燥剂。
硅酸钠 物理性质:硅酸钠又名泡花碱,为白色固体,易溶于水,其水溶 液俗称水玻璃,是一种矿物胶,可作为防火剂,防腐剂。 化学性质: 1、与碱反应 Na2SiO3+Ba(OH)2==BaSiO3 +2NaOH 2、与酸反应 Na2SiO3+CO2+H2O=H2SiO3 +Na2CO3 3、与盐反应 Na2SiO3+CaCl2=CaSiO3 +2NaCl 制取
SiCl4+2H2==Si(纯硅)+4HCl
四、用途 半导体 光伏材料(太阳电池材料)
二氧化硅 一、物理性质 熔点高,硬度大,难溶于水。 二、化学性质 1、与金属反应 2Mg+SiO2==2MgO+Si(K、Ca都可以) 2、与非金属的反应 2C+SiO2==2CO+Si↑ 3、与碱的反应 SiO2+2NaOH==Na2SiO3+H2O(氢氧化钠不能用玻璃瓶塞的原因) 4、与酸的反应(唯一)
练习
1.下列物质中属于硅酸盐材料的是( )①水泥 ②玻璃 ③陶瓷
④水晶
A.只有①③
B.②④
C.只有②③ D.①②③2.硅被誉为无机非金属材料的主角。下列物品用
到硅单质的是( )A.陶瓷餐具 B.石英钟表 C.计算机芯片
D.光导纤维
3.下面关于硅的叙述中,正确的是( )A.硅的非金属性比碳的强,只有在 高温下才能与氢气发生化合反应B.硅是构成矿物和岩石的主要元素,硅在 地壳中的含量在所有的元素中居第一位C.硅的化学性质不活泼,在自然界 中可以以游离态存在D.硅在电子工业中,是重要的半导体材料
高一化学《硅》课件

硅元素是地壳中第二丰富的元素, 仅次于氧元素
硅元素在岩石、矿物、土壤、植物 和动物中都有存在
添加标题
添加标题
添加标题
添加标题
硅元素主要以二氧化硅、硅酸盐等 形式存在
硅元素在自然界中主要以硅酸盐的 形式存在,如石英、长石、云母等 矿物
物理性质:无色透明,硬度高,熔 点高,导电性差
应用:广泛应用于半导体、太阳能 电池、光纤等领域
硅烷醇:SiH3OH,无色液体,易溶于水
硅烷醇醚:SiH3O-CH2-,无色液体,易 溶于水
硅烷醇盐:SiH3O-,无色液体,易溶于 水
硅烷醇酮:SiH3O-CH2-CO-,无色液体, 易溶于水
硅在高科技领域的 应用
硅是半导体工业的主要材料 硅的物理性质:导电性、热导率、光学性质等 硅的化学性质:稳定性、耐腐蚀性等 硅在半导体工业中的应用:集成电路、太阳能电池、LED等
三氧化二硅是一 种重要的半导体 材料,广泛应用 于电子、光学等 领域
硅的氧化物在自 然界中广泛存在, 如石英、硅藻土 等
硅酸酐:硅酸酐是硅酸和硅酸盐的统称,包括硅酸、硅酸盐等 硅酸酐的性质:硅酸酐具有很强的酸性,能与碱反应生成硅酸盐 硅酸酐的应用:硅酸酐广泛应用于玻璃、陶瓷、水泥、耐火材料等领域
硅酸酐的制备:硅酸酐可以通过硅酸盐与酸反应、硅酸盐与碱反应等方式制备
硅对土壤的影响:硅是土壤中重要的微量元素,可以改善土壤结构,提高土壤肥力。 硅对水体的影响:硅可以降低水体中的重金属含量,改善水质。 硅对生物的影响:硅是生物体必需的微量元素,可以促进生物体的生长和发育。 硅对环境的影响:硅可以改善土壤和水体的环境,提高生物多样性。
硅元素是人体必需的微量 元素之一
未来展望和总结
硅材料在半导体领域的应用将更加广泛,如高性能计算、人工 智能等领域
硅课件

1、 实验室有五种试剂,根据它们各 自的性质,必须选择适当的试剂瓶盛放, 请在对应的各种试剂瓶和所装试剂之间 进行连线。
试剂
二氧化硅
试剂瓶细口Biblioteka 口塞氢氧化钠溶液氢氟酸
广口瓶
细口塑料瓶
浓硫酸
细口橡皮塞
3、下列药品的贮存方法正确的是
( AC )
A、硅酸钠溶液应密封在带橡胶塞的试剂瓶中
B、氢氧化钠溶液密封在带玻璃塞的试剂瓶中
4、硅酸盐组成的表示
用二氧化硅、金属氧化物和水的形式表示其组成。 高岭石 Al2(Si2O5)(OH)4
2SiO 2H 表示成: Al2O3 · 2· 2O K(Al2Si3O10)(OH)2→ K2O· 2O3· 2· 2O 2Al 6SiO 2H
练习:将下列硅酸盐改写成氧化物的形式
泡沸石 Na2Al2(Si2O7)(OH)2 Na2O· 2O3· Al 2SiO2· 2O H 钙沸石 CaAl2Si3O10· 2O 3H CaO· 2O3· Al 3SiO2· 2O 3H 绿柱石 Ba3Al2Si6O18 3BaO· 2O3· Al 6SiO2
一、硅单质
单质硅有晶体硅和无定形两种。结 构类似于金刚石,是带有金属光泽的灰 黑色固体,熔点1410℃,硬度大、有脆 性,在常温下化学性质不活泼。 处于金属与非金属的过渡位置。晶 体硅的导电性介于导体和绝缘体之间, 是良好的半导体材料
滑石 Mg3(Si4O10)(OH)2
3MgO· 4SiO2· 2O H
2、下列各组物质有关性质关系的 比较,正确的是 C A.稳定性:CO2 > SiO2 B.酸性:H2SiO3 > H2CO3 C.熔点:SiO2 > CO2(干冰) D.导电能力:Si > Cu
精品PPT课件----十三、硅及其重要化合物共24页

·法拉兹
42、只有在人群中间,才能认识自 己。——德国
43、重复别人所说的话,只需要教育; 而要挑战别人所说的话,则需要头脑。—— 玛丽·佩蒂博恩·普尔
44、卓越的人一大优点是:在不利与艰 难的遭遇里百折不饶。——贝多芬
精品PPT课件----十三、硅及其重要化 合物
16、自己选择的路、跪着也要把它走 完。 17、一般情况下)不想三年以后的事, 只想现 在的事 。现在 有成就 ,以后 才能更 辉煌。
18、敢于向黑暗宣战的人,心里必须 充满光 明。 19、学习的关键--重复。
20、懦弱的人只会裹足不前,莽撞的 人只能 引为烧 身,只 有真正 勇敢的 人才能 所向披 靡。
45、自己的饭量自己知道。——苏联
42、只有在人群中间,才能认识自 己。——德国
43、重复别人所说的话,只需要教育; 而要挑战别人所说的话,则需要头脑。—— 玛丽·佩蒂博恩·普尔
44、卓越的人一大优点是:在不利与艰 难的遭遇里百折不饶。——贝多芬
精品PPT课件----十三、硅及其重要化 合物
16、自己选择的路、跪着也要把它走 完。 17、一般情况下)不想三年以后的事, 只想现 在的事 。现在 有成就 ,以后 才能更 辉煌。
18、敢于向黑暗宣战的人,心里必须 充满光 明。 19、学习的关键--重复。
20、懦弱的人只会裹足不前,莽撞的 人只能 引为烧 身,只 有真正 勇敢的 人才能 所向披 靡。
45、自己的饭量自己知道。——苏联
《硅及其化合物》化学 必修 第二册 人教版课件

硅处于金属元素和非金属元素过渡 位置,单质用作半导体材料
SiO2+还原剂
工业如何制得硅单质? Si
根据流程图写出涉及的主要化学反应
石英砂 (主要矿物成分是SiO2)
课后思考:
已知SiHCl3沸点为31.85℃,试解释该流 程为什么能制得高纯硅
2min
根据CO2与H2CO3 的性质,推测SiO2与H2SiO3的性质,并写出相应的方程式。
你了解生活中含硅及其化合物的物品吗?
陶瓷
玻璃
水泥
芯片的基础材料——硅晶片(Si)
硅太阳能电池(Si)
通讯材料——光导纤维(SiO2)
怎么认识硅及其化合物的性质?
C
CO2
H2CO3
Na2CO3
【类比思考】根据硅的原子结构示意图以及在元素周期表的位置, 找出硅及其化合物并推测对应的性质。
2min
硅及其化合物
硅在自然界以什么形式存在?
硅单质具有哪些性质?
素有“硬度之王”之称
硬度高、熔点高、难溶于水, 化学性质稳定
1min
硅在自然界以什么形式存在?
硅元素在地壳中含量仅次于氧,居于第二位。因有亲氧性,在自 然界中它总是与氧相互化合,主要以氧化物(如水晶、玛瑙)和硅酸 盐(如地壳中的大多数矿物)的形式存在。
硅及其化合物(《无机非金属材料》第1课时)
主讲人:
学 校:
学 科:化学(人教版必修第二册) 年 级:高一下学期
学习任务与目标
1.通过图片了解硅及其化合物在生产生活中的广泛存在和应用。 2.通过与同主族元素碳及其化合物性质的类比,能预测硅、二氧 化硅和硅酸的性质,并用方程式表示其主要的化学性质。 3. 通过阅读分析信息和元素周期律,能说明制备高纯硅和硅酸的 路径。
硅及其化合物PPT课件

用 多 种 复 合 材 料 装 饰 的 现 代 居 室
高 科 技 耐 高 温 隔 热 材 料
全塑料汽车
钢化玻璃的机械强度:
• 普通玻璃内由于存在着较大的内应力而易脆, 机械强度不大。为了消除这种内应力,必须在生 产玻璃时用偏光仪观察玻璃内应力的变化情况。 当温度达到某一下限时,内应力开始减小,再加 热至温度上限,内应力全部消失。生产钢化玻璃 时,温度必须略超过上限,而后急剧冷却,就好 像钢淬火一样,所以叫做钢化玻璃。钢化玻璃大 大改变了内应力的紧张状态,因而减小了它的脆 性,其机械强度增大。1955年,我国开始生产钢 化玻璃。
(1)按化学组成和特性分 2、材料的分类:
水泥、玻璃、陶瓷
高温结构陶瓷、光导纤维
传统无机非金属材料 无机非金属材料 材料
Fe、Cu、Al、合金等
新型无机非金属材料
金属材料 高分子材料:塑料、合成橡胶、合成纤维
(2)按用途分
结构材料:利用材料的力学和理、化性质, 广泛应用于机械制造、工程建 设、交通运输等各个工业部门 功能材料:利用材料的热、光、电、磁等性 能用于电子、激光、通讯、能源 和生物工程等许多高新技术领域。
新 型 无 机 非 金 属 材 料
什么是无机非金属材 料
1、材料 材料是人类赖以生存和发展的物质基础,是人 类进步的里程碑。历史上的石器时代、青铜器时 代、铁器时代都是以材料作为时代主要标志的。 石器、陶瓷、铁、铜、玻璃、水泥、有机高分 子(如塑料等)、单晶材料,每一种新型材料的 研制成功,都引起人类文化和生活的新变化。没 有半导体材料,便不可能有目前的计算机技术; 没有耐高温、高强度的特殊结构材料,便没有今 天的宇航工业;没有低损耗的光导纤维,也就没
十九世纪出现炭制品 如干电池,弧光用炭棒, 冶炼用电极等.1960年 后炭素行业迅速发展, 生产出超高功率电极, 不透性石墨,核工业用 石墨,高纯石墨等制品, 近三十年来随着现代 空间技术,信息技术,能 源技术,核工业技术发 展需要,真正意义上的 新型炭素材料工业得 到突飞猛进的发展.
硅及其化合物复习课件
(3)装置 B 的作用之一是观察 SO2 的生成速率,其中的液体 最好选择________。
a.蒸馏水 b.饱和 Na2SO3 溶液 c.饱和 NaHSO3 溶液 d.饱和 NaHCO3 溶液
实验中,为使 SO2 缓慢进入烧瓶 C,采用的操作是________。 已知反应(Ⅲ)相对较慢,则烧瓶 C 中反应达到终点的现象是
(4)Na2S3O3 和 Na2SO3 的存在对 SO24-的检验有干扰,要先除 去。根据题给信息,可先加入过量的稀盐酸将二者除去。
【答案】 (1)液柱高度保持不变 防止倒吸 NaOH(合理即 得分)
(2)2∶1 (3)c 控制滴加硫酸的速度(合理即得分) 溶液变澄清(或浑 浊消失) ad (4)取少量产品溶于足量稀盐酸,静置,取上层溶液(或过滤, 取滤液),滴加 BaCl2 溶液,若出现沉淀则说明含有 Na2SO4 杂质 (合理即得分)
(3)若生成 3 mol Na2S2O3,根据方程式的关系可知需要 3 mol S 和 3 mol Na2SO3;生成 3 mol S 需 2 mol H2S;而生成 2 mol H2S 需 2 mol Na2S 且同时生成 2 mol Na2SO3;故需要的 Na2S 为 2 mol、 Na2SO3 为 1 mol,其物质的量之比为 2∶1。
________。反应后期可用酒精灯适当加热烧瓶 A,实验室用酒精
灯加热时必须使用石棉网的仪器还有________。
a.烧杯
b.蒸发皿
c.试管
d.锥形瓶
(4)反应终止后,烧瓶 C 中的溶液经蒸发浓缩、冷却结晶即
可析出 Na2S2O3·5H2O,其中可能含有 Na2SO3、Na2SO4 等杂质。 利用所给试剂设计实验,检测产品中是否存在 Na2SO4,简要说
硅、碳族元素、无机非金属材料ppt

7 .绝大多数非金属元素的最高价含氧酸只有 一种,称为某酸,少数还可失水后生成偏某酸, 而硅的+4价含氧酸有许多种,如H4SiO4、H2SiO3、 H2Si2O5、H6Si2O7等。 8.Na2SiO3+CO2+2H2O=H4SiO4↓+Na2CO3。 该反应由于 H2CO3 的酸性比 H4SiO4 强而得以进行, 但SiO2在高温下与 Na2CO3反应生成Na2SiO3和CO2, Na2CO3+SiO2 Na2SiO3+CO2↑,是CO2气体脱 离反应体系才得以实现。
硅、碳族元素、无机非金属材料
一、碳族元素知识归纳
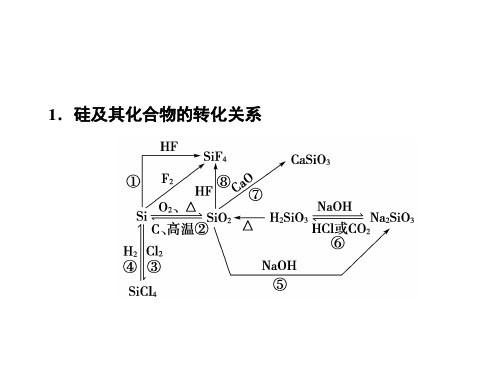
二、硅及其化合物
三、硅及其化合物的特性 1.硅的晶体是良好的半导体材料。 2 .硅及其最高价氧化物 SiO2 的晶体为原子晶体。 3.硅虽是非金属,但可与氢氟酸作用置换出氢
气。 4 .硅可与强碱溶液反应生成 H2 ,而其他非金属 均不能发生此类反应。 5 .二氧化硅为酸性氧化物,它不仅可与碱及碱 性氧化物反应生成相应的盐 (通性),而且还可以与氢 氟酸反应:SiO2+4HF=SiF4↑+2H2O。 6 .硅酸盐是多种硅的盐的总称,而通常所说的 某酸盐,为一种酸根的盐。
四、无机非金属材料分类 硅酸盐工业包含:水泥、玻璃、陶瓷。 比较水泥和玻璃的生产方法(见下表)硅酸盐产品
五、新型无机非金属材料 1.无机非金属材料的分类 (1) 传统无机非金属材料:水泥、玻璃、陶瓷等 硅酸盐材料。 (2) 新型无机非金属材料:半导体材料、超硬耐 高温材料、发光材料等。 2.新型无机非金属材料的特性 (1)耐高温、强度高 (2)具有电学特性 (3)具有光学特性 (4)具有生物功能
1. 用 4 种溶液进行实验,下表中“操作及现象” 与“溶液”对应关系错误的是 ) B (
2. 在呼吸面具和潜水艇中可用过氧化钠作为供 氧剂。请选用适当的化学试剂和实验用品,用下图 中的实验装置进行实验,证明过氧化钠可作供氧剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.物理性质
熔点高 硬度大 难溶于水
4.化学性质
高温
高温 高温 高温
5.用途
SiO2的网状结构决定了它具有优良的物理和化学性质,加上 SiO2在自然界的广泛存在,从古到今都被人类广泛地应用着。
石英坩埚
玻璃仪器
光导纤维 精美瓷器
【小试牛刀】
1、关于二氧化硅说法错误的是( AC ) A、二氧化硅分子由一个硅原子和两个氧原子构成。 B、不能由二氧化硅跟水直接作用制取硅酸。 C、二氧化硅能与氢氟酸反应,又能与烧碱反应,所
(2)粗硅提纯:Si(粗硅)+2Cl2==SiCl4;
SiCl4+H2==Si+4HCl(纯硅)
【 小试身手】
•例1:下列关于硅说法正确的是() A A.硅是人类将太阳能转化为电能的常用材料 B.由粗硅制的单晶硅不涉及氧化还原反应。 C.Si+2NaOH+H2O=Na2SiO3+2H2↑,Si是还原剂,NaOH和H2O是氧化剂。 D.盐酸可以与硅反应,故可采用盐酸为抛光液抛光单晶硅
3.硅酸 4.硅酸盐
物理性质 化学性质 用途 硅酸及硅胶的制备
概念 表示形式 常见的硅酸盐及硅酸盐材料 玻璃的制备。
1.存在及物理性质
一.硅(Si)
C +6 24
Si +14 284
2.化学性质
点燃
高温 高温
高温
•3.硅的制备
反应原理:
高温
(1)制粗硅:主要以SiO2为原料:SiO2+2C=Si+2CO↑;(粗硅)
H2SiO3 =∆= H2O + SiO2
3.用途
硅胶可用作干燥剂,也可作催化剂的载体
•4.硅酸的制备(强酸制弱酸)
可用可溶性的硅酸钠和其他酸制备,所得溶液凝成硅酸溶胶。
SiO2+2NaOH=Na2SiO3+H2O
Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3
Na2SiO3+2HCl=2NaCl+H2SiO3↓
(四)硅酸盐
1.定义:硅酸盐由硅,氧,和金属元素组成的化合物的总称 2.表示形式: ①化学式法(表示组成简单的硅酸盐) 如:硅酸钠:Na2SiO3
②氧化物法(表示复杂的硅酸盐)用二氧化硅和金属氧化物的形式来表示其组成 例: 石棉CaMg3Si4O12 :CaO·3MgO·4SiO2 (氧化物的顺序按化学式中元素的排列顺 序) 长石KAlSi3O8 :K2O·Al2O3·6SiO2 (分数化整)
(1)锥形瓶中装某可溶性正盐溶液,分液漏斗所盛试剂应为 _稀__盐__酸__________。
(2)装置B所盛的试剂是饱__和__碳__酸__氢_钠__,其作用是_吸__收_H__C_l气__体_______。 (3)装置C所盛试剂是__硅__酸__钠__溶__液__,CSi中O3反2-+C应O2的(少离量子)方+H2程O=C—O3—2-+H—2S—iO3—↓ — (4)由此得出结论是,酸性 由强到弱依次是:—盐—酸—>碳—酸—>—硅—酸———。 【解题思路:强酸+弱酸盐-----弱酸+强酸盐】
【注意:(1)氧化物顺序:活泼金属氧化物——较活泼金属氧化物——二氧化硅— —水;氧化物之间用“•”连接。(2)各原子总个数比符合原来的组成,分数化整 数。】 3、最简单的硅酸盐——硅酸钠 可溶于水,水溶液呈碱性,其水溶液叫水玻璃,又叫泡花碱,可用于制备硅胶,做 木材防火剂等。
以它是两性氧化物。 D、二氧化硅和二氧化碳在物理性质上有很大差别。
2、下列说法正确的是( B )
A、SiO2溶于水显酸性
B、二氧化硅也叫硅酸酐
C、SiO2是酸性氧化物,它不溶于任何酸
D、因高温时SiO2与Na2CO3反应放出CO2,所以硅酸
酸性比碳酸强
•3、证明生石灰中既混有石英、又混有石灰石的正确方法是( D) A.加入过量盐酸,观察是否有气泡冒出 B.加入过量烧碱溶液,观察是否有固体溶解 C.加热至高温、观察是否有气泡冒出,是否有硅酸钙生成 D.先加过量盐酸搅拌,观察是否有不溶物剩余及气泡出现;若有 不溶物则滤出,投入到氢氧化钠溶液中看其是否溶解
二.硅的化合物
•(一)SiO2
1.存在:
结晶形。例如:玻璃,水晶,玛瑙,石英,硅石,沙子。 无定形。
2.结构
SiO2晶体是由Si和O按1:2的比例所组成的立体网状结构 的晶体。不存在SiO2分子,是以Si和O原子构成。通常用 SiO2来表示二氧化硅的组成。 SiO2不是分子式,而是化学 式(晶体中原子个数最简单的整数比)
(二)硅酸(H2SiO3)
1.物理性质: 溶解度很小,难溶于水
2.化学性质
(1)弱酸性:酸性比碳酸弱,不能使指示剂变色
Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3 Na2SiO3+2HCl=2NaCl+H2SiO3↓(强酸制弱酸) H2SiO3+2NaOH=2 H2O +Na2SiO3 (2)不稳定性(比H2CO3稳定):受热易分解
硅及其化合物
学习目标
• 了解单质硅,二氧化硅,硅酸盐主要存在形式, 知道它们的主要用途。
• 掌握二氧化硅的化学性质,能够熟练写出其化学 方程式,并灵活应用。
• 掌握硅酸的性质和制备,知道硅酸盐的性质以及 玻璃的制备方法。
知识框架
1.硅 2.SiO2
存在形式 物理性质 化学性质 制备
存在 结构 物理性质 化学性质
例2:下列关于硅和碳的比较,正确的是() B A.碳能将二氧化硅中的硅还原成硅,说明碳的还原性比硅强。 B.碳和硅的最高正价都是+4价。 C.硅元素在地壳中含量居第2,碳居第1位 D.自然界的硅和碳的存在形式既有游离态又有化合态
•3.制造太阳能电池需要高纯度的硅,工业上制高纯硅常用以下反应 实现①Si(s)+3HCl(g)======SiHCl3(g)+H2(g) ②SiHCl3+ H2======Si+3HCl •对上述两个反应的下列叙述中,错误的是( )B A.反应①中HCl是还原剂 B.反应②是置换反应 C.由于反应②放热,则反应①一定吸热 D.两个反应都是氧化还 原反应
5.硅胶的制备
聚合
H2SiO3
干燥脱水
硅酸凝胶
硅酸干凝胶 “硅胶”
Hale Waihona Puke 【即学即练】•例1.能证明碳酸比硅酸的酸性强的实验是()D A.CO2能溶于水生成碳酸,而SiO2却不能溶于水 B.高温时发生反应;SiO2+ Na2CO3 == Na2SiO3 + CO2↑ C.碳酸比硅酸受热易分解 D.将CO2通入的Na2SiO3水溶液中,有白色沉淀生成 •例2.为确定HCl、H2CO3、H2SiO3的酸性强弱,某同学设计了如上图所示的装置 一次实验即可达到目的(不必选其他酸性物质)。请据此回答:
