高纯碳酸锰的制备研究
由二氧化锰制备碳酸锰的实验研究报告

由二氧化锰制备碳酸锰的实验研究报告【实验目的】通过二氧化锰的热分解反应制备碳酸锰,并研究反应过程。
【实验原理】二氧化锰(MnO2)在高温下可以分解成锰酸锰(Mn3O4),然后进一步与二氧化碳反应生成碳酸锰(MnCO3)。
热分解反应的化学方程式如下所示:2MnO2(s)→2MnO(s)+O2(g)2MnO(s)+2CO2(g)→2MnCO3(s)+O2(g)【实验步骤】1.将一定质量的二氧化锰放入烧杯中。
2.将烧杯放入预热至500℃的炉中,保持一定时间。
3.取出烧杯,待其冷却至室温,称取得到的产物质量,记录下来。
4.分析产物质量变化,计算反应的收率。
【实验结果】进行了3次实验,实验数据如下:实验次数,二氧化锰质量(g),产物质量(g)-------------------------------------------1,5.00,3.632,4.00,2.823,3.00,2.05【实验数据处理】根据实验结果,计算每次实验的产物收率:实验1的产物收率=(3.63g/5.00g)×100%≈72.6%实验2的产物收率=(2.82g/4.00g)×100%≈70.5%实验3的产物收率=(2.05g/3.00g)×100%≈68.3%【实验讨论】通过实验数据可以观察到,随着二氧化锰质量的减少,产物质量也随之减少,且产物收率略有下降。
实验中可能存在的误差有:1.热分解反应需要一定时间才能充分进行,而实际操作中可能未能保证所有反应都充分进行,从而导致产物量的减少。
2.反应过程中,氧气可能通过碳酸锰形成的孔隙逸出,也可能未能充分进入二氧化锰中进行反应,从而导致产物收率的降低。
3.称取和称量等步骤可能存在误差,影响了实验结果的准确性。
【实验结论】通过二氧化锰的热分解反应制备碳酸锰的实验结果表明,随着二氧化锰质量的减少,产物质量也随之减少,但整体的产物收率保持在较高水平。
从而证实了该反应的可行性,并为进一步研究和应用提供了实验基础。
工业流程制取碳酸锰方程式

制取碳酸锰的工业流程通常包括以下步骤:
1. 制备锰矿石:首先从锰矿石矿床中开采出含锰的矿石。常见的锰矿石有菱锰矿( MnCO3)和辉锰矿(MnO2)等。
2. 矿石破碎和磨细:将锰矿石经过破碎和磨细的过程,使其粒度适合后续的反应和处理。
3. 酸浸:将磨细后的锰矿石与稀硫酸(H2SO4)溶液进行反应,生成硫酸锰(MnSO4) 溶液。反应方程式如下:
MnCO3 + H2SO4 → MnSO4 + CO2 + H2O
工业流程制取碳酸锰方程式
4. 过滤和净化:将产生的硫酸锰溶液进行过滤,去除杂质和固体颗粒。
5. 氧化:将过滤后的硫酸锰溶液进行氧化反应,使其转化为二氧化锰(MnO2)。常用的 氧化剂可以是空气或过氧化氢(H2O2)等。反应方程式如下:
最终的制取碳酸锰反应方程式可以表示为: MnSO4 + O2 → MnO2 + H2SO4 MnO2 + H2O + CO2 → MnCO3 + H2O2
需要注意的是,上述流程仅为一种常见的制取碳酸锰的工业流程,实际生产中可能会有不 同的工艺和步骤。同时,该流程中的反应条件、反应物比例和具体操作方法等也需要根据实 际情况进行调整和优化。
2MnSO4 + O2 → 2MnO2 + 2H2SO4
6. 沉淀:将氧化后的溶液进行沉淀处理,使二氧化锰沉淀下来。通常通过调节pH值和加 入沉淀剂来促进沉淀反应。
工业流程制取碳酸锰方程式
7. 过滤和干燥:将沉淀下来的二氧化锰进行过滤,去除溶液。然后对沉淀进行干燥处理, 得到碳酸锰(MnCO3)。
碳酸锰生产工艺

碳酸锰生产工艺引言碳酸锰是一种重要的化学品,广泛应用于电池、陶瓷、玻璃等行业。
本文将详细介绍碳酸锰的生产工艺,从原料准备、制备工艺到产品提纯,全面探讨碳酸锰生产的关键步骤和技术。
原料准备1.选用优质锰矿石作为原料,确保锰含量达到要求。
2.将锰矿石进行破碎、磁选、洗涤等处理,去除杂质和有害物质。
制备工艺1. 浸出工艺1.将经过处理的锰矿石与稀硫酸溶液进行浸出反应。
2.通过控制浸出温度、时间和浸出液的浓度,使得锰溶出率达到最大化。
3.确保浸出液中没有明显的悬浮固体,可采用过滤、离心等方法进行固液分离。
2. 沉淀工艺1.将浸出液转移到沉淀槽中,加入氨水或氢氧化钠等碱性剂。
2.进行沉淀反应,使得溶液中的锰离子转化为沉淀。
3.控制pH值、温度和反应时间,确保沉淀得到充分形成。
3. 过滤和洗涤1.将沉淀与水进行混合,形成悬浮液。
2.通过过滤,去除悬浮液中的固体颗粒。
3.用清水对沉淀进行洗涤,去除杂质和残余溶液。
产品提纯1. 产品干燥1.将洗涤后的沉淀放置在通风良好的条件下,进行自然干燥或采用加热干燥的方法。
2.确保产品达到规定的含水量,并具备良好的流动性。
2. 产品研磨和筛分1.将干燥的碳酸锰进行研磨,使得颗粒达到所需的粒度要求。
2.通过筛分,分离出符合要求的颗粒大小。
3. 产品包装和质检1.将碳酸锰装入密封包装袋或容器中,避免产品受潮和污染。
2.进行质量检验,检测产品的化学纯度、颗粒大小、含水量等指标。
结论通过对碳酸锰生产工艺的全面讨论,我们了解了碳酸锰的制备步骤,包括原料准备、浸出工艺、沉淀工艺、过滤和洗涤过程,以及产品的提纯和质检。
只有在严格控制每个工艺环节的条件和参数的基础上,才能生产出高质量的碳酸锰产品。
一种碳酸锰提纯方法

一种碳酸锰提纯方法
碳酸锰是一种广泛应用的化学品,其用途涵盖电池、耐火材料、玻璃制造等领域。
同时,也是一种优秀的锰源,经过提纯后,可以用于冶金、医药、种植业等领域。
本文将介绍一种碳酸锰提纯方法。
碳酸锰的提纯主要通过碱浸法实现。
具体步骤如下:
1. 原料准备:将含碳酸锰的矿石破碎并筛分,选取质量较好的碳酸锰矿石。
2. 碱浸:将碳酸锰与氢氧化钠(NaOH)混合,加入适量的水,使其形成泥浆状。
将泥浆置于反应釜中,加热至一定温度(一般为80℃-120℃),使碳酸锰与氢氧化钠发生化学反应。
反应后,碳酸锰被转化成了易于溶解的锰酸钠,其中不溶性杂质被沉淀。
3. 过滤:将反应液过滤,分离出沉淀。
沉淀经水洗和干燥处理后,即为提纯过的碳酸锰。
4. 溶解:将干燥后的碳酸锰沉淀加入稀盐酸(HCl)或硫酸(H2SO4)中,待其完全溶解。
经过溶解后,锰离子与不溶性杂质分离,便可得到纯度较高的锰离子溶液。
5. 沉淀:加入足量的碳酸钙(CaCO3),使得溶液中的锰离子与碳酸钙反应形成沉淀。
沉淀后,经过过滤、水洗和干燥处理,得到纯度更高的碳酸锰。
6. 烧结:将沉淀经过热处理,使其转化成氧化锰(MnO2)。
热处理的温度和时间需要根据实际情况进行调节,一般在800℃-1000℃之间。
7. 粉碎:将氧化锰研磨制成细粉,即可得到最终的碳酸锰产品。
通过以上步骤,可以获得纯度高、杂质少的碳酸锰。
这种提纯方法具有成本低、操作简便、效率高等特点,是一种较为经济实用的碳酸锰生产技术。
软锰矿粉制取碳酸锰流程

软锰矿粉制取碳酸锰流程摘要:本文深入探讨了从软锰矿粉出发,通过一系列精细的化学反应和物理处理过程,制取高纯度碳酸锰产品的整个流程。
内容不仅涵盖了从原料的准备、浸出、沉淀、过滤、干燥等关键步骤,还包括了最终产品的包装和质量控制等环节。
软锰矿粉作为制取过程中的基础原料,在经过一系列的化学反应和物理处理后,能够转化为所需的高纯度碳酸锰产品。
文章首先介绍了软锰矿粉制取碳酸锰的背景知识和研究意义,为读者提供了研究的背景和必要性。
接着,文章详细阐述了制取流程中的每个环节,不仅解释了每个步骤的技术要求,还指出了操作过程中的关键要点,帮助读者更好地理解和掌握整个制取过程。
最后,文章讨论了产品质量控制的重要性,强调了在制取过程中确保产品质量的必要措施和方法,以保证最终产品的质量达到标准和要求。
关键词:软锰矿粉;碳酸锰;制取流程;质量控制Abstract: This article delves into the entire process of producing high-purity manganese carbonate products starting from pyrolusite powder, involving a series of intricate chemical reactions and physical processing steps. The content covers not only key steps such as the preparation of raw materials, leaching, precipitation, filtration, drying, but also includes packaging and quality control of the final product. Pyrolusite powder, as the fundamental raw material in the production process, can be transformed into the required high-purity manganese carbonate product after a series of chemical reactions and physical treatments. The article first introduces the background knowledge and research significance of producing manganese carbonate from pyrolusite powder, providing the reader with the context and necessity of the study. Following that, the article details each stage of the production process, explaining the technical requirements of each step and identifying key points in the operation process, aiding the reader in better understanding and mastering the entire production process. Finally, the article discusses the importance of product quality control, emphasizing the necessary measures and methods to ensure product quality during production, to ensure that the final product meets standards and requirements.Keywords: Pyrolusite powder; Manganese carbonate; Production process; Quality control一、引言1.1 软锰矿粉制取碳酸锰的背景1.1.1 软锰矿粉的重要性软锰矿粉,其主要成分为二氧化锰(MnO₂),在全球范围内的锰资源领域中占据着极其重要的地位。
用工业硫酸锰制取高纯碳酸锰的工艺研究_1_

高纯碳酸锰是理想的高性能强磁性材料[ 1] , 因 而被广泛地应用于电子行业中。同时也是软磁铁痒 体生产的主要原料。还可作为 制造其他锰盐 的原 料, 用于锰铝合金和锰硅合金的生产, 用作肥料和饲 料的添加剂等等。
本文通过先用去离子水溶解工业硫酸锰, 再用 氨水调 pH 除去铁, 铝, 加 NH4F 除去钙, 镁, 最后用 碳酸氢铵沉淀, 制得高纯碳酸锰。同时比较了不同 的加料方式对碳酸锰产品性能的影响, 得出了一定 的结论。
第2期
胡国荣等: 用工业硫酸锰制取高纯碳酸锰的工艺研究
15
分别取硫酸锰溶液 A 500 m L, 按 不同的比 例 ( 质量比) 加入 NH4F 与( NH 4) 2C2O4 进行除杂, 除杂 结果见表 1。
同理, 分别取 500 m L 硫酸锰溶渡 A, 按不同的 比例( 质量比) 加入 NH4F 与 N H4H 2PO4 进行除杂, 除杂结果见表 2。
水, 通过控制溶液的 pH 值在 618~ 714 左右, 使锰
沉淀为碳酸锰, 而镁不沉淀, 仍留在溶液中, 沉淀经 过滤、洗 涤 至无 SO42- 时 干燥, 即 得 产品 高 纯 碳 酸锰。
利用废锰液制高纯碳酸锰
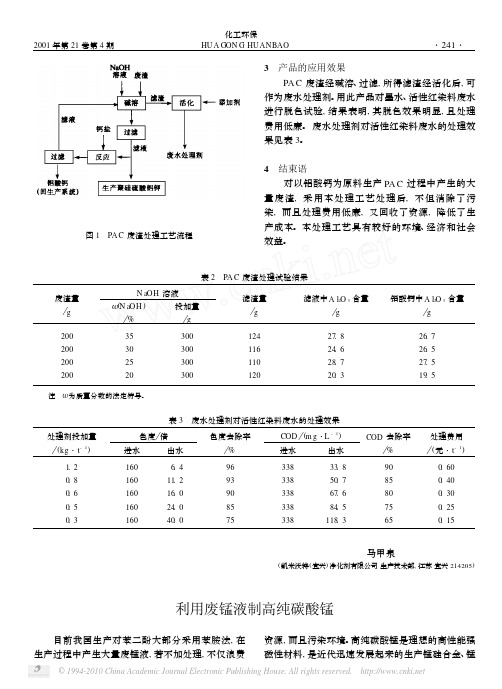
2. 2 碳酸氢铵对锰收率的影响 影响硫酸锰碳化过程的因素很多, 为了简化试
验, 只将碳酸氢铵的浓度 (质量分数A % ) 和加入量 (理论加入量的百分率B % ) 作为可变因素, 其他因 素作为不变因素预先设定。 为确保在酸性条件下析 出, 采取将碳酸氢铵按一定加料速度滴加入硫酸锰 溶液中, 反应温度控制在 30℃, 按一定沉淀反应速 度控制搅拌速度, 加料时间和加料结束后搅拌的时 间共约 1. 5 h。 碳酸氢铵的浓度及加入量对锰收率 的影响见表 2。 从表 2 可知, 碳酸氢铵的质量分数为 10%、加 入量为理论值的 110% 左右较适宜, 锰的收率达到 90% 以上。 2. 3 产品质量
C
rO
24
+
3F e2+
+
8H +
C r3+ + 3Fe3+ + 4H 2O
用浓度为 6 m o l L 的 N aO H 溶液调节溶液至碱性,
然后将其加热至 70℃, 搅拌, 使 Fe3+ 和 C r3+ 以复合
氢氧化物的形式沉淀析出, 再将其离心分离出来。
(2) 银的回收 研究了几种在除去 C r6+ 的含 A gC l 废水中回收
(1) 过滤除去废锰液中的固体残渣, 检测滤液中ቤተ መጻሕፍቲ ባይዱ是否有 Fe3+ 。 由于废锰液原料的特点, 氧化过程中 的二氧化锰过量, Fe2+ 都被氧化成 Fe3+ , 水解生成 沉淀, 经过滤进入锰泥中。
(2) 将滤液加热到 80~ 90℃, 控制 pH 在 5. 5~ 6. 0 范围内, 慢慢滴加N a2S 溶液, 防止局部过碱, 反 应 1. 5 h, 检测溶液中是否还有 N i2+ , 无 N i2+ 时停止 滴加N a2S 溶液, 然后过滤。
碳酸锰的制备

3、产量及纯度计算
纯度=碳酸锰质量/所的产品质量×100%=
理论产量=M(碳酸锰)×5.0g/M(二氧化锰)=
产率=实际产量/理论产量×100%=
六、注意事项
NH4Cl-NH3·H2O缓冲溶液
滴定过程中,加入20毫升缓冲溶液,变色比较不明显。因为铬黑T在pH=10的条件下变色比较明显,所以溶液的pH=10的缓冲溶液要足够多。
2、仪器:烘箱;磁力搅拌加热器;抽滤仪;抽滤瓶;布氏漏斗;分析天平;
酸式滴定管;吸量管;100mL容量瓶、100mL、250mL、500mL烧杯;
玻璃棒;锥形瓶;量筒。
四、实验步骤
1、碳酸锰的制备
(1)称取5.0gMnO2于200mL烧杯中,加入12mL6mol/L的H2SO4和6mL水。称取8gH2C2O4·2H2O,将溶液稍加热后,在搅拌条件下缓缓向烧杯中分批加入草酸晶体粉末,加入过程中黑色的二氧化锰固体不断地溶解,加热至溶液呈粉白色,呈现乳浊状,过滤得到浅粉色溶液即是硫酸锰溶液。
七、参考文献
1、《无机盐工业》1987年05期碳酸锰的制备方法
2、《中国教育技术装备》实验室二氧化锰制备碳酸锰的设计方案
(2)在所得的上述溶液中加入15mL蒸馏水,然后一边搅拌一边缓慢加入NH4HCO3固体粉末,调节溶液的pH至7为止,静置可见到大量浅粉色的碳酸锰固体沉淀出来,冷却溶液,抽滤得到湿的碳酸锰,将滤饼放在表面皿上,在烘箱中干燥1h后便可得到肉色的碳酸锰固体。
2、碳酸锰中锰含量的分析及产品纯度分析
(1)称取约3.8g左右的EDTA(乙二胺四乙酸)溶于200ml温热的水中,备用。精确称取0.5025gCaCO3于烧杯中(分析天平),加少量水使其润湿,滴加6mol/L的盐酸至碳酸钙全部溶解,转移至100mL容量瓶中,用适量蒸馏水冲洗小烧杯和玻璃棒将洗液也转移到容量瓶中,然后定容、摇匀,待用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
△
利用不同的硫化物沉淀在溶度积上的差 异, 控制适当 pH 值, 把 H 2 S 气体通入硫酸锰
2+ 2+ 2+ 溶液中, 使其中的 Pb 2+ 、 Cu 、 Zn 、 Cd 等
生成硫化物沉淀而除去, 也可通过加入 B aS 溶液来实现〔4〕 , 反应式如下。
按本法最佳条件制得的产品高纯碳酸 锰, 锰的回收率在92% 以上, 其外观为浅红色 粉末, 产品质量达到 GB 10503—89 I 型标准, 指标见表2。 以含M nSO 4 H 2O 8713% 的硫酸锰为原 料, 生产一吨高纯M nCO 3 的原材料消耗见表 3。 高纯M nCO 3 售价在10000元 吨以上, 同时 还可副产 112 吨富镁硫酸铵, 以 500 元 吨计, 原材料成本为5667元 吨, 扣除管理、 工资、 包 装、 税收、 设备折旧等费用, 每吨产品纯利在
淀。 重金属除尽与否, 可取净化溶液, 检查是 2+ 否存在 N i2+ 或 Zn 2+ 来判断。 N i 的检查方法 是: 取几滴溶液 (pH = 5 ~ 7) , 加入丁二酮肟, 生成红色沉淀, 则示有 N i2+ 。 除尽重金属后, 将液体加热至80 ~ 90℃, 维持约30m in, 必要 时加入絮凝剂, 然后过滤, 滤渣集中起来, 回 收有价重金属。 11414 沉淀碳酸锰 除尽重金属后的滤液 中分批加入固体农用碳铵, 控制好反应温度, 并缓慢搅拌, 加入速度以产生的二氧化碳不 致使液体外溢为限, 并视溶液的 pH 值, 适量 加入氨水 ( 与碳铵混和溶解后加入) , 使反应 液的最终 pH 值控制在 618~ 7. 4 左右。 加完 后, 维持一定温度继续反应约30m in, 然后不 保温陈化约4h。 11415 产品高纯碳酸锰 将碳酸锰沉淀离 心分离, 滤液用于回收硫酸铵及硫酸镁, 沉淀 用水洗涤至无 SO 2~ 80℃干 4 为止, 然后在70 燥, 粉碎, 制得产品高纯碳酸锰。
第6期 无机盐工业
3
高纯碳酸锰的制备研究
钟国清 蒋 礼
( 四川畜牧兽医学院基础科技系, 重庆 632460)
摘要 研究了以含杂质较多的硫酸锰作原料, 碳铵法制取高纯碳酸锰的工艺条件。 该工艺对
原料的适应性强, 除杂效果好, 碳酸锰含量 ( 以锰计) 达 45134% , 产品质量达 GB 10503—89 I 型标 准, 锰的回收率达92% 以上。 关键词 硫酸锰 碳铵法 高纯碳酸锰
社, 1985: 230
6 华中师范学院等编, 分析化学, 人民教育出版社, 1981: 652 ( 收稿日期 1996. 2. 2)
~ 46
催化剂在环境保护中得到广泛应用
催化作为一门学科所涉及的范围十分广 泛。 当催化用于环境问题时, 这一特征表现得 尤 为 明 显。 94 年 1 月, 由 催 化 学 会 发 起 在 W ilm ing ton, D el 的美俄环境催化学术研讨 会上, 来自俄国 Bo reskov 催化研究所 (N ovo
sib irsh ) 和其它各地来的许多化学家代表团
时。 同时, 在净化运输工具排出物研究领域 内 Ieslin, N. J - ba sed Engelha rd Co 研究人 员 Robert J. Fa rrau to 首次描述了一种新的 催化技术。 这种技术是为了把柴油机排出物 中的微粒降低到 EPA ( 环境保护组织) 要求 的程度。 柴油机排出物比通常的汽油机排出 物要复杂的多, Fa rrau to 解释说, 因为柴油机 排出物中含有固体 ( 碳、 无机硫酸盐和灰尘) 及液体 ( 未燃烧的燃料和润滑油) , 另外, 还有 气体 ( 未燃烧的燃料, 一氧化碳和氮的氧化 物) , 此外柴油机燃料中的单质硫在燃烧过程 中很容易转化成硫酸盐, 也增加了微粒排出 物。 从 Engelha rd 研究结果表明, 碱性金属 氧化物能使微粒中的挥发性有机组分 (VO F ) 催化转化到 EPA 要求的程度。 对这 样的催化剂有两个主要的要求: 它们必须不 能进一步氧化燃料燃烧过程中生成的大量的 贵金属催化剂对这两个反应都有效, 但 SO 2。 必须是选择性更强的催化剂。 Fa rrau to 讲述了由 Engelha rd 研制成功 了这样的碱性金属催化剂, 但是由于专利原 因, 他们拒绝进一步解释, 只说它们是无毒 的。
ห้องสมุดไป่ตู้
高纯碳酸锰主要用作软磁铁氧体磁性材 料, 一般以电解锰或硫酸锰、 碳酸氢铵等为原 料制取。 由锰矿特别是菱锰矿为原料制得的 硫酸锰中常常含有较多的镁等杂质〔1〕 , 一些 厂家以此硫酸锰作原料生产高纯碳酸锰, 锰 的 回 收 率 低, 且 镁、钠 等 含 量 超 过 了 我们利用菱锰矿 GB 10503—89 标准的指标。 制得的硫酸锰为原料, 经分离除杂, 控制条件 用碳铵法沉淀锰, 分离、 洗涤除去硫酸盐, 干 燥、 粉碎, 制得产品高纯碳酸锰, 其质量指标
≤0. 01 ≤0. 05 ≤0. 01 ≤0. 01 ≤0. 01 ≤0. 02 ≤0. 03 ≤0. 02 ≤0. 01
≤0. 01 ≤0. 30 ≤0. 01 ≤0. 01 ≤0. 01 ≤0. 02 ≤0. 03 ≤0. 02 ≤0. 005
≤0. 01 ≤0. 30 ≤0. 02 ≤0. 02 ≤0. 01 ≤0. 02 ≤0. 10 ≤0. 05 ≤0. 01
PbSO 4 + H 2S CuSO 4 + H 2S ZnSO 4 + H 2S CdSO 4 + H 2S PbS↓+ H 2SO 4 CuS↓+ H 2SO 4 ZnS↓+ H 2SO 4 CdS↓+ H 2SO 4
M nSO 4 + Fe2 ( SO 4 ) 3 + 2H 2O Fe2 ( SO 4 ) 3 + 2H 2O
将原料硫酸锰制成溶液, 或者直接利用 锰矿制得的粗硫酸锰溶液, 加入适量 M nO 2 或30% 的 H 2O 2 , 使 Fe2+ 氧化成 Fe3+ , 用中和 剂菱锰矿粉或者碳酸钙粉、 石灰乳等调节溶 液的 pH 值, 并控制反应温度, 使 Fe 3+ 水解生 成 Fe (O H ) 3 沉淀。
应控制好硫化氢的产生速度, 保持良好的通 风环境, 并加强劳动保护。
313 废水 洗涤碳酸锰沉淀将产生大量的
洗涤液, 最初的几次洗涤液可用于溶解原料 硫 酸 锰 而 循 环 使 用; 以 后 的 洗 涤 液, 其 中
2+ + 2Mg 、 NH4 、 SO 4 等含量均较少, 排出后不
6
无机盐工业 1996年
达到 GB 10503—89 I 型 标 准, 碳 酸 锰 ( 以 锰 计) 含量达45134% , 锰的回收率大于92% , 有 着较大的经济效益。 若直接用菱锰矿或软锰 矿为原料, 先制得硫酸锰溶液〔2- 3〕 , 再按本工 艺制备高纯碳酸锰, 经济效益更加显著。 1 试验部分
111 主要原料
硫 酸 锰, 工 业 品, M nSO 4 H 2O 含 量 为 8713% , 其杂质含量见表1。 碳酸氢铵, 农用品。
或 H 2O 2 + 2FeSO 4 + H 2SO 4
Fe2 ( SO 4 ) 3 + 6H 2O
2Fe (O H ) 3 ↓+ 3H 2 SO 4
3+
pH 值约510 时, 溶液中的 A l 被水解为
室温下, 由于 M nCO 3 的溶度积 K sp =
118×10 11
氢氧化铝沉淀。
, 而M gCO 3 的溶度积 K sp = 2. 6×
2 产品质量及效益分析
图1 硫酸锰制备高纯碳酸锰工艺流程
114 工艺条件 11411 制硫酸锰溶液 将硫酸锰和水按质
量比1 4配成溶液, pH 值约为6。 3+ 11412 除铁铝 pH 值为 6 时, Fe3+ 、 Al 早 已水解完全, 而 Fe2+ 却不能水解〔6〕 。 为此, 可 用邻二氮菲或铁氰化钾试剂检查溶液中是否 有 Fe2+ 存在, 若有, 可加适量的 30% 的双氧 水或者二氧化锰, 使 Fe 2+ 氧化为 Fe3+ , 加热 至80~ 90℃左右, 水解为 Fe (O H ) 3 沉淀, 时 间约30m in。 在此工序中应避免胶体的生成, 否则给过滤增加困难。 过滤, 滤渣用少量水洗 涤后弃去。 11413 除重金属 在 pH 值515 ~ 6. 0 时, 室 温下搅拌通入 H 2 S 气体, 约30m in, 使 Cu 2+ 、
农用碳铵 工业氨水 (25% ) 辅助试剂 煤 水 电 共 计
5t 30t 200kw h
160 0. 40 0. 30
800 12 60 6267
3 三废治理 311 废渣 除铁铝的废渣, 不含有毒物质,
量较少, 可作建筑用填料。 除重金属的废渣, 量也较少, 集中起来处理, 回收有价重金属。
312 废气 除重金属时, 使用硫化氢气体,
表1 原料硫酸锰的主要杂质指标
元素 含量 (% )
Fe 0. 01 Cu 0. 001 Zn 0. 03 Ca 0. 01 Mg 0. 84 Pb 0. 001 K 0. 02 Na 0. 03
112 基本原理
A l2 ( SO 4 ) 3 + 6H 2O
△
2A l (O H ) 3 ↓+ 3H 2SO 4
SiO 2 含量 A l 含量 K 含量 N a 含量 Ca 含量 M g 含量 Pb 含量
本法 产品质量
45. 34 < 0. 01 0. 05 < 0. 01 < 0. 01 0. 005 0. 01 0. 02 0. 01 0. 001
