化学溶解性表范文
初中化学溶解性表word版本

1、化合物阴离子阳离子OH-氢氧根NO3-硝酸根Cl-氯离子SO42-硫酸根CO32-碳酸根分类O2-氧离子H+H2O HNO3、↑HCl、↑H2SO4 H2CO3、↑→酸H2O氢离子水硝酸盐酸硫酸碳酸水NH4+NH4·H2O↑NH4NO3 NH4Cl (NH4)2SO4 (NH4)2CO3↓盐_铵根离子氨水硝酸铵氯化铵硫酸铵碳酸铵_K+KOH KNO3KCl K2SO4K2CO3K2O钾离子氢氧化钾硝酸钾氯化钾硫酸钾碳酸钾氧化钾Na+ NaOH NaNO3NaCl Na2SO4Na2CO3Na2O 钠离子氢氧化钠硝酸钠氯化钠硫酸钠碳酸钠氧化钠Ba2+ Ba(OH)2Ba(NO3)2BaCl2BaSO4↓BaCO3↓BaO 钡离子氢氧化钡硝酸钡氯化钡硫酸钡碳酸钡氧化钡Ca2+ Ca(OH)2Ca(NO3)2CaCl2CaSO4微CaCO3↓CaO 钙离子氢氧化钙硝酸钙氯化钙硫酸钙碳酸钙氧化钙Mg2+ Mg(OH)2↓Mg(NO3)2MgCl2 MgSO4MgCO3微MgO 镁离子氢氧化镁硝酸镁氯化镁硫酸镁碳酸镁氧化镁Mn2+ Mn(OH)2↓Mn(NO3)2MnCl2MnSO4MnCO3↓MnO 锰离子氢氧化锰硝酸锰氯化锰硫酸锰碳酸锰氧化锰Zn2+Zn(OH)2↓Zn(NO3)2ZnCl2ZnSO4ZnCO3↓ZnO 锌离子氢氧化锌硝酸锌氯化锌硫酸锌碳酸锌氧化锌Al3+ Al(OH)3↓Al(NO3)3AlCl3Al2(SO4)3 _Al2O3铝离子氢氧化铝硝酸铝氯化铝硫酸铝_氧化铝Cu2+Cu(OH)2↓Cu (NO3)2CuCl2 CuSO4CuCO3↓CuO 铜离子氢氧化铜硝酸铜氯化铜硫酸铜碳酸铜氧化铜Fe2+ Fe(OH)2↓Fe(NO3)2FeCl2FeSO4FeCO3↓FeO 亚铁离子氢氧化亚铁硝酸亚铁氯化亚铁硫酸亚铁碳酸亚铁氧化亚铁Fe3+ Fe(OH)3↓Fe(NO3)3 FeCl3Fe2(SO4)3 _Fe2O3铁离子氢氧化铁硝酸铁氯化铁硫酸铁_氧化铁Ag+_AgNO3AgCl ↓Ag2SO4微Ag2CO3↓Ag2O银离子_硝酸银氯化银硫酸银碳酸银氧化银分类碱→盐氧化物(注:表中“↑”表示挥发性,“↓”表示不溶于水,“微”表示微溶于水,“_”表示物质不存在或遇到水就会分解了,其余的全是易溶于水。
化学部分溶解性表
NO3(-1)
Cl(-1)
SO4(-2)
CO3(-2)
PO4(-3)
H(+1)
(H2O)
溶、挥
溶、挥
溶
溶、挥
溶
(HNO3)
(HCl)
(H2SO4)
(H2CO3)
K(+1)
溶(KOH)
溶(KNO3)
溶(KCl)
溶(K2SO4)
溶(K2CO3)
溶
Na(+1)
溶(NaOH)
溶(NaNO3)
溶(NaCl)
(溶,挥)
(溶,挥)
溶
(溶,挥)
(溶,挥)
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
不
不ห้องสมุดไป่ตู้
微
溶
溶
微
不
不
溶
溶
溶
微
不
溶
溶
溶
—
不
溶
溶
溶
不
不
溶
溶
溶
不
不
溶
溶
溶
不
不
溶
溶
溶
—
不
溶
溶
溶
不
—
溶
不
微
不
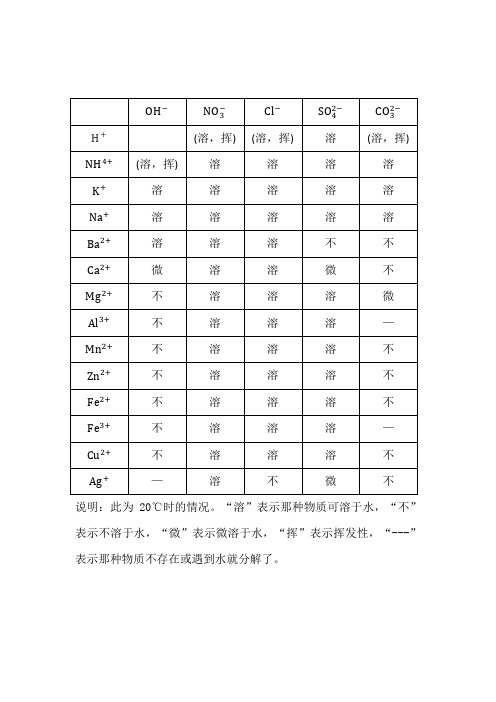
说明:此为20℃时的情况。“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“---”表示那种物质不存在或遇到水就分解了。
溶Cu(NO3)2
溶(CuCl2)
溶(CuSO4)
---
不
化学溶解性表

OHH+ K+ Na+ Ba2+ Ca2+ Mg2+ Al3+ Mn2+ Zn2+ Fe2+ Fe3+ Cu2+ Ag+ Pb2+ Hg2+ 溶 溶 溶 微 不 不 不 不 不 不 不 - 不 - NH4+ 溶、挥 NO3溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 Cl溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 不 微 溶 SO42溶 溶 溶 溶 不 微 溶 溶 溶 溶 溶 溶 溶 微 不 溶 CO32溶 溶 溶 不 不 微 - 不 不 不 - 不 不 不 不 SO32溶 溶 溶 不 不 微 - 不 不 不 - 不 不 不 不 S2溶 溶 溶 - - - - 不 不 不 - 不 不 不 不 SiO32微 溶 溶 溶 不 不 不 不 不 不 不 不 不 不 不 - PO43溶 溶 溶 溶 不 不 不 不 不 不 不 不 不 不 不 不 溶、挥 溶、挥 溶、挥 溶、挥 溶、挥
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水, “挥”表示挥发性,“—”表示那种物质不存在或遇到水就分解了。
I溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 - - 不 不 不
化学淀粉MSDS溶解性安全数据表

化学淀粉MSDS溶解性安全数据表
化学淀粉是一种常见的化学物质,它的溶解性对于安全操作和储存至关重要。
以下是化学淀粉的溶解性安全数据表:
1. 化学淀粉的化学性质
- 化学淀粉的化学名称:淀粉
- 分子式:(C6H10O5)n
- 分子量:可变
- 外观和形态:白色粉末或颗粒
2. 化学淀粉的溶解性
- 溶解性:化学淀粉可在水中溶解
- 溶解度:化学淀粉在水中的溶解度随温度的升高而增加。
在室温下,大约可溶解2克化学淀粉于100毫升水中。
3. 化学淀粉的安全操作
- 避免直接接触:化学淀粉应避免直接接触皮肤、眼睛和呼吸道。
在操作中应佩戴合适的个人防护装备,如实验手套、护目镜和口罩。
- 防止吸入:操作时应注意避免化学淀粉粉尘的吸入。
如有必要,应使用排风系统或穿戴呼吸防护设备。
- 避免误食:化学淀粉不应食用,应存放在儿童无法触及的地方。
- 操作后清洁:操作结束后,应仔细清洁工作区域,并正确处置化学淀粉的废弃物。
4. 化学淀粉的储存
- 储存条件:化学淀粉应储存在干燥、通风良好的地方,远离火源和氧化剂。
- 包装:化学淀粉应储存在密封良好的容器中,以防止湿气和其他污染物的侵入。
请注意,以上数据表仅提供了化学淀粉的溶解性和一些安全操作的基本信息。
在使用化学淀粉时,应参考具体的MSDS(材料安全数据表)以获取更详细和准确的信息。
参考文献:。
初中化学酸碱盐溶解性表

酸、碱、盐溶解性表20℃
注释:
1、此为20℃时的情况;“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“——”表示那种物质不存在或遇到水就分解了;
2、记住初中阶段可能常用到的不溶性物质已重点框出,知道几个微溶性物质有底色处;其余不溶物一般不常考,除此之外就都是可溶性物质了;
3、微溶性物质:在反应物可视为可溶,在生成物可视为不溶,适用于除杂、鉴别题型;
4、白色沉淀:氯化银、碳酸钙、碳酸钡、硫酸钡、氢氧化铝、氢氧化镁
红褐色沉淀:氢氧化铁FeOH3蓝色沉淀:氢氧化铜CuOH2
有色离子:溶液中若有铜离子Cu2+:呈蓝色亚铁离子Fe2+:呈浅绿色
铁离子Fe3+:呈黄色适用于物质推断题型;
5、特殊不溶解:氯化银、硫酸钡既不溶于水,也不溶于稀硝酸;
盐类的溶解性简记:
钾钠铵盐全部溶,
硝酸盐遇水无隐踪,
硫酸盐不溶钡和铅,
盐酸盐不溶银亚汞,
碳酸盐大多沉水中;。
化学溶解性表[1]
![化学溶解性表[1]](https://img.taocdn.com/s3/m/48d1215de518964bcf847c46.png)
化学溶解性表物质的溶解性溶解性溶解度(20℃)易溶大于等于10g可溶大于等于1g小于10g微溶大于等于0.01g小于1g难溶(不溶)小于0.01g在许多化学反应里,作为一个整体参加反应,好像一个原子一样,这样的原子集团叫做原子团。
原子团又叫做根或基团,如氢氧根OH- 、硝酸根NO3- 、碳酸根CO32-、硫酸根SO42-、氯酸根ClO3-、磷酸根PO43-、碳酸氢根HCO3-、铵根NH4+、碳酸根CO32-等。
值得注意的是:原子团不能独立存在,只是化合物的一个组成部分。
在溶液中原子团作为一个整体参加反应。
各种原子团都有自己的特性反应,如CO32 -遇酸变成CO2,SO 42-遇Ba2+产生不溶于稀硝酸的白色沉淀,OH-使酚酞试液变成红色等。
利用特性反应可以检验根的存在。
g (气体)、l (液体)、s (固体)、aq (溶液)化学活动性金属的活动性是反映金属在水溶液里形成水合离子倾向的大小,也就是反映金属在水溶液里起氧化反应的难易,Cs>Rb>K>Ca>Na>Li>Mg>Al>Ti>Zn>Fe>Sn>Pb>Ni>(H)>Cu>Hg>Ag>Os>Ru>Ir>Rh>Pt>Pd>Au 非金属活动性,一般是指卤素与类卤素的活动性。
一般的,周期大的卤素可以把周期小的卤素从它们的卤化物中置换出来F>SCN>Cl(O)>Br>CN>OCN>I>S>N>P>C>Si>H物质溶解性表及沉淀颜色1.Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解溶液呈黄色铁器除锈2.Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解3.CuO+H2SO4=CuSO4+H2O 黑色固体溶解溶液呈蓝色4.ZnO+H2SO4=ZnSO4+H2O 白色固体溶解5.MgO+H2SO4=MgSO4+H2O 白色固体溶解6.2NaOH+H2SO4=Na2SO4+2H2O7.Cu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解8.Ca(OH)2+H2SO4=CaSO4+2H2O9.Mg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解10.2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解11.2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解溶液呈黄色12.Ba(OH)2+ H2SO4=BaSO4+2H2O 生成白色沉淀不溶解于稀硝酸检验SO42的原理13..BaCl2+ H2SO4=BaSO4+2HCl 生成白色沉淀不溶解于稀硝酸检验SO42的原理14.Ba(NO3)2+H2SO4=BaSO4+2HNO3 生成白色沉淀不溶解于稀硝酸检验SO42的原理15.Na2O+2HNO3=2NaNO3+H2O 白色固体溶解16.CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解溶液呈蓝色17.ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解18.MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解19.CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解20.NaOH+HNO3=NaNO3+ H2O21.Cu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解22.Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解23.Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解24.Ca(OH)2+2HNO3=Ca(NO3)2+2H2O25.Fe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解溶液呈黄色26.3NaOH + H3PO4=3H2O + Na3PO427.3NH3+H3PO4=(NH4)3PO428.2NaOH+CO2=Na2CO3+ H2O 吸收COO2H2中的CO229.2NaOH+SO2=Na2SO3+ H2O2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)30.FeCl3+3NaOH=Fe(OH)3+3NaCl 溶液黄色褪去有红褐色沉淀生成1.碳与氧气(不足)的反应2C+O2==== 2CO 碳与氧气(充足)的反应C+O2==== CO22.一氧化碳与氧气的反应2CO+O2==== 2CO23.二氧化碳与碳的反应CO2+C==== 2CO4.碳酸氢钠与盐酸的反应NaHCO3+HCl==== NaCl+H2O+CO2↑5.碳酸钠与盐酸的反应Na2CO3+ 2HCl==== 2NaCl+ H2O+ CO2↑6.碳酸钙与盐酸的反应CaCO3+2HCl==== CaCl2+ H2O+ CO2↑7.碳酸氢钠与氢氧化钠的反应NaHCO3+NaOH==== Na2CO3 +H2O8.碳酸钠与氢氧化钙的反应Na2CO3+Ca(OH)2==== CaCO3↓+ 2NaOH9.碳酸氢钠(少量)与氢氧化钙的反应NaHCO3+ Ca(OH)2==== CaCO3↓+NaOH+ H2O碳酸氢钠(过量)与氢氧化钙的反应2NaHCO3+ Ca(OH)2==== CaCO3↓+Na2CO3+2H2O10.碳酸氢钠加热的反应2Na HCO3==== Na2CO3+ H2O+CO2↑11.碳酸氢钙加热的反应Ca(HCO3)2==== CaCO3↓+H2O+CO2↑12.碳酸钙加热的反应CaCO3==== CaO+CO2↑13.二氧化碳(过量)通入氢氧化钙溶液中的反应Ca(OH)2+2CO2==== Ca(HCO3)2二氧化碳(少量)通入氢氧化钙溶液中的反应Ca(OH)2+CO2==== CaCO3↓+H2O14.氮气与氧气的反应N2+O2==== 2NO15.一氧化氮与氧气的反应2NO+O2==== 2NO216.二氧化氮与水的反应3NO2+ H2O==== 2HNO3+ NO17.氮气与氢气的反应N2+3H2========= 2NH318.氨气与水的反应NH3+H2O==== NH3•H2O19.氨气与盐酸的反应NH3+HCl==== NH4Cl20.氨气与硫酸的反应2NH3+H2SO4==== (NH4)2SO421.氨气与强酸的离子的反应NH3+H+==== NH4+22.氨的催化氧化的反应4NH3+5O2====== 4NO+6H2O23.碳酸氢铵加热的反应NH4HCO3==== NH3↑+CO2↑+H2O24.氯化铵加热的反应NH4Cl==== NH3↑+HCl↑25.碳酸铵加热的反应(NH4)2CO3==== 2NH3↑+CO2↑+H2O26.氯化铵与氢氧化钙的反应2NH4Cl+ Ca(OH)2==== CaCl2+2NH3↑+2H2O27.氯化铵与氢氧化钠的反应NH4Cl+ NaOH==== NaCl+NH3↑+H2O28.碳酸氢铵与氢氧化钠的反应NH4HCO3+2NaOH==== Na2CO3+NH3↑+2H2O29.碳酸氢铵与氢氧化钙的反应N H4HCO3+Ca(OH)2==== CaCO3↓+NH3↑+2H2O30.硝酸的分解的反应4HNO3========= 4NO2↑+O2↑+2H2O31.铜与浓硝酸的反应Cu+4HNO3(浓)==== Cu(NO3)2+2NO2↑+2H2O32.铜与稀硝酸的反应3Cu+8HNO3(稀)==== 3Cu(NO3)2+2NO↑+4H2O33.铁与浓硝酸的反应Fe+6HNO3(浓)==== Fe(NO3)3+3NO2↑+3H2O34.铁与稀硝酸的反应Fe+4HNO3(稀)==== Fe(NO3)3+NO↑+2H2O35.碳与浓硝酸的反应C+4HNO3(浓)==== CO2↑+4NO2↑+2H2O36.一氧化氮与一氧化碳的反应2NO+2CO====== N2+2CO237.一氧化氮与氧气和水的反应4NO+3O2+2H2O==== 4HNO338.二氧化氮与氧气和水的反应4NO2+O2+2H2O==== 4HNO339.氢氧化钠吸收二氧化氮和一氧化氮的反应2NaOH+NO2+NO==== 2NaNO2+ H2O40.氨气(过量)与氯气的反应8NH3+3Cl2==== 6NH4Cl+N2氨气(少量)与氯气的反应2NH3+3Cl2==== 6HCl+N241.二氧化氮生成四氧化二氮的反应2NO2==== N2O442.硫与铜的反应S+2Cu==== Cu2S43.硫与铁的反应S+Fe==== FeS44.硫与钠的反应S+2Na==== Na2S45.硫与铝的反应3S+2Al==== Al2S346.硫与汞的反应S+Hg==== HgS47.硫与氧气的反应S+O2==== SO248.硫与氢气的反应S+H2==== H2S49.硫与氢氧化钠的反应3S+6NaOH==== 2Na2S+Na2SO3+3H2O50.硫与浓硫酸的反应 S+2H2SO4(浓)==== 3SO2+2H2O51.黑火药点燃S+2KNO3+3C==== K2S+3CO2↑+N2↑52.二氧化硫(少量)与氢氧化钠的反应SO2+2NaOH==== Na2SO3+H2O二氧化硫(过量)与氢氧化钠的反应SO2+NaOH==== NaHSO353.二氧化硫与氢氧化钙的反应SO2+Ca(OH)2==== CaSO3↓+H2O54.二氧化硫与亚硫酸钙溶液的反应SO2+CaSO3+H2O ==== Ca(HSO3)255.二氧化硫与水的反应SO2+H2O==== H2SO356.二氧化硫与硫化氢的反应SO2+2H2S==== 3S↓+2H2O57.二氧化硫与氧气的反应2SO2+O2====== 2SO358.二氧化硫与过氧化钠的反应SO2+Na2O2==== Na2SO459.二氧化硫与氯水的反应SO2+ Cl2+2H2O==== H2SO4+2HCl60.三氧化硫与水的反应SO3+H2O==== H2SO461.亚硫酸与氧气的反应2H2SO3+O2==== 2H2SO462.亚硫酸钠与氧气的反应2Na2SO3+O2==== 2Na2SO463.浓硫酸与铜的反应 2H2SO4(浓)+Cu==== CuSO4+SO2↑+2H2O64.浓硫酸与碳的反应 2H2SO4(浓)+C==== CO2↑+2SO2↑+2H2O寿65.工业制备硫酸(初步) 4FeS2+11O2==== 8SO2+2Fe2O366.实验室制备硫酸(初步) Na2SO3+H2SO4(浓)==== Na2SO4+SO2↑+H2O67.硫化氢(少量)与氢氧化钠的反应H2S+2NaOH==== Na2S+2H2O硫化氢(过量)与氢氧化钠的反应H2S+NaOH==== NaHS+H2O68.硫化氢(少量)与氨气的反应H2S+2NH3==== (NH4)2S硫化氢(过量)与氨气的反应H2S+NH3==== NH4HS69.硫化氢与氧气(不足)的反应2H2S+O2==== 2S↓+2H2O 2H2S+O2==== 2S+2H2O硫化氢与氧气(充足)的反应2H2S+3O2==== 2SO2+2H2O70.硫化氢与氯气的反应H2S+Cl2==== 2H Cl+S↓71.硫化氢与浓硫酸的反应 H2S+H2SO4(浓)==== S↓+SO2↑+2H2O72.硫化氢的制备FeS+H2SO4==== FeSO4+H2S↑73.电解饱和食盐水(氯碱工业) 2NaCl+2H2O==== 2NaOH+H2↑+Cl2↑74.电解熔融状态氯化钠(制单质钠) 2NaCl==== 2Na+Cl2↑75.海水制镁(1) CaCO3==== CaO+CO2 (2) CaO+H2O==== Ca(OH)2 (3) Mg2++2OH2-==== Mg(OH)2↓ (4) Mg(OH)2+2HCl==== MgCl2+2H2O (5) MgCl2==== Mg+Cl2↑76.镁在空气中燃烧(与氧气的反应) 2Mg+O2==== 2MgO(与氮气的反应) 3Mg+N2==== Mg3N2(与二氧化碳的反应) 2Mg+CO2==== 2MgO+C77.镁与氯气的反应Mg+Cl2==== MgCl278.镁与水的反应Mg+2H2O==== Mg(OH)2+H2↑79.镁与盐酸的反应Mg+2HCl==== MgCl2+H2↑80.镁与氢离子的反应Mg+2H+==== Mg2++H2↑81.二氮化三镁与水的反应Mg3N2+6H2O==== 3Mg(OH)2↓+2NH3↑82.镁与溴水的反应(颜色退去) Mg+Br2==== MgBr2(产生气泡) Mg+2HBr==== MgBr2+H2↑83.溴与水的反应Br2+H2O==== HBr+HBrO84.溴与氢氧化钠的反应Br2+2NaOH==== NaBr+NaBrO+H2O85.溴与氢气的反应Br2+H2==== 2HBr86.溴与铁的反应3Br2+2Fe==== 2FeBr387.碘与铁的反应I2+Fe==== FeI288.溴与碘化钾的反应Br2+2KI==== 2KBr+I289.氯气与溴化钾的反应2KBr+Cl2==== 2KCl+Br290.硅与氧气的反应Si+O2==== SiO291.硅与氯气的反应Si+2Cl2==== SiCl492.硅与氢气的反应Si+2H2===== SiH493.二氧化硅与氟的反应Si+2F2==== SiF494.硅与碳的反应Si+C==== SiC95.硅与氢氧化钠溶液的反应Si+2NaOH+H2O==== Na2SiO3+2H2↑96.硅与氢氟酸的反应Si+4HF==== SiF4+2H2↑97.单质硅的制备(1.制备)SiO2+2C==== Si+2CO(2.提纯)Si+2Cl2==== SiCl4(3.提纯)SiCl4+2H2==== Si+4HCl98.二氧化硅与氢氧化钠的反应SiO2+2NaOH==== Na2SiO3+H2O99.二氧化硅与氧化钠的反应SiO2+Na2O==== Na2SiO3100.二氧化硅与碳酸钠的反应SiO2+Na2CO3==== Na2SiO3+ CO2↑101.二氧化硅与氧化钙的反应SiO2+CaO==== CaSiO3102.二氧化硅与碳酸钙的反应SiO2+CaCO3==== CaSiO3+CO2↑ 103.二氧化硅与氢氟酸的反应SiO2+4HF==== SiF4+2H2O 104.硅酸的制备Na2SiO3+ CO2+H2O==== H2SiO3↓+ Na2CO3 105.硅酸加热分解H2SiO3==== SiO2+H2O 106.铝与氧气的反应4Al+3O2==== 2Al2O3 107.铝与氯气的反应2Al+3Cl2==== 2AlCl3 108.铝与盐酸的反应2Al+6HCl==== 2AlCl3+3H2↑109.铝与氢氧化钠的反应2Al+2NaOH+6H2O==== 2Na[Al(OH)4]+3H2↑ 110.铝与水的反应2Al+6H2O==== 2Al(OH)3+3H2↑111.铝与三氧化二铁的反应(铝热反应)2Al+Fe2O3==== 2Fe+Al2O3 112.铝与二氧化锰的反应(铝热反应)4Al+3MnO2==== 3Mn+2AlO3 113.氧化铝与盐酸的反应Al2O3+6HCl==== 2AlCl3+3H2O114.氧化铝与氢氧化钠的反应Al2O3+2NaOH+3H2O==== 2Na[Al(OH)4] 115.电解氧化铝2Al2O3==== 4Al+3O2↑116.硫酸与与一水合氨的反应Al2(SO4)3+6NH3•H2O==== 2Al(OH)3↓+3(NH4)2SO4 117.氯化铝与一水合氨的反应AlCl3+3NH3•H2O==== Al(OH)3↓+3NH4Cl 118.氯化铝与氢氧化钠(少量)的反应AlCl3+3NaOH==== Al(OH)3↓+3NaCl 119.氢氧化铝与氢氧化钠的反应Al(OH)3+NaOH==== Na[Al(OH)4]120.氯化铝与氢氧化钠(过量)的反应AlCl3+4NaOH==== Na[Al(OH)4]+3NaCl121.四羟基合氯酸钠与盐酸(少量)的反应Na[Al(OH)4]+HCl==== Al(OH)3↓+NaCl+H2O 122.氢氧化铝与盐酸的反应Al(OH)3+3HCl==== AlCl3+3H2O123.四羟基合氯酸钠与盐酸(过量)的反应Na[Al(OH)4]+4HCl==== AlCl3+NaCl+4H2O 124.四羟基合氯酸钠与氯化铝的反应3Na[Al(OH)4]+AlCl3==== 4Al(OH)3↓+3NaCl 125.向四羟基合氯酸钠中通入过量二氧化碳Na[Al(OH)4]+CO2==== Al(OH)3↓+NaHCO3 126.铜在潮湿空气中被腐蚀2Cu+O2+H2O+CO2==== Cu2(OH)2CO3 127.铜与氧气的反应2Cu+O2==== 2CuO 128.铜与氯气的反应Cu+Cl2==== CuCl2 129.铜氧化在高温下转化4CuO==== 2Cu2O+O 2↑ 130.硫酸铜与水的反应CuSO4+5H2O==== CuSO4•5H2O1.与碱反应产生气体(1)(2)铵盐:O H NH NH 234+↑−→−+碱⎪⎪⎩⎪⎪⎨⎧↑+=++↑+=++↑−−→−-232222222232222H SiO Na O H NaOH Si H NaAlO O H NaOH Al H Si Al OH 、单质2.与酸反应产生气体(1) (2)()()()2332222332H HH CO HCO CO S HS H S SO HSO SO +++------⎧−−→↑⎪⎪−−→↑⎨⎪−−→↑⎪⎩化合物3.Na 2S 2O 3与酸反应既产生沉淀又产生气体: S 2O 32-+2H +=S ↓+SO 2↑+H 2O4.与水反应产生气体 (1)单质(2)化合物5.强烈双水解6.既能酸反应,又能与碱反应(1)单质:Al (2)化合物:Al 2O 3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐、氨基酸。
溶解度表_精品文档

溶解度表第一篇范文:物质溶解度表溴化铊TlBrTlClTl2SO425°C25°C25°C25°C;410–62、6510–43、610–42、2510–4氯化铊硫酸铊硫氰化铊TlSCN物质水溶液溶解度表以化学品中特征元素的拼音顺序排列。
所有数据都为1atm下水溶液溶解度的数据,单位为g、100cm31、锕、氨、铵。
(2)2、钯、钡、铋、铂、钚。
33、氮、镝。
…44、铒。
45、钒。
…。
…46。
钆、钙、锆、镉、铬、汞、钴、硅。
…。
47。
铪、氦、钬。
78。
镓、钾、金。
…79。
钪。
…。
…810。
镧、锂、硫、镥、铝。
911、镁、锰。
912、钠、镍、钕。
1013、硼、铍、钋、镨。
…1214、氢、铅。
…。
1215、铷。
…。
1316。
铯、钐、砷、铈、锶。
1417。
铊、碳、铽、锑、铁、铜、钍。
1518。
锡、氙、锌、溴。
…1719。
氩、氧、铟、钇、镱、银、铀、铕。
1920。
有机化合物。
…。
2221、酸碱盐溶解性表。
231、锕、氨、铵2、钯、钡、铋、铂、钚3、氮、镝4、铒5、钒6。
钆、钙、锆、镉、铬、汞、钴、硅第二篇范文:溶解性表溶解性表钾、钠、铵盐、硝酸盐;(钾盐、钠盐、铵盐、硝酸盐均可溶于水)氯化物除银、亚汞;(氯化物除氯化银、氯化亚汞外均可溶于水)硫酸盐除钡钙铅;(硫酸盐除硫酸钡、硫酸铅外均可溶于水)碳酸、磷酸盐,只溶钾、钠、铵。
说明:以上四句歌谣概括了8类相加在水中溶解与不溶的情况。
口诀四编辑钾钠铵硝皆可溶、盐酸盐不溶银亚汞;硫酸盐不溶钡和铅、碳磷酸盐多不溶。
多数酸溶碱少溶、只有钾钠铵钡溶口诀五编辑钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)再说硫酸盐,不容有钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物)只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)最后说碱类,钾、钠、铵和钡。
物质的溶解性表3篇

物质的溶解性表第一篇:物质的溶解性表简介物质的溶解性是指在一定温度和压力下,能够被溶解在其溶剂中的物质的最大量。
各种物质的溶解性都不同,而溶解性与温度、压力、溶液浓度以及其他物质的存在等有关系。
为了方便各领域的科研工作者对溶解性的研究和应用,人们编制了一些物质的溶解性表。
物质的溶解性表属于物化学领域,在许多领域都有着很重要的应用。
例如,在医学领域,医生们需要知道某些药物在人体内的溶解度,以便调整用药剂量和用药方法。
在工业领域,研发新材料前也需要了解其在不同溶剂中的溶解度情况。
同时,化学工程师也需要化学反应的溶解程度数据来评估反应的效率和产物的纯度等方面。
物质的溶解性受到多种因素的影响,如一些特殊的物质之间相互作用,温度、压力、酸碱度、溶剂种类和浓度等。
因此,物质的溶解性表中还包含了许多相关信息,如物质的分子式、性质、密度、熔点、沸点、沸点升高、加压沸点、毒性等信息。
这些信息也对科学家和研究者们进行分析和实验有很大的帮助。
在实际应用过程中,物质的溶解性表应注意准确性和全面性。
为了使得物质的溶解性表更符合实际应用,科学家们对表中数据进行了不断的更新和修订。
目前对于个别物质的溶解度还存在争议或尚未有明确数据的情况,这需要科学家们进一步探索和研究。
总之,物质的溶解性表是化学领域的重要参考工具,对于提高各领域的研究和实践水平有着重要的作用。
第二篇:实例解析--NaCl的溶解性氯化钠(NaCl)是一种常见的无机化合物,具有很好的水溶性。
让我们进一步了解一下NaCl在不同温度下的溶解度:温度溶解度0 ℃ 35.7 g/100 mL H2O10 ℃ 38.9 g/100 mL H2O20 ℃ 39.1 g/100 mL H2O30 ℃ 39.7 g/100 mL H2O50 ℃ 42.0 g/100 mL H2O60 ℃ 38.8 g/100 mL H2O70 ℃ 37.8 g/100 mL H2O80 ℃ 37.0 g/100 mL H2O90 ℃ 36.0 g/100 mL H2O100 ℃ 35.7 g/100 mL H2O由表可知,NaCl在水中的溶解度随着温度的升高而增加。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(1) [化学溶解性表]初中化学所有沉淀图片(附酸碱盐溶解性表)
在初三化学(人教版)附录1部分酸、碱和盐的溶解性表(室温)中,“不”代表这种物质不溶于水,“微”表示这种物质微溶于水。
我们在写方程式时,要注意标注沉淀符号“↓”。
今天,老师总结了表中所有沉淀(固态g)的颜色。
都是实物照片。
非常直观,方便同学们理解记忆。
酸碱盐溶解性表
以下是沉淀(固态)图片
氢氧化钙 Ca(OH)2
氢氧化镁 Mg(OH)2
氢氧化铝 Al(OH)3
氢氧化锰本物质有两种Mn(OH)2和Mn(OH)3
氢氧化锰本物质有两种Mn(OH)2和Mn(OH)3
Mn(OH)2白色到浅桃红色结晶。
在空气中极易与氧气反应,生成棕色的偏氢氧化锰沉淀。
方程式为2Mn(OH)2+O2=2MnO(OH)2。
所以纯白色的氢氧化锰不多见,一般为带有棕色的晶体。
Mn(OH)3 白色沉淀,常温下为固体。
氢氧化锌 Zn(OH)2
氢氧化亚铁 Fe(OH)
氢氧化铁 Fe(OH)3
氯化银 AgCl
硫酸钡 BaSO4
硫酸银 Ag2SO4
硫酸钙 CaSO2H2O
碳酸钡 BaCO3
碳酸钙 CaCO
碳酸镁 MgCO3
碳酸锰 MnCO3
碳酸锌 ZnCO3
碳酸亚铁 FeCO3
碳酸银 AgCO
如果觉得有用的话,就分享并收藏吧!
(2) [化学溶解性表]初中化学酸碱盐溶解性表-
阳离子
阴离子
OH-
NO3
Cl-
SO4
S
SO3
CO3
SiO3
H+溶、挥溶、挥溶溶、挥溶、挥溶、挥不
溶
NH4 溶、挥溶
溶
溶
溶
溶
溶
溶
溶
K+
溶
溶
溶
溶
溶
溶
溶
溶Na+ 溶
溶
溶
溶
溶
溶
溶
溶
溶
Ba2+ 溶
溶
溶
溶
不
不
不
不Ca2+ 微
溶
溶
微
微
不
不
不
不Mg2+ 不
溶
溶
溶
溶
微
不
不
Al3+ 不
溶
溶
溶
-
-
-
不
不Mn2+ 不
溶
溶
溶
不
不
不
不
Zn2+ 不
溶
溶
溶
不
不
不
不
不
Cr3+ 不
溶
溶
溶
-
-
-
不
不
不
溶
溶
溶
不
不
不
不
不
Fe3+ 不
溶
溶
溶
-
-
-
不
不
Sn2+ 不
溶
溶
不
-
-
-
不
Pb2+ 不
溶
微
不
不
不
不
不
不
Bi3+ 不
溶
-
不
不
不
-
不Cu2+ 不
溶
溶
溶
不
不
不
不
不Hg+ -
溶
不
微
不
不
-
不Hg2+ -
溶
溶
溶
不
不
不
-
不
Ag+ -
溶
不
微
不
不
不
不
(3) [化学溶解性表]高中化学最全溶解性表,绝对全!一表在手,高考无忧,你值得收藏
熟悉化学物质溶解性好处多
熟悉化学物质溶解性的好处很多
1,判断复分解反应是否能够进行。
2,判断气体收集方法。
3,判断化合物分离方法。
总之,在初高中,很多化学知识都和物质溶解性密切相关。
这里给大家展示的是一张化学物质溶解性表,可以说是很全面,基本上无疏漏的了,可以全面涵盖中高考,谁溶谁不溶一目了然。
(注如果有嫌图不清晰的,可以私信和我要原表,是免费赠与的,本老师提供的一切资料都不收费)
最全面的物质溶解性表
注“溶”表示那种物质可溶于水,“不”表示不溶于水,“微或略溶”表示微溶于水,“挥”表示挥发性,“—”表示那种物质不存在或遇到水就分解了。
我是一名高中老师,大家喜欢我的文章的话可以顺手点个赞,更可以加关注,我会经常发些初高中学习与教育方面的文章来供大家阅读与参考,如有不当之处也多请大家包涵,谢谢!。
