(完整版)3.1硫酸工业制备
硫酸的工业制法PPT课件

照片
.
9
吸收塔
吸
收
塔
.
10
沸腾炉照片
沸 腾 炉
.
11
接触室照片
接
触
室
.
12
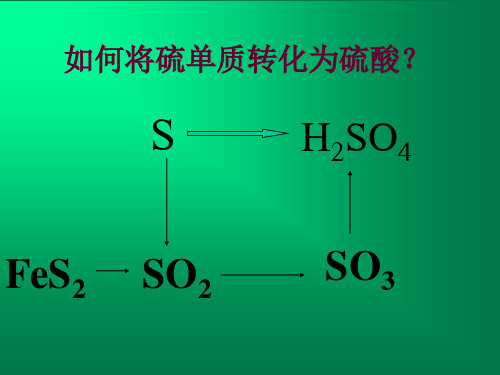
• 一、造气 1.原料 接触法制硫酸可以用硫黄、黄铁矿、石膏、有色金属
冶炼厂的烟气(含有一定量的SO2)等作原料。
从原料成本、环境保护等角度考虑,硫黄是制硫酸的 首选材料。我国由于硫黄矿产资源较少,主要用黄铁矿作 原料。
②二氧化硫的催化氧化
S+O2 点燃 SO2
4FeS2+11O2 高温 2Fe2O3+8SO2
催化剂
2SO2+O2
2SO3
③三氧化硫的吸收
SO3 +H2O → H2SO4
.
3
.
4
.
5
硫酸的工业生产 硫酸工业生产流程动画
沸腾炉
接触室
吸收塔
净 化
冷却
.
6
.
7
沸腾炉
沸 腾 炉
照片
.
8
接触室
接
触
室
.
34
.
35
• 进入接触室的SO2和O2需要加热,而接触 氧化生成SO3时放出热量,反应环境温度 会不断升高,用热交换器将这些热量来 预热SO2和O2反应。
.
36
为什么要换热?
• 由于接触氧化是一个放热反应,要想 增大SO2的转化率、提高SO3的产率,平 衡要向正反应方向移动,根据平衡移动 理论,高温不利于SO3的生成,所以装一 个热交换器可用来把反应生成的热传给 需预热的炉气。
生产设备 沸腾炉
.
16
黄铁矿 空气
SO2、O2、 N2
(完整版)3.1硫酸工业制备

第一节接触法制硫酸●教学目标1.了解接触法制硫酸的化学原理、原料、生产流程和典型设备。
2.通过二氧化硫接触氧化条件的讨论,复习巩固关于化学反应速率和化学平衡的知识,训练学生应用理论知识分析和解决问题的能力。
一、反应原理1.S+O2===SO23.SO3+H2O===H2SO4现阶段我国硫酸的生产原料以黄铁矿(主要成分为FeS2)为主,部分工厂用有色金属冶炼厂的烟气、矿产硫黄或从石油、天然气脱硫获得硫黄作原料。
4FeS2+11O2高温=====2Fe2O3+8SO2如以石膏为原料的第一步反应就是:2CaSO4+C∆====2CaO+2SO2↑+CO2二、工业制硫酸的生产流程。
工业上制硫酸主要经过以下几个途径:1、以黄铁矿为原料制取SO2的设备叫沸腾炉。
沸腾炉示意图矿石粉碎成细小的矿粒,是为了增大与空气的接触面积,通入强大的空气流为使矿粒燃烧得更充分,从而提高原料的利用率。
[设问]黄铁矿经过充分燃烧,以燃烧炉里出来的气体叫做“炉气”。
但这种炉气往往不能直接用于制取SO3,这是为什么呢?这是因为炉气中常含有很多杂质,如N2,水蒸气,还有砷、硒的化合物及矿尘等。
这些杂质有些是对生产不利的,如砷硒的化合物、矿尘能够使下一步氧化时的催化剂中毒,水蒸气对设备也有不良影响,因此炉气必须经过净化、干燥处理。
问题:1.N2对硫酸生产没有用处,为什么不除去?2.工业生产上为什么要控制条件使SO2、O2处于上述比例呢?[答案]1.N2对硫酸的生产没有用处,但也没有不利之处,若要除去,势必会增加生产成本,从综合经济效益分析没有除去的必要。
2.这样的比例是增大反应物中廉价的氧气的浓度,而提高另一种反应物二氧化硫的转化率,从而有利于SO2的进一步氧化。
三、生产设备及工艺流程2.接触室根据化学反应原理,二氧化硫的氧化是在催化剂存在条件下进行的,目前工业生产上采用的是钒催化剂。
二氧化硫同氧气在钒催化剂表面上与其接触时发生反应,所以,工业上将这种生产硫酸的方法叫做接触法制硫酸。
硫酸的工业制法
硫酸的工业制法硫酸硫酸盐一、硫酸的工业制法——接触法1、接触法制硫酸的生产原理及工业设备生产阶段化学方程式工业设备生产原理(1)SO2的制取与净化4FeS2+11O22Fe2O3+8SO2沸腾炉扩大接触面(矿石粉碎)(2)SO2氧化成SO32SO2 + O22SO3接触室热交换(3)SO3的吸收和硫酸的生成SO2 + H2O = H2SO4实际是用浓H2SO4吸收吸收塔逆流吸收2、尾气的吸收,可用氨水吸收2NH3 + H2O + SO2 = (NH4)2SO3NH3 + H2O + SO2 = NH4HSO3将生成物用稀硫酸处理后,可制得化肥(NH4)2SO4,并回收了SO2。
3、生产简要流程4、有关物质纯度、转化率、产率的计算物质的纯度不纯物中所含纯物质的质量不纯物质的总质量100%5、多步递进反应的关系式计算法遇有多步递进反应(即前一步反应的产物就是后一步反应的反应物)的计算时,可用关系式法一步求解。
此种方法的关键,是根据各步反应的化学方程式,找出起始原料与最终产物之间的物质的量之比,列出相应的关系式,然后按常规方法求解。
二、浓硫酸的特性硫酸的化学性质跟它的浓度有密切的关系。
稀硫酸具有酸类的通性(H+的性质),而浓硫酸中存在大量未电离的硫酸分子,因而浓硫酸除具有酸类的通性外,还具有吸水性、脱水性和强氧化性等特性。
1、浓硫酸的吸水性。
浓硫酸具有吸收附着在物质表面或内部的湿存水和吸收结晶水的性能。
其原因是硫酸分子极易与水分子化合成一系列稳定的水合物:H2SO4·nH2O(n = 1,2,4,6,8)。
同时放出大量的热。
这些水合物很稳定。
利用浓H2SO4的吸水性,可以做干燥剂。
浓H2SO4能干燥H 2、O 2、CO 等中性气体,也能干燥SO 2、Cl 2、CO 2、HCl 、HF 等酸性气体;但不能干燥NH 3等碱性气体,也不能干燥HBr 、HI 、H 2S 等有强还原性的气体。
2、浓硫酸的脱水性。
硫酸的工业制备

硫酸的工业制备
硫酸工业制备的原料主要有过氧化物及二氧化硫。
过氧化物包括氢过氧化物、铵、氧酸、硝酸铵和四氧化三铁等。
主要反应原料氢过氧化物和二氧化硫的反应,二氧化硫的来源可以为固体硫、硫酸钠或硫酸钙等,它可以从焦炭、石油精制和硫铝铁矿中获得。
1. 准备原料:首先将氢氧化物与二氧化硫混合,或氢氧化物与硫酸钠混合,或硝酸铵和二氧化硫混合。
2. 加热:然后将混合物加热,达到相应的反应温度,在高温条件下反应,当温度高于150℃时,反应速度加快。
3. 离心速度: 在硫酸分馏、冷却的工艺中,需要不断调整离心机的转速,使结晶硫酸分馏出,以确保其纯度。
4. 冷却:冷却后,在离心机中继续旋转,使结晶分离形成结晶硫酸。
5. 成品:结晶硫酸经过纯化提炼处理,调整到特定的含量,并进行包装,成品硫酸可用于制造化学药品、陶瓷、农业化肥等。
1. 在操作过程中应控制反应温度,防止反应温度过高,以免影响反应的进行。
3. 在硫酸的提炼处理和包装时,应遵循相关程序,并对硫酸的存储、运输以及使用应把握在合理的范围之内,以确保硫酸的质量和安全。
硫酸的工业制备人教版高一年级化学课堂教辅PPT

2.浓硫酸的三大特性 (1)吸水性 吸水性是指浓硫酸能够吸收空气或其他物质中的水分。这里的“水”可以 是结晶水合物中的结晶水,也可以是混合气体中的水蒸气,所以浓硫酸可作 为干燥剂。 (2)脱水性 脱水性是指夺取某些有机物中的氢、氧元素形成水分子。所以浓硫酸对 有机物有强烈的腐蚀作用,可使有机物脱水炭化。
CO2↑+2SO2↑+2H2O,反应中浓硫酸体现的性质为
④能与其他还原性物质反应,如H2S、HI等。
【微思考2】浓硫酸脱去了CuSO4·5H2O中的结晶水,体现了浓硫酸的什么 性质? 提示 吸水性。
3.硫酸的用途 (1)制磷肥、氮肥等肥料,也可用于除锈,还可制实验价值较大的硫酸盐等。 (2)利用其吸水性,在实验室浓硫酸常用作干燥剂。 (3)利用浓硫酸的高沸点、难挥发性,常用于制取各种挥发性酸,如HCl气体。 (4)利用其脱水性,常用作脱水剂。
的评价:
。
答案 (1)比较浓硫酸和水吸收三氧化硫的效果
4FeS2+11O2
2Fe2O3+8SO2
(2)干燥二氧化硫和氧气(或使SO2和O2充分混合或调节气体的流速)
(3)甲装置中,通氧气气体的导管口产生气泡的速率大约是通二氧化硫导管
口的2倍 BC
(4)缺少尾气吸收装置等(合理答案均可)
解析 (1)该实验的目的是比较浓硫酸和水吸收三氧化硫的效果,工业制硫
例的实验现象是
;
实验时发现,丁装置在反应过程中先出现气泡,不久就出现了白雾,而丙装置一直
都没有任何现象。
据此得出的下列结论中正确的是
。
A.浓硫酸不能吸收产生的气体
B.水与三氧化硫的反应是放热反应
C.浓硫酸吸收的效果比水好
D.水的吸收效果比浓硫酸好
工业制取硫酸方程式

工业制取硫酸方程式
工业制硫酸:4FeS2+11O2=8SO2+2Fe2O3,2SO2+O2=2SO3,
SO3+H2O=H2SO4。
工业制取硝酸:4NH3+5O2=4NO+6H2O,2NO+O2=2NO2,
3NO2+H2O=2HNO3+NO。
浓硫酸可吸收空气或其他气体中的水蒸气、混在固体中的湿存水、结晶水合物中的结晶水,常用盛有浓硫酸的洗气瓶干燥某些气体(如H2、Cl2、SO2等),不能干燥碱性气体(如NH3等)和强还原性气体(如H2S等)。
注意事项:
对皮肤、粘膜等组织有强烈的刺激和腐蚀作用。
蒸汽或雾可引起结膜炎、结膜水肿、角膜混浊,以至失明。
引起呼吸道刺激重者发生呼吸困难和肺水肿,高深度引起喉痉挛或声门水肿而窒息而亡。
口服后引起消化道烧伤以致溃疡,严重者可能有胃穿孔、腹膜炎、肾损害、休哀等,口服浓硫酸致死量约为5毫升。
硫酸的工业制法正式版
我不相信,双手握不住执着的绳索。人生一世,草木一秋,我们就跟大树上的叶子一样,早晚会枯黄陨落。树叶虽小但见证了春秋,既目睹了繁花似锦,也目睹 了大树凋零。我们都是很相似的树叶,因为人生就是这样,生老病死是谁都要经过的。 如果你是条船,漂泊就是你的命运,可别靠岸。谁校对时间 谁就会突然 老去 虽生犹死的寂寞让生命都凋零了人总要慢慢成熟,将这个浮华的世界看得更清楚,看穿伪装的真实,看清隐匿的虚假,很多原本相信的事便不再相信。但是, 要相信,这个世界里美好总要多过阴暗,欢乐总要多过苦难,还有很多事,值得你一如既往的相信。人生不能像做菜,把所有的料都准备好了才下锅 卑鄙是卑鄙 者的通行证高尚是高尚者的墓志铭 早上,灿亮的阳光扑进来,他还睡着。我打开窗帘,看窗外那一片平凡而现实的风景。心想,在平凡和现实里,也必有巨大的 美的可能吧。那时我们还年轻。穿过残垣断壁苍松古柏,我们来到山崖上。沐浴着夕阳,心静如水,我们向云雾飘荡的远方眺望。其实啥也看不到,生活的悲欢 离合远在地平线以外,而眺望是一种青春的姿态。 才子当然心里冰雪般的透彻:有些事,只能一个人做。有些关,只能一个人过。有些路啊,只能一个人走。 不必向我诉说春天我的心里并没有秋寒不必向我解释色彩我的眼里自有一片湛我叹世事多变幻世事望我却依然 我和这个世界不熟。 这并非是我逃避的原因。 我 依旧有很多憧憬, 对梦想,对记忆,对失败,对希冀。 我和这个世界不熟。 这并非是我卑微的原因。 我依旧有很多勇敢, 不信输,不信神,不信天,不信地。 我和这个世界不熟。 这并非是我失落的原因。 我依旧有很多高昂, 有存在,有价值,有独特,有意义。说实话离开故乡久了,家的概念变得混乱。有时我在他
硫酸的工业制备流程

硫酸的工业制备流程下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!硫酸是一种重要的化工产品,在工业生产中有着广泛的应用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一节接触法制硫酸•教学目标1•了解接触法制硫酸的化学原理、原料、生产流程和典型设备。
2•通过二氧化硫接触氧化条件的讨论,复习巩固关于化学反应速率和化学平衡的知识,训练学生应用理论知识分析和解决问题的能力。
一、反应原理1.S+ O2===SO2催化剂生2S0:十Q 區一ZSO H3.SO3+ H2O===H2SO4现阶段我国硫酸的生产原料以黄铁矿(主要成分为FeS2)为主,部分工厂用有色金属冶炼厂的烟气、矿产硫黄或从石油、天然气脱硫获得硫黄作原料。
咼温4FeS2+ IIO2 2Fe2O3 + 8SO2如以石膏为原料的第一步反应就是:2CaSO4 + C 2CaO + 2SO2 f + CO2二、工业制硫酸的生产流程。
工业上制硫酸主要经过以下几个途径:-- ”造"壬--- ”罠化 --- *■成燧--- ►1、以黄铁矿为原料制取SO2的设备叫沸腾炉。
沸腾炉示意图潯腭炉矿石粉碎成细小的矿粒,是为了增大与空气的接触面积,通入强大的空气流为使矿粒燃烧得更充分,从而提高原料的利用率。
[设问]黄铁矿经过充分燃烧,以燃烧炉里出来的气体叫做“炉气”。
但这种炉气往往不能直接用于制取SO3,这是为什么呢?这是因为炉气中常含有很多杂质,如N2,水蒸气,还有砷、硒的化合物及矿尘等。
这些杂质有些是对生产不利的,如砷硒的化合物、矿尘能够使下一步氧化时的催化剂中毒,水蒸气对设备也有不良影响,因此炉气必须经过净化、干燥处理。
问题:1.N 2对硫酸生产没有用处,为什么不除去?2.工业生产上为什么要控制条件使 S02、02处于上述比例呢?[答案]1.N 2对硫酸的生产没有用处,但也没有不利之处,若要除去,势必会增加生产 成本,从综合经济效益分析没有除去的必要。
2•这样的比例是增大反应物中廉价的氧气的浓度,而提高另一种反应物二氧化硫的转化率,从而有利于 S02的进一步氧化。
三、生产设备及工艺流程炉气(S0z .0z 及亲质)需净■化、干煥2•接触室根据化学反应原理,二氧化硫的氧化是在催化剂存在条件下进行的,目前工业生产上采用的是钒催化剂。
二氧化硫同氧气在钒催化剂表面上与其接触时发生反应, 所以,工业上将这种生产硫酸的方法叫做接触法制硫酸。
二氧化硫发生催化氧化的热化学方程式为:1 繼化剂[板书]50血)+专0&)= ----- SO 5(g);AH=-98.3kJ/mol[提问]S02的接触氧化在什么条件下反应可提高S02的转化率?S02的氧化为一可逆反应。
根据勒夏特列原理,加压、降温有利于S02转化率的提高。
实际生产中反应条件:常压下 400 C 〜500 C 。
为什么??.氧化硫在接触室里是如何氧化成三氧化硫的呢?经过净化、干燥的炉气,通过接触室中部的热交换器被预热到 400 C 〜500C ,通过上层催化剂被第一次氧化,因为二氧化硫的催化氧化是放热反应,随着反应的进行,反应环境的温度会不断升高,这不利于三氧化硫的生成。
接触室中部安装的热交换器正是把反应生成的 热传递给接触室里需要预热的炉气,同时降低反应后生成气体的温度,使之通过下层催化剂被第二次氧化。
这是提高可逆反应转化率的一种非常有效的方法。
3•吸收塔二氧化硫在接触室里经过催化氧化后得到的气体含三氧化硫一般不超过10%,其余为N 2、02及少量二氧化硫气体。
这时进入硫酸生产的第三阶段,即成酸阶段。
其反应的热化学方 程式为:S03(g ) + H 2O (I )===H 2S04(I ); △ H= - 130.3 kJ/mol从反应原理上看,硫酸是由三氧化硫跟水化合制得的。
事实上,工业上却是用 浓H 2SO 4来吸收S03的,为什么要这样操作呢?1.沸腾炉 黄铁矿粉碎至细粒過人强.大空气駅增大凄触面,提离转化率〉98.3% 的从理论上讲,三氧化硫转化为硫酸有二种途径: 一种是三氧化硫被硫酸水溶液吸收, 与S03(g ) + ^0(1)^=^" H 2SO 4(I ), △ H V 0,这是一个可逆放热反应。
另一途径是用水吸收,但硫酸与水蒸气发生反应生成包含杂质气体的酸雾。
因此,实际生产中,用98.3%的浓硫酸作为吸收剂吸收三氧化硫。
[讨论]1•从吸收塔里排出的尾气有哪些成分,能直接排放到空气中吗? 2•尾气应如何处理? [回答]从吸收塔排出的气体主要有 N 2、02,少量二氧化硫,若直接排放到空气中, 会造成严重的污染,同时也会造成原料的浪费。
因此应将上述气体再次通入接触室进行二次 氧化,然后进一步吸收。
也可用NH 3吸收SO 2以生产亚硫酸铵,或用碱吸收后,再通过加 酸生产高浓度二氧化硫和硫酸铵。
水溶液中的水发生反应生成硫酸。
f黄铁矿粉碎至细粒「沸腾趴通人强尢空气流3增犬接触面•提高转化林[炉气杂质}{需净化干燥AI 催化剂SO; (g) + 可Q (g)~ - ■ *S()3(g) I AH ——98* 3 kJz接触室齐反应条件:温度uoor-soov 压强;常压结构:上下两层催化剂十八一舁中部热交换器{充分氯化〉^SO3(g) + H2O(l^—HtSO((l){iH=- 130. 3 kJ/mol 98%的哝H,SO,吸收SOgC逆流操作〉安装瓷环<增大接傩面积〉尾气回收利用•综合能力训练题1•在硫酸的工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是A. 硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能燃烧B. 从沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应C. SO2氧化为SO3时需使用催化剂,这样可以提高SO2的转化率D. SO3用98.3%的浓H2SO4吸收,目的是防止形成酸雾,以便使SO3吸收完全2•固体A、B都由两种相同的元素组成,在A、B中两元素的原子个数比分别为 1 : 1和1 : 2,将A、B在高温时煅烧,产物都是C(s)和D(g)。
由D最终可制得E, E是非金属元素显+ 6价的含氧酸,该非金属元素形成的单质通常是一种淡黄色晶体,E的稀溶液和A反应时生成G(g)和F(aq),G通入D的水溶液,有淡黄色沉淀生成。
在F中滴入溴水后,加入KOH溶液有红褐色沉淀生成,加热时又能转变为G。
根据上述事实回答:(1) A的化学式是 __________ , B的化学式是___________ 。
(2) 写出下列反应的化学方程式:①B煅烧生成C和D _________________________________________ -②G通入D溶液中______________________________________________________③向F中滴入溴水 ________________________________________________________1.D2.第一步:根据E是非金属元素显+ 6价含氧酸且该非金属元素形成的单质,通常是一种淡黄色固体,所以E是H2SO4。
第二步:A(或B) 煅烧C+ D, D最终制得E, E + A G f + F,G+ D 淡黄色沉淀。
该淡黄色沉淀必为S,进一步验证E为H2SO4, A和B中均含S元素。
第三步:F B「2 KOH红褐色沉淀C,该红褐色沉淀必为Fe(OH)3,因此C为Fe2O3,F为含Fe2+的溶液,A和B中均含Fe元素。
答案:A为FeS,B为Fed。
高温①4FeS2 + 11O2 高温2Fe2O3 + 8SO2 ② 2H2S + H2SO3===3S J + 3H2O ③ 6FeSO4 + 3Br2===2Fe2(SO4)3+ 2FeBr3乱吸收塔丿第二节关于硫酸工业综合经济效益的讨论•教学目标1•使学生常识性地了解化学科学实验与化工生产的区别。
2•使学生对于如何提高化工生产的综合经济效益有一个常识性的认识。
3•通过课堂讨论培养学生分析问题和解决问题的能力。
一、环境保护与综合利用原料在化工生产中某一生产部门产生的三废,即废气、废液、废渣,往往可能是其他生产部门有用的原料。
[提问]硫酸工业生产中产生哪些废物?这些废物又如何处理呢?[回答]硫酸生产的第三阶段,即三氧化硫的吸收阶段从吸收塔中排出含少量二氧化硫的废气。
黄铁矿矿粉在沸腾炉中燃烧后产生大量废渣。
炉气的净化、干燥过程中产生废液。
1、硫酸生产中尾气的处理比込产点肥)遞回车间或用作他用CatOW E O E-------------- ►- CiS05 ------- ► CiSg 苗育)①氨水吸收,再用硫酸处理SO2 + 2NH3+ H2O===(NH 4)2SO3(NH4)2SO3+ H2SO4===(NH 4)2SO4 + SO2 f + H2O②用Na2SO3溶液吸收,然后加热吸收液SO2 + Na2SO3+ H2O===2NaHSO 32NaHSO3 Na2SO3+ SO2 f+ H2O③用NaOH溶液吸收,再用石灰乳和。
2处理SO2 + 2NaOH===Na 2SO3 + H2ONa2SO3+ Ca(OH)2===CaSO3 J + 2NaOH2CaSO3+ O2===2CaSO 4" _「制水泥的辅科、制宾厂柞劣质谎酸宜悽復用L制刖产區石ifCa(OH)2 + H2SO4===CaSO4+ 2H2O、能量的充分利用1.S (s )+ O 2(g )===SO 2(g ); △ H= - 297 kJ/mol-Fe 2O 3(s ) + 2SO 2(g ); △ H = - 853 kJ/mol 2JiI2. SO E CgO + -^Q =<S^r ^=5D >(S )皿=一勲3 k 」gL3.SO 3(g ) + H 2O (I )===H 2SO 4(l ); △ H= - 130.3 kJ/mol很明显,上述反应均为典型的放热反应, 假如我们能把这些热量充分利用,有什么重要的意义呢?若充分利用“废热”,则不仅不需要由外界向工厂供能, 而且还可以由工厂向外界供能。
三、生产规模和厂址选择现代化工生产一般要求有较大的规模。
因为大型化生产可以降低单位产量投资,便于热能的综合利用和提高劳动生产率,因而总的经济效益较大。
化工厂厂址选择是一个复杂的问题,它涉及原料、水源、能源、土地供应、市场需求、 交通运输和环境保护等诸多因素。
是否接近 原料供应地能源是否 充足卫价廉 •综合能力训练题1•据《中国环境报》报道:从一份科技攻关课题研究结果显示,我国酸雨区已占国土面 积的40%以上。
研究结果还表明,我国农业每年因遭受酸雨而造成的经济损失高达 15亿多元。
为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》 等法规。
(1) 你认为减少酸雨产生的途径可采取的措施是①不用煤作燃料;②把工厂烟囱造高;③燃料脱硫;④在已酸化的土壤中加石灰; ⑤开发新能源。
