陌生化学方程式书写专项练习
10、《陌生情景中化学方程式的书写》-专题练习hw
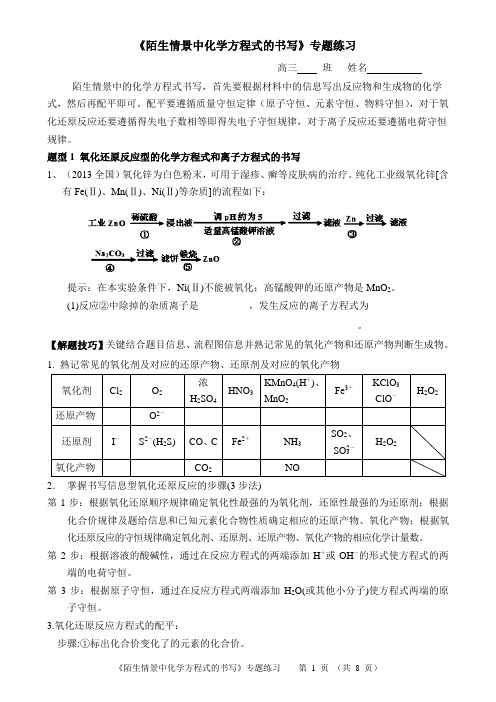
《陌生情景中化学方程式的书写》专题练习高三班姓名陌生情景中的化学方程式书写,首先要根据材料中的信息写出反应物和生成物的化学式,然后再配平即可。
配平要遵循质量守恒定律(原子守恒、元素守恒、物料守恒),对于氧化还原反应还要遵循得失电子数相等即得失电子守恒规律,对于离子反应还要遵循电荷守恒规律。
题型1 氧化还原反应型的化学方程式和离子方程式的书写1、(2013全国)氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。
纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
(1)反应②中除掉的杂质离子是__________,发生反应的离子方程式为_________________________________________________________。
【解题技巧】关键结合题目信息、流程图信息并熟记常见的氧化产物和还原产物判断生成物。
1. 熟记常见的氧化剂及对应的还原产物、还原剂及对应的氧化产物2.掌握书写信息型氧化还原反应的步骤(3步法)第1步:根据氧化还原顺序规律确定氧化性最强的为氧化剂,还原性最强的为还原剂;根据化合价规律及题给信息和已知元素化合物性质确定相应的还原产物、氧化产物;根据氧化还原反应的守恒规律确定氧化剂、还原剂、还原产物、氧化产物的相应化学计量数。
第2步:根据溶液的酸碱性,通过在反应方程式的两端添加H+或OH-的形式使方程式的两端的电荷守恒。
第3步:根据原子守恒,通过在反应方程式两端添加H2O(或其他小分子)使方程式两端的原子守恒。
3.氧化还原反应方程式的配平:步骤:①标出化合价变化了的元素的化合价。
②列变化:分别标出化合价升高数和化合价降低数③根据化合价升降总数相等确定发生氧化还原反应的物质的化学计量数。
④利用元素守恒,观察配平其他物质4. “补缺”的技巧(1)可能出现的情况:H +→H 2O (酸性)、 OH -→H 2O (碱性)、H 2O →H +(中性或酸性)、H 2O →OH -(中性或碱性)(2)绝不可能出现的情况:H +→OH - 或者OH -→H +【对点集训】2、(2013北京)在酸性条件下,将MnO -4氧化Fe 2+的离子方程式补充完整: MnO -4+ Fe 2++ ________=== Mn 2++ Fe 3++ ________。
2020高考化学一轮复习专题2-4 陌生化学方程式的书写(练习)含答案

第二章物质的组成、分类及其变化第四讲陌生化学方程式的书写1、I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。
将ii补充完整。
i.SO2+4I-+4H+S↓+2I2+2H2Oii.I2+2H2O+ + +2 I-答案: SO2;SO42−;4H+2、在酸性条件下,将MnO-4氧化Fe2+的离子方程式补充完整:MnO-4+Fe2++___ __=== Mn2++Fe3++。
答案:5;5;8H+;1;5;4H2O3、完成以下氧化还原反应的离子方程式:( )MnO4-+( )C2O42-+ =( )Mn2++( )CO2↑+_答案:2 ; 5 ;_16H+;2;10 ;_8H2O4、高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。
FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:答案:2Fe(OH)3+3ClO-+4OH- = 2FeO42-+5H2O+3Cl‾5、Na2S2O5可用作食品的抗氧化剂。
在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.01000 mol·L−1的碘标准液滴定至终点,消耗10.00 mL。
滴定反应的离子方程式为答案:;2-25S O+2I2+3H2O 22-4SO+4I-+6H+6、制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为;答案:3Cl2+6OH−=5Cl−+ClO3−+3H2O7、用酸性(NH2)2CO水溶液吸收NO x,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。
写出该反应的化学方程式:。
答案:2HNO 2+(NH2)2CO2N2↑+CO2↑+3H2O8、氧化还原反应是氧化和还原两个过程的对立统一。
现有一个还原过程的反应式如下:NO-3+4H++3e-===NO↑+2H2O(1)下列五种物质中能使上述还原过程发生的是________(填字母)。
A陌生化学方程式书写专项练习

陌生化学方程式书写专项练习1.复分解反应:首先确定反应物没有常见氧化剂,还原剂,然后按照复分解反应特征,相互交换成分,组成新的物质。
2.氧化还原反应:熟记常见的氧化还原反应,常见的氧化剂,还原剂,根据氧化还原反应规律以及各物质的性质,题目所给条件等推测产物。
1.S2Cl2与水反应,有无色刺激性气味气体产生,并有黄色沉淀生成,该反应的化学方程式是。
2.欲降低废水中重金属元素铬的毒性,可将转化为Cr(OH)3沉淀除去。
工业用电解法来处理含废水。
阳极反应式是Fe-2e-=Fe2+,阴极反应式是2 H+ +2e-=H2↑。
Fe2+与酸性溶液中的反应的离子方程式是,得到的金属阳离子在阴极区可沉淀完全。
3.通空气的条件下煅烧铬铁矿(主要成分可表示为FeO·Cr2O3)和NaOH的固体混合物生成Na2CrO4和NaFeO2反应的化学方程式是。
4.石灰乳中通入Cl2 ,得到Ca(ClO3)2与CaCl2物质的量之比为1∶5的溶液,反应的化学方程式是。
5.CaCl2溶液中通入NH3和CO2两种气体后,生成超细CaCO3的化学方程式是。
6.将含Cr2O72﹣的废水调至pH为2~3,再加入Na2S2O3溶液(转化为SO42﹣),该反应发生时,每0.4 mol Cr2O72-转移2.4 mol e-,该反应的离子方程式为。
7.铁屑与石墨能形成微型原电池,SO32—在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32—在酸性条件下放电生成H2S的电极反应式:。
8.氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式。
科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为。
9.已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8 mol电子。
该反应的离子方程式是。
10.SO2气体通入足量BaCl2和硝酸的混合溶液中,生成白色沉淀和无色气体,反应的离子方程式是。
人教版高中化学高考总复习 练6 陌生方程式书写

练6 陌生方程式书写1.(青海西宁三模)亚氯酸钠(NaClO2)是一种高效漂白剂,其有效氯含量相当于漂白粉的7倍。
可用ClO2与过氧化氢为原料制取亚氯酸钠,相关实验装置如图所示。
已知:①2NaClO3+H2O2+H2SO42ClO2↑+O2↑+Na2SO4+2H2O;②2ClO2+2NaOH NaClO2+NaClO3+H2O;③NaClO2饱和溶液在温度低于38 ℃时析出NaClO2·3H2O晶体,高于38 ℃时析出NaClO2晶体,高于60 ℃时NaClO2分解成NaClO3和NaCl。
写出装置C中制备NaClO2固体的化学方程式: 。
2.(江西抚州模拟)钒为一种高熔点金属,在工业生产中有广泛用途。
工业上常用钒炉渣(主要含FeO·V2O3,还有少量Al2O3、CuO等杂质)提取金属钒,流程如图:已知:钒有多种价态,其中+5价的最稳定。
钒在溶液中主要以V O2+和V O3-的形式存在,存在平衡:V O2++H2O2H++V O3-回答下列问题:(1)碱浸步骤中最好选用(填字母)。
a.NaOH溶液b.氨水c.纯碱溶液(2)焙烧目的是将FeO·V2O3转化为可溶的NaVO3,其中铁全部转化为+3价氧化物,则反应化学方程式为。
(3)加热NH4VO3时生成V2O5,则反应化学方程式为,流程中最后用V2O5冶炼V通常采用的方法是(填字母)。
A.炭还原法B.铝热法还原C.直接加热法D.盐的水溶液与活泼金属置换法3.(北京海淀区模拟)金属镓(Ga)是合成半导体材料砷化镓(GaAs)的重要基础材料,一种由砷化镓废料制备镓的工艺流程如图。
已知:ⅰ.Ga(OH)3与Al(OH)3性质相似ⅱ.NO2可以溶于浓HNO3中(1)酸浸溶解:①上述流程中能加快反应速率的措施有。
②将GaAs与浓HNO3反应的化学方程式补充完整。
GaAs+ HNO3(浓)Ga(NO3)3+ H3AsO4+ +2O(2)除杂转化:①上述工艺流程中浓氨水的作用是。
陌生化学方程式书写专项练习

班级_________姓名___________一、请写出下列原子的电子式He______ ; Br ______ ; S ______二、请写出下列离子/基团的电子式H3O+ ______ ; N3-______ ; O2- ______ ;CH3- ______ ; -OH______ ; -COOH______ ;三、请写出下列各物质的电子式H2 _____ _ ; N2 ______ ; F2 ____ _ ;HCl_____ _ ; CS2_____ _ ; NaClO_____ _ ; CaC2_____ _ ; NH4H_____ _ ; 一氯甲烷_____ _ ;四、用电子式表示下列物质中化学键的形成过程(1)MgCl2_____ _ ;(2) CCl4 _____ _ ;要求:写出对应情况的离子方程式并注明条件1、用氨水吸收少量二氧化硫2、实验室制氯气3、工业制氯气4、氯气与水的反应5、钠与水反应6、在标准状况下将2.24 L CO2通入1mol/L 100mL NaOH溶液中7、二氧化碳通入饱和碳酸钠溶液中8、苯酚钠溶液中通入少量二氧化碳9、氯化铁溶液中通入硫化氢气体10、FeBr2溶液与等物质的量Cl2反应11、双氧水在酸性条件下氧化亚铁离子12、AgNO3溶液与锌片反应13、碳酸钙溶液与稀硝酸反应14、少量氢氧化钙溶液与碳酸氢钠溶液混合15、碳酸氢镁溶液中加入过量的澄清石灰水16、碳酸氢铵稀溶液中加入过量稀氢氧化钠溶液陌生化学方程式书写专项练习1.(东I)S2Cl2与水反应,有无色刺激性气味气体产生,并有黄色沉淀生成,该反应的化学方程式是。
2.(东I)欲降低废水中重金属元素铬的毒性,可将转化为Cr(OH)3沉淀除去。
工业用电解法来处理含废水。
阳极反应式是Fe-2e-=Fe2+,阴极反应式是2 H+ +2e-=H2↑。
Fe2+与酸性溶液中的反应的离子方程式是,得到的金属阳离子在阴极区可沉淀完全。
陌生化学方程式的书写专题训练

陌生化学方程式的书写专题训练1.KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2该反应的化学方程式是。
2.在NaOH的环境中,Cl2与NaI反应,每1 mol NaI完全反应转移6 mol 电子,写出反应的化学方程式:。
3.已知CO是工业上常用的还原剂,500℃时,11.2 L(标准状况)SO2在催化剂作用下与CO发生化学反应。
若有2×6.02×1023个电子转移时,写出该反应的化学方程式。
4.铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2中加入,铜屑可以逐渐溶解,该反应的离子方程式:。
5.氧化还原反应中实际上包含氧化和还原两个过程。
下面是一个还原过程的反应式:NO3-+4H++3e→NO+2H2O,KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
写出并配平该氧化还原反应的方程式:6.某同学取FeSO4的溶液,酸化后加入KI、淀粉溶液,变为蓝色。
写出与上述变化过程相关的离子方程式:、。
7.(1)在强碱性环境中Cl2可将Fe(OH)3氧化为K2FeO4,学出该反应的离子方程式:。
(2)在溶液中用次氯酸钠、氢氧化铁和氢氧化钾也可制高铁酸钾,其反应的离子方程式为:。
(3)已知K2FeO4溶液中在酸性溶液中会迅速反应产生Fe2(SO4)3,则离子方程式为。
8.工业上利用KOH和MnO2为原料制取KMnO4。
主要生产过程分两步进行:其中第一步是将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌以制取K2MnO4;该步反应的化学方程式为_______ __________________。
9.污水及自来水处理的方法有很多(1)碱性环境下,Cl2可将水中的CN-转化为两种无毒的气体,写出该反应的离子方程式:。
(2)酸性环境下,向含重铬酸根的废水中加入FeSO4溶液,然后调节溶液的pH,使生成的Cr3+转化为Cr(OH)3,写出第一步对应的离子方程式:。
2018届二轮复习陌生方程式的书写训练专题练习.docx

2018届二轮复习专题之陌生方程式的书写训练__________ 班姓名_____________ 书写陌生(信息型)化学方程式时,应先根据信息确定反应物纪最终产物,再根据化合价升降法来配平,若无法判断最终产物,可先确定中间产物,再用叠加法来确定总化学方程式。
第一部分氧化还原反应类型1、(2013北京)在酸性条件下,将MnOI氧化Fe?+的离子方程式补充完整:| | MnO7 +1 | Fe2 +1 | _____________ =^=| | Mn21 +1 | Fe31 +1 |。
2、(2015浙江)完成以下氧化还原反应的离子方程式:( )MnO4" + ( )C2O42_+ ______ =( )Mn2++( )CO21+ ________3、(2012全国)高铁酸钾(K2F C O4)是一种强氧化剂,可作为水处理剂和高容量电池材料。
FcCb和KC1O在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为: _______________________________ o4、氧化还原反应是氧化和还原两个过程的对立统一。
现有一个还原过程的反应式如下:NO;+4H++3e"=NOT+2H2O(1)下列五种物质中能使上述还原过程发生的是________ (填字母)。
A. KMnO4B. Na2CO3C. Cu2OD. Fe2(SO4)3(2)写出上述反应的化学方程式并配平:_________________________________________ °5、(2013江苏)氧化镁在医药、建筑等行业应用广泛。
硫酸镁还原热解制备高纯氧化镁是一种新的探索。
以菱镁矿(主要成分为MgCO3,含少量FeCO"为原料制备高纯氧化镁的实验流程如下:稀硫酸H2O2 NH3H2O 木炭I V 1 , I菱钱矿f 酸溶I~~T过濾H 氣化卜I调pH *=4 f |过濾〜 T煨烧MgOI I I滤渣1 滤渣2 气体(1)MgCOs与稀硫酸反应的离子方程式为_______ o(2)加入比02氧化时,发生反应的化学方程式为_____________________________________ 。
高中化学:陌生氧化还原反应方程式的书写练习

高中化学:陌生氧化还原反应方程式的书写练习陌生氧化还原反应方程式的书写1.写出下列反应的方程式。
(1)酸性KMnO4溶液将乙醇氧化为乙酸,其反应的离子方程式为_______________。
(2)一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为__________。
(3)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为____。
(4)Co(OH)3与H2SO4、Na2SO3溶液反应生成CoSO4的化学方程式为______。
答案:(1)5C2H5OH+4MnO4-+12H+=5CH3COOH+4Mn2++11H2O(2)2Fe2++BH4-+4OH-=2Fe+2H2↑+B(OH)4-(3)PbO2+4HCl(浓)PbCl2+Cl2↑+2H2O(4)2Co(OH)3+Na2SO3+2H2SO4=2CoSO4+Na2SO4+5H2O 2.(1)写出LiCoO2与草酸(H2C2O4)反应生成CoC2O4沉淀的化学方程式:____________。
(2)实验室以锌灰(含ZnO、PbO、CuO、FeO、Fe2O3、SiO2等)为原料制备Zn3(PO4)2·4H2O的流程如下。
滴加KMnO4溶液后有MnO2生成,该反应的离子方程式为________________________________________________________________________。
(3)三氧化二钴(Co2O3)主要用作颜料、釉料、磁性材料、催化剂和氧化剂等。
以含钴废料(主要成分为Co2O3,含有少量MnO2、NiO、Fe3O4)为原料制备Co2O3的流程如图所示。
已知:Ⅰ.“酸浸”后的浸出液中含的阳离子有H+、Co2+、Fe3+、Ni2+等。
Ⅱ.部分阳离子以氢氧化物形式沉淀时溶液的pH如下表。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
班级_________姓名___________
一、请写出下列原子的电子式
He______ ; Br ______ ; S ______
二、请写出下列离子/基团的电子式
H3O+ ______ ; N3-______ ; O2- ______ ;
CH3- ______ ; -OH______ ; -COOH______ ;
三、请写出下列各物质的电子式
H2 _____ _ ; N2 ______ ; F2 ____ _ ;
HCl_____ _ ; CS2_____ _ ; NaClO_____ _ ; CaC2_____ _ ; NH4H_____ _ ; 一氯甲烷_____ _ ;
四、用电子式表示下列物质中化学键的形成过程
(1)MgCl2_____ _ ;
(2) CCl4 _____ _ ;
要求:写出对应情况的离子方程式并注明条件
1、用氨水吸收少量二氧化硫
2、实验室制氯气
3、工业制氯气
4、氯气与水的反应
5、钠与水反应
6、在标准状况下将2.24 L CO2通入1mol/L 100mL NaOH溶液中
7、二氧化碳通入饱和碳酸钠溶液中
8、苯酚钠溶液中通入少量二氧化碳
9、氯化铁溶液中通入硫化氢气体
10、FeBr2溶液与等物质的量Cl2反应
11、双氧水在酸性条件下氧化亚铁离子
12、AgNO3溶液与锌片反应
13、碳酸钙溶液与稀硝酸反应
14、少量氢氧化钙溶液与碳酸氢钠溶液混合
15、碳酸氢镁溶液中加入过量的澄清石灰水
16、碳酸氢铵稀溶液中加入过量稀氢氧化钠溶液
陌生化学方程式书写专项练习
1.(东I)S2Cl2与水反应,有无色刺激性气味气体产生,并有黄色沉淀生成,该反应的化
学方程式是。
2.(东I)欲降低废水中重金属元素铬的毒性,可将转化为Cr(OH)3沉淀除去。
工业用电解法来处理含废水。
阳极反应式是Fe-2e-=Fe2+,阴极反应式是2 H+ +2e-=H2↑。
Fe2+与酸性溶液中的反应的离子方程式是,得到的金属阳离子在阴极区可沉淀完全。
3.(西I)通空气的条件下煅烧铬铁矿(主要成分可表示为FeO·Cr2O3)和NaOH的固体混合物生成Na2CrO4和NaFeO2反应的化学方程式是。
4.(朝I)石灰乳中通入Cl2 ,得到Ca(ClO3)2与CaCl2物质的量之比为1∶5的溶液,反应的化学方程式是。
5.(朝I)CaCl2溶液中通入NH3和CO2两种气体后,生成超细CaCO3的化学方程式是。
6.(海I)将含Cr2O72﹣的废水调至pH为2~3,再加入Na2S2O3溶液(转化为SO42﹣),该反应发生时,每0.4 mol Cr2O72-转移2.4 mol e-,该反应的离子方程式为。
7.(丰I)铁屑与石墨能形成微型原电池,SO32—在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32—在酸性条件下放电生成H2S的电极反应式:。
8.(石I)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式。
科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为。
9.(东II)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8 mol电子。
该反应的离子方程式是。
10.(西II)SO2气体通入足量BaCl2和硝酸的混合溶液中,生成白色沉淀和无色气体,反应的离子方程式是。
11.(西II)直接加热AlCl3·6H2O不能得到无水AlCl3。
SOCl2为无色液体,极易与水反应生成HCl和一种具有漂白性的气体。
AlCl3·6H2O与SOCl2混合加热制取无水AlCl3,反应的化学方程式是。
12. (朝II)H2O2生产过程要严格避免混入Fe2+和Fe3+,否则会发生如下两个反应,加快H2O2的分解,且Fe2+和Fe3+各自的量保持不变。
① 2Fe2+ + H2O2 + 2H+=2Fe3+ + 2H2O,②(填离子方程式)。
13. (丰II)煤气化后,混合气体由CO、H2和CH4等组成,可用于制燃料电池。
其中碱性条件下CH4参与反应的电极反应式为。
14. (10西)已知:2Fe2+ + Br2=2Fe3+ +2Br-。
若将0.1 mol E通入100 mL FeBr2溶液中,溶液中有三分之一的Br-被氧化成Br2,则此反应离子方程式是,原FeBr2溶液的物质的量浓度为。
15.(10海)K2FeO4为高效绿色净水剂,可通过Fe(OH)3与KOH和Cl2反应制得。
该反应的化学方程式是。
16. (10海)用K2FeO4和Zn作原料的电池是一种新型可充电电池,该电池长时间保持稳
定的放电电压。
其总反应可写成:3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH,则充电时的阳极反应是。
17. (10朝)在饱和氯水中加块状石灰石,能制得较浓HClO溶液,同时放出一种气体。
其反应的离子方程式是。
18. (10海Ⅱ)氧化铝与焦炭的混合物在氮气中高温加热反应,制得新型非金属材料AlN 与一种中学常见气体X。
已知每转移3 mol e-,有1.5 mol化合物X生成,此反应的化学方程式______________________________________。
19. (10朝)Al—空气燃料电池,通常以NaCl溶液或KOH溶液为电解质溶液,通入空气的电极为正极。
①若以NaCl溶液为电解质溶液时,正极的反应式为。
②若以KOH溶液为电解质溶液时,电池的总反应式为。
20.(10武)氯元素最高价氧化物水化物的浓溶液不稳定,受热可分解,产物之一是黄绿色气体,且当有28mol电子转移时,共产生9mol气体,写出该反应的化学方程式。
21. 废水处理方法之一是用Cl2将废水中的CN-氧化成CO2和N2,若参加反应的Cl2与CN-的物质的量之比为5︰2,则该反应的离子方程式是。
答案:
1. 2S 2Cl 2+ 2H 2O=3S↓+SO 2↑+4HCl ↑
2. +6Fe 2++14H +=2Cr 3++6Fe 3++7H 2O
3. 4FeO·Cr 2O 3 + 7O 2 + 20NaOH 8Na 2CrO 4 + 4NaFeO 2+ 10H 2O
4. 6Cl 2+6Ca(OH)2 == 5CaCl 2+Ca(ClO 3)2 + 6H 2O
5. CaCl 2 + 2NH 3 + CO 2 + H 2O == CaCO 3↓+ 2NH 4Cl
6. 3S 2O 32- + 4Cr 2O 72- +26H + === 6SO 42- + 8Cr 3+ + 13H 2O
7. SO 32—+ 8H + + 6e —
= H 2S ↑+ 3H 2O 8. NH 3+3O 2N 2+6H 2O ;负极; 2NH 3 — 6e - + 6OH - = N 2 +6H 2O
9. S 2O 32- + 4Cl 2 + 5H 2O = 2SO 42- + 8Cl - + 10H +
10. 3Ba 2++3SO 2 +2NO 3-
+2H 2O = 3BaSO 4↓+2NO↑+4H + 11. AlCl 3·6H 2O+6SOCl 2 AlCl 3+12HCl↑+6SO 2↑
12. 2Fe 3++ H 2O 2=O 2↑+ 2Fe 2++ 2H +
13. CH 4 + 10OH — + 8e —= CO 32—
+ 7H 2O 14. 6Fe 2+ + 4Br -+5Cl 2=6Fe 3+ + 2Br 2+10Cl -
1.2 mol/L 15. 10KOH + 3Cl 2 + 2Fe(OH)3 == 2K 2FeO 4 + 6KCl + 8H 2O
16. Fe(OH)3-3e -+5OH -=FeO 42-
+4H 2O 17. 2Cl 2 + H 2O + CaCO 3 == Ca 2+ +2Cl - + 2HClO + CO 2↑
18. Al 2O 3+N 2+3C 高温 2AlN +3CO
19. O 2+2H 2O+4e -=4OH - 4Al+3O 2+4KOH=4KAlO 2+2H 2O
20. 4HClO 4
2Cl 2↑+7O 2↑+2H 2O 21. 5Cl 2 + 2CN - + 4H 2O== 10Cl - + 2CO 2+ N 2+ 8H + △ 煅烧。
