第九章 化学动力学基本原理——练习题
第九章-化学动力学基本原理第1期

§9.3 简单级数反应的动力学规律凡是反应速率只与反应物浓度有关,而且反应级数,无论是、、…或n都只是零或正整数的反应,统称为“简单级数反应”。
简单反应都是简单级数反应,但简单级数反应不一定就是简单反应,前已述及的HI气相合成反应就是一例。
具有相同级数的简单级数反应的速率遵循某些简单规律,本节将分析这类反应速率公式的微分形式、积分形式及其特征。
(1)一级反应反应速率与反应物浓度的一次方成正比的反应称为一级反应。
其速率公式可表示为(9.7)式中c为t时刻的反应物浓度。
将上式改写成的形式,积分可得(9.8)B为积分常数,其值可由t = 0时反应物起始浓度c0确定:B = ln c0。
故一级反应速率公式积分形式可表示为(9.9)或(9.10)或(9.11)使用这些公式可求算速率常数k1的数值,只要知道了k1和c0的值,即可求算任意t时刻反应物的浓度。
从(9.8)式可看出,以lnc对t作图应得一直线,其斜率即为k1。
如图9.2所示。
反应物浓度由c0消耗到c=c0/2所需的反应时间,称为反应的半衰期,以t1/2表示。
由(9.9)式可知,一级反应的t1/2表示式为(9.12)可以看出,一级反应的半衰期与反应物起始浓度c0无关。
许多分子的重排反应和热分解反应属一级反应。
还有些反应例如蔗糖水解实际上是二级反应,但由于水溶液中反应物之一H2O大大过量,其浓度在整个反应过程中可视为常数,故表观上表现为一级反应,这类反应称为“准一级反应”。
例题1 30℃时N2O5在CCl4中的分解反应为一级反应,由于N2O4和NO2均溶于CCl4中,只有O2能逸出,用量气管测定不同时刻逸出O2的体积有下列数据:t / s 0 2400 4800 7200 9600 12000 14400 16800 19200V(O2) / cm3 0 15.65 27.65 37.70 45.85 52.67 58.30 63.00 66.8584.85求算此反应的速率常数k1和半衰期t1/2。
物理化学及考试习题 试卷 答案第四次习题课(第九章化学动力学基础)ppt课件

r 2= r 3= r 4=
1 d [ A ] d [ B ]1 d [ P ] 2 k [ A ] [ B ] 2 dt dt 2 dt
d [ A ] 1 d [ B ]d [ P ]1 d [ S ] 2 k [ A ][ B ] dt2 dt dt 2 dt
5.某二级反应2A→P,设cA,0=0.005mol· dm-3,500℃和 510℃时,经300秒后分别有27.6%和35.8%的反应物分解。 计算(1)两个不同温度时的速率常数;(2)反应的活 化能。
解:(1)二级反应的动力学方程为 kt= (1/c-1/c0) 代入题给数据后得:k1=0.2541dm3· mol-1· s-1 k2=0.3718dm3· mol-1· s-1 (2)根据阿伦尼乌斯方程有 ln(k2/k1)=E/R(1/T1-1/T2) 代入题给值,得E=191.34kJ· mol-1
1 1 k ln t 1 x
代入题给数据得:k2=3.84×10-3 s-1 根据阿伦尼乌斯方程的定积分式有
E 1 k 1 ln 2 a ( ) k R T T 1 1 2
解出T2= 409.2 K
Байду номын сангаас
3.某反应物反应掉8/9时所需要的时间是反应掉 2/3时所需要时间的二倍,该反应级数是多少? 答:一级反应的动力学方程为
3、C14放射性蜕变的半衰期为5730年,今在一考古学样 品中测得C14的含量只有72%,请问该样品距今有多少年? 解:同位素的放射性蜕变是一级反应,其 动力学方程为
1 kt ln 1 x k=(ln2)/t1/2=0.6931/5730=1.209 ×10-4年-1
代入题给数据有
t=1/kln(c0/c)=(1/k)ln[1/(1-x)] =(1/1.209×10-4)ln1/(1-0.72)=2.72×103年
周物理化学第9章化学动力学基本原理

如:
r kcA cB cC
(r : mol dm3 s1、c : mol dm3 )
mol dm3 s1 k (mol dm3 )n (n )
k的单位为: (mol dm3 )1n s1
则:一级反应,n=1,k的单位为s1;
将实验数据按上述不同形式作图,若其中一种图形呈直 线,则该图代表的级数即为反应的级数。
3、半衰期法 不同级数的反应,其半衰期与级数的关系为:
t1/2 k a1n (n表示反应的级数)
lnt1/2 lnk 1 nlna
※ 采用不同的起始浓度a,测出对应的t1/2,以lnt1/2 ln a 作图,可得一直线,根据斜率求出反应级数n
反应的半衰期,用t1/2表示。
※对于一级反应而言,其半衰期为:t1/ 2
ln2 k1
※一级反应的特征: 1、 ln c t 呈线性关系,斜率为k1 ,截距为 ln c0 ; 2、半衰期与起始浓度无关 ; 3、反应速率常数的单位是 s1 。
※一级反应实例:分子重排反应、热分解反应、放射性 同位素衰变反应等;
J
1
dnB
dt
B
B dt
式中: B 组分B的化学计量系数; 反应物 B 0,产物 B 0。
※对于任意反应:aA bB gG hH J 1 dnA 1 dnB 1 dnG 1 dnH a dt b dt g dt h dt
※按反应进度来定义的反应速率与物质的选择无关。 ※对于定容反应,单位体积的反应速率为:
二级反应,n=2,k的单位为mol 1 dm3 s1。 ?…
§9.3 简单级数反应的动力学规律
物理化学答案——第九章-化学动力学基础
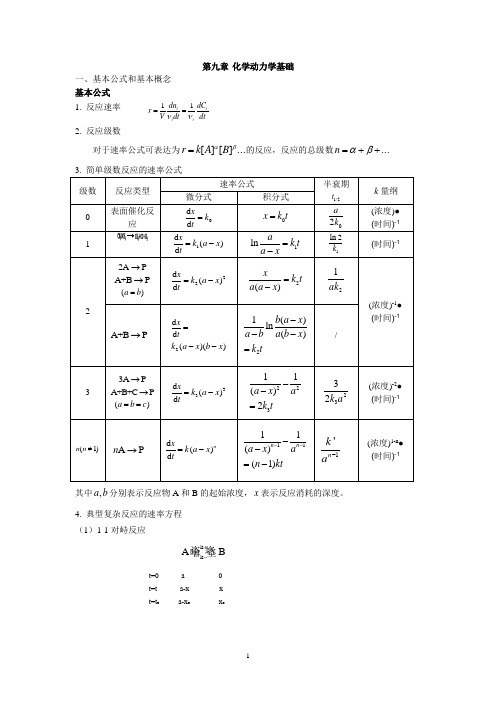
第九章 化学动力学基础一、基本公式和基本概念 基本公式 1. 反应速率 11i ii i dn dC r V dtdtνν==2. 反应级数对于速率公式可表达为...][][βαB A k r =的反应,反应的总级数...++=βαn 3. 简单级数反应的速率公式 级数 反应类型 速率公式半衰期 1/2tk 量纲微分式积分式0 表面催化反应0d d x k t =0x k t = 02a k (浓度)● (时间)-1 11d ()d x k a x t=-1lna k t a x=-1ln 2k(时间)-122A P→A +B P →()a b =22d ()d x k a x t=-2()x k t a a x =-21ak(浓度)-1●(时间)-1A +B P →2d d ()()xtk a x b x =--21()ln()b a x a b a b x k t---=/33A P→A +B +C P→()a b c ==33d ()d x k a x t=-22311()2a x a k t --=2332k a(浓度)-2● (时间)-1(1)n n ≠A P n →d ()d nx k a x t=-1111()(1)n n a x an kt----=-1'n k a-(浓度)1-n ● (时间)-1其中,a b 分别表示反应物A 和B 的起始浓度,x 表示反应消耗的深度。
4. 典型复杂反应的速率方程 (1)1-1对峙反应k k A B +-t=0 a 0 t=t a-x x t=t e a-x e x e速率方程: ()kk te e x x x e +--+-=(2)平行反应最简单的平行反应是由两个一级基元反应组成的平行反应:x=x 1+x 2速率方程:tk k aex a )(21+-=-产物B 和C 的浓度比由竞争反应的速率决定:2121k k x x = (3)连续反应最简单的连续反应是两个单向连续的一级反应:C B A kk −→−−→−21t=0 a 0 0 t=t x y z 速率方程:1k tx ae-=)(21121tk tk eek k a k y ----=]1[21121122tk tk ek k k ek k k a z ---+--=中间产物B 的浓度在反应过程中出现极大值:122)(21k k k m k k a y -=,出现极大值的时间为:2121)ln(k k k k tm-=5. 温度对反应速率的影响 (1)阿累尼乌斯经验公式2ln RTE dTk d a =阿累尼乌斯公式的指数函数式: RTE a Aek -=k 1k 2A a-xCx 2 B x 1(2)阿累尼乌斯活化能基元反应的活化能是活化分子的平均能量与所有分子平均能量之差。
化学动力学——精选推荐

第九章 化学动力学基础1、放射性Na 的半衰期是54000s ,注射到一动物体中,文放射能力降到原来的1/10需多长时间?解:k =ln2/2/1t =ln2/54000=1.2836×10-5t 5102836.110/11ln −×= ;t =179385(s )2、有一级反应,速率系数等于2.06×10-3min -1,求25分钟后有多少原始物质分解?分解95%需多少时间? 解:251006.2-11ln 3××=−x;x =5% t ××=−31006.20.95-11ln ;t =1454(min )3、在760℃时加热分解N 2O 5,当起始压力p 0为38.663kPa 时,半衰期2/1t =255s ,p 0=46.663kPa 时,2/1t =212s ,求反应级数及p 0=101.325kPa 时的2/1t 。
解:易知2/1t 与p 0成反比,二级反应。
2/1t =38.663×255/101.325=97.5(s )4、环氧乙烷的热分解是一级反应:C 2H 4O=CH 4+CO ,377℃时,半衰期为363min 。
求:(1)在377℃,C 2H 4O 分解掉99%需要多少时间?(2)若原来C 2H 4O 为1mol ,377℃经10h ,应生成CH 4多少摩尔?(3)若此反应在417℃时半衰期为26.3min ,求反应的活化能?解:(1)k =ln2/2/1t =ln2/363=1.91×10-3(min -1)t ××=−31091.10.99-11ln;t =2411(min ) (2)60101091.1-11ln 3×××=−x ;x =0.682(mol ) (3)k =ln2/2/1t =ln2/26.3=26.36×10-3 (min -1))69016501(314.81091.11036.26ln a 33−=××−−E ;解得:E a =244681(J ·mol -1)5、1molA 和1molB 混合。
第九章 化学动力学基本原理——练习题
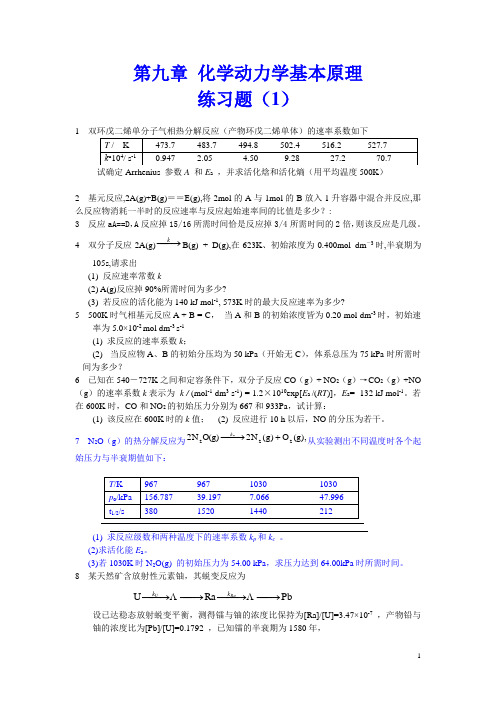
第九章 化学动力学基本原理练习题(1)1试确定Arrhenius 参数A 和E a ,并求活化焓和活化熵(用平均温度500K )2 基元反应,2A(g)+B(g)==E(g),将2mol 的A 与1mol 的B 放入1升容器中混合并反应,那么反应物消耗一半时的反应速率与反应起始速率间的比值是多少?:3 反应aA==D ,A 反应掉15/16所需时间恰是反应掉3/4所需时间的2倍,则该反应是几级。
4 双分子反应2A(g)−→−kB(g) + D(g),在623K 、初始浓度为0.400mol dm -3时,半衰期为105s,请求出(1) 反应速率常数k(2) A(g)反应掉90%所需时间为多少?(3) 若反应的活化能为140 kJ mol -1, 573K 时的最大反应速率为多少?5 500K 时气相基元反应A + B = C , 当A 和B 的初始浓度皆为0.20 mol dm -3时,初始速率为5.0×10-2 mol dm -3 s -1 (1) 求反应的速率系数k ;(2) 当反应物A 、B 的初始分压均为50 kPa (开始无C ),体系总压为75 kPa 时所需时间为多少?6 已知在540―727K 之间和定容条件下,双分子反应CO (g )+ NO 2(g )→CO 2(g )+NO (g )的速率系数k 表示为 k / (mol -1 dm 3 s -1) = 1.2×1010exp[E a /(RT )],E a = -132 kJ mol -1。
若在600K 时,CO 和NO 2的初始压力分别为667和933Pa ,试计算:(1) 该反应在600K 时的k 值; (2) 反应进行10 h 以后,NO 的分压为若干。
7 N 2O (g )的热分解反应为,(g)O )g (N 2O(g)N 22222+−→−k 从实验测出不同温度时各个起始压力与半衰期值如下:(1) 求反应级数和两种温度下的速率系数k p 和k c 。
第9章 化学动力学基本原理习题解答

第九章 化学动力学基本原理知识点归纳1. 反应速率对于任一化学反应BB0B ν=∑,反应速率为:[]B 1d 1d B d d r V t tξν== 2. 质量作用定律对于基元反应A B P a b +→,反应速率为:[][]A B a br k =反应级数与反应分子数的区别:总包反应只有反应级数,其反应级数有实验确定或由反应机理推得;基元反应反应级数等于反应分子数。
4. 阿伦尼乌斯经验式a exp E k A RT ⎛⎫=- ⎪⎝⎭或a 2d ln d E kT RT=5. 碰撞理论碰撞理论借助于气体分子运动论,把气相中的双分子反应看着是两个分子之间碰撞的结果。
我们学习的是简单碰撞理论,以硬球碰撞为模型,导出宏观反应速率常数的计算公式,故又称为硬球碰撞理论。
6. 双分子碰撞频率假定分子A 和B 都是硬球,所谓硬球碰撞是指两个想象中的硬球相互碰撞的结果。
设单位体积中A 、B 分子数分别为A N V 、B NV,A 、B 分子的直径分别为A d 和B d ,当分子碰撞时,分子中心的最小距离为A BAB 2d d d +=,并令A B A B M M M M μ=+,μ为摩尔折合质量,A M 、B M 分别为A 、B 的摩尔质量。
再把单位体积中的分子数换算为物质的量的浓度,即[]A 1A N V L =⨯,[]B 1B N V L=⨯,在单位时间单位体积内A 、B 分子碰撞的总数(即碰撞频率)为:][]2AB AB A B Z d L π=若体系中只有一种分子,则相同分子的碰撞频率为:]22AA AA 2A Z d L π=7. 有效碰撞分数cexp Eq RT ⎛⎫=- ⎪⎝⎭8. 简单碰撞理论计算双分子反应速率常数()2c sct AB E k Td RT π⎛⎫=- ⎪⎝⎭9. 实验活化能根据实验活化能的定义:()2a d ln d k T E RT T=将反应速率常数代入得:2c 2a c 2121E E RT T R E RT T ⎛⎫=+⎪⎝=+⎭ 10. 过渡态理论计算速率常数化学反应要经过一个由反应物分子以一定的构型存在的过渡态,反应物与过渡态之间存在化学平衡,总反应的速率由过渡态转化为产物的速率决定。
物化练习

第九章化学动力学基本原理一、填空题1、设物质A 可发生两个平行的一级反应:(a )C B A Ea ka +−−→−,(b )E D A Ebkb +−−→−, 式中,B 和C 是需要的产品,D 和E 为副产物。
设两反应的频率因子相等且与温度无关,E a >E b ,则反应(a)和反应(b)相比,速率较大的反应是 ,升高温度对 更有利。
2、硝酸异丙烷在水溶液中被碱中和,其反应速率常数可表示为lgk=11.899-3163/T ,该反应的表观活化能为 。
3、今将某物质A 放入一反应器内,反应了3600s ,消耗掉75%,设反应分别为一级,二级,零级反应。
则反应进行了7200s 时,对于各级反应,A 物质的剩余量分别为 、 和 。
4、某化合物的分解反应是一级反应,设反应的活化能E=14.43×104J ·mol -1,已知557K 时该反应的速率常数k=3.3×10-2s -1,现要控制反应在10min 内转化率达到90%,则应控制该反应的温度为 。
5、比较两相同类型的反应I 和II ,发现活化能E I >E II ,速率常数k I >k II ,其原因在于 。
6、在T ,V 恒定时,反应A(g)+B(g)→D(g)t=0时,P A,0=800kPa ,t 1=30s 时,P A,1=400kPa ,t 2=60s 时P A,2=200kPa ,t 3=90s 时,P A,3=100kPa 时此反应的半衰期t 1/2= ,反应级数n= ,反应的速率常数k= 。
.7、阿累尼乌斯活化能是 。
.8、气相有效分子碰撞理论的基本观点是 。
.9、根据活化络合物理论,液相分子重排反应的活化能E a 和活化焓△r H m 之间的关系是 。
.10、由经验规则“温度每增加10K ,反应速率增加二倍”可知,在T 1=298K 时和T 2=308K 时符合这规律的活化能值E a = 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第九章 化学动力学基本原理练习题(1)1试确定Arrhenius 参数A 和E a ,并求活化焓和活化熵(用平均温度500K )2 基元反应,2A(g)+B(g)==E(g),将2mol 的A 与1mol 的B 放入1升容器中混合并反应,那么反应物消耗一半时的反应速率与反应起始速率间的比值是多少?:3 反应aA==D ,A 反应掉15/16所需时间恰是反应掉3/4所需时间的2倍,则该反应是几级。
4 双分子反应2A(g)−→−kB(g) + D(g),在623K 、初始浓度为0.400mol dm -3时,半衰期为105s,请求出(1) 反应速率常数k(2) A(g)反应掉90%所需时间为多少?(3) 若反应的活化能为140 kJ mol -1, 573K 时的最大反应速率为多少?5 500K 时气相基元反应A + B = C , 当A 和B 的初始浓度皆为0.20 mol dm -3时,初始速率为5.0×10-2 mol dm -3 s -1 (1) 求反应的速率系数k ;(2) 当反应物A 、B 的初始分压均为50 kPa (开始无C ),体系总压为75 kPa 时所需时间为多少?6 已知在540―727K 之间和定容条件下,双分子反应CO (g )+ NO 2(g )→CO 2(g )+NO (g )的速率系数k 表示为 k / (mol -1 dm 3 s -1) = 1.2×1010exp[E a /(RT )],E a = -132 kJ mol -1。
若在600K 时,CO 和NO 2的初始压力分别为667和933Pa ,试计算:(1) 该反应在600K 时的k 值; (2) 反应进行10 h 以后,NO 的分压为若干。
7 N 2O (g )的热分解反应为,(g)O )g (N 2O(g)N 22222+−→−k 从实验测出不同温度时各个起始压力与半衰期值如下:(1) 求反应级数和两种温度下的速率系数k p 和k c 。
(2)求活化能E a 。
(3)若1030K 时N 2O(g) 的初始压力为54.00 kPa ,求压力达到64.00kPa 时所需时间。
8 某天然矿含放射性元素铀,其蜕变反应为Pb Ra U −→−−→−−→−−→−R a U kk 设已达稳态放射蜕变平衡,测得镭与铀的浓度比保持为[Ra]/[U]=3.47×10-7 ,产物铅与铀的浓度比为[Pb]/[U]=0.1792 ,已知镭的半衰期为1580年,(1)求铀的半衰期(2)估计此矿的地质年龄(计算时可作适当近似)。
.9 硝基异丙烷在水溶液中与碱的中和反应是二级反应,其速率系数可用下式表示89.113163)1m in 3dm 1-m ol lg(+-=-T k(1)计算反应的活化能(2)在283K 时,若硝基异丙烷与碱的浓度均为8.0 ×10-3mol.dm -3 ,求反应的半衰期。
10 某溶液含有NaOH 和CH 3COOC 2H 5 ,浓度均为1.00×10-2mol.dm -3 , 298 K 时反应经过10min 有39%的CH 3COOC 2H 5分解,而在308 K 时,10分钟有55%分解,计算: (1)该反应的活化能。
(2)288K 时,10分钟能分解多少?(3)293K 时,若有50%的CH 3COOC 2H 5分解需时多少?11 两个二级反应1和2具有完全相同的频率因子,反应1的活化能比反应2的活化能高出10.46kJmol -1;在 373K 时,若反应1的反应物初始浓度为0.1moldm -3,经过60min 后反应1已完成了30%,试问在同样温度下反应2的反应物初始浓度为0.05moldm -3时, 要使反应2完成70%需要多长时间(单位min)?12 氧化乙烯的热分解是单分子反应,在651K 时,分解50%所需时间为363min,活化能E a =217.6 kJmol -1试问如要在120min 内分解75%,温度应控制在多少K?13 请计算在298K 恒容下,温度每增加10K E a = kJmol -1(1) 碰撞频率增加的百分数;(2) 有效碰撞分数增加的百分数,由此可得出什么结论?(E a =56.0 kJmol -1)14 800K 时单分子反应的速率系数的高压极值为5×10-4s -1 ,在相同温度下一级速率系数在4Pa 压力下降为此值的一半,计算分子活化步骤的速率系数(以浓度单位表示)15 实验测得丁二烯气相二聚反应的速率系数为 k = 9.2×109exp(-T12058)dm 3mol -1.s -1(1)已知此反应Om r S ≠∆(Op )= -60.79J.K -1mol -1 ,试用过渡态理论求算此反应在600K 时的指前因子A ,并与实验值比较。
(2)已知丁二烯的碰撞直径d = 0.5nm ,试用碰撞理论求算此反应在600K 时的A 值。
解释二者计算的结果。
简要答案:1 解:由log k 对1/T 作图,直线的斜率为 –8.69×103 K, 截距为14.28 .求出 A =1.9×1014s -1 , E a =166 kJ.mol -1 ,m r H ≠∆= E a -RT =162 kJ.mol -1 , m r S ≠∆=R ln{A/ (e kT/h )}= 15.8J.K -1.mol -1 2 解:[A]:[B]= 2:1 , 反应物消耗一半时 [A]=0.5[A]0 ,[B]= 0.5[B]0 , r = k [A]2 [B] r : r 0= 1 : 83 解:r = k[A]n , n=1时t = ln ([A]0/[A])/k , t(15/16) : t(3/4) = ln16/ ln4 = 24 解:(1) r = k[A]2 , t0.5= 1/(2 k[A]0) , k = 0.012dm3mol-1s-1(2) 1/[A]– 1/[A]0 =2 k t, t = 945 s(3) ln(k/k’)=(E a/R)(1/T ’-1/T) , 573K时k = 0.00223dm3mol-1s-1,最大反应速率r max = k[A]02=3.6×10-4 moldm-3s-1.5 解:(1) r0 = k[A]0 [B]0 , k =1.25 dm3 mol-1 s-1(2) p0(A) = p0(B) , r = k p p (A) 2 , p =2 p0(A) - p (A) , p (A)= p0(A)/ 2 ,k p = k/(RT) ,t1/2 =1/[ k p p0(A)] = 66 s6 解:(1) T =600K时的k=0.0386 dm3mol-1s-1值(2) k p = k/(RT) =7.75×10-9 Pa s-1 , NO的分压为p ;ln{[ p0,B (p0,A- p)]/[ p0,A (p0,B- p)]}/( p0,A- p0,B)= kt ; p=142Pa7 解:(1)通过比较起始压力和半衰期的关系可得,此反应为二级反应。
r = k p p2 , t1/2 =1/( k p p0) , k p = k c / (RT);967K时; k p =1.68×10-5kPa-1s-1 , k c=0.135dm3mol-1s-11030K时; k p = 9.83×10-5 kPa-1s-1, k c=0.84 dm3mol-1s-1(2)活化能E a=243.6kJmol-1(3) p0=,54.00 kPa1/p - 1/p0 = k p t ; t =128s8 解:(1)稳态d[Ra]/d t= k U[U]-k Ra[Ra]=0, k U/ k Ra=[Ra]/[U]=3.47×10-7 , 镭的半衰期t0.5=ln2/ k Ra 铀的半衰期t0.5=ln2/ k U=4.55×109年(2) [U]0-[U] =[Pb],ln{[U]/ [U]0}=- k U t , t=1.08 ×109年9 解:(1)E a/(2.303R)=3163K, E a=60.56 kJ.mol-1 ,*(2)k=5.17 mol-1.dm3 min-1 , t0.5=1/( kc0)= 24 min10 解:(1)1/[A]-1/[A]0= k t , k(298 K)= 6.39 mol-1.dm3 min-1 ,k(308 K)=12.22 mol-1.dm3 min-1E a=R ln(k1/k2)(1/T2-1/T1)= 49.4kJ.mol-1(2)288K时,k=3.2 mol-1.dm3 min-1, t =10 min{[A]0-[A]}/ [A]0=24.2% (3)293K时, k=4.55 mol-1.dm3 min-1, t0.5=1/( k[A]0)= 22min11 解: 1/[A]-1/[A]0= k t , 反应1: k1= 7.14×10-2 mol-1.dm3 min-1 ,ln(k1/k2) = -10.46×103/ (RT) ,k2=2.08 mol-1.dm3 min-1 .反应2: t=22.4min12 解:651K时: k1=ln2/ t0.5=0.00191min-1 . 温度T: t0.5= 60min , k2=0.01155 min-1, T=682K13 解:(1) Z2/Z1=(T2/T1)0.5=1.017 , 增加的百分数1. 7%(2) q2/q1=exp[-E a(1/T2-1/T1)/R] =2.08 , 增加的百分数108%14 解:k app= k2 k+1[M]/( k2+ k-1 [M]) , 高压极值k2 k+1/ k-1=5×10-4s-1 , [M]= 4Pa , k app= k+1[M]=2.5×10-4s-1 , k+1=1.25×10-4Pa-1s-1, k+1=8.31×102mol-1.dm-3.s-115 解:(1)A=0.5(kT/h)( 1/O c)exp(OmrS≠∆/R)e2=3.08×1010dm3mol-1s-1(2) A=2Lπd2[RT/(πM r)]0.5e0.5=2.67×108 m3mol-1s-1第九章化学动力学基本原理练习题(2)一、选择题1. 反应 A + BC →AB + C 的焓变∆r H m> 0,A ,C 是自由基,εAB ,εBC是分子AB,BC 的摩尔键焓。
