第九章 化学动力学基本原理
周物理化学第9章化学动力学基本原理

如:
r kcA cB cC
(r : mol dm3 s1、c : mol dm3 )
mol dm3 s1 k (mol dm3 )n (n )
k的单位为: (mol dm3 )1n s1
则:一级反应,n=1,k的单位为s1;
将实验数据按上述不同形式作图,若其中一种图形呈直 线,则该图代表的级数即为反应的级数。
3、半衰期法 不同级数的反应,其半衰期与级数的关系为:
t1/2 k a1n (n表示反应的级数)
lnt1/2 lnk 1 nlna
※ 采用不同的起始浓度a,测出对应的t1/2,以lnt1/2 ln a 作图,可得一直线,根据斜率求出反应级数n
反应的半衰期,用t1/2表示。
※对于一级反应而言,其半衰期为:t1/ 2
ln2 k1
※一级反应的特征: 1、 ln c t 呈线性关系,斜率为k1 ,截距为 ln c0 ; 2、半衰期与起始浓度无关 ; 3、反应速率常数的单位是 s1 。
※一级反应实例:分子重排反应、热分解反应、放射性 同位素衰变反应等;
J
1
dnB
dt
B
B dt
式中: B 组分B的化学计量系数; 反应物 B 0,产物 B 0。
※对于任意反应:aA bB gG hH J 1 dnA 1 dnB 1 dnG 1 dnH a dt b dt g dt h dt
※按反应进度来定义的反应速率与物质的选择无关。 ※对于定容反应,单位体积的反应速率为:
二级反应,n=2,k的单位为mol 1 dm3 s1。 ?…
§9.3 简单级数反应的动力学规律
物理化学第9章 化学动力学基础

速率方程必须由实验来确定
四、反应级数 若反应的速率方程可以表示为浓度的幂乘积形式:
r = k[A][B]…
则各浓度项的方次、、…分别称为组分A、B …的
例 1、P165例题
某金属钚的同位素进行β放射,14 d 后,同位
素活性下降了6.85%。试求该同位素的:
(1) 蜕变常数,(2) 半衰期,(3) 分解掉90%所需时间
解:
(1)
k1
=
1 t
ln
a
a
x
=
1 14d
ln
100 100 6.85
=
0.00507d-1
(2) t1/2 = ln 2 / k1 = 136.7d (3) t = 1 ln 1 = 1 ln 1 = 454.2d
例如:
例如,恒容反应器中,氯代甲酸三氯甲酯分解为光气
ClCOOCCl(g) 2COCl2(g)
t = 0 p0
0
t = t p酯
p光气=2( p0 – p酯)
p总 = p酯 + p光气 = 2 p0 –p酯
∴ p酯 = 2p0 – p总
或 p光气 = 2(p总– p0)
三、反应速率 r 的经验表达式
2、适用范围
ln k = Ea B RT
k = AeEa / RT
3、A意义:称指前因子
二、活化能的概念 1、对简单反应:
那些能量高到能发生反应的分子称为“活化分子” 活化能:活化分子的平均能量与反应物分子平 均能量之差值。
物理化学答案——第九章-化学动力学基础
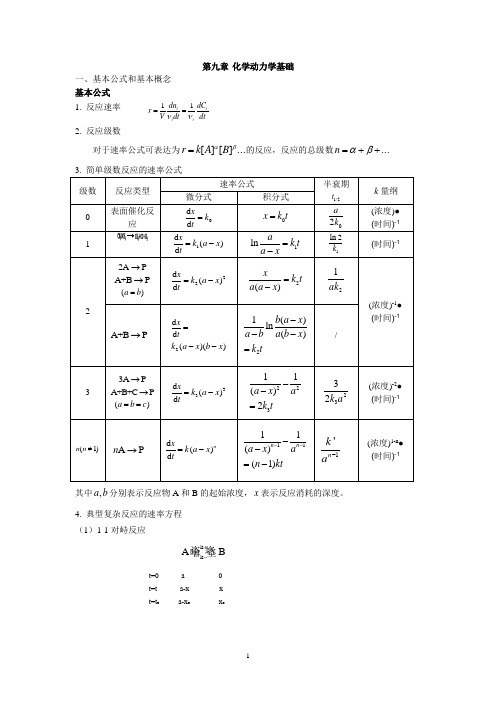
第九章 化学动力学基础一、基本公式和基本概念 基本公式 1. 反应速率 11i ii i dn dC r V dtdtνν==2. 反应级数对于速率公式可表达为...][][βαB A k r =的反应,反应的总级数...++=βαn 3. 简单级数反应的速率公式 级数 反应类型 速率公式半衰期 1/2tk 量纲微分式积分式0 表面催化反应0d d x k t =0x k t = 02a k (浓度)● (时间)-1 11d ()d x k a x t=-1lna k t a x=-1ln 2k(时间)-122A P→A +B P →()a b =22d ()d x k a x t=-2()x k t a a x =-21ak(浓度)-1●(时间)-1A +B P →2d d ()()xtk a x b x =--21()ln()b a x a b a b x k t---=/33A P→A +B +C P→()a b c ==33d ()d x k a x t=-22311()2a x a k t --=2332k a(浓度)-2● (时间)-1(1)n n ≠A P n →d ()d nx k a x t=-1111()(1)n n a x an kt----=-1'n k a-(浓度)1-n ● (时间)-1其中,a b 分别表示反应物A 和B 的起始浓度,x 表示反应消耗的深度。
4. 典型复杂反应的速率方程 (1)1-1对峙反应k k A B +-t=0 a 0 t=t a-x x t=t e a-x e x e速率方程: ()kk te e x x x e +--+-=(2)平行反应最简单的平行反应是由两个一级基元反应组成的平行反应:x=x 1+x 2速率方程:tk k aex a )(21+-=-产物B 和C 的浓度比由竞争反应的速率决定:2121k k x x = (3)连续反应最简单的连续反应是两个单向连续的一级反应:C B A kk −→−−→−21t=0 a 0 0 t=t x y z 速率方程:1k tx ae-=)(21121tk tk eek k a k y ----=]1[21121122tk tk ek k k ek k k a z ---+--=中间产物B 的浓度在反应过程中出现极大值:122)(21k k k m k k a y -=,出现极大值的时间为:2121)ln(k k k k tm-=5. 温度对反应速率的影响 (1)阿累尼乌斯经验公式2ln RTE dTk d a =阿累尼乌斯公式的指数函数式: RTE a Aek -=k 1k 2A a-xCx 2 B x 1(2)阿累尼乌斯活化能基元反应的活化能是活化分子的平均能量与所有分子平均能量之差。
化学动力学基本原理全解

B
B dt
B
B dt
对于任意化学反应
aA bB gG hH
1 d A 1 d B 1 d G 1 d H r a dt b dt g dt h dt
例如,对于气相反应: N O (g) N O (g) 1 O (g) 2 5 2 4 2
•方程
1. 反应速率的表示法
反应进度
设反应为:
R P
t 0 nR (0)
nP (0)
t t
nR (t )
np (t )
nR (t ) nR (0) np (t ) nP (0)
d dnB
§9.2 反应速率和速率方程
2. 反应速率的实验测定 动力学曲线就是反应中各物质浓度随时间的 变化曲线。有了动力学曲线才能在t时刻作切线, 求出瞬时速率。测定不同时刻各物质浓度的方法 有: (1)化学方法
不同时刻取出一定量反应物,设法用骤冷、 冲稀、加阻化剂、除去催化剂等方法使反应立即 停止,然后进行化学分析。
物理化学电子教案—第九章
化学动力学基本原理
§9.1 引言
化学热力学的研究对象和局限性
研究化学变化的方向、能达到的最大限度以及 外界条件对平衡的影响。化学热力学只能预测反应 的可能性,但无法预料反应能否发生?反应的速率 如何?反应的机理如何?例如: 1
1 3 N 2 H 2 NH 3 (g) 2 2 1 H 2 O 2 H 2 O(l) 2
B
§9.2 反应速率和速率方程
1. 反应速率的表示法 反应速率:化学反应进行的快慢程度。
d J dt
d 1
B
物化练习

第九章化学动力学基本原理一、填空题1、设物质A 可发生两个平行的一级反应:(a )C B A Ea ka +−−→−,(b )E D A Ebkb +−−→−, 式中,B 和C 是需要的产品,D 和E 为副产物。
设两反应的频率因子相等且与温度无关,E a >E b ,则反应(a)和反应(b)相比,速率较大的反应是 ,升高温度对 更有利。
2、硝酸异丙烷在水溶液中被碱中和,其反应速率常数可表示为lgk=11.899-3163/T ,该反应的表观活化能为 。
3、今将某物质A 放入一反应器内,反应了3600s ,消耗掉75%,设反应分别为一级,二级,零级反应。
则反应进行了7200s 时,对于各级反应,A 物质的剩余量分别为 、 和 。
4、某化合物的分解反应是一级反应,设反应的活化能E=14.43×104J ·mol -1,已知557K 时该反应的速率常数k=3.3×10-2s -1,现要控制反应在10min 内转化率达到90%,则应控制该反应的温度为 。
5、比较两相同类型的反应I 和II ,发现活化能E I >E II ,速率常数k I >k II ,其原因在于 。
6、在T ,V 恒定时,反应A(g)+B(g)→D(g)t=0时,P A,0=800kPa ,t 1=30s 时,P A,1=400kPa ,t 2=60s 时P A,2=200kPa ,t 3=90s 时,P A,3=100kPa 时此反应的半衰期t 1/2= ,反应级数n= ,反应的速率常数k= 。
.7、阿累尼乌斯活化能是 。
.8、气相有效分子碰撞理论的基本观点是 。
.9、根据活化络合物理论,液相分子重排反应的活化能E a 和活化焓△r H m 之间的关系是 。
.10、由经验规则“温度每增加10K ,反应速率增加二倍”可知,在T 1=298K 时和T 2=308K 时符合这规律的活化能值E a = 。
化学动力学

什么是化学动力学?
化学动力学是一门研究各种因素对反应速率影
响的规律和反应机理的科学。
1、化学动力学的基本任务
反应速率= f (c, T , P , 光,电,催化剂 ) [寻找规律]
反应机理(历程)[从微观角度研究反应的全过程] •宏观化学动力学:(1) 反应速率方程; (2) 不同反应的特性; (3) 反应机理。
mol m 3 s 1 )
即单位时间单位体积内化学反应的反应进度. 对于恒容反应 (dnB / V dcB )
1 dcB v B dt
>0 与B选择无关。 与计量式写法有关。
通常的反应速率都是指定容反应速率
1.反应速率的定义
§9.1
②反应速率(单位体积中反应进度随时间的变化率) •若化学计量反应写作 A A B B Y Y Z Z
3.基元反应的速率方程—质量作用定律
质量作用定律(Law of mass action):
§9.1
基元反应的反应速率与反应物浓度的幂乘积成正比。
幂指数就是基元反应方程中各反应物的系数。
它只适用于基元反应.
•若
aA bB 产物(基元反应)
b 速率方程 dc A / dt kc a Ac B
3.基元反应的速率方程—质量作用定律
反应速率常数k :
§9.1
—单位浓度的反应速率,比例系数
注意
(1)k 的数值与浓度无关(取决于两个因素);
(2)k 的单位 [浓度]1 n [时间]1 • 单位与反应级数有关,数值与单位的选择有关;
(3)当反应速率与物质B的选择有关时,相应
的k亦与之有关。
化学动力学基本原理

r k[H2 ][I 2 ]
k[H 2 ][Br2 ]1/ 2 r 1 k ' [HBr] /[Br2 ]
r k[H2 ][Cl 2 ]1/ 2
实验证明,它们的速率公式却有着完全不同的形式。
第九章 化学动力学基本原理
返回目录
退出
21
由实验确定的速率公式,虽是经验性的,但有
很重要的作用:
第九章 化学动力学基本原理
返回目录
退出
18
例如恒容反应器中,氯代甲酸三氯甲酯分解为光气 ClCOOCCl3(g) 2COCl2(g) t =0 p0 0
t=t
p酯
p光气=2( p0 – p酯)
p总=p酯 + p光气 = 2 p0 –p酯 所以 p酯=2p0 – p总
或 p光气=2[p总– p0]
因此说化学热力学只解决了反应可能性的问题,反 应究竟能否实现还需由化学动力学来解决。
第九章 化学动力学基本原理
返回目录
退出
4
基本任务: (1) 研究各种因素(浓度、温度、光、介质 )对反应速率的影响。 (2) 指示反应的机理(即反应实际进行的具 体步骤)。 (3)研究物质的结构与反应速率的关系。 目的:
第九章 化学动力学基本原理
返回目录
退出
8
今天,微观反应动力学已成为现代化学动 力学发展的新前沿,光谱分辨技术、空间分辨 技术、分子运动控制技术与质谱技术、光电检 测技术极大地促进了动力学研究,并发展了如 量子分子动力学、立体化学反应动力学、非绝 热过程动力学等一系列新的研究领域。
第九章 化学动力学基本原理
11
第九章 化学动力学基本原理
返回目录
退出
§9.2 反应速率和速率方程
第九章 化学动力学基本原理(效果)PPT课件

的需要
10.11.2020
长江大学化工学院
13
十一. 速率方程的一般形式
(2)反应速率常数k的大小是由化学反应的本质确定的,
它是温度、催化剂和溶剂的函数
(3)反应级数:对反应物A为 级,对反应物B为 级,......
反应的总级数为(
)
(4) 、 、 、 ......中的某一个或某几个可能为零,也
可能是负数
2NO+H2→N2+H2O2
10.11.2020
长江大学化工学院
8
八. 复合(杂)反应
由两个及两个以上的基元反应构成的化学反应 叫复合(杂)反应 例如:H2+Cl2=2HCl就是一个复合(杂)反应,因 为它是由4个基元反应构成的。
10.11.2020
长江大学化工学院
9
九. 化学反应速率的表示方法
20
十三. 一级反应动力学
(1) ln C A -t为 一 条 直 线 ( 2 ) k的 单 位 : h 1;m in 1 ; s 1
(3)半 衰 期 ( 半 寿 期 )
第九章 化学动力学基本原理
10.11.2020
1
一. 化学动力学
研究浓度、温度、催化剂、光及介质等各种 因素对化学反应速率的影响,揭示化学反应的机 理及结构与性能之间的关系的学科
10.11.2020
长江大学化工学院
2
二. 化学动力学与化学热力学的区别
热力学探讨的是化学反应实现的可能性问题, 而化学动力学探讨的是化学反应的现实性问题
长江大学化工学院
19
十三. 一级反应动力学
3.动力学特征
A k1 P
t 0; C A.0 t t; C A
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
简 单 级 数 反 应
反 应 级 数 测 定
温 度 影 响
碰 撞 理 论
过 渡 态 理 论
单 分 子 反 应
动习 力题 学课
1
§9.1 引言
Introduction
一、化学动力学的目的和任务 二、 化学动力学发展简史 三、反应机理的概念
2
一、化学动力学的目的和任务
任一化学反应有两个基本问题需要研究: (1) 有无可能性;其最后结果如何?-------化学 反应的方向和限度------化学热力学。 (2) 若可能进行,多长时间能实现------反应速 率------化学动力学。
20
虽有相同的化学反应计量方程式,由于 反应机理不同,反应速率方程不同:
H2 + I2 2HI
H2 + Br2 2HBr H2 + Cl2 2HCl
r k[ H 2 ][I 2 ]
k[ H 2 ][Br2 ]1 / 2 r 1 k '[ HBr] /[ Br2 ]
r k[ H 2 ][Cl 2 ]1/ 2
一、反应速率的表示法 二、反应速率的实验测定 三、反应速率的经验表达式:微分式; 积分式
四、反应级数
五、质量作用定律
六、速率常数
12
一、 反应速率的表示方法
The representation of reaction rate 1、 反应进度 反应 aA + bB t=0 =0 nA,0 nB,0 t=t nA nB gG + hH nG,0 nH,0 nG nH
25
r=k[H2][Cl2]1/2
3 、速率公式与上式不符的,反应级数的概念不适
五、质量作用定律 Law of mass action
―质量作用定律”:
一定温度下,基元反应的速率只与反应物浓度有
关,而且各浓度项的指数与计量系数(绝对值)
一致,其速率公式均符合如下形式: r = k[A]a[B]b 例如:基元反应 aA + bB gG + hH r = k[A]a[B]b 注意:质量作用定律只适用于基元反应(简单 反应和复合反应中的各基元反应)
21
由实验确定的速率公式,虽是经验性的,但有
很重要的作用:
1)可以知道哪些组分以怎样的关系影响反应 速率 2)为化学工程有效控制反应提供依据
3)为研究反应机理提供重要线索
22
四、反应级数 Order of reaction
―反应级数”:若反应的速率公式可以表达为: r = k[A][B] 其中: 、 …分别为组分A、B …的级数。
18
例如恒容反应器中,氯代甲酸三氯甲酯分解为光气
ClCOOCCl3(g) 2COCl2(g)
t=0 p0 0
t=t
p酯
p光气=2( p0 – p酯)
p总=p酯 + p光气 = 2 p0 –p酯 p酯 = 2 p0 – p 总 除压力外,旋光度、折光率、电导、比色、光谱等 物理性质均可应用,其优点是间接测量,不干扰反 应,方便,迅速,可连续测定。
def
nB nB ,0
B
n B
B
/ mol
or
d
def
dnB
B
13
2 、反应速率的定义 对于任意反应
d 1 dnB J dt B dt
def
aA + bB gG + hH
1 dnA 1 dnB 1 dnG 1 dnH J a dt b dt g dt h dt
3
例:2H2+O2 2H2O
rGmy= – 237.2 kJ.mol-1
其自发趋势很大,但反应速率很小
HCl(aq)+NaOH(aq)NaCl(aq)+H2O
rGmy= – 79.91 kJ.mol-1
反应的趋势似乎小些,但瞬间即可完成。
4
基本任务: 1、 研究各种因素(浓度、温度、光、介质
例如对于气相反应: 在定温定容条件下
2NO + Br2 2NOBr
1 d [ NO] d [ Br2 ] 1 d [ NOBr] r 2 dt dt 2 dt
15
二、反应速率的实验测定
Experimental measurement of rate
c
t 以c t作图,得一曲线,求各点的切线,其斜率: dc /dt ,即可求出相应时刻的r
反应机理:反应实际进行与经历的具体步骤。 例如“总反应” :H2 (g) + Cl2 (g) 2HCl (g) 实际上反应进行了下列步骤:
i. Cl2 2Cl•
ii. Cl • + H2 HCl + H •
iii. H • + Cl2 HCl + Cl • iv. 2Cl • + M Cl2 + M
六、速率常数 Rate constant
―速率常数” k:对于指定反应, k值与浓度无关, 而与反应温度及催化剂有关,不同反应k值不同 (1) k在数值上等于有关物质的浓度均为1时反应 速率,所以有时亦称为 比速常数。 (2) k的单位与反应级数 n有关,所以可由单位看 出反应级数。如:
3 1 r / mol dm s k /(mol dm 3 )1 n s 1 [ A] [ B] /(mol dm 3 )n
9
反应分子数:基元反应中,直接作用所必需的 反应物微观粒子数。分为:单分子 反应,双分子反应,三分子反应。 微观可逆性原理:微观粒子系统具有时间反演 的对称性。对于化学反应而言,微 观可逆性可以表述为:基元反应的 逆过程必然也是基元反应。 利用以上两条可以初步判断基元反应
10
请根据基元反应的特点判断下列各反应是不 是基元反应?
1/ 2
1/2
1.5级反应
24
r k[A][B]/(1 [B] ) 无简单级数
注意: 1 、反应级数是宏观概念,可以是整数,亦可以是 分数(小数),也可以为负数或 0,反应级数必
须由实验确定,反应级数与反应分子数是不同
的概念。
2、反应级数与计量系数不一定一致,
如H2 + Cl2 2HCl 用。
31
§9.3 简单级数反应的速率公式
The rate formula of reaction simple order ―简单级数反应”:r=k[A][B] 1 A、B 只是反应物 2 无论是、或n都是0或正整数。如: 一级反应 二级反应 零级反应和三级反应
简单反应都是简单级数反应,但是简单级数反应 不一定是简单反应,例如: H2 + I2 2HI r = k[H2][I2]
32
一. 一级反应(first order reaction)
反应速率只与反应物浓度的一次方成正比的 反应称为一级反应。 常见的一级反应有放射性元素的蜕变、分子
重排、五氧化二氮的分解等。
226 88
Ra
222 86
Ra He
4 2
r k[
226 88
Ra]
1 N 2 O5 N 2 O4 O2 2
17
浓度测定方法分为1.化学法,2.物理法 1、化学法: 化学分析法测浓度关键是“冻结反应”,方法 有:骤冷、冲稀、加阻化剂或脱离催化剂等。 其优点是设备简单,测量直接; 缺点是很难找到合适的“冻结方法”。 2、物理法: 测量某种物理性质,条件是该性质与浓度有 单值函数关系。 压力,旋光度、折光率、电导、比色、光谱等物理 性质均可应用,其优点是间接测量,不干扰反应, 方便,迅速,可连续测定。
注意:(1)与选择物质B无关; (2)对何种条件下进行的反应都是严格的、 正确的, (3)恒容条件下的速率表达形式 r=J/V:
14
3. 单位体积的反应速率r/ mol · dm-3.s -1 or mol · L-1.s -1
J d 1 dnB 1 dcB 1 d [ B] r V Vdt B Vdt B dt B dt
)对反应速率的影响。
2 、揭示反应的机理(即反应实际进行的具
体步骤)。
3、研究物质的结构与反应速率的关系。
5
目的: 控制反应速率 控制反应机理
得到预期的产品。
不同的反应,往往速率相差很大,可分: 慢:如岩石风化,地壳中的某些反应。 中:几十秒 几十天范围—本课程主要 研究 对象。 快:离子反应,爆炸反应—现代动力学研究的 活跃领域,激光、分子束技术。
26
速率公式符合质量作用定律的反应不一定就 是简单反应,例如:
H2 + I2 2HI r=k[H2][I2]
但该反应是复合反应,其机理为: I2 2I · H2 + 2I · 2HI 其中包含一步三分子反应。
27
例: A
k1
B D
k2 k3
k4
根据质量作用定律写出 C d[A]/dt、d[B]/dt、 d[C]/dt、d[D]/dt 与各 物质浓度的关系
0级: mol· dm-3 · s-1; 1级: s-1; 2级 : mol-1· dm3.s-1; 3 级:mol-2· dm6.s-1; …
29
1、某化学反应的方程式为2A→P,则在动力学研究中 表明该反应为( )
A、二级反应 B、基元反应 C、双分子反应 D、以上都无法确定
k 2、某化学反应为 2 A B P ,实验测定其速率常 数为 k 0.25(mol dm3 )1 s1 ,则该反应的级数为( )
d [ A] = –k [A] –k [A] 解:A同时生成B,D,故 1 4 dt
B生成C;又由A,C生成
