第九章 化学动力学概念题
第九章-化学动力学基本原理第1期

§9.3 简单级数反应的动力学规律凡是反应速率只与反应物浓度有关,而且反应级数,无论是、、…或n都只是零或正整数的反应,统称为“简单级数反应”。
简单反应都是简单级数反应,但简单级数反应不一定就是简单反应,前已述及的HI气相合成反应就是一例。
具有相同级数的简单级数反应的速率遵循某些简单规律,本节将分析这类反应速率公式的微分形式、积分形式及其特征。
(1)一级反应反应速率与反应物浓度的一次方成正比的反应称为一级反应。
其速率公式可表示为(9.7)式中c为t时刻的反应物浓度。
将上式改写成的形式,积分可得(9.8)B为积分常数,其值可由t = 0时反应物起始浓度c0确定:B = ln c0。
故一级反应速率公式积分形式可表示为(9.9)或(9.10)或(9.11)使用这些公式可求算速率常数k1的数值,只要知道了k1和c0的值,即可求算任意t时刻反应物的浓度。
从(9.8)式可看出,以lnc对t作图应得一直线,其斜率即为k1。
如图9.2所示。
反应物浓度由c0消耗到c=c0/2所需的反应时间,称为反应的半衰期,以t1/2表示。
由(9.9)式可知,一级反应的t1/2表示式为(9.12)可以看出,一级反应的半衰期与反应物起始浓度c0无关。
许多分子的重排反应和热分解反应属一级反应。
还有些反应例如蔗糖水解实际上是二级反应,但由于水溶液中反应物之一H2O大大过量,其浓度在整个反应过程中可视为常数,故表观上表现为一级反应,这类反应称为“准一级反应”。
例题1 30℃时N2O5在CCl4中的分解反应为一级反应,由于N2O4和NO2均溶于CCl4中,只有O2能逸出,用量气管测定不同时刻逸出O2的体积有下列数据:t / s 0 2400 4800 7200 9600 12000 14400 16800 19200V(O2) / cm3 0 15.65 27.65 37.70 45.85 52.67 58.30 63.00 66.8584.85求算此反应的速率常数k1和半衰期t1/2。
物理化学及考试习题 试卷 答案第四次习题课(第九章化学动力学基础)ppt课件

r 2= r 3= r 4=
1 d [ A ] d [ B ]1 d [ P ] 2 k [ A ] [ B ] 2 dt dt 2 dt
d [ A ] 1 d [ B ]d [ P ]1 d [ S ] 2 k [ A ][ B ] dt2 dt dt 2 dt
5.某二级反应2A→P,设cA,0=0.005mol· dm-3,500℃和 510℃时,经300秒后分别有27.6%和35.8%的反应物分解。 计算(1)两个不同温度时的速率常数;(2)反应的活 化能。
解:(1)二级反应的动力学方程为 kt= (1/c-1/c0) 代入题给数据后得:k1=0.2541dm3· mol-1· s-1 k2=0.3718dm3· mol-1· s-1 (2)根据阿伦尼乌斯方程有 ln(k2/k1)=E/R(1/T1-1/T2) 代入题给值,得E=191.34kJ· mol-1
1 1 k ln t 1 x
代入题给数据得:k2=3.84×10-3 s-1 根据阿伦尼乌斯方程的定积分式有
E 1 k 1 ln 2 a ( ) k R T T 1 1 2
解出T2= 409.2 K
Байду номын сангаас
3.某反应物反应掉8/9时所需要的时间是反应掉 2/3时所需要时间的二倍,该反应级数是多少? 答:一级反应的动力学方程为
3、C14放射性蜕变的半衰期为5730年,今在一考古学样 品中测得C14的含量只有72%,请问该样品距今有多少年? 解:同位素的放射性蜕变是一级反应,其 动力学方程为
1 kt ln 1 x k=(ln2)/t1/2=0.6931/5730=1.209 ×10-4年-1
代入题给数据有
t=1/kln(c0/c)=(1/k)ln[1/(1-x)] =(1/1.209×10-4)ln1/(1-0.72)=2.72×103年
物理化学答案——第九章-化学动力学基础
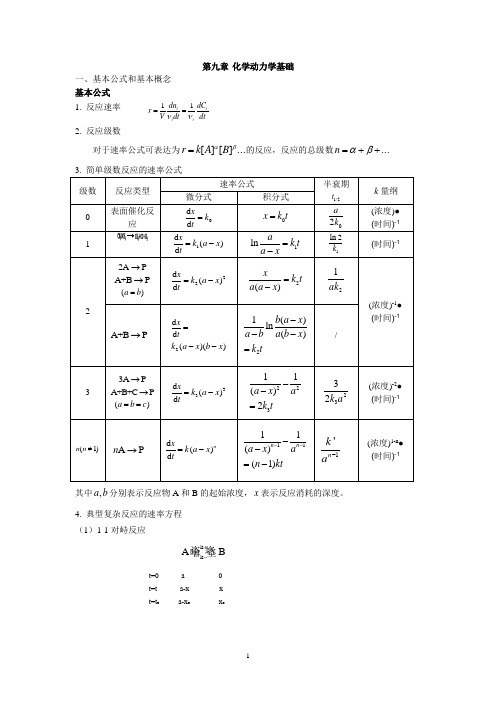
第九章 化学动力学基础一、基本公式和基本概念 基本公式 1. 反应速率 11i ii i dn dC r V dtdtνν==2. 反应级数对于速率公式可表达为...][][βαB A k r =的反应,反应的总级数...++=βαn 3. 简单级数反应的速率公式 级数 反应类型 速率公式半衰期 1/2tk 量纲微分式积分式0 表面催化反应0d d x k t =0x k t = 02a k (浓度)● (时间)-1 11d ()d x k a x t=-1lna k t a x=-1ln 2k(时间)-122A P→A +B P →()a b =22d ()d x k a x t=-2()x k t a a x =-21ak(浓度)-1●(时间)-1A +B P →2d d ()()xtk a x b x =--21()ln()b a x a b a b x k t---=/33A P→A +B +C P→()a b c ==33d ()d x k a x t=-22311()2a x a k t --=2332k a(浓度)-2● (时间)-1(1)n n ≠A P n →d ()d nx k a x t=-1111()(1)n n a x an kt----=-1'n k a-(浓度)1-n ● (时间)-1其中,a b 分别表示反应物A 和B 的起始浓度,x 表示反应消耗的深度。
4. 典型复杂反应的速率方程 (1)1-1对峙反应k k A B +-t=0 a 0 t=t a-x x t=t e a-x e x e速率方程: ()kk te e x x x e +--+-=(2)平行反应最简单的平行反应是由两个一级基元反应组成的平行反应:x=x 1+x 2速率方程:tk k aex a )(21+-=-产物B 和C 的浓度比由竞争反应的速率决定:2121k k x x = (3)连续反应最简单的连续反应是两个单向连续的一级反应:C B A kk −→−−→−21t=0 a 0 0 t=t x y z 速率方程:1k tx ae-=)(21121tk tk eek k a k y ----=]1[21121122tk tk ek k k ek k k a z ---+--=中间产物B 的浓度在反应过程中出现极大值:122)(21k k k m k k a y -=,出现极大值的时间为:2121)ln(k k k k tm-=5. 温度对反应速率的影响 (1)阿累尼乌斯经验公式2ln RTE dTk d a =阿累尼乌斯公式的指数函数式: RTE a Aek -=k 1k 2A a-xCx 2 B x 1(2)阿累尼乌斯活化能基元反应的活化能是活化分子的平均能量与所有分子平均能量之差。
化学动力学

第9章 化学动力学9.1 重要概念、规律和方法1.反应分子数和反应级数反应分子数和反应级数是两个不同的概念。
反应分子数是指在元反应中直接发生碰撞的粒子数,其值只能是1、2或3。
对于复合反应,则没有反应分子数之说。
若速率方程具有幂函数形式,其中幂的次数称为反应级数,它只表明物质浓度对反应速率的影响程度。
级数是纯经验数字,它可以是整数,也可以是分数;可以是正数,也可以是负数,还可以是零。
但是对于元反应而言,其反应级数恰等于反应分子数。
2.关于速率方程速率方程反映浓度对于反应速率的影响。
它是研究反应动力学唯观规律及微观机理的基础,是化学反应动力学性质的综合体现。
速率方程具有微分和积分两种形式,其实后者是前者的解,所以关键是微分式。
在确定反应级数或进行其他定量处理时,一定要写出速率方程微分式的具体形式7这才能为正确解决问题奠定基础。
在动力学实验中,为了使速率方程曲形式简化,,常采用以下两种原料配方:①按计量比投料。
例如,若反应A 十2B 十3C →p 的速率方程为 。
当按计量比投料时 ,则速率方程可简做成 ;②—种反应物初始浓度远小于其他反应物。
例如在上例中初始浓度a ,b ,c 满足a«b 且a«c ,则反应过程中c B ≈b ,c C ≈c ,于是速率方程简化为γβαC B A A c c kc dt dc =−/c c c ==k c k dt dc 3/==−+γβαγβC B A 3121'2n A A A c + ααγβAA A c k c c kb dt dc ''/==−总之,特定的配方往往能把一个多元幂函数简化成一元函数,结果将一个复杂问题变得简单。
在知道反应级数之后,动力学讨论或处理问题的基本程序为:①列出速率方程;②解微分方程;③由解出的结果讨论反应特点。
只要掌握这种处理方法,可以自行讨论各种级数的反应。
应该指出,动力学中的一些公式和规律往往是以特定的速率方程为前提的。
物理化学:化学动力学习题课

概念与公式 例1 例4 例2 例5 例3 例6
1 速率公式 简单级数 级数测定 阿-公式 碰撞理论 过渡态 单分子反应 习题课
(一) 概念和公式
一、反应速率表达式:aA bB
r / mol dm3 s1 d dni dci
Vdt viVdt vidt
r
当r=r0 /9 时,[A]= a/3
t 1 1 1 2 200 s k a / 3 a 0.1 0.1
6. 在温度T,实验测得某化合物在溶液中分解的数据
c0/ mol·dm-3 0.50 1.10 2.48
t1/2 /s
4280 885 174
则该化合物分解反应级数为__3_______
10 速率公式 简单级数 级数测定 阿-公式 碰撞理论 过渡态 单分子反应 习题课
kc
例3、气相反应 nA P
速率公式:
d[ A] dt
kc[
A]n
若以压力代替浓度,速率公式为: dpA
气体设为理想气体,证明
kp
kc (RT )n1
dt
kp
p
n A
证:将[A]=pA /RT代入
d[ A] dt
kc[
1 T1
1 T2
k AeEa / RT
6 速率公式 简单级数 级数测定 阿-公式 碰撞理论 过渡态 单分子反应 习题课
(二)例题
例1、选择、填空
1.对于反应2NO2=2NO+O2,其反应速率表达式为(D)
( A) 2d[NO2 ] 2d[NO] d[O2 ]
dt
dt
dt
(B) d[NO2 ] d[NO] d[O2 ] d
2 微分法: n ln(r1 / r2 ) ln(c1 / c2 )
物理化学 第九章化学动力学

2013-5-23
20
即
dp A n n k c ( RT )1 n p A k p p A dt k p k c ( RT )
1 n
式中
dp A n k p pA dt
在实验中测量的是反应系统的总压, 某组分的 分压 pA与总压的关系可以根据计量方程推出.
2013-5-23 21
2013-5-23 3来自化学动力学与化学热力学的关系
化学热力学 — 研究物质变化过程的能量效 应及过程的方向与限度, 即有关平衡的规律; 解决物质变化过程的可能性.
化学动力学 —研究完成该过程所需要的时间 以及实现这一过程的具体步骤, 即有关速率 的规律; 解决物质变化的现实性. 可能性的趋势强弱与现实性的速率快慢之间 没有必然的联系.
1. 反应速率的定义
化学反应计量式
0 B B
B
转化速率 定义为
def d dt
dnB d B
def
所以
def d 1 dnB dt B d t
单位:mol.s-1
2013-5-23
该式应用必须指明化学反应方程
7
对于恒容反应, 定义反应速率
def 1 dcB V B dt
1/ 2 kcH 2 cB r2
d[H 2 ] dt 1 k [HBr]/[Br 2 ]
2013-5-23
19
5. 用气体组分的分压表示的速率方程
若反应物A为理想气体, 则在T, V一定时, 推导如下:
nA pA RT cA RT , 即cA pA ( RT ) 1 V dc A n 将此式代入式 , kc A 得 dt dcA dpA n ( RT )1 kc { pA ( RT )1 }n kc ( RT ) n pA dt dt
物化练习

第九章化学动力学基本原理一、填空题1、设物质A 可发生两个平行的一级反应:(a )C B A Ea ka +−−→−,(b )E D A Ebkb +−−→−, 式中,B 和C 是需要的产品,D 和E 为副产物。
设两反应的频率因子相等且与温度无关,E a >E b ,则反应(a)和反应(b)相比,速率较大的反应是 ,升高温度对 更有利。
2、硝酸异丙烷在水溶液中被碱中和,其反应速率常数可表示为lgk=11.899-3163/T ,该反应的表观活化能为 。
3、今将某物质A 放入一反应器内,反应了3600s ,消耗掉75%,设反应分别为一级,二级,零级反应。
则反应进行了7200s 时,对于各级反应,A 物质的剩余量分别为 、 和 。
4、某化合物的分解反应是一级反应,设反应的活化能E=14.43×104J ·mol -1,已知557K 时该反应的速率常数k=3.3×10-2s -1,现要控制反应在10min 内转化率达到90%,则应控制该反应的温度为 。
5、比较两相同类型的反应I 和II ,发现活化能E I >E II ,速率常数k I >k II ,其原因在于 。
6、在T ,V 恒定时,反应A(g)+B(g)→D(g)t=0时,P A,0=800kPa ,t 1=30s 时,P A,1=400kPa ,t 2=60s 时P A,2=200kPa ,t 3=90s 时,P A,3=100kPa 时此反应的半衰期t 1/2= ,反应级数n= ,反应的速率常数k= 。
.7、阿累尼乌斯活化能是 。
.8、气相有效分子碰撞理论的基本观点是 。
.9、根据活化络合物理论,液相分子重排反应的活化能E a 和活化焓△r H m 之间的关系是 。
.10、由经验规则“温度每增加10K ,反应速率增加二倍”可知,在T 1=298K 时和T 2=308K 时符合这规律的活化能值E a = 。
化学动力学习题库

1、在T 、V恒定的条件下,基元反应
A(g) + B (g) D(g) 则此反应为( ) 分子反应,
若初始浓度cA,0 >> cB,0,即在反应过程中物质A大量过 剩,其反应掉的物质的量浓度与 cA,0相比较,完全可 以忽略不计。则此反应的级数n=( C ). (A)2,2; (B)1,2 ; (C) 2,1 ; (D) 1,1
因 pA =1/3pB(pC,0=0且pA,0=1/3 pB,0),
1 2 2 2 p总 pB pB ( pB , 0 pB ) pB , 0 pB 3 3 3 3 2 因此 dp / dt (dpB / dt ) 3
3、 一定T、V下,反应A(g) B(g) + D(g) 当pA,0 =100kPa时,反应的半衰期t1/2 = 25min; 当pA,0 =200kPa时,反应的半衰期t1/2 = 50min。此反应的级数n =( ),反应的速率系数k= ( )。 解:由题给数据可知,在一定T、V下,反应的半衰期与 反应物的初始压力成正比,此反应必为零级反应,故n=0, k=p A,0/2t 1/2=100kPa/225S=2.0kPa.S-1 4、 在一定温度下,液相反应 A + B D 的速率 系数kA=42.5 min-1 ,则CA从2.0mol.dm-3变到 0.50mol.dm-3所需的时间为t1 ,从0.40mol.dm-3变到 0.10mol.dm-3所需的时间为t2 ,则两者t2/ t1=( )。 解:由题给k的单位可知,为一级反应, kt=ln(c0/c) t2/t1=ln(0.4/0.1)/ln(2.0/0.5)=ln4/ln4=1
3、对行反应和平行反应各有什么特点? 对行反应的特点 1.净速率等于正、逆反应速率之差值 2.达到平衡时,反应净速率等于零 3.正、逆速率系数之比等于平衡常数Ky=k1/k-1 4.在c~t图上,达到平衡后,反应物和产物的浓度不再 随时间而改变,趋近于平衡浓度
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第九章 化学动力学概念题9.1 填空题1. 反应2B B k −−→ 3D ,其速率方程可表示为-d c B /d t = k B c B 23,也可表示为-d c D /d t = k B c B23,则-d c B /d t 与d c D /d t 之间的关系为( )。
速率常数k B 和k D 的比为( )。
2. 反应2A A k −−→B 为基元反应,k A 是与A 的消耗速率相对应的速率常数。
若用B 的生成速率及k B 表示反应的反应速率时,则其速率方程( )。
3. 反应A(g)+3B(g) →2C(g),反应开始时,反应物按计量比混合而且无产物C 存在(即p C ,O =0),若将以B 的压力变化来表示的消耗速率-dp B /d t 换成以总压p 表示-d p /d t 时,则(-d p /d t )/(- d p B /d t )=( )。
4. 在温度一定下,反应A =B +C 的反应物A 反应掉其起始浓度c A ,O 的87.5%时,需时3 min 。
在同一温度下,上述反应的反应物A 的起始浓度改为c ' A ,0且c ' A ,0=21c A ,O ,当反应掉c ' A ,0的一半时,需时1 min ,则此反应级数为( )。
5.已知某反应的反应物无论其起始浓度c A ,O 为多少,反应掉c A ,O 的2/3时所需的时间均相同,所以该反应为( )级反应。
6.某基元反应B →C +D ,测得反应的半衰期t 1/2=10 h 。
经30 h 后,所余下的反应物浓度c B 与反应起始浓度c B ,o 之比为( )。
(填入具体数值) 7.在温度T 下,气相基元反应A(g)→B(g)+Cg)的以压力(Pa)表示的速率常数k p =20 s -1,若将k 改为以浓度(mol ⋅dm -3)表示(即k C )时,则k C =( )。
(填入具体数值与单位) 8.已知反应(1)和(2)具有相同的指前因子,测得在相同温度下升高20 K 时,反应(1)和(2)的反应速率分别提高2倍和3倍,说明反应(1)的活化能E a ,1( )反应(2)的活化能E a ,2,而且同一温度下,反应(1)的k 1( )反应(2)的k 2。
9. 2B →D*和 2A →C 两反应均为二级反应,而且k =A exp (-E a /RT )公式中的指前因子A 相同。
已知在100℃下,反应(1)的k 1=0.10 dm ⋅mol -1⋅s -1,而两反应的活化能之差E a, 1-E a, 2=15 000 J ⋅mol -1,那么反应(2)在该温度下的速率常数k 2=( )(填入具体数值)。
10. 某复合反应由以下的基元反应组成:试据质量作用定律写出上述反应的B 物质的净速率B d d c t 与各物质浓度的关系,即B d d c t=( ) 11. 某复合反应的表观速率常数k 与各基元反应的速率常数间的关系为k =2k 2(412k k )23,则其表观活化能E a 与各基元反应活化能E a, 1,E a, 2及E a, 4之间的关系为( )。
12. 一级对行反应,已知则此反应在500 K 时的k -1=( )(填入具体数值)。
13. 两反应均为一级的平行反应B ,为所需产物,而C 为副产物。
已知两反应的指前因子A 1=A 2,E a, 1=100 kJ ⋅mol -1,E a, 2=70KJ ⋅mol -1。
今欲想加快反应(1)的反应速率(相对于反应(2)),应采取(提高)反应温度的措施,计算在500 K 时c B /c C =( ).14. 某对行反应A +BC +D ,当加人催化剂后其正、逆反应的速率常数分别从k 1,k -1。
变为k '1与k '1-,,测得k '1=( ) k 1那么,k '1-=( )k -1。
15.光化反应的初级反应B +h ν→B*,则此光化反应的反应速率与( )成反比,而与( )无关。
9.2 单项选择题1. 在一定条件下,基元反应为A +B → D ,则此反应为( )分子反应。
若实验测定时,起始浓度c A, 0>>c B,0,即可认为反应过程中c A, 0近似不变,则此反应的级数为( )。
选择填入:(a )2,2;(b )1,2;(c )2,1;(d )1,1。
2.反应A →B ,若开始时c B,0=0,A 的起始浓度为c A, 0,当反应物A 完全转化B 时,需时为t ,而反应掉A 的起始浓度c A, 0之一半时,所需时间为t 1/2,测得t ⁄t 1⁄2=2,则此反应的级数为( )。
选择填入:(a )零级;(b )一级;(c )3/2级;(d )二级。
3.反应2A →3B ,其速率方程可表示为-d c A /dt =k A c 2A c -1B ‘或d c B /d t =k B c 2A c -1B 则两者的速率常数之比,即k A /k B=( )。
选择填入:(a )2;(b )2/3;(c )3/2;(d )3。
4. 已知某气相反应2A(g)→2B+C 的速率常数k 的单位为dm 3⋅mol -1⋅S -1。
温度一定下,若反应开始时,A 的浓度为c A, 0=1mol ⋅dm 3,实验测得:A 反应掉1/2c A ,0所需的时间t 1/2与反应掉3/4c A, 0时所需时间t 3/4之差为600 s ,则t l/2=( )。
选择填入:(a )300 s ;(b )600s ;(c )900S ;(d )数据不足,无法计算。
5. 下列所列举的反应中,哪一反应有可能(注意是可能)是基元反应( )。
选择填入: (a)A+ 21B →C+D; (b)A+B →D ,其速率方程为-d c A /d t =k c A 21 c B ; (c ) A +B →C +E ,其反应速率随温度升高而降低;(d )A +B →E ,其速率方程-d C A/d t = k A c A c B.6.某反应B →C+ D 的速率方程可表示为B d d c t-=k B c n B .300k 、下.反应开始时只有B ,测得以下数据:则此反应的级数为( )。
选择填入:(a )零级;(b )一级;(c )二级;(d )无法计算。
7.反应A 十B →C 十D 其活化能E a =30 kJ ⋅mol -1。
在500 K ,升高温度1K 时,得k (501 K )/k (500 K );若同一反,1000K 下,也得k (1001k )/k (1 000 K ),那么,k (501 K )/k (500 K )( )k (1 001 K )/k (1000 K)。
选择填入:(a)小于;(b)等于;(c)大于;(d)无法确定。
8.在恒T ,V 下,正逆反应均为基元反应的对行反应如下测得此反应的反应热Q v =50.0 kJ ⋅mol -1,则上述反应中的正向反应之活化能E a,1( )。
选择填入:(a )一定大于50.0 kJ ⋅mol -1; (b )一定小于50.0 kJ ⋅mol -1;(c )一定等于50.0 kJ ⋅mol -1; (d )可能大于也可能小于50.0 kJ ⋅mol -1。
9.基元反应的活化能E a (a );而非基元反应的活化能E a ( )。
选择填入:(a )一定大于零;(b)一定小于零;(C )一定等于零;(d)有反应大于零,也可能有反应小于零。
10. 连串反应A →B → C ,实验测得B 为非常活泼的中间产物,当反应稳定之后,则( )。
选择填入:(a )B 的生成速率大于B 的消耗速率; (b )B 的生成速率小于B 的消耗速率;(C )B 的生成速率等于B 的消耗速率; (d ) 因条件不够,无法肯定。
11.通过实验测定某一反应(能完全反应)的活化能E a 时,在不同温度T 1,T 2下的两次实验,都从相同的浓度开始,并达到相同的转化率。
所需时间分别为t 1与t 2。
反应若为一级反应时所求得的E a 值( )反应若为二级时所求得的活化能值。
选择填入:(a )大于;(b )等于;(c )小于;(d )可能大于也可能小于。
12. 恒定下的对行反应,在300 K 时k 1=10 s -1,k -1=100 Pa -1⋅s -1。
当温度升高100K 时,k 1与k -1均各增大一倍,则正、逆反应的活化能E a, 1,E a, -1及反应的Δr U m 为( )。
选择填入:(a )E a, 1>E a, -1;Δr U m >0; (b )E a, 1>E a, -1;Δr U m <0(c )E a,1=E a,-1; Δr U m =0; (d )E a,1<E a, 1;Δr U m <0。
13.由两个一级反应构成的平行反应;表示总反应的表观活化能及表观反应速率常数,于是k A ,E a 与k 1, E a,1和k 2,E a, 2的关系为( )。
选择填入:(a )E a =E a,1+E a,2 ; k A =k 1+k 2; (b )E a =k 1E a, 1+k 2E a, 2;k A =k 1+k 2(c )k A E a =E a, 1+E a, 2;k A =k 1+k 2 (d ) k A E a =k 1E a, 1+k 2E a, 2; k A =k 1+k 214.HI 在光的作用下可按反应2HI(g)→H 2(g )+I(g)分析。
若光的波长为2.5×10-7m 时,则1个光子可引起2个HI 分子解离,故1 mol HI(g)分解需要光能为( )。
选择填入:(a )239.2kJ ;(b )438.4 kJ (c )119.6 kJ (d )358.8 kJ 。
