药品工艺验证审计模板
药品生产企业内部GMP审计5个模版

药品生产企业内部GMP审计5个模版模版1:质量管理部门审计基本信息审计对象:审计日期:审计小组人员组成:姓名:部门审计主要内容清单:1.人员和培训2.文件3.物料监控4.消费进程监控5.批记载审核和成品放行6.产质量量回忆7.验证8.用户赞扬及不良反响9.退货10.自检11.质控设备12.检验操作13.检验仪器、设备及玻璃量器14.样品的取样、接纳、贮存和检验15.检验试剂、试液和规范品、规范溶液的管理16.留样及动摇性实验17.微生物实验室管理其他:____________________________审计结论:经对上述内容停止审查,质量管理部门在人员方面…培训方面…,文件方面…,实行职责方面…。
综上以为,能否能保证质量管理体系的有效运转。
审计报告一、基本状况简介二、主要效果及其风险评价主要效果:经对上述效果的综合评价,本企业质量管理部门在实行保证产品的质量和平安方面存在风险如下:三、整改建议和跟踪反省结果包括对存在效果的整改建议、整改时限建议,跟踪反省等外容。
四、审计小组成员签字审计记载模版2:消费管理部门审计基本信息审计对象:审计日期:审计小组人员组成:姓名:部门审计主要内容清单:1、文件2、人员和培训3、厂房设备4、设备5、消费操作6、无菌制剂的消费7、中药制剂的消费其它:____________________________审计结论:经对上述内容停止审查,消费管理部门在人员方面…,培训方面…,文件方面…,正确实行职责方面…。
综上以为,能否能保证质量管理体系的有效运转。
审计报告一、基本状况简介二、主要效果及其风险评价主要效果:经过对上述效果的综合评价,本企业的质量部门在质量管理体系以及对产品的质量和平安方面存在风险如下:三、整改建议和跟踪反省结果包括对存在效果的整改建议、整改时限建议,跟踪反省等外容。
四、审计小组成员签字审计记载模版3:产品工艺验证审计编写说明:1.本模板适用于药品消费企业工艺验证的审计。
原料药工艺验证模板

工艺验证方案本公司产品XXXXX是非无菌原料药产品,为保证生产工艺在实际生产中的有效性和可靠性,故对其进行工艺验证,本工艺验证采用同步验证的方式。
本生产工艺的验证是由质量管理部负责组织,生产技术部、设备工程部、生产车间及QC检验室有关人员参与实施。
本工艺验证方案参考了ICH Q7A的生产工艺验证的指导原则。
验证小组成员方案制订方案审核方案批准1. 基本情况1.1. 概述本公司生产的XXXXX是非无菌原料药产品,为保证生产工艺在实际生产中的有效性和可靠性,采取同步验证的方式来验证XXXXX的整个生产工艺过程(说明是按变更管理规程而进行的验证)。
1.2. 生产工艺1.2.1. 生产工艺流程图应有洁净区的标识。
1.2.2. 生产工艺的详细描述目前执行的工艺规程编号为:于年月日批准生效。
具体工艺描述如下:1.2.3. 关键工艺步骤和参数按照不同中间体、半成品和成品分别列表。
表1-1 关键工艺参数列表2. 验证目的通过对整个生产工艺的验证,以证实生产工艺是有效的,稳定的,能够始终如一的生产出符合要求的产品。
3. 验证前提3.1. 工艺环境包括公用系统情况在进行工艺验证之前,具体的公用系统已经经过了验证,具体的验证情况如下A.空调净化系统的验证(文件编号为:)B.纯化水系统的验证(文件编号为:)C.压缩空气系统的验证(文件编号为:)D.……3.2. 工艺设备情况生产中用到的所有设备的材质均不与物料发生反应,各设备进行了相应的安装确认、运行确认及性能确认。
各设备均制定了清洁规程,对关键设备进行了清洁验证,且验证结果符合要求。
工艺设备的列表如下:表3-1 设备一览表3.3. 所用原辅料和包装材料情况在进行工艺验证前,对所使用的原辅料的供应商的情况进行核查,要求所用的原辅料的供应商均是批准的供应商。
应用于工艺验证的原辅料均应符合相应原辅料的质量标准。
表3-2 主要原辅料供应商一览表3.4. 所用文件的准备情况在进行工艺验证前,各种管理规程SMP,各岗位的标准操作规程SOP,各设备的标准操作规程,各设备的清洁标准操作规程以及设备的维修保养规程等与生产有关的各种文件均已经制定并签字生效。
药品gmp审计指导

产品质量回顾的审计
编写说明:
1. 本模板适用于药品生产企业自检、审计小组(人员)或企业委托进行审计的第三
方,上述人员应对其自查、审计工作负质量责任。
2. 针对质量管理部门需进行的产品质量回顾的关键要素进行审计,以保证药品生产
工艺的一致性,消除质量隐患,确保药品质量。
3. 本模板包括审计记录、审计报告、整改计划及整改落实情况,如需进一步说明,
建议标注。
审计人员在审计过程中所作的详细记录,建议作为审计报告附件。
4. 企业应对所有产品进行风险评估的基础上,每年有针对性地选择一些产品质量和
安全性风险高的产品进行质量回顾,以考察产品的质量安全以及企业质量管理体
系运行情况。
基本信息审计对象:产品名称剂型规格审计日期:
审计小组人员组成:
姓名:部门
审计结论:
审计报告
、基本情况简介
、主要问题及其风险评估
主要问题:
经对上述问题的综合评估,本企业*** 产品的质量和安全方面存在如下风险:
三、整改建议和跟踪检查结果
包括对存在问题的整改建议、整改时限建议,跟踪检查等内容。
四、审计小组成员签字
审计记录。
根据新版GMP和欧盟审计设计的工艺规程模板(药品企业))

根据新版GMP和欧盟审计设计的工艺规程模板(药品企业))Approvals审批Dept.OccupationNameSignatureDate部门门门姓名门名日期Issued byXXXXXXXXXXXX制定人Reviewed byMDXXXX门理或助理门核人制造部Reviewed byRMDXXXX门理或助理门核人新门市门部与Reviewed byXXXX工程部门理或助理门核人Reviewed by物控部门理或助理门核人Reviewed byQAXXXX门理或助理门核人门量管理部Approved byGMOXXXX副门门理批准人门门理室;生门副门,1 目的建立XXXX(门品名称)工门门程~保门工门控制和工门步门门格的按门定门行。
2 范门适用于XXXXX(门品名称)的生门门程和中门控制。
3 门门制造部、新门市门部、门量管理部门本门程的门施门门。
与4制定依据门品生门门量管理门范;XXXX年修门,第XXXX条、第XXXX条~第XXXX条中门典;国XXXX年修门,第XXXX条、第XXXX条~第XXXX条国家食品门品门督管理局门准YBH011420065 程序5.1 工门流程及门境域分区划十万门门门区原门料非门门区内装包材料中门门品门门外包材料装外包装成品门门成品门门门合格入门XXXX门门生门门门生门操作门房门号门门门门度及门差温湿门门名称固定门门门号工序XXXX温湿度 ,XX~XX?HG081007门料门湿法制粒门十万门门门循门烘箱理相门门差,XX%~XX%中制胶门外门粒囊塑包XXXX温湿度 ,?XX?N/A称量称量配料门十万门门门循门烘箱站工填内装制定生门门~指门生门作保本部门的正常门门本门门人门完成门理或助理安排的生门任门。
划运确序充包运门。
装门门管理门门理门更门史5门更门施日期门更容内文件门更号修门号XXXX.XX.XXN/A00新文件XXXX.XX.XX1、增加制定依据由XXXXXXX门门012、增加所有原门料及包材料物料代门装XXXXXXX3、增加门门生门工序及门门定置表4、增加生门涉及的其他文件名及文件称号5、……..各工序需描述的容门门内粉碎门目及材门~粉碎量及粉碎门门~物料平衡率~门裂的门理措施网数数网断门门门目及材门~门门量及门门~门门的门序~门门的方式;手工或门门,~门裂的门理措施网数数网断称量物料名及量~量门序~门量门器的最小分度门及量程~折算物料的门算方法~容器称数称制粒门混和混门门~切刀和门拌门的门;高低速,~物料加入门序及加入方法;停机加门是门察口加,~门门操湿状从作;是否门门门空等,~门材的判方法。
药品生产企业GMP内部审计参考模板(国家食品药品监督管理局药汇总

药品生产企业 GMP 内部审计(参考模版)、国家食品药品监督管理局药品认证管理中心二○○八年十二月编写说明根据药品GMP 及相关要求,为统一药品生产企业内部审计的模式,帮助药品生产企业完善药品质量管理体系,降低药品生产中的质量风险。
我们现发布质量管理部门审计、生产管理部门审计、产品工艺验证审计、供应商审计的审计、委托生产审计等五个审计模版,其他专题的审计模版将陆续发布。
本模版适用于药品生产企业进行的药品GMP 内部审计(自检),如果企业当前的技术和管理水平难以适应审计的要求,可以聘请专业化咨询公司或技术顾问进行审计,但必须如实记录咨询师或技术顾问的背景和资格情况。
审计小组应对审计承担责任,任何人不得干扰和限制其质量管理责任。
药品GMP 审计是完善和提高产品质量管理的过程,希望所有药品生产企业参考这些模版详细地对药品GMP 的执行情况进行考察,及时发现问题并在进行风险评估的基础上,制定整改方案,尽快改进提高。
同时配合内部培训,提高全体员工的质量保证意识。
药品GMP 内部审计参考模版并非强制性技术标准,企业可以根据药品GMP 原则和自身情况进行调整,但企业负责人和质量管理负责人必须认真对待药品GMP 内部审计,及时发现和纠正任何背离药品GMP 和违反产品注册标准的行为。
在药品生产企业接受药品GMP 检查时,建议向检查员出示按照本模板完成审计的有关报告及记录,以作为检查员判定企业执行药品GMP 情况的参考材料。
每一个参考模版均包括审计报告、审计记录、存在问题及整改建议。
审计报告中需有明确的审计结论,对审计发现的问题应结合企业整个质量体系、生产产品进行风险评估,同时提出整改方向的建议。
审计人员在审计过程中所作的详细记录,建议作为审计报告附件。
建议药品GMP 内部审计每年至少进行一次,在此基础上进行完善和改进。
审计工作完成后至少呈报给企业最高质量负责人。
定期评审企业质量管理体系是否符合药品GMP 要求,确保药品质量的安全、有效是企业负责人的质量责任。
模版产品标准工艺验证审计

模版3:产品工艺验证审计
编写阐明:
1.本模板合用于药物生产公司工艺验证旳审计。
2.建议公司每年对每个剂型至少抽取1-2个风险性较高旳品种按照本模板进
行工艺验证审计。
3.一份登记表格仅合用于一种产品旳审计。
4.所有品种旳审计出具一份审计报告。
5.审计结论应可以反映出公司工艺验证旳整体状况,并予以明确旳结论。
基本信息
审计对象:
剂型名称规格
审计日期:
审计小组人员构成:
姓名:部门
审计重要内容清单:
1、产品状况
2、质量原则状况
3、验证方案和报告
4、验证记录
5、检查成果
6、再验证
其他:_____________
审计结论:
经对上述内容进行审查,该产品工艺验证………。
模版产品工艺验证审计精选版

模版产品工艺验证审计 Company number【1089WT-1898YT-1W8CB-9UUT-92108】
模版3:产品工艺验证审计
编写说明:
1.本模板适用于药品生产企业工艺验证的审计。
2.建议企业每年对每个剂型至少抽取1-2个风险性较高的品种按照本模
板进行工艺验证审计。
3.一份记录表格仅适用于一个产品的审计。
4.所有品种的审计出具一份审计报告。
5.审计结论应能够反映出企业工艺验证的整体状况,并给予明确的结
论。
基本信息
审计对象:
剂型名称规格
审计日期:
审计小组人员组成:
姓名:部门
审计主要内容清单:
1、产品情况
2、质量标准情况
3、验证方案和报告
4、验证记录
5、检验结果
6、再验证
其它:_____________
审计结论:
经对上述内容进行审查,该产品工艺验证………。
审计报告
一、基本情况简介
二、主要问题及其风险评估
主要问题:
经过对上述问题的综合评估,本企业的质量部门在质量管理体系以及对产品的质量和安全方面存在风险如下:
三、整改建议和跟踪检查结果
包括对存在问题的整改建议、整改时限建议,跟踪检查等内容。
四、审计小组成员签字
审计记录。
工艺验证方案模板
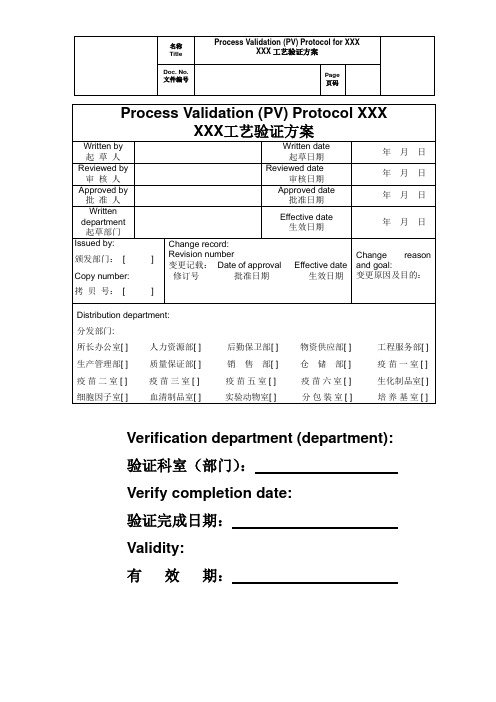
Verification department (department):验证科室(部门):Verify completion date:验证完成日期:Validity:有效期:Index 目录1.Purpose目的 (5)2.Scope范围 (5)3.Responsibility职责 (5)3.1 AAA responsibilities AAA的职责 (5)3.2 XXX responsibilities XXX的职责 (6)4.Regulation and Guidance 法规和指南 (8)5.Abbreviations缩略语 (9)6.Protocol Description方案说明 (11)7.Product And Process Description产品和工艺描述 (14)7.1 Product specification (14)7.2 Drug approval No. (14)7.3 Standard Followed: (14)7.4 Raw Materials and Adjuvants原辅料情况 (14)7.5 Process description: (16)7.6 Process Recipe工艺处方: (21)7.7 List of Production Plants生产车间一览 (26)7.8 List of Production Equipment 生产设备一览 (29)7.9 Process Flow Diagram 工艺流程图 (33)7.10 CPP Identification CPP确认 (34)7.11 Validation Plan验证计划 (49)8.Validation prerequisite验证先决条件 (51)8.1 Personal Identification人员确认 (51)8.2 Process Documentation Verification 生产文件确认 (51)8.3 Training Verification 培训确认 (52)8.4 System and Equipment Instruments Calibration Verification 系统和设备仪表校验确认.. 528.5 System and Equipment Instruments Calibration Verification 生产相关验证状态确认 (53)8.6 Test Instruments Calibration Verification 测试仪器和仪表校验确认 (53)8.7 Testing Method Validation Verification检验方法验证的确认 (54)8.8 Raw Material and Excipient Verification原辅料确认 (54)9.Sampling Plan and Evaluation Criteria取样计划及评估标准 (56)10.Sample Coding Method样品编码原则 (70)11.Process Validation Test Execution 工艺验证执行 (72)11.1 Liquid Preparation 液体配制 (72)11.2 Cell Resurrection and Passage细胞复苏及传代 (74)11.3 Harvest liquid test 收获液检测 (81)11.4 Clarification Filtration Efficacy Test 澄清过滤效果检测 (83)11.5 UF Concentration 1 Efficacy Test超滤浓缩1效果检测 (83)11.6 Ammonium sulfate precipitation efficacy test 硫酸铵沉淀效果检测 (84)11.7 Potassium bromide extraction efficacy test 溴化钾提取效果检测 (85)11.8 First density gradient centrifugation efficacy test 一次密度梯度离心效果检测 (86)11.9 Second density gradient centrifugation efficacy test 二次密度梯度离心效果检测 (87)11.10 UF Concentration 2 Efficacy Test 超滤浓缩2效果检测 (88)11.11 Chromatography purification product test 层析纯化产物检测 (90)12.Bulk Determination原液检验 (92)13.Process Validation Summarization工艺验证总结 (93)14.PV Report工艺验证报告 (94)14.1 Process Validation Report 工艺验证报告 (94)14.2 Process Validation Analysis and Evaluation 工艺验证分析与评价 (94)15.Requirements on Execution Records 执行记录要求 (95)16.Deviation Handling 偏差处理 (95)17.Change Handling 变更处理 (95)18.Test Form测试表 (96)表格1 缩略语 (9)表格2原辅料质量标准表 (11)表格3物料消耗表1 (21)表格4物料消耗表2 (21)表格5所用液体配料表 (22)表格6生产车间一览表 (26)表格7主要生产设备一览表 (29)表格8工艺风险分析表 (33)表格9工艺时间表 (49)表格10取样计划表 (56)表格11样品编码原则 (70)表格12配液取样检测信息表 (72)表格13复苏和传代取样表 (74)表格14复苏和传代样品编码 (80)表格15收获液标准 (81)表格16澄清过滤标准 (83)表格17超滤浓缩1标准 (83)表格18硫酸铵沉淀标准 (85)表格19溴化钾提取标准 (86)表格20一次密度梯度离心标准 (87)表格21二次密度梯度离心标准 (88)表格22超滤浓缩2标准 (89)表格23纯化产物标准 (90)表格24原液标准 (92)表格25测试表列表 (96)1. Purpose目的This purpose of this process validation is to provide documented evidence to show that the combination of the personnel, materials, equipment, methods, environmental conditions and the other related utilities XXX Co., LTD (XXX) can ensure the consistent production of products conforming to the enterprise internal standards and the national standards, and the processes are reliable and conforming to the GMP requirements. The process validation and the test results are to be documented based on this validation protocol.本工艺验证用于提供文件化的证据,证明XXX疫苗一室生产XXX原液的人员、材料、设备、方法、环境条件以及其它有关公用设施的组合可以始终如一的生产出符合企业内控标准及国家法定标准的产品,工艺稳定可靠,符合GMP要求,工艺验证的过程和检查的结果将按照该验证方案进行记录。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
模版 3 :产品工艺验证审计
编写说明:
1. 本模板适用于药品生产企业工艺验证的审计。
2. 建议企业每年对每个剂型至少抽取1-2 个风险性较高的品种按照本模板进行工艺验证
审计。
3. 一份记录表格仅适用于一个产品的审计。
4. 所有品种的审计出具一份审计报告。
5. 审计结论应能够反映出企业工艺验证的整体状况,并给予明确的结论。
基本信息
审计对象:
剂型名称规格
审计日期:
审计小组人员组成:
姓名:部门
审计主要内容清单:
1、产品情况
2、质量标准情况
3、验证方案和报告
4、验证记录
5、检验结果
6、再验证
其它:______________
审计结论:
经对上述内容进行审查,该产品工艺验证
一、基本情况简介
二、主要问题及其风险评估
主要问题:
经过对上述问题的综合评估,本企业的质量部门在质量管理体系以及对产品的质量和安全方面存在风险如下:
三、整改建议和跟踪检查结果
包括对存在问题的整改建议、整改时限建议,跟踪检查等内容
四、审计小组成员签字。
