第7章_卤代烃[1]1
第七章 卤代烃 亲核取代反应

CH3CH2CH2CH3
n-C8H17Br + LiAlH4
O
C8H18
第四节 亲核取代反应和消除反应机理
一 亲核取代反应机理 (一)双分子亲核取代反应(SN2)机理
以 CH3Br NaOH-H2O CH3OH + Br- 为例: 反应速率方程: v=k[CH3Br][OH-]
反应机理:
HH HHOO ++ HH CC BBrr
(三)单分子亲核取代反应(SN1)
CH3 CH3 C Br + OH-
CH3
CH3 CH3 C OH + Br-
CH3
V = K (CH3)3 C - Br
第一步:
(H3C)3C Br
第二步:
(CH3)3C+ + OH-
δ+ δ -
(H3C)3C Br
δ+ δ(H3C)3C OH
(CH3)3C+ + Br- 慢
绝对乙醚——无水、无乙醇的乙醚。
RMgX + O2
RMgX+ CO2
ROMgX H2O ROH
RCOOMgX H2O RCOOH H
HHOOHH RR′-′-OOHH
OOHH RR--HH ++ MMgg
XX OORR RR--HH ++ MMgg XX
RRMMggXX ++
RR′C′COOOOHH RR--HH ++ MMgg OOCCOORR′′ XX
第七章 卤代烷 亲核取代反应
第一节 结构、分类和命名
一、结构
X
C
X=F,Cl,Br,I
第七章 卤代烃 相转移催化反应

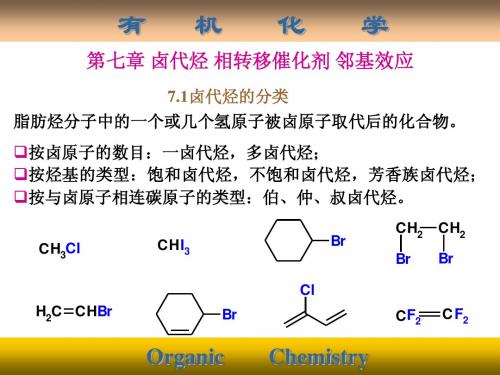
第七章 卤代烃 相转移催化反应邻基效应(一) 写出下列分子式所代表的所有同分异构体,并用系统命名法命名。
(1)C 5H 11Cl (并指出1°,2°,3°卤代烷) (2)C 4H 8Br 2 (3) C 8H 10Cl 解:(1) C 5H 11Cl 共有8个同分异构体:1-氯戊烷 CH 3CH 2CH 2CH 2CH 2ClCH 3CH 2CH 2CHCH 3Cl 2-氯戊烷CH 3CH 2CHCH 2CH 3ClCH 3CHCH 2CH 2ClCH 3CH 3CHCHCH 33ClCH 3CCH 2CH 33Cl CH 3CH 22Cl CH 3CH 3C CH 2ClCH 333-氯戊烷3-甲基-1-氯丁烷3-甲基-2-氯丁烷2-甲基-2-氯丁烷2-甲基-1-氯丁烷2,2-二甲基-1-氯丙烷o(1 )o(1 )o(1 )o(1 )o(2 )o(2 )o(2 )o(3 )(2) C 4H 8Br 2共有9个同分异构体:CH 3CH 2CH 2CHBr 2CH 3CH 2CHCH 2BrBrCH 3CHCH 2CH 2BrBrCH 2CH 2CH 2CH 2Br CH 3CH 2CCH 3BrCH 3CHCHCH 3BrBr (CH 3)22BrBr (CH 3)2CHCHBr 2BrCH 22BrCH 31,1-二溴丁烷1,2-二溴丁烷1,3-二溴丁烷1,4-二溴丁烷2,2-二溴丁烷2,3-二溴丁烷2-甲基-1,2-二溴丙烷2-甲基-1,1-二溴丙烷2-甲基-1,3-二溴丙烷(3) C 8H 10Cl 共有14个同分异构体:1-苯-2-氯乙烷1-苯-1-氯乙烷CH 2CH 2Cl CHCH 3Cl CH 32Cl CH 3CH 2ClCH 3CH 2Clo-甲基苯氯甲烷m-甲基苯氯甲烷p-甲基苯氯甲烷CH 2CH 3ClCH 3CH 3ClCH 2CH 3ClCH 2CH 3Cl CH 3CH 3Clp-氯乙苯o-氯乙苯m-氯乙苯3-氯-1,2-二甲苯4-氯-1,2-二甲苯CH 3CH 3ClCH 33ClCH 3CH 3Cl CH 3CH 3Cl5-氯-1,3-二甲苯2-氯-1,3-二甲苯4-氯-1,3-二甲苯2-氯-1,4-二甲苯(二) 用系统命名法命名下列化合物。
第7章 卤代烃-SN1、SN2亲核取代

带部分正电荷,易 被带负电荷或带孤 对电子的分子进攻
(一)亲核取代反应 SN
Nucleophilic substitution
δδδ+
δδ+
δ+
δ-
CH3
Substrate
CH2
CH2 Nu:
Cl
Cl-
Leaving group 离去基团
底物
特点:
Nucleophile
亲核试剂
带负电荷或 孤对电子
诱导效应可沿共价键在碳链上传递,随着距离的增加
而迅速减弱,一般通过三根单键以后,已基本消失 。
与C-H键相比
H H
Cg
ddd+
H
C
b
dd+
H C
d+
a
Cl
极性共价键
d-
H
H
H
三、化学性质
诱导效应,易 断裂,“消除” d+ d- X吸电子,且C-X键键 能较小(C-F除外), 易断裂,且生成的X-更 稳定。X被“取代”
CH2
CH
CH 2Cl
3-氯-1-丙烯
CH2
CH
CH
CH3
CH2 Cl
3-甲基- 4 -氯-1-丁烯
二、结构(structure)
卤代烷中所有的键都是 σ 键,碳原子为 sp3 杂化, C-X 共价键为极性键。
H
H
ห้องสมุดไป่ตู้
d+
C
d-
X
C-F 139pm
C-H 110pm
H
C-Cl 176pm
C-Br 194pm C-I 214pm
C
O-
• 5)中心原子为同种元素,受溶剂影响较大
高鸿宾《有机化学》(第4版)章节题库题-卤代烃 相转移催化反应 临基效应(圣才出品)

第7章卤代烃相转移催化反应临基效应1.下面所列的每对亲核取代反应中,哪一个反应更快,请解释原因。
解:(1)第一个反应更快,因为三级卤代烃比一级卤代烃更易生成稳定的碳正离子。
(2)第一个反应更快,因为一级卤代烃的空间位阻比二级卤代烃的空间位阻小。
(3)第一个反应更快,因为比的亲核性更强。
(4)第一个反应更快,因为硫的亲核性比氮强。
(5)第一个反应更快,因为比更易离去。
(6)第二个反应更快,因为偶极非质子溶剂对反应更有利。
2.芥子气是一种由环氧乙烷及H2S等合成得到的糜烂性毒剂,其主要特征是使人体内一些重要的代谢酶烷基化而失活,从而破坏细胞,造成糜烂。
(1)请解释该毒剂极易使酶烷基化的原因(提示:将酶结构简化为酶-NH2);(2)使用某些漂白剂(如NaOC1)能使芥子气失活,请解释其原因。
解:(1)致毒机理:(2)使芥子气失活机理:3.完成下列反应式,并写出反应机理。
解:反应物是叔氯代环烷,且进行水解反应,即试剂是弱地亲核试剂也是弱碱,因此反应按S N1机理进行。
所得产物是由两个构型相反的化合物组成的外消旋体。
首先是反应物的C—Cl键进行异裂,生成碳正离子中间体,由于带正电荷的碳原子是平面构型,H2O可从平面的两边机会均等地进攻带正电荷的碳原子,生成两种构型相反的醇。
(1)指H2O从带正电荷的碳原子所在平面的前方进攻,得到的产物是(I);(2)指H2O从带正电荷的碳原子所在平面的后方进攻,得到的产物是(Ⅱ)。
4.比较下列各组中两个反应的速率大小,并阐明理由。
解:(1)第二个反应比第一个反应快,因为的亲核性比大。
(2)第二个反应比第一个反应快,因为的亲核性比大。
5.乙烯基环丙烷溴化至少快于1-己烯的溴化300倍。
相反地,这两个烯对芳基硫卤的反应速度是相似的(乙烯基环丙烷仅快2倍)。
能否解释这种差异?反应数据能告诉我们关于产物的结构吗?解:乙烯基环丙烷及溴化1-已烯的反应历程如下:从反应历程可以看出,乙烯基环丙烷与溴反应,形成一个开链的碳正离子,这个碳正离子与环丙基发生共振,因此具有特殊的稳定性。
第七章卤代烃

CH3CH2OH + HBr
在一般情况下,此反应很慢。为增大反应速率,提高醇的产 率,常加入强碱(氢氧化钠),使生成的HX与强碱反应,可 加速反应并提高了醇的产率。
CH3CH2Br + NaOH
CH3CH2OH + NaBr
• 此反应工业用途不大,因卤烷在工业上是由醇制取,但可用 于有机合成中官能团的转化。用于复杂分子中引入羟基(先 卤代,再水解)。
醇 R-X + AgNO3
R-O NO2 + AgX 硝酸酯
反应通式如下:
R - L + :Nu RCH2X + -OH 反应物 亲核试剂 (底物) 进攻基团
R - Nu + L-
RCH2-OH + X-
产物
离去基团
1. 卤烃的水解
• 卤代烷与水作用,水解为醇,反应是可逆反应。如:
CH3CH2Br + H2O
• 查依采夫规则: • 卤代烷脱HX时,总是从含H较少的碳上脱去H原子。
Saytzeff规则应用
CH3
CH3
KOH / 醇
CH3 CH C CH2
CH3 CH C CH3 71%
CH3
H Br H
CH3 CH2 C CH2 29%
• Saytzeff规则的实质上是生成一个较稳定的烯烃。
• 总是要生成共轭效果较好的结构(较稳定)。如:
•而仲卤烃和叔卤烃在碱(氰化钠、氰化钾)的作用
下易发生消除反应,生成烯烃,此反应一般不用仲、 叔卤烃反应。
•产物腈还可转化为胺、酰胺和羧酸。
4. 卤烃的氨解
• 此反应既可用氨反应,也可用氨的衍生物反应,来 制取伯、仲、叔胺。
有机化学-卤代烃

(4)被硝酸根取代
RX + AAgg+NOONO32— 醇
R ONO2 + AgX
硝酸酯
•卤化银沉淀产生,反应可作为卤代烃的鉴别反应。
卤代烃反应活性: 烯丙基卤>叔卤代烃>仲~>伯~
(5)卤素交换
丙酮
R-Br(Cl) + KI
R-I + NaBr(Cl)
难溶于丙酮
难溶于丙酮
(6)被氨基(-NH2)取代
三、命名
普通命名法 俗名 系统命名法
1.普通命名法
在烃基名称之前(或后)加上卤素的名 称,称为卤(代)某烃或某烃基卤。
CHCl3
三氯甲烷 氯 仿 (俗名)
C2H5Cl
氯乙烷 乙基氯
(CH3)3CBr
叔丁基溴
CH2=CHBr 溴乙烯
H2C CH CH2 烯丙基溴
Br
Br
溴苯
CH3
Br
邻-溴甲苯(2-溴甲苯) 2-bromotoluene
3-甲基-5-氯庚烷 3-chloro-5-methylheptane
H2C C CH3
Cl
2-氯丙烯 2-chloro-propene
CH3CH CHCH2Cl
1-氯-2-丁烯 1-chloro-2-butene
H37C
CH
6
CH
5
C4H2
CH
3
CH
2
C1H3
CH3 I
Cl CH3
2,6-二甲基-3-氯-5-碘庚烷
•(一) 亲核试剂:具有孤对电子的物质, 能与底物中带部分正电荷的碳发生反应, 这 种 物 质 称 为 亲 核 试 剂 。 ( 也 是 Lewis 碱)。
第5章卤代烃
+ 4 Cl2 350 - 400
0
C
CCl4
+ 4
HCl
O
Br
+
CH3
NBr
(NBS) O CH2Cl
+
Cl2
500~530 0C
Organic
Chemistry
有
7.3.2不饱和烃制备 不饱和烃制备 与卤化氢或卤素加成
机
CH2=CH2 CH CH
+ +
化
Br2 HCl HgCl2
学
CH2Br
叔卤代烃 > 仲卤代烃 > 伯卤代烃
Organic
Chemistry
有
7.5.2消除反应 消除反应
机
化
学
消除反应:有机分子中脱去一个简单分子的反应。 消除反应:有机分子中脱去一个简单分子的反应。
R CH CH2 KOH EtOH R CH CH2
例如: 例如:
CH3CH2CH2CHCH3 Br
H
KOH EtOH
Organic
Chemistry
有
机
化
学
7.4 卤代烷的物理性质 室温下,氟甲烷、氯甲烷、溴甲烷、氟乙烷、氯乙烷、 室温下 ,氟甲烷 、 氯甲烷 、 溴甲烷 、 氟乙烷 、 氯乙烷、 氟丙烷是气体,其余为液体。 氟丙烷是气体 , 其余为液体 。 卤代烷在铜丝上燃烧时 产生绿色火焰。 产生绿色火焰。 沸点高于相应的烷烃. 沸点高于相应的烷烃. 烃基相同的卤代烃的沸点: 烃基相同的卤代烃的沸点: 碘代烃>溴代烃>氯代烃>氟代烃, 碘代烃>溴代烃>氯代烃>氟代烃, 异构体中,支链越多,沸点越低。 异构体中,支链越多,沸点越低。
卤代烃课件

二、溴乙烷的结构和性质
酸性KMnO4溶液褪色能否说明生成了乙烯? 生成的气体通入高锰酸钾溶液之前可先通入盛水的试管。
二、溴乙烷的结构和性质
【实验讨论】溴乙烷与氢氧化钠的醇溶液的反应实验:
(1)为什么要在气体通入KMnO4酸性溶液前加一个盛有水的试管?起什么作用? (2)除KMnO4酸性溶液外还可以用什么方法检验乙烯?实验3还有必要将气体先通入水中吗?
课堂练习
1. 在实验室要分别鉴定氯酸钾晶体和1-氯丙烷中的氯元素,设计了下列实验操作 步骤:
① 滴加AgNO3溶液 ② 加入NaOH溶液 ③ 加热 ④ 加催化剂MnO2 ⑤ 加蒸馏水过滤后取滤液 ⑥ 过滤后取滤渣 ⑦ 用HNO3酸化 ⑴ 鉴定氯酸钾中氯元素的操作步骤是 __④_③__⑤__⑦__①___ ⑵ 鉴定1-氯丙烷中氯元素的操作步骤是 __②_③__⑦__①____
消去反应 CH3CH2Br NaOH醇溶液,加热 CH2=CH2、NaBr、H2O
同种反应物,反应条件不同,发生的反应不同,产物不同。
【规律】无醇成醇,有醇成烯。
二、溴乙烷的结构和性质
2.下列化合物在一定条件下,既能发生消去反应,又能发生水解反应的是:
CH3Cl (CH3)3CCH2Cl
CCll
CH3CHBrCH3 (CH3)3CCl
CHH22BBr r
CHCl2CHBr2 HCH2Br
【结论】所有的卤代烃都能发生水解反应,但卤代烃中无相邻C或相邻C上无H的不能发生消去反应。
三、卤代烃的用途
1、喷雾推进器
使油漆、杀虫剂或化妆品加压易液化,减压易汽化
2、冷冻剂
氟利昂加压易液化,无味无臭,对金属无腐蚀性。当它汽化时吸收大量的热而令环境冷却
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例外:卤代烯烃或β-碳上连有苯环的卤代烃进行消除反应时,倾向于生成稳定的共轭二烯烃。
幻灯片18
3.与金属反应
(1)与金属钠反应(武慈反应)
2
可用于制备含有偶数碳的对称的烷烃。
幻灯片19
(2)与金属镁反应
幻灯片20
幻灯片21
【问题7–3】
1.用化学方法鉴别下列化合物:
CH3CH2CH2Br、(CH3)3CBr、CH2=CHCH2Br、CH3CH=CHBr
(4) NaCN/H2O-CH3CH2OH
(5)NaI/丙酮
(6)NH3
R-O-CH2CH3
R-OH
R-ONO2 + AgBr
R-CN
R-I
R-NH2
幻灯片14
2. 用化学方法鉴别:
(1) 环己烷、环己烯、溴代环己烷、3–溴环己烯
(2) 3–溴–2–戊烯、4–溴–2–戊烯、5–溴–2–戊烯
幻灯片15
碱性越弱,浓度越低,亲核性越弱,越有利于取代反应。
(3)溶剂的极性
溶剂的极性越小,越有利于消除反应。
溶剂的极性越大,越有利于取代反应;
(4)反应温度
升高温度有利于消除反应。
幻灯片38
【问题7–4】
1.按SN1反应排列下列化合物的活性次序:
(1)2–甲基–1–溴丁烷、2–甲基–2–溴丁烷、3–甲基–2–溴丁烷
碳正离子稳定性顺序:
R3C+>R2CH+>RCH2 +>CH3+
SN1活泼性:烯丙基型、苄基型卤代烃>R3C—X>R2CH—X>RCH2—X>CH3—X>乙烯型卤代烃和卤苯
卤代烃的卤素不同,进行SN1反应的活性不同:RI>RBr>RCl>RF
幻灯片26
进行SN1反应,可生成一对对应异构体。
SN1反应的立体化学特征之一:产物外消旋化。
2.写出下列反应的主要产物:
幻灯片22
3. 利用格氏试剂由溴丁烷合成2–甲基丁酸。
幻灯片23
第三节卤代烃的亲核取代反应和消除反应机理
1.亲核取代反应机理(以卤代烃水解为例)
v= k1c[(CH3)3CBr]
SN1反应是分两步完成的。
幻灯片24
第一步:碳正离子的生成
第二步:亲核试剂进攻碳正离子
幻灯片25
SN2反应的特点:亲核试剂从C―X键的背后接近反应中心碳原子的。
结论:空间位阻越大,反应速率越小。
幻灯片30
SN2活泼性:烯丙基型、苄基型卤代烃>CH3-X>RCH2-X>R2CH-X>R3C-X>乙烯型卤代烃和卤苯
构型翻转(产物的构型与底物的构型相反——瓦尔登Walden转化)。
R
S
幻灯片31
(1)单分子消除反应历程(E1)
幻灯片40
烯丙基型卤代烃和苄基型卤代烃按SN2历程进行反应,双键的π轨道与正在形成和断裂的键轨道从侧面相互交盖,使过渡状态的负电荷更加分散,过渡状态能量降低而容易生成,从而也有利于SN2反应的进行。
幻灯片41
2.一级、二级、三级卤代烃
反应活性:
SN1反应:3°卤代烃>2°卤代烃>1°卤代烃
SN2反应:1°卤代烃>2°卤代烃>3°卤代烃
幻灯片5
2.系统命名法
(1)卤代饱和烷烃:选择最长碳链作为主链,把卤素原子当作取代基,烃当作母体来命名。从靠近取代基的一端将主链碳原子依次编号。
幻灯片6
(2)不饱和卤代烃:选取含不饱和键和卤素的最长碳链为主链,编号要使双键和三键的位次最小
1 2 3 4
1 2 3
3-甲基-4-氯-1-丁烯
1-溴丙烯
幻灯片7
幻灯片11
水解
还原
RCN
RCH2NH2
RCOOH
幻灯片12
卤代烃与硝酸银的醇溶液反应,卤原子被取代并生成卤化银沉淀,可用于鉴别卤代烃。
幻灯片13
【问题7–2 】
1. 写出异丁基溴和溴代环己烷分别与下列试剂反应时的主要产物:
(1) CH3CH2ONa/CH3CH2OH
(2) KOH/H2O
(3)AgNO3/CH3CH2OH
叔丁基溴在碱性溶液中发生的消除反应:
幻灯片32
E1反应也常发生重排反应:
幻灯片33
(2)双分子消除反应历程(E2)
幻灯片34
E2消除立体特征:反式消除
幻灯片35
(3)消除反应的取向:Saytzeff(扎依采夫)规则
幻灯片36
3.消除反应与亲核取代反应的竞争
(1)卤代烃的结构
伯卤代烷容易进行SN2反应,
SN1反应的特征之二:有重排产物生成
幻灯片27
因SN1反应经过碳正离子中间ቤተ መጻሕፍቲ ባይዱ,会发生分子重排生成一个较稳定碳正离子。
幻灯片28
(2)双分子亲核取代( SN 2)反应机理
动力学研究表明:有一类亲核取代反应的速率与底物的浓度和试剂的浓度同时相关:
其反应机理为(以溴甲烷水解为例):
幻灯片29
在SN2(Nu-从离去基团L的背面进攻反应中心)
2.消除反应
有机物分子中相邻两个碳上脱去一个小分子(HX、H2O等)而形成双键的反应。
通常情况下,叔卤代烃最容易消去卤化氢,伯卤代烃最难。
卤代烃中含有多种β-氢原子时,反应可以按两种方向进行:
幻灯片16
不对称卤代烃消去反应,产物主要是双键碳原子上取代基最多的烯烃,或消除含氢比较少的碳原子上的氢原子,--------------查依采夫规则
在强碱条件下;β-氢原子酸性增加(如烯丙氢、苄基氢),有利于E2反应。消除反应进行的较少
叔卤代烷一般容易发生SN1和E1反应,得到两种反应产物的混合物,但有强碱存在时,主要发生E2反应。
仲卤代烃处于伯卤代烃和叔卤代烃之间,情况比较复杂,实验条件不同,反应不同。
幻灯片37
(2)试剂的亲核性
试剂的碱性越强,浓度越大,亲核性越强,体积越大,越有利于消除反应;
(2)氯乙烷、溴乙烷、碘乙烷
2.按SN2反应排列下列化合物的活性次序:
(1)1–溴丁烷、2–甲基–2–溴丁烷、2–溴丁烷(2)苄基溴、叔丁基溴、溴乙烷、乙烯基溴
幻灯片39
第四节卤代烃化学结构与化学活性的关系
卤原子原子易离解下来,形成p-π共轭体系的碳正离子,正电荷得到分散,使体系趋于稳定,因此有利于SN1的进行。
结构分析:
①取代反应
③与金属反应
②消除反应
幻灯片10
1. 亲核取代反应
:Nu——亲核试剂。由亲核试剂进攻引起的取代反应称为亲核取代反应(用SN表示:Nucleophilic Substitution Reaction)。
亲核试剂(Nu):带负电荷的离子或带未共用电子对的中性分子,如HO-、RO-、-CN、NH3等。
幻灯片1
第七章 卤代烃
halohydrocarbon
幻灯片2
第一节 卤代烃的分类
和命名
幻灯片3
一、卤代烃分类
氟代烃
饱和卤代烃
氯代烃
不饱和卤代烃
溴代烃
卤代芳烃
碘代烃
伯卤代烃
仲卤代烃
一卤代烃
二卤代烃
叔卤代烃
多卤代烃
甲基卤代烃
幻灯片4
(二)命名
1.普通命名法:以分子中与卤素相连的烃基为母体,卤素为取代基,称为卤代某烃或某基卤。
与AgNO3的醇溶液反应:
3°卤代烃室温生成↓,而1°2°l卤代烃需要加热才能生成↓。
幻灯片42
3.乙烯型卤代烃和卤苯
由于p-π共扼的存在,使得这种结构比较稳定,在加热条件下也不与AgNO3的醇溶液反应。
幻灯片43
所以,各种卤代烃的活性顺序:
>
>
(3)卤代芳烃:
以芳环作为母体,卤原子作为取代基。
2-氯甲苯
2,4-二溴甲苯
(4)多卤代烃则按F、Cl、Br、I的顺序命名。
幻灯片8
【问题7-1】
2.命名下列化合物或写出结构式:
(3) 2-甲基-3-溴丁烷
(4) 2-溴-1-己烯-4-炔
(5) 6-甲基-3-溴二环[3.1.1]庚烷
幻灯片9
第二节卤代烃的化学性质
