的空间构型
一些典型分子的空间构型

杂化轨道间夹角 ,其中有 个杂化轨道上已有成对电
子,另外 个轨道的未成对电子可以与氢原子的1s电子
配对成键,且孤电子对对成键电子对起排斥作用,所以氨
气呈
形。
sp2杂化
激发
Sp2杂化
重叠
形成3个(sp2-p) σ键 BF3分子形成过程
BF3分子形成过程
F
F
B
F
➢sp2杂化轨道示意图 ➢BF3分子的结构示意图
氮气
氧气
32页 二氧化碳
结构式
路易斯结构式
一、共价键 2、共价键的类型及形成
(1)σ键与Π键
氯元素基态原子电子排布式: 价电子轨道表示式:
(1)σ键的形成: 氢原子形成氢分子的电子云描述
H
H
H
H
σ键
s-sσ键
H Cl
H-Cl
Cl
H-Cl的s-pσ键的形成
Cl
Cl
Cl
Cl-Cl的p-pσ键的形成
б键的种类: 根据形成б键的轨道不同可分为 S—Sб键、S—Pб键、P—Pб键等。
(2) Π键的形成: p-pπ键的形成
(1)σ键的形成:
1S 互相靠拢 1S
电子云重叠
H—H共价键
б键的特征:
σ键的特征:以形成化学键的两原子核的连线 为轴作旋转操作,共价键电子云的图形不变, 这种特征称为轴对称。(可以旋转)
0.120nm
CC
H
180° 0.106nm
两个碳原子的sp1杂化轨道沿各自对称轴形成sp1— sp1 键,
另两个sp1杂化轨道分别与两个氢原子的1s轨道重叠形成两
个sp1—s 键,两个py轨道和两个pz轨道分别从侧面相互重 叠,形成两个相互垂直的p—p键,形成乙炔分子。
配合物结构的空间构型
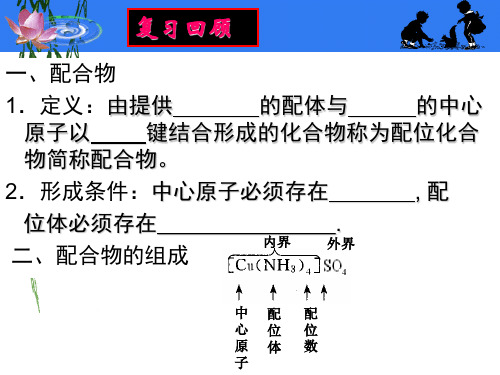
易与
Mn+结合.如NH3>
3. 形成配合物后,颜色、溶解性、酸碱性、氧化
还原性等都有可能发生改变。
3 正三角形
4 正四面体型
4 平面四边型
5 三角双锥体
5 四方锥体
6
八面体
6
八面体
通式
ML2±
ML3± ML4± ML4± ML5± ML5± ML6± ML6±
实例
[Ag(NH3)2]+
[HgI3][Zn(NH3)4]2+ [Pb(CN)4]2-
PF5 SbF52AlF63[Fe(CN)6]3-
新课讲述
学生练习
1.AgCl不溶于水,不溶于硝酸,但溶于氨 水。写出离子方程式。
AgCl+2NH3·H2O=[Ag(NH3)2]2++2Cl-
+H2O
2.Cu(OH)2和NH
是弱碱,
3
混合后碱
性怎
样变化?写出离子方程式。
Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH碱性增强。
新课总结
三、配合物的空间构型
形成条件:两种或两种以上配位体。
交流与讨论
四、配合物的同分异构现象
几何异构
交 流 与 1. 怎样判断顺式和反式? 讨 论 2. Pt(NH3)2Cl2顺式和反式性质有何差异?
新课讲述
Pt(NH3)2Cl2顺反异构体的性质差异.并完成下表.
配合物 顺式 反式
结构式
Cl Cl
Pt
NH3 NH3
Cl
➢解: 分别取二种溶液少许,向其中分别滴 加 S显O现B4a有象Cl白,2溶色说液沉明稀淀它硝生们酸成虽,,然其C化中o学S[OC式4o(相NBHr同3()N,5]HB但3r)结无5] 构明 不同,因此互为同分异构体。
分子的空间构型(课件PPT)

为平面正三角形。
BF3分子形成
2s
2p
激发 2s
2p
正三角形
B的基态
激发态
F
B
120°
F
F
sp2 杂化态
碳的sp2杂化轨道
sp2 杂 化 : 三 个 夹 角 为 120° 的 平 面 三 角 形 杂 化轨道。
等性sp 杂化
同一原子中 ns-np 杂化成新轨道:一个 s 轨道和一个 p 轨 道杂化组合成两个新的 sp 杂化轨道。
4、教学必须从学习者已有的经验开始。——杜威 5、构成我们学习最大障碍的是已知的东西,而不是未知的东西。——贝尔纳 6、学习要注意到细处,不是粗枝大叶的,这样可以逐步学习摸索,找到客观规律。——徐特立 7、学习文学而懒于记诵是不成的,特别是诗。一个高中文科的学生,与其囫囵吞枣或走马观花地读十部诗集,不如仔仔细细地背诵三百首诗。——朱自清 8、一般青年的任务,尤其是共产主义青年团及其他一切组织的任务,可以用一句话来表示,就是要学习。——列宁 9、学习和研究好比爬梯子,要一步一步地往上爬,企图一脚跨上四五步,平地登天,那就必须会摔跤了。——华罗庚 10、儿童的心灵是敏感的,它是为着接受一切好的东西而敞开的。如果教师诱导儿童学习好榜样,鼓励仿效一切好的行为,那末,儿童身上的所有缺点就会没有痛苦和创伤地不觉得难受地逐渐消失。——苏霍姆林斯基
BeCl2分子形成
2p 2s
2p 2s
激发
直线形 杂化
Be基态
Cl
180
Be Cl
激发态
键合
sp杂化态 直线形
化合态
碳的sp杂化轨道
sp 杂 化 : 夹 角 为 180° 的直线形杂化轨道。
化学物质的空间构型

化学物质的空间构型在化学领域中,物质的空间构型是指分子中原子的排列方式和相互之间的空间关系。
了解和研究化学物质的空间构型对于理解分子性质、反应机理以及药物合成等方面具有重要意义。
本文将介绍几种常见的化学物质的空间构型及其相关概念。
一、线性构型线性构型是指分子中的原子沿着一条直线排列的方式。
典型的例子是氮气(N2)分子。
在氮气分子中,两个氮原子通过三重键连接,并且在同一条直线上排列。
除了氮气,一些其他的双原子分子,如氧气(O2)和碘气(I2)等,也具有线性构型。
二、平面构型平面构型是指分子中的原子排列在同一个平面内。
一个典型的例子是二氧化碳(CO2)分子。
在二氧化碳中,一个碳原子与两个氧原子通过双键连接,三个原子排列在一个平面上。
此外,苯分子(C6H6)也具有平面构型。
三、三角锥构型三角锥构型是指四个原子通过共享键排列成三角锥形状。
一个典型的例子是氨(NH3)分子。
在氨分子中,一个氮原子与三个氢原子通过共价键连接,氢原子排列在氮原子的周围形成三角锥形状。
四、四面体构型四面体构型是指五个原子通过共享键排列成四面体形状。
一个典型的例子是甲烷(CH4)分子。
在甲烷中,一个碳原子与四个氢原子通过共价键连接,氢原子均匀分布在碳原子的周围,形成一个四面体。
五、八面体构型八面体构型是指六个原子通过共享键排列成八面体形状。
一个典型的例子是硫酸(H2SO4)分子。
在硫酸中,一个硫原子与四个氧原子和两个氢原子通过共价键连接,形成一个八面体。
值得注意的是,以上所介绍的仅仅是化学物质的一些常见空间构型。
实际上,由于原子之间的各种相互作用,化学物质的空间构型有时会变得复杂和多样化。
通过实验技术,如X射线衍射和核磁共振,可以精确确定并确定化学物质的空间构型。
总结起来,化学物质的空间构型对于理解分子结构和性质具有重要作用。
通过研究和掌握不同构型的特点和性质,我们可以更好地理解化学反应的本质,并为药物合成和材料设计等领域的研究提供指导。
分子结构的空间构型和性质

分子结构的空间构型和性质分子结构的空间构型是指分子中各个原子之间的排列方式和相对位置。
这种空间构型决定了分子的性质。
对于有机化合物和生物分子等大分子化合物,它们的空间构型尤为重要。
例如,蛋白质的结构决定了它的功能,而类固醇分子的空间构型也极大地影响了它的生物活性。
因此,对于化学家来说,深入了解分子结构的空间构型和性质是非常必要的。
分子的空间构型通常可以用分子模型来表示,分子模型可以是立体模型、分子球棍模型或者电子云模型。
其中,立体模型最能反映分子的三维结构,即原子之间的空间关系,而分子球棍模型主要用于直观地表示分子中各个原子的种类、数量和化学键。
电子云模型则通常用于描述分子中电子云的密度分布和化学键的性质。
当我们了解了分子的空间构型后,就可以进一步探讨分子的性质。
分子的性质包括化学性质和物理性质。
化学性质指的是分子在不同环境下的化学反应,而物理性质则包括分子的热力学性质和物理学性质等。
分子的空间构型决定了化学反应的发生方式和速度。
例如,不对称的分子更容易参与立体选择性反应,因为反应的发生取决于反应物之间的空间安排。
另外,分子的空间构型也会影响分子的手性。
手性指的是分子的镜面对称性,对称的手性分子和非对称的手性分子可能会具有完全不同的性质。
例如,抗生素“红霉素”和“克拉霉素”的化学结构几乎相同,但它们的空间构型不同,因此它们的手性也不同。
这意味着它们的生物活性、吸收性和代谢方式等都会有所不同。
此外,分子的空间构型也可以影响分子的热力学性质。
分子的热力学性质是指分子在不同温度和压力下的物理状态和热学性质。
例如,分子的空间构型可以影响分子的熔点和沸点,因为它们决定了分子中的各个原子的相对位置和分子之间的相互作用力。
分子的空间构型还可以影响分子的光学旋光度、溶解度、稳定性以及有机溶剂和水的亲疏性等性质。
总之,分子的空间构型和性质之间存在密切的关系。
了解分子的空间构型可以帮助我们深入了解分子的物理和化学性质,从而实现对分子结构和性质的精确设计和控制。
化学分子的空间构型

化学分子的空间构型在化学领域中,分子的空间构型是指分子中各原子的相对排列方式和空间结构。
分子的空间构型对于分子的性质和反应方式起着重要的影响。
本文将探讨化学分子的空间构型及其影响因素。
一、分子的空间构型概述分子的空间构型包括分子的立体结构和键角(键长和键角度)的排列方式。
分子的立体结构决定了分子的三维形状,而键角则决定了分子中原子的相对位置。
分子的空间构型由化学键的性质和原子间相互作用力所决定。
二、空间构型的影响因素1. 化学键类型:分子中的化学键类型不同,对应的空间构型也会有所不同。
例如,碳原子之间的单键使得分子呈现出线性构型,而双键或三键则会使分子呈现出非线性的形状。
2. 原子尺寸:原子的尺寸决定了分子中原子之间的距离,从而影响分子的空间构型。
较大的原子会使得分子呈现出较离散的构型,而较小的原子则有助于分子形成更紧凑的结构。
3. 电子云的排斥和吸引力:分子中的电子云具有互相排斥的作用,导致分子呈现出一定的空间构型。
同时,电子云也可以被相邻原子的核吸引,从而使分子形成更稳定的构型。
4. 手性性质:手性分子是一种具有非对称的空间构型的分子。
它们的空间构型决定了它们的立体异构体是否对映。
手性分子的手性性质对于化学反应的选择性和生物活性具有重要影响。
三、分子空间构型的应用与研究分子空间构型的研究不仅对于理解物质的性质和反应机理具有重要意义,还广泛应用于以下领域:1. 新药研发:分子的空间构型对于药物的生物活性和效果起着至关重要的作用。
通过研究分子的空间构型,可以设计出更具选择性和效果的药物。
2. 光电器件:分子的空间构型决定了分子的光学和电学性质,对于光电器件的设计与性能提升有着重要影响。
3. 催化剂设计:催化剂的活性和选择性与其空间构型密切相关。
研究催化剂的空间构型有助于设计高效和选择性的催化剂。
4. 有机合成:有机合成中,分子的空间构型决定了反应的发生性和选择性。
研究分子的空间构型有助于有效设计合成路线和合成新的化合物。
的空间构型
的空间构型空间构型是一种由不同空间分量形成的结构,它形象地表现了空间的多样性和复杂性。
它不仅可以用来描述客观事物,也可以用来表达艺术家的情感和动机,使用者可以更好地理解空间的特性,以及它与其它方面之间的联系。
空间构型通常包括空间尺度、深度、变化、节奏、延伸、不同区域、路径等概念,它们按照既定的规则和技巧,结合了几何学的原理,塑造空间的形态。
空间尺度指的是空间的大小范围,它可以确定空间的最小块、细节和大范围的关系。
它的实现通常靠单位尺度的应用、线性规律和形体的调节等方法。
深度是指空间的另一个构成要素,它提供了空间的维度感和相对的距离,并且可以建立起空间中不同空间块之间的关联。
深度的实现,主要通过横截面的变化、背景和前景的排列等手段,增加空间的可视性。
变化是指空间构型中物体的改变,它可以改变物体的形状、位置、大小等,并可以通过渐变、叠加多层、正交和曲线等方式实现。
变化的实现,可以增强空间的活力,并且可以营造出意想不到的空间效果。
节奏是指空间中物体的变化规律,它指的是空间的地貌和景观,它可以给观者以宁静或活力的感受,从而营造出特有的气氛。
延伸是指空间的水平拓展,它可以通过拓展的空间分区或者改变空间比例实现。
延伸的实现可以给观者带来更加深远的感受,从而改变他们对空间的感知。
不同区域指的是空间中起到重要作用的区域,它们可以是有用的功能区,也可以是代表特定功能的象征性区域,其实现可以通过空间的划分、把握重心等方法实现。
路径的概念是指空间中的行走网络,它可以通过简便的曲线、入口等路径网络,给观者以视觉和心理上的指引,从而改变他们对空间的认知。
空间构型是一种表达空间属性的艺术形式,但它也可以用于实用目的,如城市规划、建筑设计、环境艺术等,从而改变空间环境,使得其具有更强的可见性、功能性和可体验性。
因此,空间构型在各种艺术形式和实用目的中都扮演着非常重要的角色,它不仅可以表现出空间的变化,还可以丰富空间的视觉感受,使空间更加有意义和和谐、安全。
分子的空间构型PPT课件
444 233 444 353 346
.
13
价层电子对互斥 (VSEPR)模型:
电子对数
目与立体
结构
2
3
电子对数 目与立体
结构
5.
4
6
14
价层电子对互斥 (VSEPR)模型:
2
3
4
5
6
直线形 平面三角形 正四面体 三角双锥体 正八面体
.
15
中心原子上无孤对电子的分子: VSEPR模型就是其分子的立体结构。
CH2O
BF3
.
21
3、价层电子对数:4 正四面体
CH4
NH3
孤对电 0
1
子对数
H2O 2
正四面体
三角锥形
.
角形
22
NH3 的空间构型
H 2 O 的空间构型
.
23
4、价层电子对数:5 三角双锥
PCl5 SF4
ClF3
I3-
孤对电
子对数 0
1
2
3
三角双锥
变形四面体
.
T形
直线形
24
5、价层电子对数:6 八面体
SF6
孤对电 子对数 0
IF5
ICl4-
1
2
八面体
四方锥形.
平面正方形 25
项目 价层
中心 原子
电子
所含 孤对
分子式
对数
电子 对数
CO2
20
VSEPR模型
价层电 子对的 空间构
型
分子的立体 结构模型
分子 的空 间构 型
直线形
直线形
H2O
42
NH3
分子的对称性和空间构型
分子的对称性和空间构型在化学中,分子的对称性和空间构型是两个重要的概念。
对称性是指分子在一些操作下保持不变的性质,而空间构型则是描述分子中原子的相对位置和排列方式。
这两个概念在研究分子性质和反应机理中起着至关重要的作用。
首先,让我们来探讨分子的对称性。
对称性是指分子在一些操作下保持不变的性质,比如旋转、反射、转动等。
分子的对称性可以通过对称元素来描述,包括轴对称元素和面对称元素。
轴对称元素是指分子中存在一个轴,沿着这个轴旋转分子一定角度后,分子与原来的位置完全重合。
常见的轴对称元素有Cn轴(n为整数)和S2n轴(n为整数)。
面对称元素是指分子中存在一个面,将分子沿着这个面反射后,分子与原来的位置完全重合。
常见的面对称元素有σ面。
对称性对于分子的性质和反应机理的研究非常重要。
对称性可以决定分子的光谱性质、化学反应的速率和选择性等。
例如,分子的对称性可以决定分子的振动光谱中是否存在红外活性峰。
在化学反应中,对称性可以决定反应的速率和反应产物的选择性。
因此,通过对分子的对称性进行研究,可以更好地理解分子的性质和反应机理。
接下来,我们来讨论分子的空间构型。
空间构型是描述分子中原子的相对位置和排列方式的概念。
分子的空间构型可以通过分子的立体结构来描述。
分子的立体结构可以通过实验技术如X射线衍射、核磁共振等确定。
在分子的立体结构中,原子的相对位置和排列方式对于分子的性质和反应机理有着重要的影响。
例如,分子的立体结构可以决定分子的手性性质。
手性分子是指与其镜像不可重叠的分子,具有手性的分子在光学活性、药物作用等方面表现出独特的特性。
此外,分子的立体结构还可以决定分子之间的相互作用,如分子间的氢键、范德华力等。
分子的对称性和空间构型在化学中的应用非常广泛。
在有机化学中,对称性和空间构型的研究可以帮助我们理解有机分子的合成和反应机理。
在无机化学中,对称性和空间构型的研究可以帮助我们理解无机化合物的性质和反应机理。
分子的空间构型
SP3杂化
由1个s轨道和3个p轨道混杂并重新组合成4个能量 与形状完全相同的轨道。由于每个轨道中都含有1/4 的s轨道成分和3/4的p轨道成分,因此我们把这种轨 道称之为 sp3杂化轨道。
为了四个杂化轨道在空间尽可能远离,使轨道间的排 斥最小,四个杂化轨道的伸展方向分别指向正四面体 的四个顶点.
种轨道称之为sp2杂化轨道。
sp2杂化轨道的形成和空间取向示意图
sp2杂化轨道的形成和特点:
由1个s轨道与2个p轨道组合成3个sp2 杂化轨
道的过程称为sp2 杂化。每个sp2 杂化轨道中含有1/3 的s轨道成分和2/3的p轨道成分。
为使轨道间的排斥能最小,3个sp2杂化轨道呈正 三角形分布,夹角为1200。当3个sp2杂化轨道分别与 其他3个相同原子的轨道重叠成键后,就会形成平面 三角形构型的分子。
SP 2 2 180° 直线形 BeCl2 CO2 HgCl2 [Ag(NH3)2]+
SP2 3 3 120° 平面三 角形 BF3 COCl2 NO3— CO32—
SP3 4 4 109.5° 四面体 CH4 CCl4 CHCl3 PO43— 三角 双锥 PCl5 八面体 SF6
价电子 对数目 杂化类 型 理想几 何构型
注:在化合物中以等电子观点看:O- 和F、Cl、NH2相当,O和CH2、NH相当。 则:
NO2 NOCl NO3 NO2 Cl
1个O 换 成 1个Cl
-
1个O 换 成1个Cl
-
CO3 COCl2
CH 3CH 2 CH 3 CH 3OCH 3
第一单元
分子构型与物质的性质
一 分子的空间构型
分子的空间构型 三原子分子的空间构型有直线型和V型两种.如 CO2分子为直线型,而水的空间构型为V型,键角为 104.5°
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.空间的构型有哪些?
空间构型有:直线型、平面正三角形、正四面体、三角锥形、折线形、平面形、折面形、平面正四边形、正四面梯形。
折线形:比如水分子;直线型:比如二氧化碳;平面型:比如苯分子;折面型:比如丁烷;三角锥形:比如氨;正四面梯形:比如甲烷;平面三角形:比如三氟化硼;平面正四边形:比如四氯化碘。
分子空间构型及杂化方式
分子的空间构型是指分子中各种基团或原子在空间分布的几何形状。
分子中的原子不是杂乱无章地堆积在一起,而是按照一定规律结合的整体,使分子在空间呈现出一定的几何形状(即空间构型)。
如果确定了某分子内化学键的键长和键角数据,那么这个分子的几何构型就确立了。
sp2杂化:同一个原子内的ns轨道与两个np轨道杂化,形成三个等同的sp2杂化轨道,并分别与自旋相反的电子结合,形成三个σ键,其相互间夹角为120°。
因此经sp2杂化而形成的分子具有平面三角形的构型。
sp3杂化:2s轨道与2p轨道实行sp3杂化后,已经成对的两个电子占据一个杂化轨道,三个未成对电子则各占一个杂化轨道,再按电子配对法共与三个电子自旋相反的氢原子形成三个共价键,因此分子呈三角锥构型。
